МУК 4.2.762-99
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы микробиологического контроля готовых изделий с кремом
Дата введения 1999-09-02
1. РАЗРАБОТАНЫ Институтом Питания Российской академии медицинских наук (Тутельян В.А., Куваева И.Б., Шевелева С.А., Карликанова Н.Р.), Государственным научно-исследовательским институтом хлебопекарной промышленности (Богатырева Т.Г., Сидорова О.А., Полякова С.П.).
2. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Первым заместителем министра здравоохранения Российской Федерации - Главным государственным санитарным врачом Российской Федерации 02.07.99.
3. С введением настоящих методических указаний утрачивают силу "Методические указания по проведению санитарно-бактериологических исследований на предприятиях, вырабатывающих кондитерские кремовые изделия", N 1351-75.
1. Общие положения
1.1. Настоящие методические указания устанавливают методы лабораторных исследований (испытаний) качества готовых изделий с кремом по микробиологическим показателям безопасности для здоровья человека, проводимых в порядке производственного контроля, государственного санитарно-эпидемиологического надзора, а также при испытании указанной продукции в целях сертификации соответствия.
1.2. Методические указания предназначены для применения в аккредитованных бактериологических производственных, испытательных лабораториях и лабораториях организаций Государственной санитарно-эпидемиологической службы Российской Федерации, осуществляющих контроль качества и безопасности готовых изделий с кремом, и позволяют проводить контроль на соответствие СанПиН 2.3.2.560-96 "Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов".
1.3. Данный документ разработан в связи с необходимостью совершенствования методов микробиологического анализа в соответствии с рекомендациями ФАО/ВОЗ.
Методы адаптированы к условиям работы лабораторий, осуществляющих контроль качества и безопасности готовых изделий с кремом.
1.4. Для правильного выбора массы продукта, засеваемой при контроле за отсутствием бактерий группы кишечных палочек (колиформных бактерий), S. aureus, патогенных микроорганизмов, в т.ч. сальмонелл, в методические указания включены микробиологические нормативы, соответствующие СанПиН 2.3.2.560-96 "Гигиенические требования к качеству продовольственного сырья и пищевых продуктов", а также микробиологические нормативы в соответствии с утвержденной в установленном порядке нормативной документацией на изделия с кремом, производимые по усовершенствованным технологиям, с использованием новых видов жиров и т.д.
1.5. Настоящие методические указания должны учитываться при пересмотре действующей и разработке вновь создаваемой нормативной документации на готовые изделия с кремом, вырабатываемые хлебопекарными и кондитерскими предприятиями и цехами, и компоненты, используемые при их изготовлении.
2. Нормативные ссылки
2.1. Федеральный закон "О санитарно-эпидемиологическом благополучии населения" от 30.03.99.
2.2. Положение о государственном санитарно-эпидемиологическом нормировании, утвержденное Постановлением Правительства Российской Федерации от 05.06.94 N 625 с изменениями и дополнениями к нему, утвержденными постановлением Правительства Российской Федерации от 30 июня 1998 г. N 680.
2.3. Положение о государственной санитарно-эпидемиологической службе РФ, утвержденное постановлением правительства Российской Федерации от 30.06.98 N 680.
3. Методы отбора, доставки и подготовки проб к анализу
3.1. Отбор проб
3.1.1. Качество изделий с кремом оценивают по результатам анализа части продукции, отобранной из партии. Партией считают продукцию одного вида, сорта и наименования, выработанную за одну смену и оформленную документом о качестве установленной формы. Документ о качестве должен содержать:
- наименование продукции;
- наименование и адрес изготовителя;
- номер и дату выдачи;
- дату и час выработки;
- условия хранения и сроки годности;
- подтверждение о соответствии качества продукции нормативно-технической документации;
- обозначение нормативно-технической документации.
3.1.2. При отборе проб следует руководствоваться ГОСТом 26668-85 "Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов" и ГОСТом 5904-82 "Изделия кондитерские. Правила приемки, методы отбора и подготовки проб".
Для составления объединенной пробы от выборки отбирают:
- для тортов не менее 1 шт. массой не менее 300 г;
- для пирожных в ассортименте - не менее 10 шт. массой менее 50 г, не менее 6 шт. массой 50-60 г, не менее 5 шт. массой 65-75 г, не менее 4 шт. массой 80-90 г, не менее 3 шт. массой 100-200 г.
Oтбop проб производят, вскрывая определенное количество транспортных единиц упаковки, оговоренное в нормативно-технической документации, и изымая часть продукции. Пробы отбирают асептически с помощью стерильных инструментов в стерильную посуду таким образом, чтобы в них были представлены все компоненты изделий в соотношении, наиболее близком к составу анализируемых тортов или пирожных.
3.1.3. Пробу, отобранную из отдельной единицы упаковки, называют разовой. Количество продукта в разовых пробах из каждой единицы упаковки должно быть одинаковым. Разовые пробы соединяют, перемешивают и составляют среднюю пробу. Средняя проба должна быть отобрана таким образом, чтобы ее состав соответствовал всей партии. Масса средней пробы должна быть не менее 250 г.
3.1.4. Банку с пробой снабжают этикеткой, на которой указывают:
- номер пробы, дату и час отбора пробы;
- наименование продукции;
- номер и объем партии;
- дату и час выработки продукции;
- должность и подпись лица, отбиравшего пробу;
- обозначение действующей нормативно-технической документации, по которой вырабатывалась продукция.
Пробу, отправляемую в лабораторию вне данного предприятия, пломбируют или опечатывают и снабжают этикеткой, на которой дополнительно указывают наименование предприятия-изготовителя.
3.2. Доставка и хранение проб
3.2.1. Доставка проб в лабораторию должна осуществляться, по возможности, специальным автотранспортом в термоконтейнерах с охлаждающими вкладышами не позднее 2 ч с момента их отбора.
3.2.2. Бактериологическое исследование продукции производят не позднее, чем через 4 ч с момента отбора пробы. Образцы до начала исследования сохраняют при температуре от 2 до 6 °С.
3.3. Подготовка проб к анализу
3.3.1. Подготовка проб к анализу проводится по ГОСТу 26669-85 "Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов" и ГОСТу 5904-82 "Изделия кондитерские. Правила приемки, методы отбора и подготовки проб". Все работы проводят с помощью стерильных инструментов в стерильных условиях.
3.3.2. Среднюю пробу асептично помещают в стерильный стакан гомогенизатора или фарфоровую ступку и тщательно измельчают до однородной массы (при необходимости можно добавить 2-5 г стерильного кварцевого песка).
3.3.3. Приготовление разведений для посева.
3.3.3.1. Навеску массой 10,0±0,1 г, приготовленную по п.3.3.2, отбирают из средней пробы изделия и асептично вносят в колбу с 90 см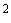 стерильного физиологического раствора (п.6.3.1.2) или 0,1%-ной пептонной воды (п.6.3.1.1), тщательно перемешивают круговыми движениями и помещают на водяную баню либо в термостат при 45 °С на 15-20 мин, либо на аппарат для встряхивания при той же температуре на 3-5 мин до получения однородной взвеси. 1 см
стерильного физиологического раствора (п.6.3.1.2) или 0,1%-ной пептонной воды (п.6.3.1.1), тщательно перемешивают круговыми движениями и помещают на водяную баню либо в термостат при 45 °С на 15-20 мин, либо на аппарат для встряхивания при той же температуре на 3-5 мин до получения однородной взвеси. 1 см приготовленной таким образом взвеси (гомогената) содержит 0,1 г исследуемого образца (первое разведение). Если при гомогенизации продукта получена неоднородная взвесь, то ее отстаивают в течение 15 мин и для посева и (или) приготовления разведений используют надосадочную жидкость.
приготовленной таким образом взвеси (гомогената) содержит 0,1 г исследуемого образца (первое разведение). Если при гомогенизации продукта получена неоднородная взвесь, то ее отстаивают в течение 15 мин и для посева и (или) приготовления разведений используют надосадочную жидкость.
3.3.3.2. Из первого разведения образца стерильной пипеткой берут 1 см и переносят в пробирку, содержащую 9 см
и переносят в пробирку, содержащую 9 см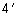 стерильного раствора. Другой пипеткой взвесь перемешивают 5-10 раз и получают второе разведение (1:100). При необходимости последующие разведения готовят таким же образом. При приготовлении разведений каждый раз используют новую пипетку, опуская конец пипетки и жидкость не более чем на 2 см ниже уровня. Перед посевом разведения осторожно встряхивают .
стерильного раствора. Другой пипеткой взвесь перемешивают 5-10 раз и получают второе разведение (1:100). При необходимости последующие разведения готовят таким же образом. При приготовлении разведений каждый раз используют новую пипетку, опуская конец пипетки и жидкость не более чем на 2 см ниже уровня. Перед посевом разведения осторожно встряхивают .
3.3.4. Время от момента приготовления разведений до посева не должно превышать 30 мин.
4. Методы анализа
При контроле микробиологического качества и безопасности кондитерских изделий с кремом используют стандартизованные методы микробиологического посева. При этом определяют следующие группы микроорганизмов: мезофильные аэробные и факультативно-анаэробные микроорганизмы, бактерии группы кишечных палочек (колиформные бактерии), S. aureus и патогенные микроорганизмы, в т.ч. сальмонеллы, дрожжи и плесени.
При выявлении или определении количества микроорганизмов соответствующих групп необходимо руководствоваться ГОСТом 26670-91 "Продукты пищевые. Методы культивирования микроорганизмов".
При проведении посевов на селективные среды накопления для определения условно-патогенных и патогенных микроорганизмов рекомендуется использовать контрольные культуры соответствующих микроорганизмов, которые следует изучать параллельно с культурами, выделенными из исследуемых образцов тортов и пирожных.
В аккредитованных микробиологических лабораториях, осуществляющих контроль качества и безопасности кондитерских изделий с кремом, допускается использование автоматизированных экспресс-методов микробиологического контроля.
Для автоматизированного микробиологического экспресс-контроля применяют компьютеризированные приборы, представляющие собой измерительные системы для определения микробной обсемененности и выявления различных микробов, принцип действия которых основан на регистрации относительного изменения электрического сопротивления, оптической плотности, турбидиметрического или колориметрического эффекта питательных сред, происходящих под влиянием процессов роста и размножения микроорганизмов. Для этих целей применяют микробиологические экспресс-анализаторы БакТрак 4100 (Австрия), Рэббит (Англия), Мальтус (Ирландия), Бактометр (Франция), БакТ/Алерт (США), Биоскрин (Финляндия) или другие приборы аналогичного назначения.
Анализаторы позволяют определять мезофильные аэробные и факультативно-анаэробные микроорганизмы, условно-патогенные и патогенные микроорганизмы (колиформы, сальмонеллы, стафилококки и др.), дрожжи, плесени, молочнокислые бактерии и др.
В комплект приборов входят: контролируемые компьютером термостатируемые инкубаторные блоки на различное количество образцов, персональный компьютер, принтер, комплекты измерительных ячеек с электродами (объемом на 10 и 100 мл), наборы высокоселективных сред, другие материалы.
Использование микробиологических автоматических анализаторов позволяет сократить время на проведение испытаний и получить результаты анализа уже через 6-8 ч после начала исследования.
Обязательным условием для применения микробиологических анализаторов при осуществлении контроля качества продукции является наличие утвержденных в установленном порядке в системе государственного санитарно-эпидемиологического нормирования методических указаний, созданных в результате сравнительных испытаний определения на приборе конкретного типа со стандартизованными методами микробиологического контроля и адаптированных к установленным в СанПиН 2.3.2.560-96 нормативным показателям для кондитерских изделий с кремом.
4.1. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ)
4.1.1. Сущность метода.
Метод основан на количественном подсчете колоний микроорганизмов, вырастающих в глубине и на поверхности плотного питательного агара при температуре 30±1 °С в течение 72 ч.
При определении количества мезофильных аэробных и факультативно-анаэробных микроорганизмов руководствуются ГОСТом 26670-91 и ГОСТом 10444.15-94 с учетом нижеизложенных рекомендаций.
4.1.2. Проведение анализа.
Для определения общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов выбирают те разведения, при посеве которых на чашках вырастает не менее 15 и не более 300 колоний.
Перед посевом чашки маркируют. На дно чашки карандашом по стеклу наносят номер исследуемого образца, разведение и дату.
По 1 см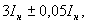 каждого разведения образца, приготовленного по п.3.3.3, вносят в 2 чашки Петри (параллельное определение). Посевной материал можно вносить от большего разведения к меньшему, пользуясь одной пипеткой. Пипетку с посевным материалом держат под углом 45°, касаясь концом пипетки дна чашки, не выдувая последнюю каплю из пипетки. Затем, не позже чем через 20 мин, вносят в чашку питательную среду (п.6.3.2.3, 6.3.2.5), расплавленную на водяной бане и остуженную до 45 °С, осторожно и равномерно перемешивают содержимое чашки. Высота слоя питательной среды должна быть не менее 4-5 мм.
каждого разведения образца, приготовленного по п.3.3.3, вносят в 2 чашки Петри (параллельное определение). Посевной материал можно вносить от большего разведения к меньшему, пользуясь одной пипеткой. Пипетку с посевным материалом держат под углом 45°, касаясь концом пипетки дна чашки, не выдувая последнюю каплю из пипетки. Затем, не позже чем через 20 мин, вносят в чашку питательную среду (п.6.3.2.3, 6.3.2.5), расплавленную на водяной бане и остуженную до 45 °С, осторожно и равномерно перемешивают содержимое чашки. Высота слоя питательной среды должна быть не менее 4-5 мм.
После застывания среды чашки переворачивают крышками вниз и помещают в термостат при 30±1 °С на 72 ч (допускается предварительный учет через 48 ч с последующим окончательным учетом еще через 24 ч).
После инкубации подсчитывают все выросшие колонии на тех чашках, где их количество составляет 15-300 колонии, при этом чашки располагают вверх дном на темном фоне. Подсчет производят при помощи лупы с увеличением от 4 до 10 раз или специального прибора для счета колоний.
Если инкубированные чашки с разведением 1:10 не содержат колоний, то результат выражают так: меньше чем 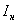 КОЕ (колониеобразующих единиц) на 1 г исследуемого образца.
КОЕ (колониеобразующих единиц) на 1 г исследуемого образца.
Если на каждой из двух параллельных чашек с разведением 1:10 содержится меньше чем 15 колоний, то результат выражается так: менее чем 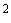 .
.
Если количество колоний более 15, подсчитывают колонии на обеих чашках с одним и тем же разведением и вычисляют среднюю величину, умножают среднюю величину на соответствующее разведение и получают число микроорганизмов в 1 г продукта.
При подсчете микроорганизмов целесообразно руководствоваться ГОСТом 26670-85 "Продукты пищевые и вкусовые. Методы культивирования микроорганизмов".
Полученный результат округляют до числа, кратного:
- 5, если среднее арифметическое число микроорганизмов менее 100;
- 20, если среднее арифметическое число микроорганизмов более 100 и оканчивается цифрой 5;
- 10, если среднее арифметическое число микроорганизмов более 100 и не оканчивается цифрой 5.
Ответ выражают в виде числа КОЕ/г с указанием соответствия или несоответствия тортов и пирожных микробиологическому нормативу на этот показатель (см. табл.2, 3, 4).
4.2. Определение бактерий группы кишечных палочек (колиформных бактерий)
В соответствии с принятой международной номенклатурой к бактериям группы кишечных палочек (БГКП) отнесены факультативно-анаэробные, грамотрицательные, не образующие спор палочки, сбраживающие лактозу с образованием кислоты и газа при температуре 36±1 ° С в течение 24-48 ч, в основном являющиеся представителями родов Escherichia, Citrobacter, Enterobacter, Klebsiella, Serratia (т.е. учитываются как цитратотрицательные, так и цитратположительные варианты БГКП). Методы исследования на БГКП приведены в ГОСТе Р 50474-93.
4.2.1. Сущность метода.
Метод основан на высеве определенного количества продукта в жидкую селективную среду, содержащую лактозу для определения сбраживающей способности по образованию кислоты и газа и, при необходимости, пересева культуральной жидкости на поверхность плотных специальных агаризованных сред для подтверждения принадлежности по культуральным и биохимическим признакам выделенных колоний к колиформным бактериям.
4.2.2. Проведение анализа.
Для посева используют то количество продукта, подготовленного по п.3.3.3, в котором предусматривается отсутствие БГКП (табл.2). Посев производят в среду Кесслер с лактозой (п.6.3.2.5) (с поплавками) в соотношении разведения и среды 1:10.
Пробирки или колбы с посевами помещают в термостат при температуре 36±1 °С на 24-48 ч, после этого посевы просматривают и при отсутствии признаков роста - газообразования или помутнения среды - дают заключение об отсутствии БГКП (колиформ) в исследуемой массе изделия.
Из пробирок или колб со средой Кесслер, в которых обнаружено газообразование или помутнение, производят пересев на среду Эндо или Левина (п.6.3.2.6). Посев производят петлей по поверхности хорошо подсушенной среды штрихами для получения изолированных колоний. Чашки с посевами помещают крышками вниз в термостат с температурой 36±1 °С на 18-24 ч.
При отсутствии на среде Эндо или Левина колоний, типичных для бактерий группы кишечных палочек (на среде Эндо - красных и темно-красных с металлическим блеском или без него, розовых или бледно-розовых; на среде Левина - черных с металлическим блеском, темных с черным центром, сиреневых с темным центром), дают заключение об отсутствии БГКП в исследуемом количестве изделия и соответствии его нормативу на бактерии группы кишечных палочек (колиформные бактерии).
При наличии на среде Эндо или Левина колоний, характерных для кишечных палочек, из них готовят мазки, окрашивают их по Граму и микроскопируют.
Наличие в мазках-препаратах грамотрицательных, не содержащих спор палочек, указывает на присутствие бактерий группы кишечных палочек в анализируемой массе изделия и несоответствие его микробиологическому нормативу.
При выявлении на среде Эндо мелких бесцветных колоний, подозрительных на наличие возбудителей кишечных инфекций, колонии снимают и изучают на принадлежность к патогенным микроорганизмам семейства кишечных (п.4.3), а в случае подтверждения извещают территориальное учреждение госсанэпиднадзора и при необходимости передают туда для дальнейшей идентификации.
4.3. Определение бактерий рода Salmonella
Сальмонеллы - обширный род семейства энтеробактерий, включающий более 2000 сероваров, большинство которых обладает патогенными свойствами. Сальмонеллы - факультативно-анаэробные грамотрицательные, в основном подвижные палочки или неподвижные (S. pullorum, S. gallinarum и др.), хорошо растущие на обычных питательных средах и разнообразных пищевых субстратах.
При исследовании образцов на наличие сальмонелл руководствуются ГОСТом Р 50480-93 с учетом нижеизложенных методических рекомендаций.
4.3.1. Сущность метода.
Метод основан на высеве определенной массы (количества) продукта, в которой нормируется отсутствие патогенных микроорганизмов, в жидкую неселективную среду, инкубировании посевов, последующем накоплении бактерий в жидких селективных средах, выявлении бактерий, образующих типичные колонии на агаризованных дифференциально-диагностических средах, имеющих типичные для бактерий рода Salmonella биохимические и серологические характеристики.
4.3.2. Проведение анализа.
Навеску изделия (25 г), соответствующую указанному в табл.2 нормативу на сальмонеллы, приготовленную по п.3.3.1, засевают в колбу с пептонным буферным раствором (п.6.3.2.8) в соотношении 1:9 для предварительного неселективного обогащения. Посевы инкубируют при 36±1 °С в течение 18-24 ч.
После этого производят пересев культуры из пептонного буферного раствора в две среды для селективного обогащения. Для этого 10 см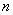 культуральной жидкости переносят в 100 см
культуральной жидкости переносят в 100 см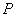 магниевой среды, приготовленной по п.6.3.2.11, и в 100 см
магниевой среды, приготовленной по п.6.3.2.11, и в 100 см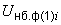 тетратионатной среды, приготовленной по п.6.3.2.10 или по 10 см
тетратионатной среды, приготовленной по п.6.3.2.10 или по 10 см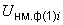 культуры переносят в 100 см
культуры переносят в 100 см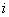 селенитовой среды (п.6.3.2.13) и в 100 см
селенитовой среды (п.6.3.2.13) и в 100 см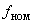 тетратионатной среды.
тетратионатной среды.
Посевы инкубируют 24 ч на магниевой и селенитовой средах при температуре 36±1 °С, а на тетратионатной среде при температуре 43±1 °С.
Через 24 ч инкубиривания культуры пересевают на три агаризованные среды: висмут-сульфит агар, среду Плоскирева и среду Эндо (взамен Эндо можно использовать среду Левина).
Допускается использование одной чашки каждой из сред для одновременного высева с двух селективных сред.
Посевы инкубируют при температуре 36±1 °С в течение 24-48 ч.
После 24 ч инкубирования посевов проводят предварительный учет результатов, а после 48 ч - окончательный.
После инкубирования посевов на дифференциально-диагностических средах отмечают рост колоний, характерных для бактерий рода Salmonella:
- на висмут-сульфит агаре - колонии черные с характерным металлическим блеском, а также зеленоватые с темно-зеленым ободком и с пигментированием среды под колонией;
- на среде Плоскирева - колонии бесцветные прозрачные, но более плотные, чем на среде Эндо;
- на среде Эндо - колонии круглые бесцветные или слегка розоватые, прозрачные;
- на среде Левина - колонии прозрачные, слабо-розовые или розовато-фиолетовые.
При отсутствии в посевах на дифференциально-диагностических средах, характерных для бактерий рода Salmonella колоний дают заключение об отсутствии бактерий рода Salmonella в анализируемой навеске продукта.
При наличии хотя бы на одной дифференциально-диагностической среде характерных для бактерий рода Salmonella колоний проводят их дальнейшее изучение.
4.3.3. Биохимическое подтверждение принадлежности выделенных характерных колоний к бактериям рода Salmonella.
Не менее трех характерных колоний с каждой дифференциально-диагностической среды (а в случае наличия 1-2 типичных колоний - каждую из них) пересевают на скошенную поверхность мясо-пептонного агара или среды из сухого питательного агара, приготовленные по п.6.3.2.4 или п.6.3.2.5. Часть колоний пересевают штрихом по поверхности и уколом в столбик трехсахарного агара, приготовленного по п.6.3.2.13.
Посевы инкубируют при температуре 36±1 °С в течение 24 ч.
Из отобранных по п.4.3.3 для биохимического подтверждения колоний приготовляют мазки и окрашивают по Граму (по ГОСТу 10444.1).
Бактерии рода Salmonella являются бесспоровыми грамотрицательными палочками с закругленными концами.
После инкубации посевов, как указано в п.4.3.3, проводят учет результатов ферментации лактозы, глюкозы и сахарозы на трехсахарном агаре:
- пожелтение скошенной части среды указывает на ферментацию лактозы или сахарозы или обоих сахаров (пожелтение столбика среды с разрывом агара или пузырьками газа указывает на ферментацию глюкозы с образованием кислоты и газа, пожелтение столбика среды без разрывов или пузырьков газа указывает на ферментацию глюкозы до кислоты без образования газа);
- почернение среды в столбике указывает на образование сероводорода.
Типичными для бактерий рода Salmonella являются культуры, ферментирующие глюкозу с образованием или без образования газа, не ферментирующие лактозу и сахарозу, образующие сероводород.
Дальнейшему изучению подвергаются также лактозоположительные бактерии, не образующие сероводород, но обязательно ферментирующие глюкозу с образованием или без образования газа.
У культур, отобранных согласно п.4.3.3 и пересеянных на поверхность мясо-пептонного агара или среды, приготовленной из сухого питательною агара, изучают следующие биохимические и физиологические признаки: расщепление мочевины, образование ацетоина и индола, ферментацию лизина, сахарозы, маннита, салицина и подвижность.
4.3.3.1. Определение расщепления мочевины.
Культуры пересевают штрихом на поверхность агара Кристенсена с мочевиной (п.6.3.2.23). Посевы инкубируют при температуре 36±1 °С в течение 24 ч.
При положительной реакции - расщепление мочевины - цвет среды от розового до светло-вишневого. Для уреазоположительных бактерий реакция часто становится видимой после 2 ч инкубирования.
Бактрии рода Salmonella не расщепляют мочевину.
4.3.3.2. Изучение ферментации маннита и сахарозы.
Культуры пересевают в среды Гисса с маннитом и сахарозой.
Посевы инкубируют при температуре 36±1 °С в течение 24 ч.
Бактерии рода Salmonella не сбраживают сахарозу, но сбраживают маннит. При сбраживании маннита цвет среды изменяется, образуется или не образуется газ.
4.3.3.2*. Определение образования индола.
_______________
* Нумерация соответствует оригиналу. Примечание .
При исследовании на индол из подозрительной колонии микроорганизмы высевают в пробирки с 1%-ной пептонной водой или среду на индол с триптофаном по п.6.3.2.7 и термостатируют при 36±1 °С 24 ч. Затем в пробирку с суточной культурой по стенке добавляют 5-10 капель реактива Эрлиха (п.6.3.1.5). При наличии индола не позднее чем через 5 минут в пограничном слое образуется ярко-красное кольцо, при отсутствии - кольцо остается светло-желтого цвета.
Для определения индолообразования пользуются также реактивом Ковача (п.6.3.1.6). К суточной культуре добавляют 0,2-0,3 см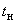 реактива и взбалтывают. Результаты учитывают через 10 минут: реактив поднимается на поверхность среды и при наличии индола окрашивается в темно-красный цвет.
реактива и взбалтывают. Результаты учитывают через 10 минут: реактив поднимается на поверхность среды и при наличии индола окрашивается в темно-красный цвет.
Бактерии рода Salmonella индола не образуют.
4.3.3.3. Определение образования ацетоина (реакция Фогес-Проскауэра).
Культуры пересевают в мясо-пептонный бульон с глюкозой (п.6.3.2.4). Посевы инкубируют при температуре 36±1 °С в течение 48 ч. После инкубирования к 1 см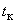 культуральной жидкости добавляют 0,6 см
культуральной жидкости добавляют 0,6 см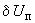 раствора альфа-нафтола (п.6.3.1.3) и 0,2 см
раствора альфа-нафтола (п.6.3.1.3) и 0,2 см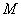 раствора гидроокиси калия (400 г/дм
раствора гидроокиси калия (400 г/дм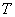 ). После прибавления каждого реактива пробирку встряхивают. Появление ярко-красного окрашивания не позднее чем через 15 минут указывает на положительную реакцию образования ацетоина.
). После прибавления каждого реактива пробирку встряхивают. Появление ярко-красного окрашивания не позднее чем через 15 минут указывает на положительную реакцию образования ацетоина.
4.3.3.4. Определение подвижности.
Культуры пересевают уколом в полужидкий мясо-пептонный агар.
Посевы инкубируют при температуре 36±1 °С в течение 24 ч. При росте подвижных культур отмечается диффузный рост по всему столбику агара, при росте неподвижных культур - вдоль места укола.
Большинство штаммов бактерий рода Salmonella подвижны.
4.3.3.5. Определение декарбоксилирования лизина.
Культуру высевают на поверхность жидкой лизиновой среды для декарбоксилирования (п.6.3.2.21). Посевы инкубируют при температуре 36±1 °С в течение 24 ч. Появление темно-красной или фиолетовой окраски - положительная реакция, желтая окраска среды - отрицательная реакция.
Бактерии рода Salmonella дают положительную реакцию.
4.3.3.6. Определение способности ферментировать салицин.
Исследуемую культуру пересевают в полужидкую среду по п.6.3.2.25. Посевы инкубируют при температуре 36±1 °С в течение 24 ч. О ферментации салицина судят по изменению цвета среды, с образованием или без образования газа. Бактерии рода Salmonella (за исключением IV группы) салицин не ферментируют.
Допускается для биохимического подтверждения принадлежности выделенных культур к бактериям рода Salmonella, вместо классических методов, описанных в п.4.3.3, использовать коммерческие наборы для идентификации микроорганизмов, зарегистрированные и сертифицированные в системе государственного санитарно-эпидемиологического надзора Российской Федерации.
4.3.3.7. Использование системы мультимикротестов (ММТ Е1 и ММТ Е2) для биохимической идентификации энтеробактерий.
ММТ Е1 и ММТ Е2 - системы одноразового использования для идентификации микроорганизмов семейства Enlerobacteriaceae.
ММТ Е1 позволяет определить 12 ключевых ферментативных свойств энтеробактерий: образование сероводорода, индола, наличие лизиндекарбоксилазы, орнитиндекарбоксилазы, уреазы, фенилаланиндезаминазы, утилизацию цитрата натрия (модификация цветной реакции Симмонса), малоната натрия, маннита, сахарозы, лактозы, сорбита.
ММТ Е2 позволяет определить 12 дополнительных биохимических свойств, которые в сочетании с 12 ключевыми свойствами, определяемыми ММТ Е1, служат для видовой идентификации энтеробактерий: наличие аргининдегидролазы, бета-галактозидазы, нитратредуктазы, утилизацию инозита, дульцита, арабинозы, рамнозы, мальтозы, адонита, рафинозы, салицина, глюкозы.
Системы ММТ Е1 и ММТ Е2 представляют собой прозрачные полистироловые 96-луночные или 48-луночные планшеты, в лунки которых помещены соответствующие субстратно-индикаторные среды, стабилизированные поливиниловым спиртом и стерилизованные ультрафиолетовым излучением.
Исследуемые культуры предварительно выращивают на питательном агаре или на средах для первичной дифференциации (среда Клиглера, Олькеницкого) в течение 12-18 часов при температуре 36±1 °С, затем приготавливают из них суспензию.
Исследования бактериальных культур проводят согласно инструкциям, прилагаемым к указанным системам. Учет результатов проводят визуально с помощью приложенной к системам таблицы через 18-24 ч инкубации.
Идентификацию проводят с помощью таблицы "Биохимическая характеристика энтеробактерий" с учетом данных по характеру роста, микроскопии, источников изоляции и др., или с помощью компьютерной программы "IDENT", разработанной НПО "Аллерген".
Результаты полученных биохимических реакций сравнивают с данными табл.1.
Таблица 1
Наименование биохимических характеристик |
Salmonella I |
Salmonella II |
Salmonella III-Arizona |
Salmonella IY |
Salmonella cholerae suis |
Salmonella gallinarum |
Salmonella paratyphi A |
Salmonella pullorum |
Salmonella typhi |
Образование индола |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Образование ацетоина |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Образование |
+ |
+ |
+ |
+ |
(-) |
+ |
- |
+ |
+ |
Декарбоксилирование лизина |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
Ферментация салицина |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
Расщепление мочевины |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Подвижность |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
+ |
Сбраживание глюкозы с образованием газа |
+ |
+ |
+ |
+ |
+ |
- |
+ |
(+) |
- |
Сбраживание глюкозы с образованием кислоты |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
Сбраживание лактозы |
- |
- |
(-) |
- |
- |
- |
- |
- |
- |
Сбраживание сахарозы |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Сбраживание маннита |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
Условные обозначения: "+" - 90-100% штаммов положительны; "(+)" - 76-89% штаммов положительны;
"(-)" - 26-75% штаммов положительны: "-" - 0-10% штаммов положительны.
Типичными для бактерий рода Salmonella являются подвижные культуры, ферментирующие глюкозу с образованием или без образования газа, не ферментирующие лактозу и сахарозу, не образующие индол и ацетоин, образующие сероводород.
Однако установлено, что при определенных условиях сальмонеллы могут приобретать признак сбраживания лактозы. Вопрос о принадлежности таких штаммов к бактериям рода Salmonella решается по совокупности результатов серологических и биохимических тестов.
Если ни одна из выделенных культур не показывает типичных для бактерий рода Salmonella биохимических реакций, то дают заключение об отсутствии сальмонелл в исследуемой массе изделия.
С культурами, давшими типичные биохимические реакции согласно табл.1, проводят дальнейшее изучение с постановкой серологических реакций.
Также серологическому исследованию подлежат:
Лактозоположительные или типичные (не более чем по одному из других перечисленных выше биохимических признаков, исключая индол и ацетоин) штаммы бактерий, ферментирующие глюкозу с образованием или без образования газа, которые по комплексу основных биохимических тестов могут расцениваться как подозрительные на принадлежность роду Salmonella.
4.3.4. Серологические исследования.
Серологическое исследование проводят из пробирок с суточными культурами, предварительно пересеянными на поверхность скошенного мясопептонного агара или среды, приготовленной из сухого питательного агара.
Для этого петлей берут небольшое количество культуры из пробирок, помещают на предметное стекло и добавляют каплю поливалентной адсорбированной сальмонеллезной диагностической О-сыворотки; осторожно покачивают предметное стекло для получения однородной суспензии культуры.
Положительная реакция на сальмонеллы (агглютинация) наблюдается в течение 30-60 секунд и проявляется в виде склеивания бактериальной массы и полного или частичного просветления жидкости. При отрицательной реакции агглютинации культура в капле сыворотки сохраняется в виде гомогенной смеси.
Обязательна постановка отрицательной реакции (культура + физиологический раствор) для выявления способности к самоагглютинации. Штаммы бактерий, обладающие самоагглютинацией, не подвергают дальнейшему серологическому тестированию.
По показаниям и при необходимости для полной типизации сальмонелл по схеме Кауфмана-Уайта проводят постановку реакций агглютинации не только с О-, но и с Н-сыворотками (наставление по применению агглютинирующих диагностических сальмонеллезных О- и Н-сывороток).
4.3.4.1. Оценка результатов.
Выделенную культуру относят к бактериям рода Salmonella, если она показывает типичные биохимические и серологические реакции.
Предположительно относят к бактериям рода Salmonella:
- культуры, у которых не обнаружено самоагглютинации и О-антигенов, но показавших типичные биохимические реакции;
- культуры, у которых обнаружена самоагглютинация, и показавших типичные биохимические реакции;
- культуры, у которых обнаружена самоагглютинация, и показавших типичные биохимические реакции;
- культуры, у которых обнаружены не все типичные биохимические реакции, но дающие положительную серологическую реакцию с одной из сывороток групп А, В, С, D, Е.
В этих случаях констатируется присутствие бактерий рода Salmonella в засеянной массе изделия и несоответствие его микробиологическому нормативу.
Культуры, у которых не обнаружено самоагглютинации и не показавших типичные биохимические и серологические реакции, не относят к бактериям рода Salmonella, а продукты, из которых они были выделены, считают соответствующими микробиологическому нормативу по этому показателю.
4.4. Определение коагулазоположительных стафилококков (Staphylococcus aureus)
S. aureus - факультативно-анаэробные грамположительные-сферические микроорганизмы, обладающие ферментами: коагулазой, термостабильной ДНК-азой, кислой фосфатазой, сбраживающие маннит в анаэробных условиях, определенная часть которых способна продуцировать энтеротоксины.
Исследования на наличие в образце коагулазоположительных стафилококков проводят в соответствии с ГОСТом 10444.2-94 с учетом нижеизложенных рекомендаций.
4.4.1. Сущность метода.
Метод основан на способности микроорганизмов рода Slaphylococcus расти на питательных средах с повышенным содержанием хлорида натрия. Наибольшее санитарно-гигиеническое значение имеет S. aureus (золотистый стафилококк), принадлежность к которому, в основном, определяется по способности коагулировать цитратную плазму крови человека или кролика и вырабатывать фермент лецитиназу (фосфолиназу С).
4.4.2. Проведение анализа.
Для посева используют количество средней пробы продукта, подготовленной по п.3.3.3, в котором предусматривается отсутствие S. aureus (табл.2). Посевы производят в солевой бульон с 6,5% хлористого натрия (п.6.3.2.16). Соотношение засеваемого материала и питательной среды должно составлять 1:10. Посевы термостатируют при температуре 36±1 °С в течение 24 ч. Затем со среды накопления делают пересев петлей на подсушенные среды типа Байрд-Паркер (п.6.3.2.17) или ЖСА (желточно-солевой агар) (п.6.3.2.19) для получения изолированных колоний. Посевы помещают в термостат при температуре 36±1 °С на 18-24 ч.
Таблица 2
Микробиологические нормативы для готовых изделий с кремом
Наименование |
КМАФАнМ, КОЕ/г, не более |
Масса продукта (г), в которой не допускаются |
Дрожжи, КОЕ/г, не более |
Плесени, КОЕ/г, не более |
Примечания | ||
БГКП (колиформы) |
S. aureus |
Патогенные, в т.ч. сальмонеллы |
|||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Торты, пирожные и рулеты бисквитные, песочные, заварные, слоеные, воздушные, крошковые с отделкой: |
* при использовании маргарина | ||||||
- сливочным кремом |
5х10 |
0,01 |
0,01 |
25 |
100* |
50* |
**при использовании орехов |
- белково-сбивной, типа суфле |
1х10 |
0,01 |
0,01 |
25 |
50 |
100 |
100 КОЕ/г |
- фруктово-ягодной, повидлом |
1х10 |
0,01 |
0,1 |
25 |
50 |
50** |
|
- заварным кремом |
1х10 |
0,01 |
1,0 |
25 |
10 |
10** |
|
- творожно- |
5х10 |
0,01 |
0,1 |
25 |
- |
- |
|
- глазурью, помадкой, шоколадом |
1х10 |
0,01 |
0,1 |
25 |
50 |
100 |
|
- орехом, марципаном, пралине |
1х10 |
1,0 |
1,0 |
25 |
50 |
100 |
|
- комбинированной |
5х10 |
0,01 |
0,01 |
25 |
100 |
100 |
|
Торты, пирожные и рулеты бисквитные, песочные, заварные, слоеные, воздушные, крошковые без отделки |
1х10 |
0,1 |
0,1 |
25 |
50 |
50 |
|
На поверхности среды типа Байрд-Паркера S. aureus растут в виде черных, блестящих, слегка выпуклых колоний диаметром 1-1,5-2 мм, окруженных зоной просветления среды шириной 1-3 мм (лецитиназная реакция).
На ЖСА колонии S. aureus имеют форму выпуклых дисков диаметром 2-4 мм белого, желтого, кремового, лимонного, золотистого цвета с ровными краями, вокруг колоний образуется радужное кольцо и зона помутнения среды.
При отсутствии типичных колоний на каждой из сред дают заключение об отсутствии золотистых стафилококков в исследуемом количестве продукта и соответствии его нормативу на S. aureus.
При обнаружении на средах типа Байрд-Паркер или ЖСА подозрительных колоний - их микроскопируют. При наличии в мазках гроздьевидных грамположительных мелких кокков из отобранных колоний (не менее трех колоний каждого вида) делают пересев на сектора чашек Петри или в пробирки со скошенным МПА (п.6.3.2.2), посевы выдерживают в термостате при 36±1 °С в течение 16-24 ч. Из культур, выросших на МПА, после предварительной проверки мазка на чистоту под микроскопом, ставят реакцию плазмокоагуляции.
4.4.2.1. Постановка реакции плазмокоагуляции.
В пробирку с 0,5 см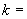 разведенной кроличьей плазмы (п.6.3.2.18) вносят петлю изучаемой суточной агаровой культуры. Параллельно ставят контроль: одну пробирку с плазмой оставляют незасеянной, а в другую засевают заведомо коагулазоноложительный стафилококк. Все пробирки помещают в термостат при температуре 36±1 °С. Учитывают результаты через 1-2-4 ч и оставляют до утра при комнатной температуре для окончательного учета. Ускорение реакции производят за счет использования 3-х и 4-х-часовых бульонных культур стафилококков, добавляя их по 0,1 см
разведенной кроличьей плазмы (п.6.3.2.18) вносят петлю изучаемой суточной агаровой культуры. Параллельно ставят контроль: одну пробирку с плазмой оставляют незасеянной, а в другую засевают заведомо коагулазоноложительный стафилококк. Все пробирки помещают в термостат при температуре 36±1 °С. Учитывают результаты через 1-2-4 ч и оставляют до утра при комнатной температуре для окончательного учета. Ускорение реакции производят за счет использования 3-х и 4-х-часовых бульонных культур стафилококков, добавляя их по 0,1 см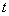 в 0,5 см
в 0,5 см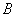 разведенной цитратной плазмы. Пробирки на свертывание плазмы следует просматривать осторожно, чтобы не разрушить образовавшийся сгусток. При учете реакции плазмокоагуляции могут наблюдаться три степени активности фермента коагулазы:
разведенной цитратной плазмы. Пробирки на свертывание плазмы следует просматривать осторожно, чтобы не разрушить образовавшийся сгусток. При учете реакции плазмокоагуляции могут наблюдаться три степени активности фермента коагулазы:
++++ - сгусток плотный;
+++ - сгусток, имеющий небольшой отсек;
++ - сгусток в виде взвешенного мешочка.
Все три варианта являются положительными результатами, которые свидетельствуют о присутствии коагулазоноложительных стафилококков в засеянной массе изделия и несоответствии его микробиологическому нормативу. Отрицательная реакция плазмокоагуляции свидетельствует об отсутствии S. aureus в данной массе продукта.
4.5. Определение дрожжей и плесневых грибов
4.5.1 Сущность метода.
Метод основан на высеве разведений определенного количества продукта в селективную среду, культивировании посевов при 24±1 °С в течение 120 ч, подсчете всех видимых колоний плесневых грибов и дрожжей, типичных по макро- и микроскопической морфологии и пересчете их количеств на 1 г продукта.
При определении количества дрожжей и плесневых грибов необходимо руководствоваться ГОСТом 10444.12-88 с учетом приведенных ниже рекомендаций.
4.5.2 Проведение анализа.
Для определения количества дрожжей и плесневых грибов выбирают те разведения, при посеве которых на чашках вырастает не менее 15 и не более 150 колоний для дрожжей и не менее 5 и не более 50 для плесеней.
По 1 см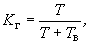 каждого разведения образца, приготовленного по п.3.3, вносят в 2 чашки Петри (параллельное определение). Затем не позже чем через 20 мин, вносят в чашку питательную среду (п.п.6.3.2.20-6.3.2.22), расплавленную на водяной бане и остуженную до 45 °С, осторожно и равномерно перемешивают содержимое чашки. Высота слоя питательной среды должна быть не менее 4-5 мм. Параллельно с этим заливают одну чашку Петри 15-20 см
каждого разведения образца, приготовленного по п.3.3, вносят в 2 чашки Петри (параллельное определение). Затем не позже чем через 20 мин, вносят в чашку питательную среду (п.п.6.3.2.20-6.3.2.22), расплавленную на водяной бане и остуженную до 45 °С, осторожно и равномерно перемешивают содержимое чашки. Высота слоя питательной среды должна быть не менее 4-5 мм. Параллельно с этим заливают одну чашку Петри 15-20 см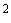 среды для проверки ее стерильности.
среды для проверки ее стерильности.
После застывания среды чашки переворачивают крышками вниз и помещают в термостат при 24±1 °С на 5 сут. Через 3 сут допускается предварительный учет типичных колоний.
Если в посевах на агаризованных средах присутствуют мукоровые, очень быстро растущие грибы, то учет предварительных результатов необходимо проводить очень осторожно, не допуская того, чтобы споры этих грибов осыпались и дали рост вторичных колоний. На пятые сутки проводят окончательный учет результатов посевов. Колонии дрожжей и плесневых грибов различают визуально.
Рост дрожжей сопровождается образованием крупных, выпуклых, блестящих и без блеска, серовато-белых, розоватых, кремовых колоний с гладкой поверхностью и ровным краем.
Развитие плесневых грибов на питательных средах сопровождается появлением мицелия различной окраски.
Для количественного подсчета отбирают те чашки, на которых выросло 15-150 колоний дрожжей и (или) 5-50 колоний плесневых грибов.
5. Микробиологические нормативы для кондитерских изделий с кремом
В табл.2 отражены микробиологические нормативы для кондитерских изделий с кремом, изготовленных по традиционным технологиям (ОСТ 10-060-95) и имеющих, согласно СанПиН 42-123-4117-86 "Условия и сроки хранения особо скоропортящихся продуктов", срок реализации от 6 до 72 ч при хранении от 2 до 6 °С. Эти нормативы соответствуют СанПиН 2.3.2.560-96 "Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов".
В табл.3 отражены рекомендуемые микробиологические нормативы для кондитерских изделий с кремом, изготовленных по усовершенствованным технологиям в целях пролонгирования сроков годности. Указанные технологии включают усиленный входной микробиологический контроль пищевого сырья и компонентов; применение ингредиентов только высшего качества (например, яичного порошка, поступающего по импорту, масла сливочного с содержанием влаги не более 16% и соответствующего по микробиологическим показателям маслу вологодскому); в качестве консервантов - пищевых добавок с антимикробным действием; а также специальных технологических приемов для снижения бактериальной контаминации (например, белок куриного яйца заливают горячим сиропом (80 °С) и т.д. Применение этих приемов позволяет получить продукцию более чистую в микробиологическом отношении, стабильную в хранении и безопасную для потребителей в течение всего пролонгированного срока. Для такой продукции на основании специальных исследований, проведенных в Институте РАМН и других аккредитованных в системе госсанэпиднадзора РФ испытательных лабораториях, были введены пролонгированные сроки годности (до 5-7 сут.) и усовершенствованы микробиологические нормативы.
Таблица 3
Микробиологические нормативы для готовых кондитерских изделий с кремом, изготовленных по усовершенствованной технологии, со сроками годности - 5-7 суток при 4±2 °С
Группа продуктов |
КМАФАнМ, КОЕ/г не более |
Масса продукта (г), в которой не допускается |
Дрожжи, КОЕ/г не более |
Плесени, КОЕ/г не более | ||
БГКП (колиформные) |
S. aureus |
Патогенные, в т.ч. сальмонеллы |
||||
Торты и пирожные бисквитно-кремовые с: |
||||||
- шоколадной глазурью |
1х10 |
0,1 |
0,1 |
25 |
100 |
50 |
- суфле |
1х10 |
0,1 |
0,1 |
25 |
100 |
50 |
- желе и цукатами |
1х10 |
0,1 |
0,1 |
25 |
100 |
50 |
- сбивной начинкой (заварные) |
1х10 |
0,1 |
0.1 |
25 |
100 |
50 |
В табл.4 отражены рекомендуемые микробиологические показатели для кондитерских изделий с кремом, изготовленных по новым технологиям с использованием специальных растительных жиров и их композиций, содержащих насыщенные жирные кислоты, для приготовления отделочных полуфабрикатов типа "сливок".
Таблица 4
Микробиологические нормативы для готовых изделий с кремом, изготовленных с использованием специальных растительных жиров и жировых композиций, содержащих насыщенные жирные кислоты со сроками годности 16-30 суток
Группа продуктов |
КМАФАнМ, КОЕ/г продукта |
Масса продукта (г), в которой не допускается |
Дрожжи, КОЕ/г не более |
Плесени, КОЕ/г не более | ||
БГКП (колиформные) |
S. aureus |
Патогенные, в т.ч. сальмонеллы |
||||
Торты и пирожные бисквитные, заварные, слоеные со взбитыми "сливками" на основе растительных жиров |
1х10 |
0,1 |
0,1 |
25 |
50 |
50 |
С комбинированными отделками на основе растительных жиров и добавлением компонентов, либо применение приемов, снижающих обсеменение (спирт, термообработка) |
5х10 |
1,0 |
1,0 |
25 |
50 |
50 |
В одних случаях используют взбитые "сливки" на основе только специальных растительных жиров; в других случаях белковая масса начинки производится завариванием белка куриных яиц при температуре 70-90 °С, и в сбивную начинку растительного жира со сгущенным молоком добавляют спирт.
Такая продукция имеет более жесткие микробиологические показатели; сроки годности изделий, вырабатываемых по усовершенствованным технологиям и с использованием новых видов жиров, добавок и т.п., устанавливаются на основе проведения обязательных комплексных санитарно-химических и санитарно-микробиологических испытаний каждого конкретного вида продукта в соответствии с требованиями МУК 4.2.2.727-99 "Гигиеническая оценка сроков годности пищевых продуктов". Указанные нормативы и сроки годности включаются в нормативную документацию на эти виды изделий (технические условия) в установленном порядке.
6. Материалы, реактивы и питательные среды
6.1. Перечень средств измерений, оборудования, инвентаря, лабораторной посуды, материалов, реактивов и питательных сред, необходимых для проведения микробиологических анализов, полностью приведен в ГОСТе 27543-87 "Изделия кондитерские. Аппаратура, материалы, реактивы и питательные среды для микробиологических анализов".
6.2. Сухие питательные среды для микробиологических анализов промышленного производства, сертифицированные в системе ГСЭН РФ или имеющие НД, согласованные в установленном порядке с Минздравом РФ:
- среда для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов - КМАФАнМ;
- питательный агар (аналог МПА и агара Хоттингера);
- питательный бульон (аналог МПБ и бульона Хоттингера);
- среда Кесслер;
- среда Эндо;
- среда Левина;
- магниевая среда;
- среда Плоскирева;
- висмут-сульфит агар;
- селенитовый бульон;
- среда Олькеницкого;
- среда Ресселя;
- среда Гисса с глюкозой;
- среда Гисса с лактозой;
- среда Гисса с сахарозой;
- среда Гисса с маннитом;
- среда Гисса с мальтозой;
- среда Гисса с сорбитом;
- среда Сабуро;
- Байрд-Паркера агар;
- агар солевой;
- бульон солевой;
- сухая цитратная кроличья плазма.
6.3 Приготовление растворов, реактивов, питательных сред
6.3.1 Приготовление растворов и реактивов.
6.3.1.1. 0,1%-ный водный раствор пептона (понтонная вода).
К 1000 см дистиллированной воды добавляют 1 г пептона. После размешивания раствор кипятят, фильтруют и разливают в пробирки, колбы и флаконы в необходимых количествах. Стерилизуют при 121 °С в течение 20 мин. Раствор хранят в условиях, исключающих испарение влаги и нарушение асептики.
дистиллированной воды добавляют 1 г пептона. После размешивания раствор кипятят, фильтруют и разливают в пробирки, колбы и флаконы в необходимых количествах. Стерилизуют при 121 °С в течение 20 мин. Раствор хранят в условиях, исключающих испарение влаги и нарушение асептики.
6.3.1.2 Изотонический 0,85%-ный раствор хлористого натрия (физиологический раствор).
Для приготовления изотонического раствора с рН 6,9-7,0 используют дистиллированную воду, рН которой проверяют индикатором бромтимолблау. При его добавлении цвет воды должен быть бутылочно-зеленым. В иных случаях воду не используют.
В 1000 см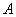 воды растворяют 8,5 г хлористого натрия, разливают раствор в пробирки, колбы и флаконы в необходимых количествах и стерилизуют в течение 20 мин при 121 °С. Раствор хранят в условиях, исключающих испарение влаги и нарушение асептики.
воды растворяют 8,5 г хлористого натрия, разливают раствор в пробирки, колбы и флаконы в необходимых количествах и стерилизуют в течение 20 мин при 121 °С. Раствор хранят в условиях, исключающих испарение влаги и нарушение асептики.
6.3.1.3. 5%-ный раствор 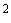 -нафтола.
-нафтола.
Взвешивают 5,0 г  -нафтола, растворяют в 100 см
-нафтола, растворяют в 100 см 96%-ного этилового спирта. Хранят раствор при температуре 4±1 °С.
96%-ного этилового спирта. Хранят раствор при температуре 4±1 °С.
6.3.1.4 Реактивы для окраски по Граму (модификация Г.П.Калины).
Реактив 1
К 1000 см этилового спирта добавляют 0,5 г кристаллического фиолетового.
этилового спирта добавляют 0,5 г кристаллического фиолетового.
Реактив 2
К 96 см 0,5%-ного спиртового раствора йодистого калия добавляют 2 см
0,5%-ного спиртового раствора йодистого калия добавляют 2 см 5%-ного спиртового раствора основного фуксина и 2 см
5%-ного спиртового раствора основного фуксина и 2 см 5%-ного спиртового раствора йода.
5%-ного спиртового раствора йода.
Примечание. Растворение йодистого калия в спирте рекомендуется проводить в водяной бане при температуре 45-50 °С при постоянном помешивании.
6.3.1.5. Реактив на индол (Эрлиха).
Взвешивают 5,0 г пара-диметиламинобензальдегида в стеклянном стакане вместимостью 100 см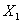 , помещают в коническую колбу вместимостью 200 см
, помещают в коническую колбу вместимостью 200 см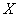 и растворяют в 50 см
и растворяют в 50 см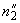 этилового спирта. С помощью мерного цилиндра вместимостью 100 см
этилового спирта. С помощью мерного цилиндра вместимостью 100 см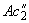 медленно добавляют 50 см
медленно добавляют 50 см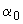 концентрированной соляной кислоты. Раствор хранят в колбе с притертой пробкой при температуре 4 °С.
концентрированной соляной кислоты. Раствор хранят в колбе с притертой пробкой при температуре 4 °С.
6.3.1.6 Реактив на индол (Ковача).
Взвешивают 5,0 г пара-диметиламинобензальдегида в стеклянном стакане вместимостью 100 см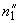 , помещают в коническую колбу вместимостью 200 см
, помещают в коническую колбу вместимостью 200 см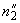 и растворяют в 75 см
и растворяют в 75 см изобутилового спирта. С помощью мерного цилиндра вместимостью 100 см
изобутилового спирта. С помощью мерного цилиндра вместимостью 100 см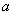 медленно добавляют 25 см
медленно добавляют 25 см концентрированной соляной кислоты. Раствор хранят в колбе с притертой пробкой при температуре 4 °С.
концентрированной соляной кислоты. Раствор хранят в колбе с притертой пробкой при температуре 4 °С.
6.3.2. Приготовление питательных сред.
6.3.2.1 Мясо-пептонный бульон (МПБ).
Говяжье мясо, освобожденное от жира и сухожилий, пропускают через мясорубку, взвешивают, складывают в кастрюлю, смешивают с двойным количеством водопроводной воды и оставляют на 12-14 ч при температуре 4-6 °С. Для ускорения процессов экстракции питательных веществ содержимое кастрюли подогревают при 50 °С в течение 1 ч и затем кипятят 30 мин.
После кипячения бульон в горячем состоянии фильтруют через двойной бумажный или ватно-марлевый фильтр, фильтрат измеряют и добавляют к нему водопроводную воду до первоначального объема, а также 1%-ного пептона и 0,5%-ной поваренной соли. После установления рН 7,2-7,4 бульон разливают в колбы и стерилизуют при 121 °С в течение 20 мин. При необходимости бульон перед использованием фильтруют через складчатый фильтр, разливают и повторно стерилизуют при 121 °С в течение 15 мин.
6.3.2.2. Мясо-пептонный агар.
В 1 дм мясо-пептонного бульона добавляют 15-20 г микробиологического агар-агара. После 10-15-минутного набухания агар-агара смесь кипятят при постоянном помешивании до полного его растворения. Полученную среду после установления рН 7,2-7,4 фильтруют в горячем виде через ватно-марлевый фильтр, разливают в колбы, флаконы и пробирки и стерилизуют при 121 °С 20 мин.
мясо-пептонного бульона добавляют 15-20 г микробиологического агар-агара. После 10-15-минутного набухания агар-агара смесь кипятят при постоянном помешивании до полного его растворения. Полученную среду после установления рН 7,2-7,4 фильтруют в горячем виде через ватно-марлевый фильтр, разливают в колбы, флаконы и пробирки и стерилизуют при 121 °С 20 мин.
6.3.2.3. Мясо-пептонный бульон (агар) с глюкозой.
К 1 дм мясо-пептонного бульона перед стерилизацией добавляют 1 г или 10 г глюкозы, устанавливают рН 7,0-7,2 и стерилизуют 20 мин при 121 °С.
мясо-пептонного бульона перед стерилизацией добавляют 1 г или 10 г глюкозы, устанавливают рН 7,0-7,2 и стерилизуют 20 мин при 121 °С.
6.3.2.4 Специальная питательная среда для определения общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов:
питательный агар сухой |
35 г; | |
экстракт кормовых дрожжей |
2,5 г; | |
глюкоза |
1 г; | |
вода дистиллированная |
до 1000 см | |
рН |
7,0; |
стерилизация в автоклаве при 121 °С в течение 20 мин.
Среда для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (общего количества бактерий) также выпускается в сухом виде и готовится согласно прилагаемой прописи.
6.3.2.5. Среда Кесслер (с лактозой).
К 1000 см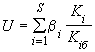 водопроводной воды добавляют 10 г пептона и 50 см
водопроводной воды добавляют 10 г пептона и 50 см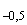 стерильной бычьей желчи. Смесь кипятят на водяной бане при помешивании 20-30 мин. Затем фильтруют ее через ватно-марлевый фильтр, добавляют 2,5 г лактозы; доводят объем до 1000 см
стерильной бычьей желчи. Смесь кипятят на водяной бане при помешивании 20-30 мин. Затем фильтруют ее через ватно-марлевый фильтр, добавляют 2,5 г лактозы; доводят объем до 1000 см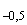 . Устанавливают рН 7,4-7,6, используя 1н растворы NaOH или НСl и проверяя значение рН на рН-метре или универсальной индикаторной бумагой. Добавляют 4 см
. Устанавливают рН 7,4-7,6, используя 1н растворы NaOH или НСl и проверяя значение рН на рН-метре или универсальной индикаторной бумагой. Добавляют 4 см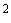 1%-ного водного раствора генцианового (кристаллического) фиолетового, разливают в пробирки и колбы в необходимых количествах, закладывают поплавки. Стерилизуют 15 мин при 121 °С.
1%-ного водного раствора генцианового (кристаллического) фиолетового, разливают в пробирки и колбы в необходимых количествах, закладывают поплавки. Стерилизуют 15 мин при 121 °С.
Возможно использование сухой модифицированной среды Кесслер (п.6.2).
Подготовку среды для посева и стерилизацию проводят согласно прописи на этикетке.
6.3.2.6. Дифференциально-диагностические среды (сухие).
висмут-сульфит агар (Вильсона-Блера);
среду Эндо;
среду Левина:
среду Плоскирева, выпускаемые в сухом виде, следует готовить согласно прописям, указанным на этикетках. Приготовленные и разлитые в стерильные чашки Петри среды можно хранить при температуре 4 °С до 10 суток.
6.3.2.7. Среда на индол.
10,0 г сухого панкреатического гидролизата казеина (или 100 см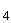 жидкого панкреатического гидролизата казеина с содержанием 500 мг % аминного азота), 5,0 г хлористого натрия, 1,0 г DL-триптофана растворяют в 1000 см
жидкого панкреатического гидролизата казеина с содержанием 500 мг % аминного азота), 5,0 г хлористого натрия, 1,0 г DL-триптофана растворяют в 1000 см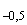 дистиллированной воды. Доводят рН до 7,0 1н растворами NaOH или НСl и измеряя значение рН на потенциометре или по универсальной индикаторной бумаге, разливают в пробирки по 5 см
дистиллированной воды. Доводят рН до 7,0 1н растворами NaOH или НСl и измеряя значение рН на потенциометре или по универсальной индикаторной бумаге, разливают в пробирки по 5 см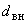 , стерилизуют 15 мин при 121 °С.
, стерилизуют 15 мин при 121 °С.
6.3.2.8. Пептонно-буферный раствор:
калия дигидрофосфат ( |
0,45 г; | |
натрия гидрофосфат, безводный ( |
5,34 г; | |
пептонная вода (1 г пептона + 1000 см |
1000 см |
Приготовление: ингредиенты смешивают, разливают в пробирки и флаконы, стерилизуют в автоклаве при 121 °С 30 мин.
6.3.2.9. Среда Мюллера (тетратионатовый бульон Мюллера), мел,
стерилизованный |
45 г; или | |
кальция карбонат ( |
25 г; | |
мясо-пептонный бульон |
900 см | |
раствор Люголя |
20 см | |
натрия тиосульфат ( |
100 см |
Приготовление: в стерильные флаконы помещают по 4,5 г мела, стерилизуют сухим жаром, после чего в каждый флакон наливают по 90 см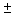 МПБ. Стерилизуют при 121 °С 30 мин (рН 7,2-7,4). Затем асептически добавляют в каждый флакон по 2 см
МПБ. Стерилизуют при 121 °С 30 мин (рН 7,2-7,4). Затем асептически добавляют в каждый флакон по 2 см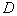 раствора Люголя и по 10 см
раствора Люголя и по 10 см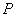 раствора натрия тиосульфата, хорошо смешивают и разливают по пробиркам. Готовая среда стерилизации не подлежит.
раствора натрия тиосульфата, хорошо смешивают и разливают по пробиркам. Готовая среда стерилизации не подлежит.
Приготовление раствора Люголя:
калий йодид ( |
20 г; | |
йод кристаллический ( |
25 г; | |
вода дистиллированная |
100 см |
Приготовление 50%-ного раствора натрия тиосульфата: в мерный цилиндр насыпают 50 г натрия тиосульфата и добавляют воду до 100 см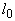 , растворяют, переливают во флакон, стерилизуют текучим паром 30 мин.
, растворяют, переливают во флакон, стерилизуют текучим паром 30 мин.
6.3.2.10. Тетратионатная среда (Мюллер-Kaуфман):
среда Мюллера (стерильная) |
500 см | |
желчь бычья (стерильная) |
250 см | |
бриллиантовый зеленый (0,1%-ный водный раствор) |
50 см |
Приготовление: ингредиенты смешивают, асептически разливают в стерильные пробирки по 10 см , дополнительно не стерилизуют.
, дополнительно не стерилизуют.
20%-ный желчный бульон:
бульон мясо-пептонный (или Хоттингера) |
800 см | |
желчь бычья нативная |
200 см |
Приготовление: рН должен быть равен 7,6. Разливают по 50 см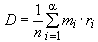 во флаконы с поплавками. Стерилизуют текучим паром три дня по 30 мин.
во флаконы с поплавками. Стерилизуют текучим паром три дня по 30 мин.
6.3.2.11. Магниевая среда.
Среда состоит из трех растворов:
Раствор 1:
пептон |
4,2 г; | |
натрия хлорид ( |
7,15 г; | |
калия дигидрофосфат ( |
1,48 г; | |
дрожжевой диализат |
9 см | |
вода дистиллированная |
890 см |
Раствор 2:
магния хлорид ( |
35 г; | |
вода дистиллированная |
90 см |
Раствор 3:
Бриллиантовый зеленый 0,5%-ный |
0,9 см |
Приготовление: Все три раствора смешивают в указанных количествах, разливают в необходимых объемах в колбы, флаконы или пробирки, стерилизуют при 121 °С 30 мин.
6.3.2.12. Селенитовый бульон.
Среду готовят из двух основных растворов: А и Б.
Раствор А состоит из 5 г пептона, 7 г безводного двузамещенного фосфорнокислого натрия, 4 г х. ч. лактозы, 100 см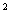 дистиллированной воды рН 6,9-7,1. Раствор стерилизуют при 121 °С 30 мин.
дистиллированной воды рН 6,9-7,1. Раствор стерилизуют при 121 °С 30 мин.
Раствор Б состоит из 10%-ного раствора кислого селенитокислого натрия, приготовленного на стерильной воде. Раствор готовят непосредственно перед употреблением.
Для приготовления среды в 50 см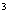 раствора А стерильно добавляют 2 см
раствора А стерильно добавляют 2 см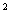 раствора Б. Среду разливают в стерильные пробирки по 5-7 см
раствора Б. Среду разливают в стерильные пробирки по 5-7 см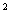 , но не стерилизуют, т.к. при этом выпадает осадок красного цвета и среда становится непригодной.
, но не стерилизуют, т.к. при этом выпадает осадок красного цвета и среда становится непригодной.
Селенитовая среда выпускается также в сухом виде и готовится по прилагаемой прописи.
6.3.2.13. Комбинированная среда по Олькеницкому:
агар питательный сухой |
25 г; | |
лактоза |
10 г; | |
аммоний-железа (II) сульфат |
0,2 г; | |
натрия тиосульфат ( |
0,3 г; | |
мочевина |
10 г; | |
феноловый красный (0,4% водный раствор) |
4 см | |
вода дистиллированная |
1000 см |
Приготовление: соли предварительно растворяют в небольшом количестве дистиллированной воды. Углеводы и мочевину также растворяют в небольших объемах воды при подогревании на водяной бане. Сухой питательный агар расплавляют в оставшемся количестве воды при нагревании и помешивании. Затем все ингредиенты соединяют, перемешивают с расплавленным агаром, фильтруют через марлевый фильтр устанавливают рН 7,2-7,4, добавляют индикатор и разливают в пробирки по 6-7 см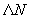 .
.
Среду стерилизуют текучим паром 3 дня подряд по 20 мин и скашивают, оставляя столбик 2-2,5 см. Готовая среда бледно-розового цвета.
Комбинированная среда по Олькеницкому выпускается также в сухом виде и готовится по прилагаемой прописи.
6.3.2.14. Среды для идентификации:
агар Клиглера;
среда Ресселя;
среды Гисса (среды с сахарами) выпускаются в сухом виде. Их приготовление указано на этикетках.
6.3.2.15. Агглютинирующие адсорбированные диагностические сальмонеллезные сыворотки (поливалентные О- и Н групп A, В, С, Д, Е и редких групп).
Необходимые разведения сыворотки готовят перед использованием согласно прилагаемой инструкции.
6.3.2.16. Солевой бульон.
К 100 см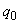 мясо-пептонного бульона (МПБ) с рН 7,2-7,4 в колбе вместимостью 200 см
мясо-пептонного бульона (МПБ) с рН 7,2-7,4 в колбе вместимостью 200 см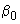 добавляют 6,5 г хлористого натрия и разливают в пробирки по 10 см
добавляют 6,5 г хлористого натрия и разливают в пробирки по 10 см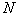 . Стерилизуют в автоклаве при 121 °С в течение 20 мин.
. Стерилизуют в автоклаве при 121 °С в течение 20 мин.
6.3.2.17. Агар типа Байрд-Паркер.
30 г сухого питательного агара размешивают в 1 дм дистиллированной воды, добавляют 10 г пирувата натрия, 5 г хлористого лития, тщательно перемешивают и кипятят в течение 1 мин до полного растворения ингредиентов. Устанавливают рН 7,2. Разливают по флаконам объемами 100-200-300 см
дистиллированной воды, добавляют 10 г пирувата натрия, 5 г хлористого лития, тщательно перемешивают и кипятят в течение 1 мин до полного растворения ингредиентов. Устанавливают рН 7,2. Разливают по флаконам объемами 100-200-300 см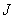 в зависимости от потребности и стерилизуют при 121 °С 15 мин. Среда может храниться в течение месяца в условиях холодильника. Перед употреблением в растопленную и охлажденную до 45-50 °С среду с соблюдением правил асептики прибавляют (из расчета на 100 см
в зависимости от потребности и стерилизуют при 121 °С 15 мин. Среда может храниться в течение месяца в условиях холодильника. Перед употреблением в растопленную и охлажденную до 45-50 °С среду с соблюдением правил асептики прибавляют (из расчета на 100 см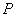 среды) 0,5 см
среды) 0,5 см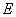 2%-ного раствора теллурита калия и 5 см
2%-ного раствора теллурита калия и 5 см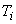 эмульсии яичного желтка. Среду тщательно перемешивают и разливают в чашки Петри в объеме не менее 20 см
эмульсии яичного желтка. Среду тщательно перемешивают и разливают в чашки Петри в объеме не менее 20 см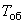 на чашку. Чашки со средой могут быть использованы в течение 24 ч, максимум 48 ч. Перед посевом чашки со средой подсушивают в термостате общепринятым способом.
на чашку. Чашки со средой могут быть использованы в течение 24 ч, максимум 48 ч. Перед посевом чашки со средой подсушивают в термостате общепринятым способом.
6.3.2.18. Нитратная плазма кролика.
Цитратная плазма кролика для реакции плазмокоагуляции выпускается в сухом виде. Готовят непосредственно перед употреблением согласно прописи в прилагаемом наставлении.
6.3.2.19. Желточно-солевой агар (ЖСА).
Основа - солевой агар: к мясо-пептонному бульону (МПБ) с рН 7,2-7,4 добавляют 2%-ного агара и 6,5%-ного хлористого натрия, расплавляют на водяной бане, при необходимости фильтруют через ватно-марлевый фильтр, разливают мерным цилиндром по 100 см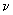 в колбы вместимостью 250 см
в колбы вместимостью 250 см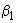 и стерилизуют при 121 °С в течение 30 мин. Получают солевой агар. Вместо МПБ можно использовать сухой питательный агар, добавив к нему 6,5%-ного хлористого натрия.
и стерилизуют при 121 °С в течение 30 мин. Получают солевой агар. Вместо МПБ можно использовать сухой питательный агар, добавив к нему 6,5%-ного хлористого натрия.
ЖСА: на 100 см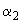 стерильного расплавленного и остуженного до 45 °С солевого агара добавляют 20 см
стерильного расплавленного и остуженного до 45 °С солевого агара добавляют 20 см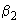 эмульсии яичного желтка. После полного размешивания желточно-солевой агар разливают в стерильные чашки Петри по 20- 25 см
эмульсии яичного желтка. После полного размешивания желточно-солевой агар разливают в стерильные чашки Петри по 20- 25 см и хранят в холодильнике 5-7 дней.
и хранят в холодильнике 5-7 дней.
Эмульсия яичного желтка: на дно стерильной чашки Петри помещают куриное яйцо, которое тщательно протирают ватой, смоченной этиловым спиртом. Стерильным пинцетом пробивают с двух противоположных сторон яйца два отверстия. Через одно из этих отверстий из яйца полностью удаляют белок, а затем, несколько увеличив отверстие, выливают желток в стерильную колбу вместимостью 200 см . Желток добавляют в колбу с 4-мя объемами стерильного физиологического раствора, затем содержимое тщательно встряхивают до получения гомогенной массы.
. Желток добавляют в колбу с 4-мя объемами стерильного физиологического раствора, затем содержимое тщательно встряхивают до получения гомогенной массы.
6.3.2.20. Среда Сабуро (основа среды).
40 г глюкозы, 10 г пептона, 18 г агара добавляют к 1 дм дистиллированной воды. Смесь подогревают, периодически помешивая, до расплавления составных частей, охлаждают до 45-50 °С, устанавливают рН так, чтобы после стерилизации он составлял при 25 °С 6,5±0,1, разливают в мерные колбы и стерилизуют при 121 °С 15 мин.
дистиллированной воды. Смесь подогревают, периодически помешивая, до расплавления составных частей, охлаждают до 45-50 °С, устанавливают рН так, чтобы после стерилизации он составлял при 25 °С 6,5±0,1, разливают в мерные колбы и стерилизуют при 121 °С 15 мин.
Основу среды хранят при температуре 2-6 °С не более 14 сут.
6.3.2.21. Среда с лизином.
10,0 г L-лизина или L-лизина монохлорида, 5,0 г пептона, 3,0 г дрожжевого экстракта, 1,0 г глюкозы, 0,012 г бромкрезоллового пурпурного (или 0,6 см 1,6%-ного спиртового раствора) растворяют в 1000 см
1,6%-ного спиртового раствора) растворяют в 1000 см кипящей дистиллированной воды, устанавливают рН таким образом, чтобы после стерилизации он составлял при 25 °С 6,8±0,1. Среду разливают в узкие бактериологические пробирки по 5 см
кипящей дистиллированной воды, устанавливают рН таким образом, чтобы после стерилизации он составлял при 25 °С 6,8±0,1. Среду разливают в узкие бактериологические пробирки по 5 см и стерилизуют при 110 °С 30 мин. Среда имеет светло-фиолетовый цвет. Используют в день приготовления.
и стерилизуют при 110 °С 30 мин. Среда имеет светло-фиолетовый цвет. Используют в день приготовления.
6.3.2.22. Питательные среды с антибиотиками.
Среда агаризованная с левомицетином.
К 1 дм основы (п.6.3.2.20) добавляют 2 см
основы (п.6.3.2.20) добавляют 2 см раствора левомицетина сукцината растворимого (для инъекций) массовой концентрацией 50 г/дм
раствора левомицетина сукцината растворимого (для инъекций) массовой концентрацией 50 г/дм или 1 см
или 1 см раствора массовой концентрацией 100 г/дм
раствора массовой концентрацией 100 г/дм . При использовании левомицетина массовой концентрации 5 г/дм
. При использовании левомицетина массовой концентрации 5 г/дм к 980 см
к 980 см основы добавляют 20 см
основы добавляют 20 см раствора.
раствора.
Среда агаризованная с окситетрациклином.
К 900 см основы добавляют 100 см
основы добавляют 100 см раствора окситетрациклина дигидрата массовой концентрацией 1г/дм
раствора окситетрациклина дигидрата массовой концентрацией 1г/дм .
.
Среда агаризованная с окситетрациклином и гентамицином.
К 890 см основы добавляют 100 см
основы добавляют 100 см раствора окситетрациклина дигидрата массовой концентрацией 1 г/дм
раствора окситетрациклина дигидрата массовой концентрацией 1 г/дм и 5 см
и 5 см раствора гентамицина массовой концентрацией 10 г/дм
раствора гентамицина массовой концентрацией 10 г/дм .
.
Среда агаризованная с антибиотиками группы пенициллина и стрептомицина
К 1 дм основы добавляют 1 или 0,5 см
основы добавляют 1 или 0,5 см раствора антибиотика группы пенициллина, содержащего соответственно 50000 или 100000 ЕД, затем к среде добавляют 0,4 см
раствора антибиотика группы пенициллина, содержащего соответственно 50000 или 100000 ЕД, затем к среде добавляют 0,4 см раствора антибиотика группы стрептомицина массовой концентрацией 100 г/дм
раствора антибиотика группы стрептомицина массовой концентрацией 100 г/дм .
.
Среда агаризованная с неомицином сульфатом.
К 1 дм основы добавляют 7 см
основы добавляют 7 см раствора неомицина сульфата массовой концентрацией 50 г/дм
раствора неомицина сульфата массовой концентрацией 50 г/дм .
.
При использовании раствора неомицина сульфата массовой концентрацией 10 г/дм к 965 см
к 965 см основы добавляют 35 см
основы добавляют 35 см раствора.
раствора.
6.3.2.23. Солодовое агаризованное сусло.
Солодовое сусло готовят по ГОСТу 10444.1-84.
В 1 л водопроводной воды с температурой 50 °С вносят 250 г ячменного неферментированного солода, перемешивают и ставят на водяную баню. В течение 30 мин поддерживают температуру смеси 45 °С. Затем температуру затора медленно (не быстрее, чем на 1 °С в мин) доводят до 63 °С и эту температуру поддерживают до конца осахаривания (в течение 2 ч). Осахаренный затор фильтруют через сито, отжимают и после остывания устанавливают плотность сусла по сахарометру 3 Б или 6 Б. Сусло разливают в колбы, добавляют 2%-ного агара и стерилизуют в автоклаве при 112 °С в течение 30 мин. Допускается использование готового неохмеленнного пивного сусла.
Для определения дрожжей и грибов в продуктах, сильно обсемененных микроорганизмами, сусло при приготовлении подкисляют стерильным раствором лимонной кислоты массовой концентрацией 200 г/дм или стерильным раствором молочной кислоты с объемной долей молочной кислоты 40% до рН 3,6±0,1, при этом при приготовлении среды увеличивают количество агара до 30 г/дм
или стерильным раствором молочной кислоты с объемной долей молочной кислоты 40% до рН 3,6±0,1, при этом при приготовлении среды увеличивают количество агара до 30 г/дм .
.
6.3.2.24. Питательный полужидкий агар.
3,0 г мясного экстракта, 5,0 г пептона, 4-8 г агара растворяют в 1000 см дистиллированной воды. Устанавливают рН таким образом, чтобы после стерилизации он составлял 7,0±0,1. Среду разливают в пробирки по 5-7 см
дистиллированной воды. Устанавливают рН таким образом, чтобы после стерилизации он составлял 7,0±0,1. Среду разливают в пробирки по 5-7 см и стерилизуют при 121 °С 20 мин.
и стерилизуют при 121 °С 20 мин.
6.3.2.25. Среда с салицином.
10,0 г пептона, 5,0 г натрия хлорида, 10 мл индикатора Андреде*, 2-4 г агара растворяют в 1000 см дистиллированной воды, устанавливают рН 7,1-7,2 и стерилизуют при 121 °С в течение 15 мин; к стерильной основе добавляют салицин в количестве 0,5% (5 г на 1000 см
дистиллированной воды, устанавливают рН 7,1-7,2 и стерилизуют при 121 °С в течение 15 мин; к стерильной основе добавляют салицин в количестве 0,5% (5 г на 1000 см основы среды) растворяют и разливают в стерильные пробирки по 3-4 см
основы среды) растворяют и разливают в стерильные пробирки по 3-4 см и стерилизуют при 110 °С в течение 30 мин (или дробной стерилизацией текучим паром два дня по 30 мин).
и стерилизуют при 110 °С в течение 30 мин (или дробной стерилизацией текучим паром два дня по 30 мин).
_______________
* В качестве индикатора рН могут также быть использованы растворы бромтимолового синего, фенолового красного или бромкрезолового пурпурного.
Список литературы
1. СанПиН 2.3.2.560-96. Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов. - М., 1996.
2. Методические указания по проведению санитарно-бактериологических исследований на предприятиях, вырабатывающих кондитерские кремовые изделия. - М., 1975.
3. Рецептуры на торты, пирожные, кексы и рулеты. Ч.I, II, III. - М., 1977.
4. Технологические инструкции по производству мучных кондитерских изделий. - М. 1992.
5. ГОСТ 5904-82. Изделия кондитерские. Правила приемки, методы отбора и подготовки проб.
6. ГОСТ 10444.1-84. Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе.
7. ГОСТ 10444.2-94. Продукты пищевые. Методы выявления и определения количества Staphylococcus aureus.
8. ГОСТ 10444.12-88. Продукты пищевые. Метод определения дрожжей и плесневых грибов.
9. ГОСТ 10444.15-94. Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов.
10. ГОСТ 26668-85. Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов.
11. ГОСТ 26669-85. Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов.
12. ГОСТ 26670-91. Продукты пищевые. Методы культивирования микроорганизмов.
13. ГОСТ 27543-87. Изделия кондитерские. Аппаратура, материалы, реактивы и питательные среды микробиологических анализов.
14. ГОСТ Р 50474-93. Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий).
15. ГОСТ Р 50480-93. Продукты пищевые. Метод выявления бактерий рода Salmonella.
Текст документа сверен по:
официальное издание
М.: Федеральный центр госсанэпиднадзора
Минздрава России, 1999


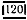
 ;
;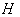 )
)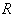 дистиллированной воды)
дистиллированной воды)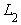 .
.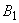 ), сухой стерильный
), сухой стерильный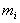 ;
;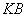 .
. )
) .
.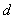 ;
;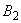 .
.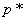 .
. )
)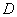 )
)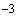 ;
;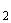 )
) .
.
 )
) )
) ;
;