- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
СП 1.2.011-94
САНИТАРНЫЕ ПРАВИЛА И НОРМЫ
1.2. ЭПИДЕМИОЛОГИЯ
БЕЗОПАСНОСТЬ РАБОТЫ С МИКРООРГАНИЗМАМИ I-II ГРУПП ПАТОГЕННОСТИ
Safety work with microorganisms of I-II groups of pathogenicity
Дата введения - с момента опубликования
1. РАЗРАБОТАНЫ:
- Госкомсанэпиднадзором России (Федеров Ю.М.).
- Противочумным центром Госкомсанэпиднадзора России (Пономарева Т.Н., Королев Ю.С., Кюрегян А.А., Головченко Н.Н., Безсмертный В.Е.)
- Российским научно-исследовательским противочумным институтом "Микроб" (Кокушкин А.М., Попов Ю.А., Васенин А.С.)
- Научно-исследовательским институтом профилактической токсикологии и дезинфекции (Пантелеева Л.Г., Арефьева Л.И., Соколова Н.Ф., Потемкин А.С., Рамкова Н.В.)
- Иркутским научно-исследовательским противочумным институтом Сибири и Дальнего Востока (Захлебная О.Д.)
- Ставропольским научно-исследовательским противочумным институтом Кавказа и Закавказья (Юндин Е.В.)
- Волгоградским научно-исследовательским противочумным институтом (Липницкий А.В., Лесовой В.С.)
- Ростовским научно-исследовательским противочумным институтом (Анисимов Б.И.)
- Институтом вирусологии им. Д.И.Ивановского (Львов Д.К., Гайдамович С.Я., Фадеева Л.Л., Дерябин П.Г., Буденко А.М., Терских И.И., Слепушкин А.Н.)
- Научно-исследовательским институтом эпидемиологии и микробиологии им. Н.Ф.Гамалеи (Вертиев Ю.В., Тарасевич И.В.)
2. УТВЕРЖДЕНО И ВВЕДЕНО В ДЕЙСТВИЕ Постановлением Госкомсанэпиднадзора России от 04.05.1994 г.
3. ВВОДЯТСЯ ВПЕРВЫЕ ВЗАМЕН "Инструкции о противоэпидемическом режиме работы с материалом, зараженном или подозрительным на зараженность возбудителями инфекционных заболеваний I-II групп", утвержденной Минздравом СССР 29 июня 1978 г.
1. Область применения
Настоящие правила подготовлены в соответствии с "Положением о порядке разработки, утверждения, издания, введения в действие федеральных, республиканских и местных санитарных правил, а также о порядке действия на территории РСФСР общесоюзных санитарных правил", утвержденным постановлением Совета Министров РСФСР от 01.07.91 N 375, и устанавливает требования к организации работы с микроорганизмами I-II групп патогенности.
Требования правил обязательны для выполнения всеми учреждениями на территории Российской Федерации независимо от их ведомственной принадлежности и форм собственности, а также должностными лицами и гражданами, проводящими работы с использованием микроорганизмов I-II групп патогенности (приложение 5.1) или материала, подозрительного на их содержание*.
________________
* - далее - биологический материал I-II групп патогенности
Правила направлены на обеспечение личной и общественной безопасности работы с биологическим материалом I-II групп патогенности и предусматривают проведение следующих мероприятий:
- организационных, заключающихся в рациональной планировке оборудованных соответствующими инженерно-техническими системами помещений; обеспечении лабораторий необходимыми средствами индивидуальной и коллективной защиты; укомплектовании соответствующим по подготовке персоналом; использовании в работе только проверенных, безопасных методов работы, а также надежных средств и методов обеззараживания; наличии эффективных планов по локализации и ликвидации последствий аварий; строгом контроле за выполнением настоящих правил сотрудниками со стороны администрации учреждения и комиссии по контролю за соблюдением требований биологической безопасности*; обеспечении надежным источником электроэнергии, водоснабжения и др. (степень надежности определяется в зависимости от вида биологического материала, характера выполняемых исследований);
_________________
* - далее - Комиссия
- регламентирующих ограничение крута лиц, допущенных к работе с биологическим материалом I-II групп; выезд сотрудников, работающих с этим материалом или принимающих участие в локализации и ликвидации эпидемических очагов; выезд населения при эпидемических проявлениях чумы, холеры и высококонтагиозных вирусных геморрагических лихорадок;
- специальных, предусматривающих прием на работу лиц, не имеющих противопоказаний к вакцинопрофилактике; медицинское наблюдение за персоналом; использование специфической иммунопрофилактики для персонала; изоляцию и профилактическое лечение лиц, контактировавших с возбудителем при аварии и проведении мероприятий по тщательной дезинфекции с целью предупреждения выноса инфекции за пределы помещения, где произошла авария.
2. Нормативные ссылки
В настоящих правилах использованы ссылки на следующие нормативные документы:
2.1. Закон РСФСР "О санитарно-эпидемиологическом благополучии населения".
2.2. Приказ Минздрава СССР от 29.09.89 г. N 555 "О совершенствовании системы медицинских осмотров трудящихся и водителей индивидуальных транспортных средств".
2.3. "Положение о порядке учета, хранения, обращения, отпуска и пересылки культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бактериальных токсинов, ядов биологического происхождения". Утверждено Минздравом СССР 18.05.79 г.
2.4. "Инструкция по лиофильному высушиванию возбудителей инфекционных заболеваний I-II групп на коллекторном аппарате системы К.Е.Долинова". Утверждена Минздравом СССР 12.03.79 г.
2.5. Санитарно-противоэпидемические правила "Безопасность работ с рекомбинантными молекулами ДНК". Утверждены Минздравом СССР 12.01.89 г.
2.6. "Инструкция по первичной обработке материала, зараженного или подозрительного на зараженность возбудителями чумы, холеры, туляремии, бруцеллеза и сибирской язвы при проведении гистоцитоэнзимохимических исследований". Утверждена ГУКИ МЗ СССР (1984 г.)
2.7. "Методические указания по контролю работы паровых и воздушных стерилизаторов". Утверждены ГЭУ Минздрава СССР (1991 г.)
2.8. "Инструкция по режиму работы с аэрозолями возбудителей особо-опасных и других бактериальных инфекций". Утверждена Минздравом СССР 18.11.76 г.
2.9. "Правила техники безопасности, производственной санитарии и санитарно-противоэпидемического режима для предприятий по производству бактерийных и вирусных препаратов". Утверждены Минздравом СССР 10.07.67 г.
3. Требования к организации работы с биологическим материалом I-II групп патогенности
3.1. Общие
3.1.1. Работу с биологическим материалом I-II групп патогенности разрешают лабораториям, имеющим условия для соблюдения требований по безопасности работы, предусмотренных настоящими правилами, и полного разделения диагностических и экспериментальных исследований (к диагностическим - относят исследования объектов биотической и абиотической природы с идентификацией культуры; к экспериментальным - все виды работы с культурой возбудителей I-II групп).
3.1.2. Порядок выдачи разрешений на работу с биологическим материалом I-II групп патогенности регламентирован "Санитарными правилами по безопасности работы с микроорганизмами" Часть I "Порядок выдачи разрешения на работу с микроорганизмами I-IV групп патогенности и рекомбинантными молекулами ДНК" СП 1.2.006-93.
Исследования биологического материала I группы патогенности проводят противочумные и другие специализированные учреждения.
3.1.3. Плановые диагностические исследования на холеру и ботулинический токсин, выполняемые с целью профилактики этих инфекций, проводят бактериологические лаборатории, имеющие разрешение на работу с микроорганизмами III-IV групп.
3.1.4. Разрешение на работу с биологическим материалом I-II групп считают недействительным при перепланировке помещений или изменении технологии работы.
3.1.5. Проекты строительства новых и реконструкции действующих лабораторий должны быть согласованы со службами Государственного санитарно-эпидемиологического надзора и утверждены руководителем учреждения.
3.1.6. Работу с биологическим материалом I-II групп выполняют специалисты с высшим и средним медицинским, биологическим и ветеринарным образованием (для ветеринарных учреждений), окончившие соответствующие курсы специализации и не имеющие противопоказаний к вакцинопрофилактике и лечению специфическими препаратами.
3.1.7. Допуск к работе с экспериментальным и диагностическим материалом оформляют приказом руководителя учреждения один раз в два года после проверки знаний по безопасности работы. Инженерно-технический персонал, дезинфекторы и лабораторные служители проходят подготовку в структурном подразделении и допускаются к работе в соответствии с должностными обязанностями приказом по учреждению.
3.1.8. Разрешение на посещение лаборатории инженерно-техническому персоналу, не работающему постоянно, выдает руководитель учреждения. Посещение осуществляется после прекращения работы и проведения дезинфекции, в сопровождении сотрудника структурного подразделения и регистрируется в журнале.
3.1.9. Специалистов (врачи медицинского и ветеринарного профиля, биологи и др.), постоянно не работающих в учреждении, допускают в помещения, где проводят работу с биологическим материалом, по письменному разрешению руководителя учреждения. Цель посещения и его продолжительность регистрируется в журнале.
3.1.10. Сотрудников, по роду работы соприкасающихся с биологическим материалом I-II групп (кроме холеры), вакцинируют. Имеющих противопоказания допускают к работе отдельным приказом по учреждению. Лиц, имеющих противопоказания к прививкам, к работе в аэрозольных лабораториях и с материалом, зараженным или подозрительным на зараженность возбудителем лихорадки Ку, не допускают.
3.1.11. У всех сотрудников, работающих с биологическим материалом I-II групп (исключая холеру и яды биологического происхождения), проводится ежедневная термометрия, результаты которой фиксируют в журнале и заверяют подписью ответственного врача (научного сотрудника). Для лиц, работающих с возбудителем холеры, устанавливают обязательное обследование на вибриононосительство в случае дисфункции желудочно-кишечного тракта.
3.1.12. Все сотрудники, работающие с биологическим материалом I-II групп, находятся на диспансерном наблюдении. Периодические медицинские осмотры проводятся в соответствии с приказом Минздрава СССР от 29.09.89 г. N 555. Работающим с глубокими микозами осуществляется постановка аллергических проб.
3.1.13. При появлении у сотрудника симптомов, характерных для инфекционного заболевания, вызываемого возбудителем, с которым он работал, сотрудник обязан поставить в известность руководителя подразделения или дежурного по учреждению. Дальнейшее решение принимает руководитель учреждения.
3.1.14. В случае заболевания сотрудника, работавшего с инфекционным материалом или культурами возбудителей чумы, холеры, вирусов I группы, на квартиру больного направляют врача учреждения с целью уточнения эпиданамнеза и решения вопроса о необходимости его изоляции. Результаты посещения регистрируют в журнале и доводят до сведения руководителя учреждения. Вызов врача общемедицинской сети разрешается только после посещения больного врачом учреждения, исключением является обращение по жизненным показаниям. При этом больной или его родственники должны поставить в известность прибывшего врача о характере выполняемой работы и информировать о случившемся руководителя структурного подразделения.
3.1.15. Сотрудники, которые по тем или иным причинам не могут явиться на работу, обязаны в течение двух часов поставить об этом в известность заведующего подразделением. В случае неявки сотрудника в учреждение в течение двух часов от начала работы и отсутствия сведений о его местонахождении, заведующий подразделением принимает меры по установлению его местонахождения и причины отсутствия.
3.1.16. Перенос оборудования, лабораторной и хозяйственной посуды, реактивов, инструментов и т.п. внутри учреждения производят с согласия руководителей заинтересованных подразделений. Вынос перечисленных материалов из учреждения осуществляют после дезинфекции по письменному разрешению руководителя учреждения.
3.1.17. Все виды работ с биологическим материалом I-II групп патогенности проводят с соблюдением принципа парности (не менее двух человек, один из которых - врач или научный сотрудник). Время непрерывной работы с таким материалом ограничивают 4-мя часами, после которых устанавливают 30-60 минутный перерыв. Работа в вечернее и ночное время, а также в выходные и праздничные дни возможна по письменному разрешению руководителя учреждения при условии соблюдения посменной работы и наличия двух человек.
3.1.18. Для индивидуальной защиты персонала используют защитную одежду, описание которой дано в разделе 3.3. Перед сдачей в стирку защитные костюмы обеззараживают.
3.1.19. Дезинфекцию различных объектов при работе с биологическим материалом I-II групп патогенности проводят в соответствии с настоящими правилами (приложение 5.4.), а также действующими инструкциями и руководствами.
3.1.20. Запрещается вызывать сотрудников во время выполнения ими любого вида работ с биологическим материалом.
3.1.21. Прием посетителей, общественная работа и прием пищи разрешают только в специально отведенных помещениях.
3.1.22. Территория и помещения учреждения подлежат круглосуточной охране.
3.1.23. При работе с биологическим материалом I-II групп патогенности, требующей особых методических приемов, необходимо разрабатывать дополнения к настоящим правилам с учетом требований, изложенных в них. Дополнения, изложенные в виде методических рекомендаций, рассматриваются комиссией и утверждаются руководителем учреждения.
3.1.24. Противопожарные и дополнительные правила безопасности в лаборатории (учреждении) необходимо составлять с учетом требований настоящих правил.
3.1.25. Ответственным за организацию биологической безопасности по учреждению в целом является его руководитель, а по подразделениям - их заведующие. Контроль за выполнением требований настоящих правил возлагается в институтах на заместителя руководителя по научной работе, в других учреждениях - на заместителя руководителя по эпидработе.
3.1.26. Помещения микробиологических лабораторий и, в ряде случаев, территория учреждения, по степени опасности для персонала разделяются на три зоны:
I. "Заразная" зона - помещения, в которых проводят работу с биологическим материалом I-II групп патогенности, персонал одет в соответствующий тип защитной одежды.
II. "Условно-заразная" зона - помещения лабораторий (в ряде случаев территории учреждения), где не проводят работу с биологическим материалом, персонал одет в рабочую одежду (пижама, носки, тапочки). В пределах этой зоны осуществляют только транспортировку биологического материала между блоками "заразной" зоны.
III. "Чистая" зона - помещения, где не проводят работу с биологическим материалом, персонал одет в личную одежду.
3.1.27. Сотрудники проходят из "чистой" зоны в "условно-заразную" через санитарный пропускник. Верхнюю одежду оставляют в индивидуальных шкафах, предназначенных для ее хранения, меняют свою обувь на тапочки и проходят в помещение для надевания рабочей одежды.
Разрешается проносить через санпропускник только письменные принадлежности.
Питье воды и курение разрешается в отведенных для этого местах. Уборку помещений "условно-заразной" зоны проводят ежедневно с применением моющих и дезинфицирующих средств.
3.1.28. Перенос материалов и оборудования в пределах "условно-заразной" зоны производит персонал, одетый в рабочую одежду.
Перенос культур возбудителей в контейнерах (биксах) из одного подразделения в другое производят лица, допущенные к работе с биологическим материалом I-II групп, одетые в рабочую одежду, в присутствии сопровождающего.
Перенос заразного материала в баках для автоклавирования, поставленных в металлические поддоны с высокими (20 см) бортиками, производит младший и средний персонал, одетый в противочумный костюм III типа, дополненный фартуком, в сопровождении лаборанта, допущенного к работе с биологическим материалом. Движение осуществляют по определенным маршрутам. На время переноса материала в автоклавную на пути его следования прекращается другое движение.
3.1.29. Режим производственной деятельности в комнатах целевого назначения "условно-заразной" зоны (радиоизотопной, биохимической, электронной микроскопии, препараторской и т.п.) должен соответствовать профилю выполняемой работы с соблюдением требований техники безопасности.
В целях предупреждения аллергических заболеваний работу с убитыми микроорганизмами, высушенными любыми способами, проводят в вытяжных шкафах или настольных боксах с вытяжкой с последующей влажной обработкой бокса.
3.1.30. Вход персонала в бактериологические комнаты (боксы) и выход из них осуществляют через предбоксы (шлюзы). Сотрудники надевают и снимают в предбоксе (шлюзе) защитную одежду.
3.1.31. Уборку бактериологических комнат (боксов) проводит ежедневно до начала рабочего дня младший персонал в рабочей одежде, дополненной резиновыми перчатками, с применением дезинфицирующих средств под наблюдением лаборанта. После влажной уборки на 30-40 минут включают бактерицидные лампы. Лабораторные столы и боксы безопасности готовят лаборанты.
По окончании работы с биологическим материалом объекты с посевами переносят в хранилища (сейфы, холодильники, баки для автоклавирования, термостаты и т.п.), проводят дезинфекцию рабочих поверхностей в помещении, обрабатывают руки 70 ° этиловым спиртом и включают на 30-40 мин бактерицидные лампы.
Перед уходом из помещения сотрудники проверяют отключение газа, воды, ненужных приборов и пр. Помещения "заразной" зоны лаборатории опечатывают и запирают на замок. Открывание и снятие печатей, запирание и опечатывание всей лаборатории производят сотрудники (научные сотрудники, врачи, лаборанты), имеющие соответствующие разрешения руководителя учреждения (лаборатории).
3.1.32. Запрещается проведение в одном и том же помещении диагностических и экспериментальных исследований, а также одновременная работа с диагностическим материалом и живыми вакцинами.
Запрещается проведение любого вида экспериментальных работ с вирулентными антибиотикоустойчивыми штаммами, если в учреждении не имеется лекарственных препаратов (не менее двух), к которым чувствительны используемые штаммы.
Разрешается проведение одновременной работы с разными видами возбудителей в одной бактериологической комнате, если это вызвано производственной необходимостью. При этом биологическая безопасность обеспечивается требованиями, предъявляемыми к работе с наиболее опасным видом.
3.1.33. Просмотр агаровых культур, проведение бактериологической работы с диагностическим материалом, а также с низкими концентрациями (менее 10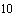 КОЕ/мл)* и малыми объемами (менее 500 мл) вирулентных культур возбудителей I-II групп (кроме сапа, мелиоидоза и возбудителей глубоких микозов) осуществляют за бактериологическим столом в противочумном костюме IV типа. При работе с возбудителями сапа, мелиоидоза и глубоких микозов костюм IV типа дополняют респиратором и перчатками.
КОЕ/мл)* и малыми объемами (менее 500 мл) вирулентных культур возбудителей I-II групп (кроме сапа, мелиоидоза и возбудителей глубоких микозов) осуществляют за бактериологическим столом в противочумном костюме IV типа. При работе с возбудителями сапа, мелиоидоза и глубоких микозов костюм IV типа дополняют респиратором и перчатками.
_________________
* КОЕ - число колоний-образующих единиц или число микробных клеток в 1 миллилитре.
Работу с высокими концентрациями (более 10 КОЕ/мл), большими объемами (более 500 мл), при отсутствии боксов безопасности проводят в противочумном костюме I типа (без сапог).
3.1.34. Заражение эктопаразитов возбудителями I-II групп на биомембране (помещенной в емкость с высокими бортиками), растирание и посев зараженных эктопаразитов на питательные среды проводят за бактериологическим столом в костюме IV типа, дополненным ватно-марлевой повязкой и резиновыми перчатками.
Просмотр зараженных эктопаразитов проводят в костюме IV типа.
Хранение зараженных эктопаразитов осуществляют в пробирках и флаконах, помещенных в холодильники, термостаты, шкафы.
3.1.35. При пипетировании необходимо пользоваться грушами или автоматическими устройствами. При этом кончик пипетки всегда должен быть ниже уровня жидкости в сосуде, или жидкость из пипетки должна стекать по внутренней стенке сосуда. Запрещается переливание жидких культур, продувание через них воздуха из пипеток. Сбор культур с поверхности агара следует проводить петлей, металлическим, стеклянным или пластиковым шпателем.
Перед использованием посуда, пипетки, оборудование, шприцы и т.д. должны быть проверены на целостность и исправность.
Бактериологическая петля должна быть замкнута в непрерывное кольцо и иметь плечо длиной не более 6 см.
3.1.36. Запрещается фиксировать мазки нагреванием. Для фиксации используют 96° этиловый спирт, смесь Никифорова (равное количество спирта и эфира), а при исследовании материала, содержащего возбудителя сибирской язвы или неизвестной этиологии, - 96° этиловый спирт с добавлением 3% перекиси водорода. Время фиксации - 30 мин.
3.1.37. Запрещается оставлять после окончания работы на открытых местах или в неопечатанных хранилищах нефиксированные мазки, объекты с посевами и другие материалы, содержащие биологический материал.
Разрешается оставлять на столах и в боксах безопасности посуду надписанную, но не засеянную, сделав соответствующую надпись.
При необходимости кратковременного выхода (5-10 мин) из бактериологической комнаты сотрудник может оставить объекты с биологическим материалом на столе (в боксе безопасности), если в комнате остается другой сотрудник, или дверь комнаты запирается на замок.
3.1.38. Работу, связанную с риском образования аэрозоля вирулентных микроорганизмов (с высокими концентрациями и большими объемами возбудителей, центрифугирование, гомогенизирование, измельчение тканей, разрушение возбудителей, перенос репликаторами, шуттелирование и т.п.) проводят в боксах безопасности персоналом, одетым в костюм IV типа.
Проведение центрифугирования, шуттелирования и встряхивания культур на аппаратах без защиты (не установленных в боксах безопасности) возможно, как и в боксах безопасности, только в том случае, если контейнеры, содержащие материал, будут выполнены из небьющегося материала и снабжены завинчивающимися герметичными крышками. При этом персонал должен быть одет в костюм I типа.
3.1.39. Перед началом работы в боксе безопасности включают вытяжную вентиляцию, по шкале боксового манометра проверяют наличие отрицательного давления, проверяют исправность оборудования в боксе и загружают материал.
Вся работа должна выполняться ближе к задней стенке бокса и быть видимой снаружи.
Во время работы запрещается открывать дверь бокса безопасности, а после ее прекращения дверь может быть открыта только тогда, когда заразный материал убран в контейнеры и проведена текущая дезинфекция (приложение 5.4.).
После удаления контейнеров с биологическим материалом дверь бокса безопасности закрывают, внутри бокса включают бактерицидные лампы.
Следует учитывать, что боксы безопасности В/О "Изотоп", выполненные из органического стекла, взрыво- и пожароопасны, поэтому для обжига бактериологических петель целесообразно использовать электронагревательные устройства или спиртовки, а не газовые горелки.
3.1.40. Хранение биоматериала I-II групп патогенности, учет их, обмен с другими учреждениями и уничтожение осуществляют согласно действующему "Положению о порядке учета, хранения, обращения, отпуска и пересылки культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бактерийных токсинов, ядов биологического происхождения".
3.1.41. Культуры возбудителей I-II групп, выделенные при диагностических исследованиях, передают в территориальные противочумные институты или головные по проблемам учреждения. Перевозку этих штаммов проводят с разрешения руководителей этих учреждений. Акты на передачу и уничтожение оформляют в установленном порядке.
На противочумных станциях разрешается хранить минимальное количество (определяемое территориальным противочумным институтом) культур типичных и атипичных для данного природного очага, необходимых для научной и практической работы.
Лаборатории, не имеющие разрешения на работу с возбудителем холеры, после идентификации передают культуры в территориальное противочумное учреждение или уничтожают по согласованию с ним.
В учреждениях (институтах), работающих с микроорганизмами I-II групп, разрешается иметь коллекции (музей) штаммов для проведения научных исследований и набор типовых культур для диагностических целей.
3.1.42. Надписи на объектах с культурами и посевами должны быть четкими с подробным обозначением засеянного материала и указанием даты посева.
Объекты с культурами возбудителей хранят в металлических водонепроницаемых емкостях с плотно закрывающимися крышками, которые помещают в холодильники или железные шкафы. Допускается временное хранение культур, подготовленных для автоклавирования, в баках из термостойкого материала (металл, пластик) с отверстиями в верхней части. Баки, опечатанные печатью научного сотрудника (врача), при хранении помещают в поддоны с бортиками высотой 20 см.
Все хранилища (термостаты, холодильники и шкафы) запирают на замок и опечатывают. Ключи от хранилищ и личные печати находятся непосредственно у сотрудников или у заведующего подразделением (лабораторией).
Вакцинные штаммы хранят отдельно от патогенных. Антибиотикорезистентные - отдельно от чувствительных. Не допускается хранение в одном холодильнике живых культур микроорганизмов и диагностических или лечебных препаратов.
3.1.43. Работу по лиофилизации культур возбудителей инфекционных заболеваний I-II групп проводят в соответствии с действующей "Инструкцией по лиофильному высушиванию возбудителей инфекционных заболеваний I-IV групп на коллекторном аппарате системы К.Е.Долинова". Допускается использование более современных аппаратов.
3.1.44. Ампулы с высушенными культурами вскрывают в помещении музея (коллекции) живых культур в боксе с вытяжной системой вентиляции. При этом оттянутый конец ампулы нагревают над пламенем горелки, затем влажным концом стерильного ватного тампона прикасаются к нагретой части, в результате чего появляются трещины. Конец ампулы накрывают трехслойной марлевой салфеткой, смоченной дезраствором и хорошо отжатой, и обламывают пинцетом. После вскрытия ампула остается накрытой той же салфеткой в течение одной-двух минут. Затем салфетку осторожно снимают и вместе с остатками стекла погружают в дезраствор. Вскрытую ампулу накрывают стерильным марлевым тампоном на 1-2 мин, затем в ампулу вносят раствор для приготовления взвеси, которую далее высевают на твердые и жидкие питательные среды. Посевы культур на питательных средах выдают в лаборатории.
3.1.45. Лаборатории ведут учет биологического материала по утвержденным формам и в специальных журналах.
Журналы должны быть пронумерованы, прошнурованы и скреплены печатью.
3.1.46. При проведении серологических исследований производят предварительное обеззараживание материала:
- сыворотки и суспензии крови обеззараживают добавлением мертиолята натрия, проверенного на бактерицидное действие, до концентрации 1:10000 с последующим прогреванием их при 56 °С в течение 30 мин. Для забора крови и смывов с внутренних органов допускается использование фильтровальной бумаги, пропитанной мертиолятом натрия в концентрации 1:1000, обеззараживание наступает после часовой экспозиции при комнатной температуре;
- суспензии внутренних органов или костного мозга животных, материал от больных людей, а также бактериальные взвеси чумы, туляремии, бруцеллеза обеззараживают добавлением проверенного на бактерицидное действие формалина до 1-2% концентрации с последующим выдерживанием не менее 12 часов или до концентрации 4% с экспозицией при комнатной температуре 1 час. Культуры холерного вибриона обеззараживают кипячением в течение 30 минут. Эффективность обеззараживания контролируют пробой на специфическую стерильность.
При необходимости проведения срочного анализа на наличие антигенов возбудителей I-II групп и отсутствии времени для обеззараживания материала или постановки пробы на стерильность серологические реакции ставят в пробирках с круглым дном. Лабораторную посуду и инструменты обеззараживают.
3.1.47. Все работы, связанные с приемом и первичной обработкой биологического материала - от людей, грызунов, эктопаразитов, проб внешней среды и т.д., а также заражение животных и их исследование разрешается проводить только в помещениях блока для инфицированных животных. Заражение лабораторных животных проводит врач совместно с лаборантом. Вскрытие диких и биопробных животных и посев органов для бактериологического исследования проводит врач или лаборант. При исследовании полевого материала дезинфектору может быть поручен очес и вскрытие диких грызунов, а взятие материала на исследование проводит врач или лаборант. Уборку в помещениях для инфицированных животных, уход за ними и кормление проводят лаборанты и дезинфекторы. В исключительных случаях при исследовании полевого материала к уборке могут быть привлечены по приказу руководителя учреждения лабораторные служители.
Посещение блока для инфицированных животных регистрируют в журнале с указанием времени пребывания и характера выполненных работ.
Вход персонала в блок для работы с инфицированными животными осуществляют через комнату для надевания защитной одежды, а выход - через комнату для снятия и обеззараживания защитной одежды. Запрещается в одной и той же комнате надевать защитную одежду и снимать ее после работы с биологическим материалом.
3.1.48. Мелких животных и эктопаразитов содержат в помещениях блока для инфицированных животных с соблюдением следующих правил:
- мелких животных помещают в банки, ящики и садки заранее осмотренные на целостность, на которые прикрепляют заполненные этикетки. Ящики и банки закрывают сетчатыми крышками, не допускающими выбегания животных;
- эктопаразитов помещают в банки и флаконы, плотно завязанные мелкосетчатым материалом, а также в пробирки, закрытые ватно-марлевой или корковой пробкой;
- банки со зверьками помещают на металлические (деревянные) стеллажи, окрашенные масляной краской, или в засетченные шкафы, а сосуды с эктопаразитами - в такие же шкафы, холодильники или термостаты;
- банки с животными, зараженными возбудителями сибирской язвы, глубоких микозов, размещают на металлических или деревянных, но обитых железом стеллажах;
- при накоплении в банках или садках большого количества подстилочного материала (1/3 банки), животных пересаживают в чистые банки, а используемые заливают дезраствором или автоклавируют (приложение 4).
3.1.49. В зависимости от характера выполняемой работы в блоке для инфицированных животных, степени ее опасности для персонала используют строго определенные типы защитной одежды:
- при исследовании материала от больных с подозрением на чуму, глубокие микозы, сап, мелиоидоз или с неясной этиологией используют защитный костюм I типа; на сибирскую язву, туляремию, бруцеллез, холеру, легионеллез - костюм II типа;
- при исследовании дикоживущих грызунов и биопробных животных, а также их трупов (взвешивание, измерение, очес, выбор эктопаразитов, вскрытие, посев органов, приготовление суспензий, разбор гнезд) - защитный костюм II типа;
- при заражении биопробных животных материалом от дикоживущих грызунов и других объектов, подозрительных на чуму, глубокие микозы, сап, мелиоидоз, - используют костюм I типа; материалом, подозрительным на зараженность возбудителями сибирской язвы, туляремии, бруцеллеза, холеры и легионеллеза, - костюм II типа;
- при заражении лабораторных животных вирулентными культурами возбудителей чумы, сапа, мелиоидоза, сибирской язвы, туляремии, бруцеллеза, глубоких микозов и проведении всех манипуляций с зараженными животными (взятие крови, измерение температуры, кормление эктопаразитов на грызунах, их очес, лечение и пересадка животных, кормление их и т.д.) и их вскрытии используют костюм I типа;
- при заражении лабораторных животных культурами возбудителей холеры, легионеллеза, а также исследовании таких животных и их вскрытии, применяют костюм II типа.
3.1.50. Живых грызунов, предназначенных для вскрытия, умерщвляют хлороформом, эфиром или другими соответствующими требованиям биологической безопасности и характеру исследования способами.
При вскрытии грызунов врач (лаборант) захватывает труп длинными щипцами (корнцангами), погружает его на 10-15 секунд в 3% водно-мыльный раствор и, дав ему стечь (на сетке), переносит на доску для вскрытия.
Вскрытое животное после взятия материала на исследование обеззараживают. Животных, погибших от мелиоидоза, для полного обеззараживания выдерживают в 5% растворе лизола в течение 7 суток. После вскрытия животных инструменты, доски для вскрытия, банки, бачки, садки из-под животных и т.д. обеззараживают (приложение 4).
Для утилизации твердых обеззараженных отходов и тушек животных, используют крематорий или выделенные и согласованные с территориальным Центром Госсанэпиднадзора места захоронения. При отсутствии крематория и выделенных мест захоронения на территории учреждения выкапывают яму, расположенную как можно дальше от коммуникаций или колодца, с соблюдением следующих условий:
- яма глубиной 1,5-2 метра не должна доходить до водоносного слоя;
- яму закрывают плотным без щелей настилом с люком, запирающимся на замок;
- окружность ямы должна возвышаться для предохранения от затопления дождевыми или паводковыми водами;
- после каждого сброса материала его заливают свежеприготовленными дезинфицирующими растворами (20% хлорной извести, черной карболки, крезолов и т.п.);
- при заполнении ямы (не более, чем 1 м до поверхности) ее засыпают доверху землей и утрамбовывают. Настил можно снять и использовать повторно.
При необходимости вскрытия грызунов и их исследования в малонаселенных или не заселенных людьми местах обеззараженные трупы вскрытых грызунов разрешается закапывать в специально вырываемые каждый раз ямы.
3.1.51. В максимально изолированных лабораториях при работе в блоках для инфицированных животных заражение, вскрытие и все другие манипуляции с животными проводят в системе боксов безопасности, а содержание животных - в вентилируемых шкафах пониженного давления. Работу и уборку проводит персонал, одетый в противочумный костюм II типа.
3.1.52. Дезинфекцию биологического материала проводят в соответствии с действующими документами и приложением 5.4., 5.8. настоящих правил.
Введение в практику новых средств дезинфекции, дезинсекции и дератизации допускается только после их испытания и с разрешения Госкомсанэпиднадзора России. Все поступающие на склад серии дезинфекционных средств должны быть проверены на активность с выдачей заключения об их пригодности.
Методы и средства обеззараживания определяют в каждом конкретном случае в зависимости от вида возбудителя, характера и объема обеззараживаемого материала.
Записи результатов исследований и подсчета объектов с биологическим материалом ведут на отдельных листах (протоколах), которые обеззараживают погружением в дезинфектант.
Передача обеззараженного материала между лабораториями одного учреждения и за его пределы допускается после проверки на специфическую стерильность. Передачу такого материала за пределы учреждения проводят с разрешения руководителя учреждения.
3.1.53. В лабораториях должно быть достаточное количество дезинфицирующих растворов, неприкосновенный запас их на случай аварии. Емкости с дезрастворами маркируют. При работе с эктопаразитами те же требования предъявляют к дезинсектантам.
Дезинфицирующие растворы готовит лаборант или дезинфектор, за качеством приготовления их следит врач. Дезинфицирующие растворы применяют свежеприготовленными.
Ответственность за правильное обеззараживание материала возлагается на руководителя структурного подразделения или выделенного для этого врача (научного сотрудника). При наличии централизованной автоклавной ответственность за обеззараживание несет заведующий автоклавной.
3.1.54. Работа с рекомбинантными молекулами ДНК регламентируется санитарно-противоэпидемическими правилами "Безопасность работы с рекомбинантными молекулами ДНК".
Гистоцитоэнзиматические исследования проводят в соответствии с требованиями действующей "Инструкцией по первичной обработке материала, зараженного или подозрительного на зараженность возбудителями чумы, холеры, туляремии, бруцеллеза и сибирской язвы при проведении гистоцитоэнзимохимических исследований".
3.1.55. Новые методы и методические приемы перед использованием их в лабораторной практике должны быть рассмотрены комиссией учреждения по контролю за соблюдением требований биологической безопасности и утверждены его руководителем.
3.1.56. Лаборатории, проводящие работу с биологическим материалом, должны иметь на случай ликвидации последствий аварии аптечку экстренной профилактики, запас рабочей и защитной одежды, гидропульт или автомакс, которые хранят в специально отведенном месте "условно-заразной" зоны.
В аптечке экстренной профилактики должны находиться 70° этиловый спирт, 1% раствор протаргола, йод, сухой марганцовокислый калий, стерильная дистиллированная вода, набор антибиотиков специфического действия, глазные пипетки, шприц для приготовления растворов антибиотиков, ножницы, перевязочные средства.
В аптечке микологической лаборатории должен быть 1% раствор борной кислоты.
Лаборатории, проводящие работу с ботулиническим токсином, должны иметь гомологичные антитоксические сыворотки.
Срок годности препаратов и комплектность аптечки проверяет ответственный врач, назначенный руководителем подразделения.
3.1.57. Учреждения, проводящие работу с биологическим материалом I-II групп патогенности, регулярно проводят контроль эффективности фильтров вытяжной системы вентиляции (приложение 5.7.); контроль наличия в сточных водах остаточной концентрации дезинфектанта (приложение 5.9.) и исследования их на патогенную микрофлору, а при работе с вирулентными культурами сибирской язвы - контроль на обсемененность помещения 1 раз в месяц.
3.2. К помещениям и оборудованию микробиологических лабораторий
3.2.1. Стационарные лаборатории, в которых проводят работу с биологическим материалом I-II групп патогенности, должны иметь следующий основной набор помещений:
В "заразной" зоне:
- бокс(ы), отделенные от "условно-заразной" зоны предбоксами или шлюзами;
- блок для работы с инфицированными животными, состоящий из комнаты для приема и первичной обработки биологического материала, комнаты для работы с этим материалом (заражение, вскрытие, посев), комнаты обеззараживания инвентаря для содержания биопробных животных (клетки, садки и др.) и комнаты для содержания зараженных животных. Блок для работы с инфицированными животными отделен от "условно-заразной" зоны боксами для надевания и снятия защитной одежды (принципиальные схемы планировки комнат блока представлены на рисунке 1);
- автоклавная для обеззараживания материала;
- термостатная (может отсутствовать.
Схемы принципиальных планировок комнат блока для работы с инфицированными животными
|
1 - Биопробная |
|
В "условно-заразной" зоне:
- комната(ы) целевого назначения - люминесцентная, биохимическая, серологическая и другие для работы только с обеззараженным материалом;
- подготовительная(ые) комната(ы) - лаборантская, препараторская и другие;
- комната(ы) для ведения записей в рабочих журналах;
- коридоры.
Помещения "условно-заразной" зоны отделены от помещений "чистой" зоны санитарными пропускниками.
В "чистой" зоне:
- комната (гардероб) для верхней одежды;
- комната(ы) для административной работы, для работы с литературой, приема пищи, отдыха и т.п.
3.2.2. Блок для работы с инфицированными животными, автоклавная для обеззараживания, подготовительные, санитарные пропускники могут быть использованы несколькими подразделениями одного учреждения.
3.2.3. Лаборатории размещают, как правило, в отдельном здании с двумя входами или в тупиковом конце его. На входной двери должны быть обозначены название (номер) лаборатории и международный знак "Биологическая опасность" (рис.2). Дверь должна иметь запирающее устройство. Все помещения лаборатории должны быть непроницаемы для грызунов.

БИОЛОГИЧЕСКАЯ ОПАСНОСТЬ!!
3.2.4. Общие требования к помещениям "заразной" зоны.
Помещения должны быть изолированы от других зон. Освещенность устанавливают в зависимости от вида работ согласно требованиям СНиП. Пол, стены и потолок должны быть гладкими, легко моющимися, устойчивыми к действию дезинфицирующих средств, полы не должны быть скользкими.
Выступающие и проходящие трубы (батареи отопления) должны располагаться на достаточном расстоянии от стен с целью возможности их дезинфекции, места ввода инженерных коммуникаций, оконные и дверные проемы должны быть герметизированы.
Форточки должны быть защищены сеткой от насекомых. Окна цокольного и первого этажей закрывают металлической решеткой, охранная сигнализация не исключает необходимости ее наличия.
В помещениях "заразной" зоны не допускается установка системы водоснабжения, не защищенной техническими средствами от подсоса и обратного тока.
В помещениях блока для работы с инфицированными животными ставят высокие (30 см) пороги, недоступные для проникновения грызунов и эктопаразитов.
В лабораториях устанавливают приточно-вытяжную систему вентиляции. Вентиляционную систему на границе "заразной" и "чистой" зон оборудуют фильтрами тонкой очистки, проверенными на защитную эффективность. Порядок их замены и проверки приведен в приложении 5.7.
Во всех помещениях устанавливают бактерицидные лампы из расчета 2,5 вт/м .
.
В условиях жаркого климата возможна установка бытовых кондиционеров при условии их выключения во время работы с биологическим материалом. В комнатах для содержания зараженных животных установка кондиционеров не разрешается.
Помещения должны быть снабжены средствами пожаротушения.
3.2.5. В предбоксах (шлюзах), а также комнатах для снятия защитной одежды устанавливают водопроводные краны (рукомойники) и емкости с дезрастворами на случай аварии. На полу должен находиться коврик, смоченный дезраствором.
Аварийную звуковую или световую сигнализацию выводят из боксов в те помещения "условно-заразной" или "чистой" зон, где постоянно находится персонал.
В предбоксах (шлюзах), а также комнатах для надевания защитной одежды должно быть зеркало.
Обе двери предбокса (шлюза) должны плотно закрываться, иметь окна для наблюдения. Дверь, выходящая в "условно-заразную" зону, должна иметь замок.
3.2.6. Автоклавные для обеззараживания и термостатные комнаты, в которых непосредственно не проводят работу с биологическим материалом, могут не иметь предбоксов (шлюзов).
3.2.7. Помещения "условно-заразной" зоны должны обеспечивать безопасные условия работы для персонала. Комнаты оборудуют и оснащают в соответствии с требованиями нормативных документов согласно их назначению (биохимическая, серологическая, препараторская и др.).
3.2.8. Санитарный пропускник должен иметь раздельные комнаты для личной и рабочей одежды с индивидуальными шкафами, а также душевые, расположенные между этими двумя помещениями.
3.2.9. Лабораторное оборудование и мебель (столы, стеллажи для содержания животных, стулья и т.д.) должны быть прочными, без острых краев и шероховатостей, водонепроницаемыми и устойчивыми к действию дезинфектантов.
Холодильники периодически очищают от наледи с одновременным проведением их дезинфекции.
Все вакуумные линии обеспечивают средствами обеззараживания воздуха (фильтрами и др.).
Контейнеры для хранения и переноса заразного материала изготавливают из прочного, антикоррозийного материала. Дно должно быть выстлано мягким, адсорбирующим материалом в количестве, достаточном для поглощения всего жидкого материала в случае его утечки. Крышка должна плотно закрываться. Контейнеры снабжают удобной ручкой (ручками).
В контейнерах для автоклавирования по верхнему краю боковых стенок располагают отверстия, обеспечивающие свободную циркуляцию пара. Контейнер для автоклавирования переносят на поддоне. Целостность контейнеров и поддонов периодически проверяют.
Центрифужные стаканы должны быть небьющимися, герметически закрывающимися и устойчивыми к действию дезинфектантов.
Паровые стерилизаторы (автоклавы) могут быть любой конструкции, если они обеспечивают эффективное обеззараживание объектов и конденсата. Контроль работы автоклавов осуществляют в соответствии с "Методическими указаниями по контролю работы паровых и воздушных стерилизаторов", утвержденных ГЭУ Минздрава СССР, химическим, физическим (максимальные термометры) и бактериологическими методами (приложения N 5.5.; 5.6.).
Эффективность обеззараживания ежемесячно контролируют путем высева (определение цитопатогенного эффекта) убитой автоклавированием культуры микроорганизмов, с которой работают в лаборатории.
3.2.10. Для снижения риска при работе, связанной с возможным образованием аэрозоля (центрифугирование, измельчениие, интенсивное встряхивание, обработка ультразвуком, вскрытие объектов с зараженным материалом, большие объемы и высокая концентрация инфекционных агентов), необходимо использовать боксы безопасности.
В качестве боксов безопасности используют боксы В/О "Изотоп", импортные боксы безопасности 3 класса, боксы из гибкой прозрачной пленки, а также другие герметичные конструкции, обеспечивающие максимальную защиту персонала. Боксы безопасности снабжают фильтрами тонкой очистки на входе и выходе воздушного потока, манометрами, бактерицидными лампами, лампами освещения и подключают к вытяжной вентиляции. Вытяжная вентиляция должна обеспечивать в боксе разрежение 10 мм вод.ст. (98,1 Па) и ниже, или скорость движения воздуха в открытых проемах 0,4-0,75 м/сек. Рециркуляция воздуха из бокса в помещение запрещена. После установки боксов безопасности проверяют эффективность работы их фильтров (приложение 5.7.), считывают показания манометра, замеряют скорость движения воздуха в проеме. Результаты проверки оформляют актом. Разрежение в боксе контролируют во время работы по показаниям манометра.
Внутри боксов безопасности устанавливают оборудование, эксплуатация которого не приводит к накоплению газов и взрывопожароопасных веществ в критических концентрациях. При необходимости боксы безопасности соединяют между собой, создавая технологические линии. Места ввода инженерных коммуникаций и места соединения боксов между собой тщательно герметизируют.
3.2.11. Из помещений "заразной" зоны запрещен слив (сток) необеззараженных жидкостей в канализационную сеть даже при наличии централизованной системы обработки стоков.
3.2.12. Требования к планировке лабораторий, внутренней отделке, оформлению помещений и оснащению их оборудованием варьируют в зависимости от конкретных задач:
А. Временные лаборатории эпидотрядов, экспедиций, предназначенные для проведения диагностических исследований, могут быть размещены в приспособленных зданиях, палатках, юртах, на шасси траспортных средств. При этом необходимо стремиться к наиболее полной изоляции помещений от внешней среды, а также использованию при переоборудовании пыле-влагонепроницаемых, устойчивых к действию дезинфектантов подручных материалов (полиэтилена, клеенки, пластика, дерева и фанеры, окрашенных прочными красками, и т.п.), в крайнем случае - ткани. В одной общей комнате, разделенной легкими перегородками или пленкой (тканью), могут быть организованы следующие рабочие места:
- для хранения добытых грызунов и другого полевого материала;
- первичной обработки паразитологического материала;
- зоологической обработки грызунов;
- вскрытия грызунов и заражения лабораторных животных;
- содержания биопробных животных;
- снятия и обеззараживания защитной одежды.
Помещение для бактериологической работы может быть не оборудовано предбоксом (шлюзом). Защитную одежду надевают и снимают в бактериологической комнате.
Санитарный пропускник может находиться в одном помещении, где оборудованы раздельные места для хранения личной и рабочей одежды.
Б. В стационарных лабораториях, ведущих только диагностическую работу и имеющих минимальный набор помещений, может отсутствовать "условно-заразная" зона. При этом помещения, относящиеся к указанной зоне, располагаются на "чистой" половине, а санитарный пропускник на границе "чистой" и "заразной" зон.
В. В стационарных лабораториях, ведущих диагностическую и (или) экспериментальную работу, не связанную с исследованием диких грызунов и использованием биологического метода, может отсутствовать блок для работы с инфицированными животными.
Диагностический материал для бактериологического (серологического) исследования поступает в комнату для приема, регистрации и сортировки проб через отдельный вход или окно.
Г. В стационарных лабораториях, где ведется только экспериментальная работа с возбудителями I-II групп, в блоке для работы с инфицированными животными может отсутствовать комната для приема и первичной обработки материала.
При поступлении диагностического материала по эпидемиологическим показаниям работу с экспериментальным материалом прекращают и проводят заключительную дезинфекцию. Разбор и первичную обработку поступивших проб в зависимости от их характера проводят в одной из бактериологических комнат или в комнате блока для работы с инфицированными животными.
Д. В стационарных максимально изолированных лабораториях, где проводят постоянную экспериментальную работу с использованием новых методов, потенциально связанных с повышенной опасностью образования аэрозоля, требования к помещениям и оборудованию ужесточают в дополнение к п.п.3.2.4.-3.2.11.
Лаборатория должна иметь резервный электрогенератор или другой, независимый от основного, источник тока для обеспечения работы основного оборудования, системы приточно-вытяжной вентиляции, термостатов, холодильников. Система общего водоснабжения "условно-заразной" зоны должна быть обеспечена техническими средствами, предотвращающими подсос воздуха и обратный ток воды.
Окна помещений "заразной" зоны должны быть тщательно герметизированы. Вентиляционную систему устанавливают с расчетом обеспечения отрицательного давления 2-5 мм в.ст. (19,62-19,05 Па) в помещениях и на 10-15 мм в.ст. ниже в боксах безопасности III класса. Воздух должен поступать через фильтр тонкой очистки со стороны "условно-заразной" зоны и удаляться через систему таких фильтров (не менее двух) из помещений. Вентиляционные агрегаты устанавливают за пределами "заразной" зоны и дублируют на случай выхода из строя одного из них.
В таких лабораториях должен быть установлен проходной автоклав для обеззараживания.
Е. Помещения и оборудование аэрозольных лабораторий должны отвечать требованиям настоящих правил и действующей "Инструкции по режиму работы с аэрозолями возбудителей особо опасных и других бактериальных инфекций".
3.3. К рабочей одежде
3.3.1. Для работы с биологическим материалом каждый сотрудник должен быть обеспечен рабочей одеждой и обувью (пижамами - три комплекта, носками - три пары, тапочками - две пары), а также халатами противочумными - шесть, халатами медицинскими - два, косынками - шесть и другими видами спецодежды и обуви, предусмотренными нормами.
Для выхода на территорию учреждения ("условно-заразную" зону) сотрудников дополнительно обеспечивают головными уборами, теплыми халатами (ватниками), соответствующей обувью.
3.3.2. Для работы в "заразной" зоне с целью защиты персонала от патогенных микроорганизмов используют защитную одежду (противочумные костюмы, изолирующие костюмы типа КЗМ-I и другие средства индивидуальной защиты, разрешенные к применению).
Существуют следующие основные типы противочумных костюмов:
I тип - пижама или комбинезон; носки, тапочки, большая косынка (120х120х150 см) или капюшон; противочумный халат (по типу хирургического, длиной до нижней трети голени, полы должны далеко заходить друг за друга, длинные завязки у ворота, на поясе и рукавах); ватно-марлевая маска (из марли 125х50 см со слоем ваты 25х17х1,5 - 2 см весом 20 г), или противопылевой респиратор, или фильтрующий противогаз, плотно прилегающие очки-консервы, или целлофановая пленка одноразового пользования (размером 17х39 см с учетом 6 см с каждой стороны для привязывания тесемок длиной по 30 см); резиновые перчатки; сапоги резиновые (бахилы), полотенце.
II тип - пижама или комбинезон, носки, тапочки, большая косынка (капюшон), противочумный халат, ватно-марлевая маска, резиновые перчатки, сапоги, полотенце.
III тип - пижама или комбинезон, носки, тапочки, большая косынка, противочумный халат, резиновые перчатки, защитная обувь, полотенце.
IV тип - пижама или комбинезон, носки, тапочки, шапочка (косынка малая), противочумный или хирургический халат.
3.3.3. Противочумный костюм надевают до входа в помещение, где работают с биологическим материалом, в строго определенной последовательности. Порядок надевания следующий: рабочая одежда и обувь, капюшон (большая косынка), противочумный халат и сапоги. Тесемки у ворота халата, а также пояс халата завязывают спереди на левой стороне обязательно петлей, после чего закрепляют тесемки на рукавах. Респиратор (повязку) надевают на лицо так, чтобы были закрыты рот и нос, для чего верхний край маски должен находиться на уровне нижней части орбит, а нижний - под подбородком. Верхние тесемки завязывают петлей на затылке, а нижние - на темени (по типу пращевидной повязки). Надев респиратор (маску), по бокам крыльев носа закладывают плотные ватные тампоны для того, чтобы воздух не фильтровался помимо маски.
Очки (целлофановая пленка) должны быть пригнаны, стекла натирают карандашом (для предупреждения их запотевания) или кусочком сухого мыла. В местах вероятной фильтрации воздуха закладывают ватные тампоны. Затем надевают перчатки, предварительно проверив их на целостность. За пояс халата с правой стороны закладывают полотенце.
При вскрытии трупов людей и верблюдов дополнительно надевают в следующем порядке: клеенчатый или полиэтиленовый фартук, такие же нарукавники и вторую пару резиновых перчаток, полотенце закладывают за пояс фартука с правой стороны.
При необходимости пользоваться фонендоскопом его надевают раньше капюшона или большой косынки.
3.3.4. Защитную одежду, предназначенную для работы в очагах инфекционных заболеваний, госпиталях, изоляторах, блоках для работы с инфицированными животными, обеззараживают сразу после использования. При обеззараживании костюма все его части погружают полностью в дезинфицирующий раствор. В тех случаях, когда обеззараживание проводят автоклавированием, кипячением или в дезкамере, костюм складывают соответственно в биксы, баки или камерные мешки.
При работе в бактериологических комнатах защитную одежду не реже одного раза в неделю обеззараживают, а затем передают в стирку. Перечень дезинфицирующих агентов и режим обеззараживания приведены в приложении 5.3. и 5.4.
Для обеззараживания средств индивидуальной защиты должны быть предусмотрены отдельные емкости с дезинфицирующим раствором или биксы (камерные мешки): для обработки защитной обуви; рук в перчатках в процессе снятия защитной одежды; очков, целлофана, фонендоскопа; ватно-марлевых масок; халатов, косынок и полотенец; перчаток; коробок противогаза.
3.3.5. Костюм снимают медленно, в установленном порядке, погружая руки в перчатках в дезинфицирующий раствор после снятия каждой его части: сапоги или калоши протирают сверху вниз тампонами, обильно смоченными дезраствором; вынимают полотенце; фартук протирают ватным тампоном, смоченным дезраствором, и снимают, складывая наружной стороной внутрь; снимают нарукавники и вторую пару перчаток; вынимают фонендоскоп; снимают очки (целлофановую пленку), оттягивая их двумя руками вперед, вверх и назад за голову; ватно-марлевую маску развязывают и снимают, не касаясь лица наружной ее стороной; развязывают завязки ворота халата, пояс, и, опустив верхний край перчаток, развязывают тесемки рукавов, снимают халат, заворачивая наружную его часть внутрь; снимают косынку, осторожно собирая на затылке все концы в одну руку; снимают перчатки (при подозрении на нарушение целостности их проверяют в дезрастворе, но не воздухом); снимают сапоги.
После снятия защитного костюма руки обрабатывают 70° этиловым спиртом, затем тщательно моют с мылом.
3.3.6. В зависимости от характера выполняемой работы, степени ее опасности для персонала используют строго определенные типы защитной одежды.
3.4. Дополнительные - при работе с вирусами и риккетсиями
3.4.1. Работу с вирусами I группы патогенности проводят только в специально предназначенных для этого лабораториях. Требования к помещениям лабораторий, в основном, такие же, как к стационарным максимально изолированным лабораториям (пункт 3.2.12.Д. настоящих Правил).
3.4.2. Все исследования с вирусами I группы от момента поступления до уничтожения проводят в системе сообщающихся между собой боксов безопасности. Обязательным условием для оборудования помещений "заразной" зоны является установка проходного автоклава с автоматической блокировкой дверей. Вход в "заразную" зону осуществляют через санитарный пропускник с душевой или шлюз, где рабочую одежду заменяют на соответствующую защитную. Во время работы в шлюзе должен быть включен источник ультрафиолета (бактерицидная лампа).
Входные двери в шлюзы должны быть самозакрывающиеся и снабжены замками.
Во время работы двери помещений "заразной" зоны должны быть закрыты. В это время запрещается выходить и входить в вирусологический бокс. Для связи с другими помещениями используют телефон или переговорные устройства.
Хранение биологического материала осуществляют в герметичных, выдерживающих низкие температуры, небьющихся контейнерах, которые помещают в низкотемпературные шкафы или сосуды с жидким азотом.
Перенос биологического материала между технологическими линиями и в хранилища проводят в герметично закрывающихся влагонепроницаемых контейнерах. Перед выносом из технологических линий контейнеры подвергают обеззараживанию погружением в резервуар с дезинфицирующим раствором.
Все отходы вирусологической лаборатории, включая отработанную душевую воду, обеззараживают; текущую и заключительную дезинфекцию помещений, технологических линий осуществляют в соответствии с приложением 5.4.
При работе персонал использует противочумный костюм II типа. По окончании работы персонал принимает гигиенический душ.
3.4.3. Работу с вирусами II группы осуществляют в специализированных лабораториях. Требования к помещениям и оборудованию соответствуют требованиям, предъявляемым к стационарным лабораториям и изложенным в разделе 3.2. Целесообразным является использование боксов безопасности.
Персонал работает во всех помещениях "заразной" зоны в комбинезонах или противочумных костюмах III типа, дополненных ватно-марлевой маской или респиратором.
3.4.4. При проведении серологических исследований используют антигены и сыворотки, прошедшие контроль на отсутствие активного вируса.
3.4.5. Требования к помещениям, где проводят работу с риккетсиями II группы, соответствуют изложенным в разделе 3.2. требованиям к стационарным лабораториям.
3.4.6. Все работы с биологическим материалом проводят в помещении, состоящем из отдельных боксов с предбоксами, оборудованных термостатами для культивирования риккетсий в куриных эмбрионах, клеточных культурах, эктопаразитах и т.д.
3.4.7. Центрифугирование и вакуумное высушивание инфекционного материала также осуществляют в отдельных боксовых помещениях.
3.4.8. Заражение куриных эмбрионов, животных, эктопаразитов, центрифугирование и вакуумное высушивание биологического материала проводят в защитном костюме I типа.
Вскрытие ампул с высушенной культурой риккетсий, гомогенизацию биомассы риккетсий осуществляют в настольном боксе с вытяжкой в защитном костюме II типа.
Другие виды работ с биологическим материалом в "заразном" блоке выполняют также в защитном костюме II типа. При уходе за животными дополнительно надевают клеенчатый фартук и нарукавники.
3.5. Дополнительные - при работе с возбудителями глубоких микозов
3.5.1. Все манипуляции с культурами мицелиальной фазы, а также изучение выживаемости грибов во всех фазах проводят в герметичном боксе, с фильтровентиляционной системой, включающей фильтрацию воздуха, поступающего в бокс и выходящего из него через фильтры из тканей Петрянова или другие высокоэффективные стерилизующие фильтры. Воздух, выходящий из бокса, кроме того, проходит фильтр из пропитанной раствором лизола стекловаты или 10% раствор лизола (в сосуде), или поступает в общую фильтровентиляционную систему, на выходе которой установлены фильтры из ткани Петрянова. Помещение, где находится бокс, максимально герметизируют.
3.5.2. За 15 мин до начала работы в боксе включают бактерицидные лампы и вытяжную систему вентиляции бокса. Во время загрузки бокса вытяжную систему выключают, а затем после загрузки включают снова. Работу вакуум-насоса контролируют по объемной скорости движения воздуха с помощью реометра или манометром, определяющим в боксе вакуум, который должен быть равным 2-5 мм водяного столба (19,62-49,05 Па).
3.5.3. В целях исключения попадания возбудителей грибов в помещение, где находится бокс, проверяют его герметичность при установке, а затем не реже одного раза в квартал; бактериологическое исследование воздуха за фильтром проводят один раз в месяц; лизол, находящийся в сосуде и пропитывающий стекловату, меняют один раз в 7-10 дней, а стекловату - по мере ее уплотнения.
Если во время работы в боксе прекратился отсос воздуха из него, работу немедленно прекращают.
3.5.4. Посевы мицелиальных культур в боксах делают после предварительного внесения в пробирки или матрацы физиологического раствора или бульона. При производственных смывах мицелиальных культур жидкость в матрацы вносят через пробки шприцом с длинной иглой. Посевы инкубируют в металлических емкостях.
3.5.5. При работе с мицелиальными фазами грибов во избежание заражения аэрогенным путем агаровые пластинки с посевами выдерживают в термостате не более 5 суток (до начала спороношения). Матрацы, пробирки с посевами мицелиальной фазы грибов вне бокса не открывают.
3.5.6. Просмотр посевов с мицелиальными фазами грибов проводят в боксовых комнатах в костюме IV типа с ватно-марлевой маской.
Работу с дрожжевыми фазами грибов проводят в боксовой комнате в костюме III типа с маской. Серологические исследования - в костюме IV типа.
3.5.7. Для проведения подсчета клеточных элементов в камере Горяева суспензии грибов либо автоклавируют, либо в них для ускорения подсчета добавляют формалин до 10% и выдерживают в термостате 2 часа при 37 °С.
3.5.8. С целью получения антигенов, вакцин и проведения других работ выращенную грибницу обеззараживают:
- автоклавированием при 0,5 атм в течение 30 мин;
- добавлением формалина до конечной концентрации 0,5% (дрожжевые формы возбудителей гистоплазмоза, бластомикозов, мицелиальные фазы всех возбудителей).
3.5.9. Для проверки грибной массы или фильтратов на стерильность их засевают по 0,5 мл в пробирки с сахарным мясо-пептонным агаром и бульоном, твердой и жидкой средой Сабуро, сусло жидкое и сусло-агар (по 4 пробирки каждой среды). Взвеси, убитые формалином, предварительно разводят в 20-100 раз физиологическим раствором или бульоном. Посевы выдерживают в течение 10 суток при 28 °С и 37 °С. До получения результатов контроля взвеси и фильтры хранят при 4 °С.
3.5.10. Исследование проб почвы, гнезд грызунов, помета птиц и т.п. проводят в боксе с фильтровентиляционной системой.
3.5.11. При заражении лабораторных животных место введения материала обрабатывают 1% настойкой йода (йодоната).
3.5.12. При проведении серологических исследований обеззараживание материала проводят путем автоклавирования или добавлением формалина до конечной концентрации 0,5-1% с последующим выдерживанием не менее 2 суток при 37 °С и проверкой на стерильность. Сыворотки перед постановкой серологических реакций прогревают при 56 °С 30 мин, а затем добавляют к ним тиомерсал (мертиолят) до концентрации 1:10000 и исследуют не ранее чем через 24 часа.
3.6. Дополнительные - при работе в лабораториях производственных отделов
3.6.1. Режим в лабораториях производственных отделов при работе с культурами микроорганизмов I-II групп патогенности устанавливают в соответствии с действующими "Правилами техники безопасности, производственной санитарии и санитарно-противоэпидемического режима для предприятий по производству бактерийных и вирусных препаратов" и настоящими правилами.
3.6.2. В соответствии с настоящими правилами в производственных лабораториях должны быть разработаны дополнения к ним, исходя из особенностей технологии производства, используемого оборудования и других условий. Дополнения утверждает директор предприятия (учреждения).
3.7. Дополнительные - при работе с ботулиническим токсином, биологическими ядами
3.7.1. При работе с ботулиническим токсином, не освобожденным от спор, необходимо учитывать особенности биологической безопасности работы со споровыми культурами.
3.7.2. Работу с очищенным от спор ботулиническим токсином (биологическими ядами) проводят в боксе с предбоксом в медицинском (хирургическом) халате, медицинской шапочке, тапочках, дополненных при работе с сухим токсином ватно-марлевой маской (респиратором).
3.7.3. Заражение лабораторных животных ботулиническим токсином (ядом) проводят в отдельной комнате общего вивария в медицинском (хирургическом) халате, косынке, тапочках, резиновых перчатках и ватно-марлевой маске (респираторе).
3.7.4. Для обеззараживания применяют 6% раствор перекиси водорода, автоклавирование (132 °С ±2 °С - 90 минут) - приложение 5.4.
3.8. К проведению зоологической и паразитологической работы
3.8.1. Работники противочумных, других медико-биологических учреждений и отделов ООИ центров Госсанэпиднадзора, проводящие отлов грызунов, сбор эктопаразитов (носителей и переносчиков природно-очаговых болезней), а также другие полевые работы с дикими позвоночными и беспозвоночными животными должны быть обеспечены соответствующей сезону защитной одеждой:
а) в теплое время года х/б рабочим костюмом (брюки и куртка, защитный противоэнцефалитный костюм, комбинированный костюм по защите от гнуса и клещей), сапогами кирзовыми и резиновыми болотными при работе в пойменных биотопах, брезентовыми рукавицами и головным убором. На одного работника должно быть по 2 комплекта костюма и три пары хлопчатобумажных перчаток;
б) в холодное время года х/б костюмом, телогрейкой или утепленной курткой с непромокаемым верхом, ватными брюками, сапогами кирзовыми или валенками с калошами, брезентовыми и теплыми рукавицами, головным убором (типа шапки-ушанки или фуражки с наушниками).
3.8.2. При работе в природных очагах чумы комбинезон и сапоги импрегнируют стойкими репеллентами (ДЭТА КЮЗОЛ и др. - 80 г/м см. специальную инструкцию), импрегнацию повторяют через 7 дней и после каждой стирки. Одежда должна быть удобной и подобрана по размерам.
см. специальную инструкцию), импрегнацию повторяют через 7 дней и после каждой стирки. Одежда должна быть удобной и подобрана по размерам.
При проведении обследовательских работ в горных очагах сурочьего типа импрегнация комбинезона и сапог стойкими репеллентами не обязательна из-за отсутствия миграции сурочьих блох.
3.8.3. Для работ по истреблению грызунов все рабочие должны быть обеспечены защитной одеждой: комбинезоном, носками или чулками, обувью (сапоги) и рукавицами. Одежду импрегнируют репеллентами или стойкими инсектицидами типа пиретринов.
3.8.4. В процессе работы при добыче грызунов и сборе членистоногих переносчиков и эктопаразитов, а также при их истреблении перед перерывами в работе, перед курением и при завершении работы необходимо обеззараживать руки и инструменты соответствующими дезинфицирующими растворами (приложение 5.4).
3.8.5. Места стоянок в поле надо выбирать таким образом, чтобы поблизости не было нор грызунов, если это невозможно, проводить истребление грызунов; место расположения палатки необходимо обрабатывать порошковидными инсектицидами.
3.8.6. Полевое оборудование, соприкасающееся в процессе работы с грызунами и эктопаразитами (капканы, давилки, ленты для вылова эктопаразитов, пробирки, мешочки и т.д.), следует перевозить и переносить в закрытой таре. Доставку такого оборудования и полевого материала в лабораторию осуществляют транспортом, которым располагает полевая бригада, или транспортом, выделенным лабораторией, в сопровождении лица, знакомого с режимом работы. Хранить такое оборудование так же как и добытый полевой материал, необходимо в специальных местах, недоступных для посторонних лиц.
3.8.7. Добытых зверьков при необходимости умерщвляют непосредственно в капкане путем сдавления шеи корнцангом или тигельными щипцами. Трупы для безопасности транспортировки складывают в бязевые мешочки, а последние - в отсадники, ящики или брезентовые (клеенчатые) мешочки. Бязевые мешочки плотно завязывают дважды (второй раз через подвернутый край мешочка), чтобы исключить рассеивание эктопаразитов.
3.8.8. Живых грызунов помещают в металлические или обитые изнутри оцинкованным железом отсадники или ящики. Эктопаразитов для паразитологического и микробиологического исследования доставляют в пробирках, закрытых ватно-марлевыми пробками и помещенных в металлические пеналы, или в толстостенных стеклянных флаконах с притертыми пробками, помещенных в бязевые мешочки.
3.8.9. Грызунов, добытых мертвыми, после освобождения из мешочков очесывают, добытых живыми дустируют в отсадниках. Доставленных эктопаразитов освобождают от песка и других субстратов.
3.8.10. Дезинсекцию и дезинфекцию бязевых мешочков, в которых были доставлены зверьки и прочий материал, производят после каждого их использования путем кипячения в течение 30 минут в мыльно-содовом растворе с последующим тщательным прополаскиванием в чистой воде. Флаконы и пробирки из-под эктопаразитов дезинфицируют путем кипячения в воде.
3.8.11. Дезинфекцию орудий лова и других инструментов проводят систематически по окончании ежедневной работы путем прогревания на солнце (в летнее время), кипячения, обработки дезинфицирующими растворами (с последующим проветриванием и смазыванием их растительным маслом). Ящики и отсадники также дезинфицируют (приложение 5.4.).
3.8.12. Определение вида эктопаразитов, лабораторное исследование (приготовление суспензии и ее посев) проводят в бактериологической комнате. Эктопаразитов перед определением иммобилизуют парами эфира, раскладывают на широком предметном стекле и просматривают в сухом виде под микроскопом.
Если для определения необходимо рассматривать эктопаразитов живыми в капле воды под покровным стеклом, то предметное стекло помещают в чашку Петри, чтобы избежать загрязнения столика микроскопа стекающей со стекла жидкостью. После окончания работы чашки Петри и стекла погружают в дезинфицирующий раствор. Во избежание разбрызгивания жидкости во время растирания клещей при приготовлении взвеси из них необходимо перед растиранием разрезать клещей ножницами под прикрытием крышки от чашки Петри или большой воронки.
3.8.13. Съемку шкурок и приготовление коллекционных тушек со зверьков, пойманных в районах, где возможна или протекает эпизоотия, проводят следующим образом:
а) при изготовлении коллекционных тушек для учебных целей зверьков необходимо предварительно выдержать в 10% формалине. Срок выдерживания определяется, исходя из размеров зверька и скорости проникновения формалина в ткани (1 см в сутки); работу с фиксированными в формалине зверьками можно проводить в любом служебном помещении; защитный костюм не регламентируется;
б) при изготовлении тушек для научных целей, когда воздействие формалина недопустимо, зверька перед съемкой шкурки опускают на 10-15 мин в 5% раствор лизола, а снятую шкурку снова опускают на 3 часа в раствор лизола, после чего очищают ее от жира, обмывают и обрабатывают с внутренней стороны мышьяковистым натрием; череп либо выдерживают в формалине, либо дезинфицируют кипячением. Снятие шкурки с грызуна проводят с соблюдением режима работы в помещении блока для зараженных животных или в другом специально отведенном помещении (палатка, отдельная комната, отдельное рабочее место в лаборатории и т.д.). Всю работу по съемке и набивке коллекционных тушек разрешают проводить непосредственно руками в перчатках, так как одними инструментами она невыполнима. Работу по съемке шкурок проводят в защитном костюме I типа, для работы по набивке тушек из выдержанных в лизоле шкурок применяют костюмы II типа.
3.8.14. Разбор погадок хищных птиц и экскрементов зверьков проводят после 12-18 часового содержания в 1% растворе формалина в любом служебном помещении, защитный костюм не регламентируется.
3.9. К порядку отлова, транспортировки и содержания диких позвоночных животных и членистоногих при проведении экспериментальных работ
3.9.1. На энзоотичной по чуме территории отлов и вывоз диких животных и членистоногих разрешают противочумным учреждениям, обслуживающим конкретные природные очаги, и по согласованию с ними отделам особо опасных инфекций центров Госсанэпиднадзора. В необходимых случаях центры Госсанэпиднадзора по согласованию с противочумными учреждениями могут давать разрешения на отлов другим организациям (частным лицам).
На неэнзоотичной по чуме территории каждое учреждение медико-биологического профиля может осуществлять отлов и содержание позвоночных животных и кровососущих членистоногих при строгом соблюдении настоящих правил.
Отлов и вывоз позвоночных животных и членистоногих с энзоотичной территории по геморрагическим лихорадкам (ГЛПС, Крымской, Омской) разрешают отделам особо опасных инфекций центров Госсанэпиднадзора, противочумным учреждениям и медико-биологическим учреждениям, проводящим наблюдения за конкретными природными очагами.
Любой материал считается потенциально опасным в отношении возможного заражения природно-очаговыми заболеваниями, свойственными той ландшафтной зоне, в пределах которой он собран.
3.9.2. Перед началом работы по отлову диких животных начальник экспедиции должен получить справку из центра Госсанэпиднадзора об отсутствии за последние 3 года эпизоотий и случаев заболевания людей природно-очаговыми болезнями в районе предполагаемого отлова зверьков или членистоногих.
3.9.3. Ответственность за проведение отлова диких животных и их содержание возлагают на руководителя (начальника) эпидотряда или экспедиции. Весь состав отряда или экспедиции должен быть ознакомлен с правилами безопасности работы по предотвращению заражения природно-очаговыми инфекциями, циркулирующими на данной территории.
При работе в энзоотичных по чуме районах каждый сотрудник проводит ежедневную термометрию, результаты которой записывают в журнал.
3.9.4. Живых диких животных и членистоногих, отловленных в природе, перед вывозом в научные и другие учреждения выдерживают в карантине. Карантинный виварий может быть организован на базе временного эпидотряда (экспедиции) или стационарного учреждения. Продолжительность карантина - 1 месяц.
3.9.5. Помещения для карантинного вивария и работы с членистоногими (инсектария) должны быть изолированы от других помещений и защищены от проникновения грызунов и насекомых.
3.9.6. Ответственность за соблюдение правил безопасности работы в карантинном виварии и помещении для работы с членистоногими возлагается на начальника эпидотряда (экспедиции), заведующего отделом или лабораторией, на базе которой организован виварий.
3.9.7. Диких позвоночных животных доставляют в карантинный виварий в отсадниках или деревянных ящиках, обитых внутри жестью, которые после каждого использования обрабатывают дезинфектантом.
Членистоногих доставляют в пробирках с ватно-марлевыми пробками (влажные камеры), помещенных в металлические пеналы, или в толстостенных флаконах с притертой пробкой, помещенных в бязевые мешочки (клещи, блохи, вши). Комаров, мошек, слепней и др. двукрылых кровососущих насекомых доставляют живыми в садках, сшитых из марли мельничного сита (двойных), или анестезированными, помещенными в стеклянные пробирки или пенициллиновые флаконы, закрывающиеся резиновыми пробками, которые транспортируют в термоконтейнерах с сухим льдом или жидким азотом.
3.9.8. Перевоз животных в карантинный виварий осуществляют на специально выделенном транспорте в сопровождении сотрудника, допущенного к работе с биологическим материалом I-II групп. Запрещается перевоз полевого материала общественным транспортом.
Добытый зоогруппами противочумных и других учреждений материал (грызуны, членистоногие, объекты внешней среды) независимо от энзоотичности территории по природноочаговым инфекциям считают условно зараженным и его доставляют со всеми мерами предосторожности. Грызунов упаковывают в бязевые мешочки, которые помещают в клеенчатые мешки, а затем в специальные металлические отсадники, биксы, контейнеры.
3.9.9. Доставленные в карантинный виварий зверьки должны быть освобождены от эктопаразитов и пересажены в чистые металлические или стеклянные банки с плотными сетчатыми крышками. Очесывание животных и уход за ними в течение карантина проводят в защитном костюме II типа с полным соблюдением требований безопасности работы.
3.9.10. У животных, доставленных из природных очагов чумы, в карантинном виварии из пальцев лапок или хвоста берут кровь для бактериологического и серологического исследований. Обнаружение у зверьков специфических антител свидетельствует об имевшей место эпизоотии чумы, а обнаружение возбудителя или фракции I чумного микроба - о заболевании зверька. Таких зверьков умерщвляют и исследуют.
3.9.11. В случае обнаружения в банке павшего зверька необходимо провести бактериологическое (вирусологическое) и серологическое исследования трупа.
3.9.12. При обнаружении инфекционного заболевания среди животных срок карантина продлевают на месяц, считая со дня регистрации гибели последнего животного. В случае массового падежа всех животных забивают, а виварий тщательно дезинфицируют (приложение 5.4).
3.9.13. Трупы павших или забитых животных обеззараживают автоклавированием, кипячением, сжиганием или помещением в дезинфицирующий раствор.
3.9.14. Здоровых животных после прохождения срока карантина подготавливают к транспортировке или переносят в лабораторию.
3.9.15. Насекомых содержат в специальном помещении (инсектарии) в садках или банках, исключающих их рассеивание.
3.9.16. Посуду, применяемую при работе с членистоногими, дезинфицируют кипячением. Отходы заливают дезинфицирующим раствором или сжигают, инструменты кипятят или обжигают на огне.
3.9.17. В виварии и инсектарии учет движения позвоночных и членистоногих ведут в специальном пронумерованном и прошнурованном журнале с указанием места и даты вылова, результатов исследования и карантинизации.
3.9.18. Передача позвоночных и членистоногих из вивария или инсектария в другие учреждения возможна только по разрешению руководителя учреждения, причем зверьков только из числа родившихся в чистом виварии.
3.9.19. Помещения вивария и инсектария по окончании работы опечатывают.
3.10. К порядку действий при ликвидации аварий во время работы с биологическим материалом
3.10.1. При каждом противочумном учреждении и другом учреждении, проводящим научно-исследовательскую работу с возбудителями чумы, холеры, сапа, мелиоидоза, глубоких микозов, с высококонтагиозными вирусами I группы патогенности, должен быть изолятор.
3.10.2. В изолятор помещают сотрудников, соприкасавшихся с биологическим материалом, в случае обнаружения у них симптомов заболеваний, вызванных перечисленными в п.3.10.1. возбудителями I-II групп патогенности, а также лиц, допустивших аварию.
3.10.3. При установлении заболевания или подозрения на него сотрудника помещают в изолятор, берут материал для лабораторного исследования, проводят курс специфического лечения.
При необходимости госпитализации сотрудника в инфекционный стационар ее проводят в соответствии с комплексным планом мероприятий по локализации и ликвидации очагов особо опасных инфекций по городу (району).
3.10.4. Врачи, обслуживающие изолятор, должны иметь клиническую подготовку и быть допущенными к работе с биологическим материалом. В случае необходимости к обслуживанию в изоляторе могут дополнительно привлекать врачей, лаборантов, дезинфекторов и лабораторных служителей из числа сотрудников учреждения, имеющих соответствующий допуск.
Для консультаций могут привлекать опытных инфекционистов и других специалистов, не имеющих допуска к работе с возбудителями I-II групп, если они будут предварительно проинструктированы по вопросам безопасности работы и одеты в соответствующую защитную одежду. Во время посещения больного их сопровождает врач изолятора учреждения. За консультантами устанавливают медицинское наблюдение (без изоляции) на срок инкубационного периода; на этот срок им запрещают выезд в другие населенные пункты.
3.10.5. В изоляторе должен быть запас основных и резервных специфических лекарственных препаратов, запас медикаментов для оказания помощи по жизненным показаниям (кардиологических, противошоковых, антидотов и т.д.). За комплектацию аптечки современными эффективными препаратами несет ответственность врач изолятора.
3.10.6. При авариях во время работы с биологическим материалом ее немедленно прекращают и включают аварийную сигнализацию.
А. Если авария произошла с разбрызгиванием инфекционного материала, т.е. возможностью образования аэрозоля (бой пробирки, флакона, колбы с жидкой культурой, бой чашек, пробирок с культурами на агаре с конденсатом, разбрызгивание бактериальной суспензии из пипетки или шприца, тканевой жидкости при вскрытии зараженных трупов животных и людей, авария на вакуумной установке в процессе сушки вирулентных культур, а также при других видах аварий, ведущих к контаминации воздуха или окружающих предметов), все находящиеся в комнате тотчас прекращают работу и, задержав дыхание, выходят из комнаты, где проводили работу, в предбокс, закрывают за собой дверь, обрабатывают руки дезраствором или спиртом, если лицо не было защищено, то обильно обрабатывают его 70° этиловым спиртом, затем обильно смачивают дезраствором защитную одежду (начиная с косынки или шлема), снимают ее, погружают в дезраствор или помещают в бикс (бак) для автоклавирования. После этого протирают открытые части тела 70° этиловым спиртом, переодеваются в сменную рабочую одежду и обрабатывают слизистые глаз, носа и рта препаратами из аварийной аптечки. Рот и горло прополаскивают 70° этиловым спиртом, в нос закапывают 1% раствор протаргола. При попадании ботулинического токсина на открытые участки кожи смывают его большим количеством воды с мылом (смывные воды автоклавируют).
В глаза (можно и в нос вместо протаргола) закапывают растворы антибиотиков, к которым чувствителен возбудитель. При работе с возбудителем чумы и туляремии в глаза закапывают раствор стрептомицина (25 мг/мл), гентамицина (4 мг/мл), сизомицина (5 мг/мл), тобрамицина (4 мг/мл), амикацина (4 мг/мл), нетилмицина (4 мг/мл), при работе с возбудителем холеры - тетрациклина (20 мг/мл); сибирской язвы - пенициллина или стрептомицина (20 мг/мл); бруцеллеза и сапа - тетрациклина или хлортетрациклина (20 мг/мл); мелиоидоза - хлортетрациклина или левомицетина (20 мг/мл); лихорадки Ку, орнитоза - окситетрациклина (15 мг/мл); легионеллеза - тетрациклина (5-10 мг/мл) или гентамицина (1-5 мг/мл).
При аварии во время работы с вирусами глаза промывают 1% раствором борной кислоты или струей воды; в нос закапывают 1% протаргол, рот и горло прополаскивают 70° этиловым спиртом или 0,05% раствором марганцовокислого калия, или 1% раствором борной кислоты; при наличии иммуноспецифических препаратов (гаммаглобулин, сыворотки реконвалесцентов) - вводят внутримышечно по схеме.
В случае аварии при работе с возбудителями глубоких микозов в глаза и нос закапывают 1% борную кислоту, рот и горло прополаскивают 70° этиловым спиртом.
При аварии с ботулиническим токсином глаза и рот промывают водой и разведенной до 10 МЕ/мл антитоксической сывороткой, вводят сыворотку или анатоксин в зависимости от сроков вакцинации (ревакцинации).
Если авария произошла при работе с неизвестным возбудителем, применяют сочетание антибиотиков группы аминогликозидов (стрептомицин, канамицин, мономицин в концентрации 200 мг/мл) с тетрациклиновой группой (хлортетрациклин, окситетрациклин, тетрациклин в концентрации 100-200 мг/мл). Возможно также использование других испытанных для каждой инфекции антибиотиков.
Б. Если авария произошла без разбрызгивания биологического материала (касание петлей с инфицированным материалом края чашки, пробирки, флакона, кристаллизатора, трещина на чашке Петри, пробирке, флаконе с биологическим материалом, падение на стол твердой частицы при обжигании петли после посева, касание поверхности посева на твердой питательной среде и т.п.), не выходя из помещения накладывают тампон с дезраствором на место контаминации биологическим материалом поверхности объекта, вызывают заведующего или лицо, его замещающее, и продолжают дезинфекционную обработку места аварии. После этого сотрудник выходит из помещения, где произошла авария, снимает и погружает в дезраствор защитную одежду. Открытые части тела обрабатывают дезраствором или 70° спиртом.
В. Если авария произошла в исправном боксе безопасности - прекращают работу, гасят спиртовку, выключают оборудование (центрифуги, качалки и т.п., не открывая их), на место аварии накладывают салфетки, обильно смоченные дезраствором. В боксе безопасности и в помещении включают на 30 минут бактерицидные лампы. Включают аварийную сигнализацию. В боксе проводят дезинфекцию. Через 2 часа после завершения дезинфекции работу в боксе безопасности можно продолжать. Вытяжная вентиляция во время аварии и дезинфекции должна оставаться включенной.
Г. Если авария связана с ранением или другим нарушением целостности кожных покровов, работу прекращают, руки обрабатывают дезраствором, снимают перчатку и выдавливают из ранки кровь в дезраствор, на место ранения ставят на 4-5 мин компресс из дезраствора или 70° этилового спирта. При работе с сибирской язвой место ранения тщательно промывают водой с мылом и смазывают йодом без применения дезрастворов.
При аварии с возбудителями глубоких микозов место ранения обрабатывают соответствующим дезраствором (приложение 5.4.), моют водой с мылом, смазывают йодом.
При работе с вирусами I-II групп кровь выдавливают в сухую стерильную салфетку и обрабатывают ранку йодом без применения дезраствора.
При аварии с ботулиническим токсином место ранения промывают водой и разведенной антитоксической сывороткой (10 МЕ/мл).
Д. Если авария произошла при транспортировке материала (в автоклавную и между подразделениями), персонал, задержав дыхание и оставив на местах переносимые емкости, покидает опасную зону, перекрывая подходы к ней. Сопровождающий сообщает о случившемся руководителю подразделения. Допустившие аварию проходят санитарную и профилактическую обработку в объеме, указанном выше (раздел А). Прибывшие на место аварии сотрудники проводят дезинфекцию.
3.10.7. По сигналу "авария", любой сотрудник, принявший его, немедленно извещает о случившемся руководителя подразделения или замещающего его лицо. Последний сообщает о случившемся председателю (члену) комиссии и руководителю учреждения. Заведующий и члены комиссии, прибывшие к месту аварии, оценивают сложившуюся ситуацию, определяют объем мероприятий по ликвидации последствий случившегося, организуют и контролируют действия сотрудников.
3.10.8. В зависимости от характера аварии проводят различный объем дезинфекционных мероприятий от обработки места аварии до полной обработки помещения.
Полную обработку помещения проводят в противочумном костюме I типа или противочумном костюме I типа с фильтрующим противогазом; или в изолирующем костюме КЗМ-1 с фильтрующим противогазом. Персонал входит в помещение, распыляя перед собой из гидропульта дезинфицирующий раствор, орошая воздух, потолок, стены, все предметы, пол. По окончании распыления дезраствора в помещении включают на 30-40 минут стационарные или переносные бактерицидные лампы. Защитные костюмы обеззараживают. Через 2 часа после дезинфекции проводят уборку помещения и работу в нем можно возобновить.
В качестве альтернативного варианта используют газовый метод дезинфекции парами формальдегида, при этом персонал должен быть одет в костюм КЗМ-1 или в защитный костюм I типа с фильтрующим противогазом. После соответствующей экспозиции проводят нейтрализацию газа и влажную уборку.
3.10.9. О происшедшей аварии и проведенных мероприятиях заведующий лабораторией докладывает руководителю учреждения с подробным изложением характера аварии, характеристики возбудителя, сведений о вакцинации пострадавших. Руководитель учреждения по рекомендации комиссии решает вопрос о необходимости медицинского наблюдения, изоляции с правом выхода на работу, изоляции без права выхода на работу, изоляции с профилактическим лечением, профилактического лечения без изоляции.
3.10.10. О всех несчастных случаях и ошибках как своих, так и чужих, происшедших при работе с биологическим материалом, сотрудники обязаны поставить в известность руководителя подразделения или представителя комиссии. За сокрытие аварии виновных отстраняют от работы с биологическим материалом I-II групп.
Руководитель подразделения может временно (до принятия решения руководителем учреждения) отстранить от работы с биологическим материалом лиц, допустивших нарушения настоящих правил, работающих невнимательно или небрежно.
Лица, систематически нарушающие настоящие правила, могут быть отстранены от работы с биологическим материалом распоряжением руководителя учреждения.
3.10.11. Обо всех случаях аварий во время работы с биологическим материалом I-II групп, требующих профилактического лечения пострадавшего, необходимо сообщать в Противочумный центр Госкомсанэпиднадзора России.
3.10.12. О всех случаях лабораторного заражения возбудителями I-II групп патогенности информацию немедленно представляют в Противочумный центр Госкомсанэпиднадзора России, местный центр Госсанэпиднадзора и органы здравоохранения.
3.11. К работе в госпиталях, изоляторах и обсерваторах
3.11.1. Больных или подозрительных на инфекционные заболевания, вызванные микроорганизмами I-II групп (чума, холера, легочная форма сибирской язвы, вирусы I группы), а также контактировавших с ними и выезжающих из зон карантина, помещают в специальные лечебные учреждения.
3.11.2. Больных с подозрением на чуму, холеру и высококонтагиозные лихорадки, вызванные вирусами I группы, госпитализируют в провизорный госпиталь или отделение, расположенное в отдельном здании или изолированном помещении специализированного госпиталя с отдельными входами для больных и обслуживающего персонала.
3.11.3. Госпиталь для больных чумой, холерой, высококонтагиозными лихорадками, вызванными вирусами I группы, может быть организован на базе инфекционной или многопрофильной больницы. Разрешается организация временного госпиталя в изолированных помещениях типа школьных зданий, общежитии и т.п., а также в палатках с обязательным выделением отдельного обслуживающего персонала и соблюдением настоящих правил.
3.11.4. Больных остальными инфекциями госпитализируют в инфекционное отделение любой больницы. При этом больных сибирской язвой, сапом, мелиоидозом, крымской геморрагической лихорадкой (КГЛ), глубокими микозами, орнитозом и лихорадкой КУ с поражением легких помещают в изолированные палаты или боксы.
3.11.5. В заразном отделении госпиталя предусматривают:
а) приемо-сортировочное отделение с отдельным входом для больных и кладовой для хранения одежды больных до отправки ее в дезкамеру;
б) отделение для больных, в котором должны быть предусмотрены палаты (боксы) для раздельного размещения больных по срокам поступления, клиническим формам и степени тяжести болезни;
в) раздаточную пищи;
г) комнату для обеззараживания инфекционного материала (выделения больных, судна, белье и т.д.);
д) ванные и туалетные комнаты;
е) процедурную;
ж) помещение для выписки больных с санитарным пропускником;
з) санпропускник для персонала (комнаты для надевания и снятия защитной одежды, душевая);
и) в госпитале для больных холерой - палаты для регидратации;
к) в госпитале для больных чумой - рентгеновский кабинет, оборудованный передвижной аппаратурой.
3.11.6. В приемно-сортировочном отделении осматривают поступающих больных, оказывают экстренную помощь, берут материал для бактериологического (вирусологического) исследования, проводят санитарную обработку, переодевают больного, готовят одежду больного к отправке в дезкамеру, начинают специфическое лечение и составляют первичную документацию на поступившего больного. Приемное отделение оборудуют в соответствии с его назначением и необходимостью проведения текущей и заключительной дезинфекции.
В кладовой одежду хранят в индивидуальных мешках, сложенных в баки или полиэтиленовые мешки, внутренняя поверхность которых обработана раствором инсектицида.
3.11.7. В отделении госпиталя должны быть палаты для больных со смешанными инфекциями, для беременных и рожениц, а также вся аппаратура и инструментарий для оказания экстренной хирургической акушерско-гинекологической помощи. В палатах для больных должны быть созданы все условия для их лечения, индивидуального обеспечения предметами личного пользования, текущей и заключительной дезинфекции.
Больные не должны пользоваться общими туалетами. Ванные и туалеты должны быть постоянно закрыты на ключ, который хранят у ответственного за соблюдение биологической безопасности. Туалеты открывают для слива обеззараженных растворов, а ванны - для санобработки выписываемых.
Пищу для больных доставляют в посуде кухни к служебному входу незаразного блока и там переливают и перекладывают из посуды кухни в посуду буфетной госпиталя. В буфетной пищу раскладывают в посуду отделений и направляют в раздаточную отделения, где пищу распределяют по порциям и разносят по палатам. Посуду, в которой пища поступила в отделение, обеззараживают кипячением, после чего бак с посудой передают в буфетную, где ее моют и хранят до следующей раздачи. Раздаточная должна быть снабжена всем необходимым для обеззараживания остатков пищи. Индивидуальную посуду обеззараживают кипячением.
3.11.8. В незаразной половине располагают помещения для обслуживающего персонала:
а) гардеробная для верхнего платья;
б) санпропускник (желательно отдельно для мужчин и женщин);
в) туалетные;
г) буфетная;
д) бельевая;
е) комнаты для дежурного персонала (для оформления историй болезни, другой документации и для отдыха);
ж) другие подсобные помещения (аптека и т.п.).
3.11.9. На территории госпиталя оборудуют площадку со стоком и ямой для дезинфекции транспорта, используемого для перевозки больных.
3.11.10. Постельные принадлежности выписанного из госпиталя реконвалесцента сдают в дезинфекционную камеру, кровать и тумбочку обеззараживают (приложение 5.4.).
3.11.11. Перед выпиской больной проходит санитарную обработку. Условия выписки больных из госпиталя указаны в соответствующих инструкциях по каждой инфекции.
3.11.12. Казарменное положение обязательно для персонала, обслуживающего больных легочной формой чумы, высококонтагиозными лихорадками, вызванными вирусами I группы, подозрительных на эти заболевания и контактировавших с ними. Весь персонал, обслуживающий указанный выше контингент, находится под систематическим медицинским наблюдением.
3.11.13. Все лица, принимающие участие в эвакуации подозрительных на заболевание чумой, высококонтагиозными лихорадками, вызванными вирусами I группы, КГЛ и легочной формой сапа, надевают защитные костюмы I типа; при эвакуации больных холерой - костюмы IV типа.
При эвакуации больных, подозрительных на заболевания, вызванные остальными микроорганизмами II группы, используют защитную одежду, предусмотренную при эвакуации инфекционных больных.
3.11.14. Перевоз в стационар больных проводит бригада эвакуаторов на специально выделенном автотранспорте. В состав бригады включают врача или среднего медицинского работника, знакомых с мерами безопасности, двух санитаров и шофера. Шофер эвакобригады при наличии изолированой кабины должен быть одет в комбинезон, при отсутствии ее - в тот же тип костюма, что и остальные члены бригады.
3.11.15. После доставки больного в стационар транспорт и предметы, использованные при транспортировке, обеззараживают на специально оборудованной площадке силами бригады эвакуаторов. По окончании каждого рейса персонал, сопровождавший больного, обязан продезинфицировать обувь и руки (в перчатках) и полиэтиленовые (клеенчатые) фартуки, дополнительно надеваемые при массовых перевозках. Все члены бригады после смены обязаны пройти санитарную обработку.
При перевозке больных легочной формой чумы и сапа, высококонтагиозными лихорадками, вызываемыми вирусами I группы, КГЛ или с подозрением на эти заболевания, эвакуаторы меняют защитную одежду после каждого больного.
3.11.16. Всю работу в госпитале по уходу и лечению больных проводят в защитной одежде:
а) в госпитале, где имеются больные легочной или септической формами чумы, высококонтагиозными лихорадками, вызываемыми вирусами I группы, КГЛ и легочной формой сапа, надевают костюм I типа. Продолжительность работы в костюме I типа не должна превышать трех часов. В жаркое время года продолжительность непрерывной работы сокращается до двух часов;
б) в госпитале, где находятся больные бубонной или кожной формами чумы, получающие специфическое лечение, применяют защитный костюм III типа;
в) до установления окончательного диагноза у больных бубонной и кожной формами чумы и до получения первого отрицательного результата бактериологического исследования весь персонал этого отделения должен быть одет в защитный костюм I типа;
г) в госпитале, где находятся больные сибирской язвой, кожной и носовой формами сапа, применяют костюм III типа, больные орнитозом, лихорадкой Ку с поражением легких - II типа;
д) в госпитале, где находятся больные холерой, весь персонал работает в костюме IV типа, а при проведении туалета больному, взятии ректального материала - надевают резиновые перчатки. Младший персонал дополнительно надевает клеенчатый (полиэтиленовый) фартук, резиновую обувь, а при обработке выделений больного - маску.
По окончании работы защитный костюм, кроме пижамы, подлежит обеззараживанию.
3.11.17. В госпитале, где находятся больные туляремией, бруцеллезом, мелиоидозом и другими заболеваниями, отнесенными ко II группе, устанавливают противоэпидемический режим, предусмотренный для соответствующей инфекции. Персонал холерного стационара работает по режиму, установленному для отделений с острыми желудочно-кишечными заболеваниями.
3.11.18. Больных, подозрительных на заболевание чумой, холерой, высококонтагиозными лихорадками, вызываемыми вирусами I группы и КГЛ, и подлежащих провизорной госпитализации, размещают индивидуально или небольшими группами по срокам поступления и, желательно, по клиническим формам и по тяжести заболевания.
3.11.19. Устройство, порядок и режим работы провизорного госпиталя устанавливают таким же, как и для инфекционного госпиталя.
3.11.20. При подтверждении в провизорном госпитале предполагаемого диагноза больных переводят в соответствующие отделения инфекционного госпиталя.
В палате провизорного отделения после перевода больного проводят дезинфекцию в соответствии с характером инфекции. Остальным больным (контактным) проводят санобработку, переодевают в чистое белье, по возможности, переводят в другую палату и приступают к профилактическому лечению.
При исключении подозреваемого диагноза персонал работает в костюме, соответствующем диагностированному заболеванию.
3.11.21. Срок выписки больных из провизорного госпиталя определяют конкретно в каждом случае, но он не должен быть менее инкубационного периода подозреваемого заболевания, исчисляемого после выявления последнего случая в этом госпитале.
3.11.22. Устройство и режим изолятора такой же, как и в инфекционном госпитале.
3.11.23. В изоляторе, где находятся лица, контактировавшие с больными легочной формой чумы, высококонтагиозными лихорадками, вызванными вирусами I группы и КГЛ, весь обслуживающий персонал обязан проводить работу в защитном костюме I типа.
В изоляторе для контактировавших с больными бубонной, септической или кожной формами чумы, бактериологически подтвержденными и получающими специфическое профилактическое лечение, а также с больными холерой, обслуживающий персонал работает в защитном костюме IV типа.
3.11.24. В госпитале и изоляторе, особенно в палатах для больных и изолированных, не должно быть лишних предметов. Вся обстановка госпиталя и изолятора должна состоять из таких предметов, которые могут быть легко обеззаражены.
3.11.25. Выделения больных и изолированных (мокрота, моча, испражнения и т.д.) подлежат обязательному обеззараживанию. Методы обеззараживания применяются в соответствии с характером инфекции (приложение 5.4.).
3.11.26. В госпитале и изоляторе ежедневно проводят тщательную текущую дезинфекцию, после освобождения их - заключительную дезинфекцию.
3.11.27. Режим биологической безопасности инфекционного, провизорного госпиталя и изолятора находится под систематическим контролем противочумного учреждения; где нет противочумных учреждений - под контролем отделов особо опасных инфекций центров Госсанэпиднадзора.
3.11.28. Лица, находящиеся в карантинной зоне по чуме, могут выехать за ее пределы после 6-суточной обсервации с ежедневной термометрией. О прохождении обсервации выдают справку по установленной форме.
3.11.29. Лица, находящиеся в карантинной зоне по холере, могут выехать за ее пределы после 5-суточной обсервации. В ходе обсервации проводят однократное обследование на вибриононосительство. О прохождении обсервации выдают справки по установленной форме.
3.11.30. Въезд в карантинную зону по чуме разрешается только с санкции органа, имеющего на то право.
3.11.31. Обсерваторы развертывают в приспособленных помещениях (административных зданиях, школах, профилакториях, гостиницах, детских и спортивных лагерях, пассажирских судах и т.п.).
3.11.32. В помещении обсерватора должны быть предусмотрены приемная, палаты для обсервируемых, комнаты для медицинского и обслуживающего персонала, комнаты для взятия материала, хранения личных вещей обсервируемых, буфетная, санпропускник и подсобные помещения.
3.11.33. Помещаемые в обсерватор проходят медицинский осмотр с целью выявления лиц с температурой или желудочно-кишечными расстройствами. В обсерватор допускаются только здоровые люди.
3.11.34. Заполнение отделений или палат обсерватора проводят одномоментно. Обсервируемых размещают по срокам поступления, по возможности небольшими группами с принятием мер к исключению общения с лицами из других помещений.
3.11.35. При выявлении в обсерваторе больного с температурой или с острым кишечным заболеванием его переводят в провизорный госпиталь. Лиц, контактировавших с заболевшим, изолируют на месте до получения результатов бактериологического исследования.
При недостаточной разобщенности обсервируемых срок обсервации возобновляют с момента вывода последнего больного и проведения заключительной дезинфекции. В случае получения отрицательных результатов лабораторного исследования срок обсервации не изменяют.
3.11.36. После освобождения отделения обсерватора проводят заключительную дезинфекцию и повторное его заполнение.
3.11.37. Медицинский и обслуживающий персонал обсерватора находится на казарменном положении и должен быть провакцинирован. Для работы в обсерваторе разрешается мобилизация медицинских работников и другого обслуживающего персонала из числа обсервируемых.
3.11.38. Стационары круглосуточно охраняют воинские или милицейские наряды.
3.12. К медицинскому наблюдению за населением, дезинфекции и патологоанатомической работе в очагах особо опасных инфекций
3.12.1. При возникновении среди населения случаев заболеваний, вызываемых микроорганизмами I-II групп, в очаге заболевания проводят подворные обходы: в очагах чумы - под руководством врача противочумного учреждения, а в очагах холеры и других инфекций - эпидемиолога центра Госсанэпиднадзора.
3.12.2. Медицинский персонал, проводящий подворные обходы, надевает следующую защитную одежду:
а) в очаге, где выявлен больной легочной формой чумы или высококонтагиозными лихорадками, вызываемыми вирусами I группы, - защитный костюм I типа;
б) на территории, где выявлен больной с диагностированной кожной, бубонной или септической формами чумы или на угрожаемой по чуме территории, а также в очагах крымской геморрагической лихорадки - IV типа, в котором тапочки заменены сапогами или ботинками. При этом обследующие обязаны иметь при себе резиновые перчатки, ватно-марлевые маски, защитные очки, которые надевают до входа в помещение, где при предварительном опросе окружающих выявлен подозрительный больной;
в) в очагах холеры, сибирской язвы, туляремии, бруцеллеза и других заболеваний, вызываемых микроорганизмами II группы, а также при текущем эпидемиологическом наблюдении за здоровым населением на потенциально опасных по вышеуказанным инфекциям территориях - медицинский халат или косынка (шапочка).
В зависимости от эпидемической обстановки начальник очага может изменить установленный тип защитной одежды для медицинского персонала при проведении подворных обходов.
3.12.3. Лица, занятые проведением текущей или заключительной дезинфекции и дезинсекции в очагах заболеваний легочной формой чумы и сапа, высококонтагиозными лихорадками, вызываемыми вирусами I группы, КГЛ, должны быть одеты в защитные костюмы I типа; в очагах бубонной формы чумы, мелиоидоза, другими формами сапа, сибирской язвы, холеры, лихорадки Ку - в костюмы II типа; в очагах заболеваний, вызываемых микроорганизмами II группы (не названные выше), - костюмы III типа.
3.12.4. Все трупы людей, умерших от заболеваний, вызываемых микроорганизмами I-II групп (кроме вирусов I группы), подлежат обязательному патологоанатомическому, бактериологическому (вирусологическому), серологическому исследованиям. Вскрытие производит патологоанатом или судмедэксперт в присутствии специалиста по этим инфекциям.
Вскрытие трупа производят в специальном помещении, расположенном, по возможности, на территории госпиталя. Секционное помещение должно быть достаточно светлым, защищенным от мух и других насекомых и не проницаемым для грызунов, с плотными полами без щелей и обеспечено достаточным количеством дезинфицирующих средств и емкостей для растворов.
Категорически запрещается слив жидкости в процессе вскрытия трупов из секционной в канализацию. Жидкость должна быть обеззаражена.
3.12.5. При отсутствии секционного помещения вскрытие проводят на краю могилы, приготовленной для захоронения трупа. Персонал, участвующий во вскрытии, располагается по отношению к трупу с наветренной стороны.
3.12.6. По окончании вскрытия труп опускают в могилу и сбрасывают в нее верхний слой с того места, где производили вскрытие. Захоронение проводят с учетом обычаев местного населения.
3.12.7. Инструментарий, транспорт, на котором перевозили труп, защитные костюмы персонала и все предметы, соприкасавшиеся с трупом, подлежат тщательному обеззараживанию (приложение 5.4.).
3.12.8. Перевозить труп умершего от чумы, геморрагических лихорадок, вызванных вирусами I группы, сибирской язвы, мелиоидоза к месту погребения можно на любом транспорте в металлическом или плотно закрытом деревянном гробу, обитом внутри клеенкой. Во избежание затекания жидкости из трупа, швы в клеенке должны лежать сверху вниз и располагаться на боковых сторонах гроба. На дно могилы засыпают хлорную известь. Труп, уложенный в гроб, засыпают сверху хлорной известью и плотно закрывают крышкой.
3.12.9. В виде редкого исключения, захоронение трупов людей можно проводить без гроба, завернутых в простыню, смоченную дезинфицирующим раствором.
3.12.10. Лица, принимающие участие во вскрытии трупа человека или верблюда, погибших от чумы, а также трупов людей, умерших от КГЛ, должны быть одеты в противочумный костюм I типа.
Вскрытие и захоронение трупов лиц, умерших от холеры, сибирской язвы, мелиоидоза, сапа, проводят в костюме II типа.
При вскрытии дополнительно надевают клеенчатый или полиэтиленовый фартук, такие же нарукавники и вторую пару перчаток.
3.12.11. Захоронение трупов людей, умерших от остальных заболеваний, отнесенных ко II группе, проводят в общем порядке.
3.13. К порядку выезда сотрудников учреждений, работающих с биологическим материалом
3.13.1. Сотрудники, непосредственно работающие на энзоотичной по чуме территории (врачи, зоологи, энтомологи, лаборанты, дезинфекторы, препараторы, санитарки и сезонные рабочие), могут выезжать в другие населенные пункты только после 6-суточной обсервации с ежедневной термометрией.
При работе с возбудителем холеры сроки обсервации - 5 суток.
При работе в помещении, где одновременно осуществляют работу с возбудителями чумы и холеры, срок обсервации для сотрудников - 6 суток.
При работе с высококонтагиозными вирусами I группы - 21 день.
В течение обсервации за сотрудниками устанавливают медицинское наблюдение.
3.13.2. На все время обсервации посещение тех комнат, где ведут работу с биологическим материалом, запрещается.
3.13.3. Если сотрудник во время предвыездной обсервации имел контакт с лицом, работающим с биологическим материалом, у которого в момент общения с ним была повышенная температура или отмечались симптомы острого желудочно-кишечного заболевания, выезд находящегося в обсервации сотрудника откладывают до снятия подозрительного диагноза у заболевшего, при этом обсервация у выезжающего не удлиняется и считается законченной на 5-6 сутки от ее начала.
3.13.4. В случае какого-либо заболевания обсервируемого выезд его откладывается до выздоровления.
3.13.5. Для лиц, не работавших с биологическим материалом I-II групп (сотрудники бухгалтерии, административно-хозяйственного аппарата и др.), выезд может последовать без соблюдения вышеназванных ограничений при отсутствии у них контакта с лабораторными работниками, имеющими повышенную температуру или симптомы острого желудочно-кишечного заболевания неустановленной этиологии, и при условии, что они не посещали помещений, в которых велась работа с этим материалом.
3.13.6. Документы о прохождении обсервации (перед отпуском, командировками, увольнением и т.п.) и разрешение на выезд оформляют следующим образом:
а) сроки обсервации устанавливают приказом по учреждению с извещением обсервируемого;
б) разрешение на выезд оформляют удостоверением следующей формы, которое выдают на руки:
УДОСТОВЕРЕНИЕ
(Ф.И.О.)______________________________________, занимающему должность ___________________ в соответствии с п._____________ Правил "Безопасность работы с биологическим материалом I-II групп патогенности", утвержденных _________199___ г., разрешен выезд в _________________ с ___________________199___ г.
Печать
Подпись руководителя учреждения
3.13.7. В тех населенных пунктах, где имеются противочумные учреждения, прибывший сотрудник сдает удостоверение руководителю этого учреждения, получая при выезде другое, аналогичное. При прибытии командированного в Москву он обязан в суточный срок явиться в Противочумный центр Госкомсанэпиднадзора России и сдать удостоверение на право выезда. Во всех других случаях удостоверение сохраняется у выехавшего и сдается по возвращении в учреждение.
3.13.8. Выезд без обсервации сотрудников, работающих с возбудителями чумы, холеры, вирусами I группы патогенности, возможен по разрешению Госкомсанэпиднадзора России и в составе не менее двух человек.
Все члены группы в период нахождения в пути и по приезде на место командировки обязаны продолжать обсервацию. При обнаружении повышенной температуры у кого-либо из членов группы или появления симптомов острого кишечного заболевания заболевший должен быть немедленно изолирован в ближайшем противочумном или общемедицинском учреждении с экстренным извещением по месту работы.
3.13.9. Переезды сотрудников противочумных учреждений в зоне, обслуживаемой данным или другим противочумным учреждением (кроме гг. Москва и Санкт-Петербург), совершаются без предварительной обсервации, если время пути между населенными пунктами, в которых имеются противочумные учреждения, не превышает вместе с ожиданием в пунктах пересадки 24 часов.
При уходе в отпуск работники противочумных учреждений проходят обсервацию согласно пунктам 3.13.1-3.13.5 настоящих правил. Порядок выезда, указанный в пунктах 3.13.1-3.13.6, распространяется и на лиц, находившихся в командировке в противочумном учреждении.
3.13.10. Выезд сотрудников, работающих только с неконтагиозными возбудителями II группы, разрешается без прохождения обсервации.
4. Организация контроля
4.1. Санитарно-эпидемиологический надзор за выполнением требований настоящих правил должны осуществлять учреждения Госкомсанэпиднадзора России:
- Противочумный центр - в учреждениях, выполняющих работу с биологическим материалом I группы патогенности, на территории России;
- Противочумные учреждения (Противочумный центр, противочумные станции, научно-исследовательские противочумные институты) - в центрах Госсанэпиднадзора, выполняющих работы с биологическим материалом II группы патогенности, на прикрепленной административной территории;
- Центры Госсанэпиднадзора - в учреждениях, выполняющих работы с биологическим материалом II группы патогенности на обслуживаемой территории.
4.2. В каждом учреждении, работающем с биологическим материалом I-II групп патогенности должны быть созданы комиссии по контролю за соблюдением требований биологической безопасности. Организация их работы определяется "Положением ?" (Приложение 5.2.).
4.3. Методическое руководство по вопросам проведения санитарно-эпидемиологического надзора за выполнением требований биологической безопасности при работе с биоматериалом I-II групп патогенности и анализ деятельности по этому разделу работы осуществляет Противочумный центр Госкомсанэпиднадзора России.
4.4. Санитарно-эпидемиологический надзор за выполнением общесанитарных норм и правил в подразделениях, работающих с биоматериалом I-II групп патогенности, должен осуществлять территориальный центр Госсанэпиднадзора.
Приложение 5.1.
(Обязательное)
Классификация патогенных для человека микроорганизмов
Бактерии
|
I группа | ||
|
1. |
Yersinia pestis |
- чумы |
|
II группа | ||
|
1. |
Bacillus anthracis |
- сибирской язвы |
|
2. |
Brucella abortus |
- бруцеллеза |
|
3. |
Francisella tularensis |
- туляремии |
|
4. |
Legionella pneumophila |
- легионеллеза |
|
5. |
Pseudomonas mallei |
- сапа |
|
6. |
Pseudomonas pseudomallei |
- мелиоидоза |
|
7. |
Vibrio cholerae 01 |
- холеры |
|
8. |
Vibrio cholerae non 01 |
- холеры |
|
III группа | ||
|
1. |
Bordetella pertussis |
- коклюша |
|
2. |
Borrelia recurrentis |
- возвратного тифа |
|
3. |
Campylobacter fetus |
- абсцессов, септицемий |
|
4. |
Campylobacter jejuni |
- энтерита, холецистита, септицемий |
|
5. |
Clostridium botulinum |
- ботулизма |
|
6. |
Clostridium tetani |
- столбняка |
|
7. |
Corynebacterium diphteriae |
- дифтерии |
|
8. |
Erysipelothrix rhusiopathiae |
- эризипелоида |
|
9. |
Helicobacter pylori |
- гастрита, язвенной болезни желудка и 12-перстной кишки |
|
10. |
Leptospira interrogans |
- лептоспироза |
|
11. |
Listeria monocytogenes |
- листериоза |
|
12. |
Mycobacterium leprae |
- проказы |
|
13. |
Mycobacterium tuberculosis |
- туберкулеза |
|
14. |
Neisseria gonorrhoeae |
- гонорреи |
|
15. |
Neisseria meningitidis |
- менингита |
|
16. |
Nocardia asteroides |
- нокардиоза |
|
17. |
Proactinomyces israelii |
- актиномикоза |
|
18. |
Salmonella paratyphi A |
- паратифа А |
|
19. |
Salmonella paratyphi В |
- паратифа В |
|
20. |
Salmonella typhi |
- брюшного тифа |
|
21. |
Shigella spp. |
- дизентерии |
|
22. |
Treponema pallidum |
- сифилиса |
|
23. |
Yersinia pseudotuberculosis |
- псевдотуберкулеза |
|
24. |
Vibrio cholerae 01 |
- диареи |
|
25. |
Vibrio cholerae non 01 |
- диареи, раневых инфекций, септицемии и др. |
|
IV группа | ||
|
1. |
Aerobacter aerogenes |
- энтерита |
|
2. |
Bacillus cereus |
- пищевой токсикоинфекции |
|
3. |
Bacteroides spp. |
- абсцессов легких, бактериемий |
|
4. |
Borrelia spp. |
- клещевого спирохетоза |
|
5. |
Bordetella bronchiseptica |
- бронхосептикоза |
|
|
Bordetella parapertussis |
- паракоклюша |
|
6. |
Campylobacter spp. |
- гастроэнтерита, гингивита, периодонтита |
|
7. |
Citrobacter spp. |
- местных воспалительных процессов, пищевой токсикоинфекции |
|
8. |
Clostridium perfringens |
- газовой гангрены |
|
9. |
Escherichia coli |
- энтерита |
|
10. |
Eubacterium endocarditidis |
- септического эндокардита |
|
11. |
Eubacterium lentum |
- вторичных септицемий, абсцессов |
|
|
Eubacterium ventricosum |
|
|
12. |
Flavobacterium meningosepticum |
- менингита, септицемий |
|
13. |
Haemophilus influenza |
- менингита, пневмонии, ларингита |
|
14. |
Hafnia alvei |
- холецистита, цистита |
|
15. |
Klebsiella ozaenae |
- озены |
|
16. |
Klebsiella pneumoniae |
- пневмонии |
|
17. |
Klebsiella rhinoscleromatis |
- риносклеромы |
|
18. |
Mycobacterium spp. |
- микобактериозов |
|
19. |
Micoplasma hominis 1 |
- местных воспалительных процессов, пневмонии |
|
20. |
Propionibacterium avidum |
- сепсиса, абсцессов |
|
21. |
Proteus spp. |
- пищевой токсикоинфекции, сепсиса, местных воспалительных процессов |
|
22. |
Pseudomonas aeruginosa |
- местных воспалительных процессов, сепсиса |
|
23. |
Salmonella spp. |
- сальмонеллезов |
|
24. |
Serratia marcescens |
- местных воспалительных процессов, сепсиса |
|
25. |
Staphylococcus spp. |
- пищевой токсикоинфекции, септицемии, пневмонии |
|
26. |
Streptococcus spp. |
- пневмонии, тонзиллита, полиартрита, септицемии |
|
27. |
Vibrio spp. |
- диарей, пищевых токсикоинфекций, раневых инфекций, септицемий и т.д. |
|
28. |
Yersinia enterocolitica |
- энтерита, колита |
|
29. |
Actinomyces albus |
- актиномикоза |
Риккетсии
|
II группа | ||
|
1. |
Rickettsia prowazekii |
- эпидемического сыпного тифа и болезни Брилля |
|
2. |
R.typhi |
- крысиного сыпного тифа |
|
3. |
R.rickettsii |
- пятнистой лихорадки Скалистых гор |
|
4. |
R.tsutsugamushi |
- лихорадки цуцугамуши |
|
5. |
Coxiella burnetii |
- коксиеллеза (лихорадка Ку) |
|
III группа | ||
|
1. |
R.sibirica |
- клещевого сыпного тифа Северной Азии |
|
2. |
R.conorii |
- средиземноморской пятнистой лихорадки |
|
3. |
R.sharoni |
- израильской лихорадки |
|
4. |
R.sp.now? |
- "астраханской лихорадки" |
|
5. |
R.acari |
- везикулезного риккетсиоза |
|
6. |
R.australis |
- клещевого сыпного тифа Северного Квинсленда |
|
7. |
R.japonica |
- японской пятнистой лихорадки |
|
8. |
R.sp.now? |
- "африканской лихорадки" |
|
9. |
R.sp.now? штамм "ТТT" |
- "клещевого риккетсиоза Таиланда" |
Эрлихии (подсемейство Ehrlichiae, сем. Rickettsiaceae)
|
III группа | ||
|
|
Ehrlichia sennetsu |
- болезни сеннетсу |
|
|
E.canis |
- название отсутствует |
|
|
E.chaffeensis |
- название отсутствует |
Грибы
|
II группа | ||
|
1. |
Blastomyces brasiliensis |
- бластомикоза |
|
2. |
Coccidioides immitis |
- кокцидиоидоза |
|
3. |
Histoplasma capsulatum |
- гистоплазмоза |
|
III группa | ||
|
1. |
Aspergillus flavus |
- аспергиллеза |
|
2. |
Candida albicans |
- кандидоза |
|
3. |
Cryptococcus neoformans |
- криптококкоза |
|
IV группа | ||
|
1. |
Absidia corymbifera |
- мукороза |
|
2. |
Aspergillus niger |
- аспергиллеза |
|
3. |
Candida brumptii |
- кандидоза |
|
4. |
Cephalosporium acremonium |
- цефалоспориоза |
|
5. |
Epidermophyton floccosum |
- эпидермофитии |
|
6. |
Geotrichum candidum |
- геотрихоза |
|
7. |
Microsporum spp. |
- микроспории |
|
8. |
Mucor musedo |
- мукороза |
|
9. |
Penicillium crustosum |
- пенициллиоза |
|
10. |
Pityrosporum orbiculare |
- разноцветного лишая |
|
11. |
Rhizopus nigricans |
- мукороза |
|
12. |
Trichophyton spp. |
- черепитчатого микоза |
|
13. |
Trichosporon cerebriforme |
- узловатой трихоспории |
Простейшие
|
III группa | ||
|
1. |
Leishmania donovani |
- висцерального лейшманиоза |
|
2. |
Plasmodium vivax |
- малярии |
|
3. |
Trichomonas vaginalis |
- мочеполового трихомонадоза |
|
IV группа | ||
|
1. |
Acanthamoeba culbertsoni |
- менингоэнцефалита |
|
2. |
Babesia caucasica |
- бабезиоза |
|
3. |
Balantidium coli |
- балантидиоза |
|
4. |
Entamoeba hystolytica |
- амебиаза |
|
5. |
Isospora belli |
- энтерита |
|
6. |
Naegleria spp. |
- менингоэнцефалита |
|
7. |
Pentatrichomonas hominis |
- колита |
|
8. |
Leishmania major |
- кожного лейшманиоза |
|
9. |
Toxoplasma gondii |
- токсоплазмоза |
Вирусы
(В связи с отсутствием биноминальной номенклатуры для вирусов обозначения даются в русской транскрипции)
|
I группа | ||
|
1. |
Filoviridae: |
|
|
2. |
Arenaviridae: |
|
|
3. |
Poxviridae: |
|
|
4. |
Herpesviridae: |
|
|
II группа | ||
|
1. |
Togaviridae: |
|
|
|
вирусы лихорадок Семлики, Чикунгунья, O'Ньонг-Ньонг, Карельской, Синдбис, реки Росс, Майяро, Мукамбо |
- лихорадочных заболеваний |
|
2. |
Flaviviridae: |
|
|
|
Болезни леса Киассанур, Омской геморрагической лихорадки (ОГЛ) |
- геморрагических лихорадок |
|
|
вирусы комплекса японского энцефалита (ЯЭ), Западного Нила, Ильеус, Росио, Сент-Луис, энцефалит Усуту, энцефалит долины Муррея |
- энцефалитов, менингоэнцефалитов |
|
|
Карши, Кунжин, Сепик, Вессельсборн |
- лихорадочных заболеваний |
|
|
Желтой лихорадки |
- геморрагической лихорадки |
|
|
вирус гепатита С |
- парентерального гепатита, гепатоцелюлярной карциномы печени |
|
3. |
Bunyaviridae, |
- энцефалитов, энцефаломиелитов, менингоэнцефалитов и лихорадочных заболеваний с менингиальным синдромом и артритами |
|
|
комплекс С-вирусы Апеу, Мадрид, Орибона, Oсса, Рестан и др. |
- лихорадочных заболеваний с миозитами и артритами |
|
|
Род Phlebovirus: |
|
|
|
Род Nairovirus: |
|
|
|
болезни овец Найроби, Ганджам; |
- лихорадки с менингиальным синдромом |
|
|
Дугбе |
- энцефалита |
|
|
Род Hantavirus: |
|
|
4. |
Reoviridae, |
|
|
5. |
Rhabdoviridae, |
|
|
|
Дикования, Лагос-бат |
- псевдобешенства и энцефалопатий |
|
6. |
Picornaviridae, |
|
|
7. |
Arenaviridae: |
|
|
8. |
Hepadnaviridae: |
|
|
9. |
Retroviridae: |
|
|
|
вирус Т-клеточного лейкоза человека ( |
- Т-клеточного лейкоза человека |
|
10 |
Unconventional agents: |
|
|
III группа | ||
|
1, |
Orthomyxoviridae: |
|
|
2. |
Picornaviridae, |
|
|
|
вирусы гепатитов А и Е |
- энтеральных гепатитов |
|
|
вирус острого геморрагического конъюнктивита (АНС) |
- геморрагического конъюнктивита |
|
|
Herpesviridae: |
- герпеса простого |
|
|
герпесвирус зостор-ветрянки |
- ветряной оспы, опоясывающего герпетического лишая |
|
|
вирус герпеса 6 типа (HB |
- поражение В-лимфоцитов человека, родовой экзантемы, лимфопролиферативных заболеваний |
|
|
вирус цитомегалии |
- цитомегалии |
|
|
вирус Эпштейн-Барра |
- инфекционного мононуклеоза, лимфомы Беркитта, назофарингиальной карциномы |
|
IV группа | ||
|
1. |
Adenoviridae: |
|
|
2. |
Reoviridae, |
|
|
|
Род Rotavirus: |
|
|
3. |
Picornaviridae, |
|
|
|
вирусы ECHO |
- серозных менингитов, диареи, ОРВИ, полиневритов, увеитов |
|
|
энтеровирусы - типы 68-71 |
- серозных менингитов, конъюнктивитов, ОРВИ |
|
|
Род Rinovirus: |
|
|
|
Род Cardlovirus: |
|
|
4. |
Coronaviridae |
- ОРВИ (профузного насморка без температуры), энтериты |
|
5. |
Caliciviridae: |
|
|
6. |
Paramyxoviridae: |
|
|
|
респираторно-синцитиальный вирус (PC-вирус) |
- пневмоний, бронхитов, бронхиолитов |
|
|
вирус эпидемического паротита |
- эпидемического паротита |
|
|
вирус кори |
- кори |
|
|
вирус Ньюкаслской болезни |
- конъюнктивитов |
|
7. |
Togaviridae, |
|
|
8. |
Rabdoviridae, |
|
|
|
Род Vesiculovirus: |
|
|
9. |
Poxviridae: |
|
|
|
вирус эктромелии |
- эктромелии мышей |
|
|
вирус узелков доильщиц |
- хронической болезни рук доильщиц |
|
|
орфвирус |
- контагиозного пустулярного дерматита |
|
|
вирус контагиозного моллюска |
- контагиозного моллюска кожи и слизистых |
|
|
вирусы Тана и Яба |
- болезни Яба |
Хламидии
|
II группа | ||
|
1. |
Chlamydia psittaci |
- орнитоза-пситтакоза |
|
III группа | ||
|
1. |
Chlamydia trachomatis |
- трахомы, урогенитального хламидиоза |
|
2. |
Chlamydia paratrachomatis |
- трахомоподобного конъюнктивита |
|
3. |
Chlamydia veneral lymphagranulema |
- венерической лимфогранулемы, поражение паховых лимфатических узлов |
Яды биологического происхождения
|
II группа | ||
|
1. |
Ботулинические токсины всех видов | |
|
2. |
Столбнячный токсин | |
|
3. |
Яд паука каракурта | |
|
III группа | ||
|
1. |
Микотоксины |
- микотоксикозы |
|
2. |
Дифтерийный токсин |
|
|
3. |
Стрептококковый токсин группы А |
|
|
4. |
Стафилококковые токсины |
|
|
5. |
Яды змей (кобры, эфы, гюрзы и др.) |
|
Примечание:
1. Аттенуированные штаммы возбудителей I-II групп относят к микроорганизмам III группы патогенности. Аттенуированные штаммы III-IV групп относят к IV группе патогенности.
2. В качестве источника заболеваний человека и животных, вызываемых микроорганизмами I-IV групп, следует считать инфицированных: человека, теплокровных животных, переносчиков, объектов внешней среды.
Приложение 5.2.
(Обязательное)
Положение о комиссии по контролю за соблюдением требований биологической
безопасности в учреждении (предприятии)
1. Комиссия по контролю за соблюдением требований биологической безопасности в учреждении (Далее "Комиссия") является исполнительно-консультативным органом, контролирующим порядок проведения работы с биологическим материалом в диагностических, научно-исследовательских и производственных лабораториях.
2. Комиссия создается в учреждениях (предприятиях), на базе которых проводятся любые виды работы (диагностические, исследовательские, производственные) с биологическим материалом I-II групп патогенности.
3. Комиссия в составе не менее 3-5 человек, компетентных в вопросах безопасности работы с биологическим материалом, назначается приказом по учреждению сроком на 5 лет.
Председателем комиссии назначается заместитель руководителя учреждения по эпидвопросам (науке) или специалист, имеющий соответствующие знания и опыт работы.
4. В своей деятельности комиссия руководствуется настоящими Санитарными правилами, другими нормативными документами по обеспечению биологической безопасности и указаниями руководителя учреждения.
5. Комиссия по административной линии подчиняется руководителю учреждения, ответственному за состояние безопасности работы с биологическим материалом.
6. В целях обеспечения безопасности работы с биологическим материалом при проведении диагностических, исследовательских и производственных работ комиссия решает следующие задачи:
- организация и проведение постоянного контроля за соблюдением регламентированного порядка обеспечения биологической безопасности в учреждении;
- организация и проведение комплекса мероприятий, направленных на предупреждение аварийных ситуаций и ликвидацию их последствий;
- контроль за подготовленностью персонала к работе с инфекционным материалом и организация наблюдения за состоянием здоровья;
- осуществление контроля за выполнением требований соответствующих нормативных документов, а также распоряжений руководителя учреждения и предложений комиссии учреждения;
- проведение анализа состояния биологической безопасности и разработка комплекса мер по ее совершенствованию;
- подготовка отчетной и другой документации по вопросам биологической безопасности;
7. В соответствии с возложенными на нее задачами комиссия проводит следующий комплекс мероприятий:
- осуществляет плановый и периодически внеплановый контроль за выполнением регламентированного порядка обеспечения биологической безопасности;
- осуществляет контроль за своевременной диспансеризацией персонала, контролирует регламентированный порядок иммуно-профилактики, ведет учет лиц с повышенной чувствительностью к антибиотикам и имеющих противопоказания к вакцинации;
- в случае "аварии"* при работе с биологическим материалом разрабатывает и представляет руководителю учреждения план мероприятий по ликвидации ее последствий;
___________
* "Аварией" называют все случаи нарушения правил безопасности при работе с биологическим материалом, обуславливающие возможность заражения персонала, реальную или потенциальную опасность распространения инфекции.
- проводит анализ установленных нарушений правил безопасности, предпосылок к этому, причин аварий и представляет руководителю учреждения план мероприятий по повышению эффективности системы биологической безопасности;
- оформляет необходимую документацию для получения (продления) разрешения на проведение работы с биологическим материалом;
- проводит проверку знаний по вопросам обеспечения биологической безопасности персонала, работающего с биологическим материалом;
- контролирует установленный порядок выезда сотрудников, выдает и принимает обсервационные удостоверения;
- готовит отчет о работе комиссии за год и представляет его в учреждения, осуществляющие надзорные функции п.4.1. настоящих правил;
- имеет план работы, утвержденный руководителем учреждения, нормативные и другие документы, необходимость которых определяется ее задачами и функциями.
8. В целях эффективной реализации своих задач комиссия имеет следующие права:
- требовать от руководителей подразделений и отдельных лиц безусловного выполнения правил биологической безопасности, а также ходатайствовать перед руководителем учреждения об устранении имеющихся нарушений;
- проводить самостоятельно или с привлечением других квалифицированных специалистов плановые и внеплановые проверки соблюдения правил биологической безопасности в учреждении;
- ходатайствовать перед руководителем учреждения о приостановлении работы с биологическим материалом в случае невозможности выполнения правил биологической безопасности или их систематического нарушения, а также о приостановлении или лишении допуска к работе с биологическим материалом отдельных лиц;
- возбуждать мотивированное ходатайство перед учреждением, выдавшим разрешение, о приостановлении использования или запрещении внедрения в практику новых лабораторных методик, видов оборудования, дезинфектантов и т.п., не обеспечивающих необходимого уровня биологической безопасности;
- рассматривать документы и давать заключения;
- заслушивать на заседании комиссии руководителей подразделений, сотрудников учреждения;
- ходатайствовать перед руководителем учреждения о привлечении к административной ответственности лиц за нарушение установленных правил безопасности работы с биологическим материалом.
Приложение 5.3.
(Справочное)
Средства и методы дезинфекции, используемые при работе
с патогенными микроорганизмами
I. Бактерии, не образующие споры
1. Хлорамин Б или ХБ (содержание активного хлора - АХ не менее 26%) 0,5%, 1%, 2%, 3% по препарату растворы.
2. Хлорная известь (содержание АХ не менее 25%)
сухое вещество
0,5%, 1%, 2% (по препарату) осветленные растворы
10% (по препарату) осветленный и неосветленный растворы
20% (по препарату) хлорно-известковое молоко
3. Известь белильная термостойкая (содержание АХ не менее 25%)
сухое вещество
0,5%, 1%, 2% (по препарату) осветленные растворы
10% (по препарату) осветленный и неосветленный растворы
4. Нейтральный гипохлорит кальция НГК (содержание АХ не менее 52% для марки А и не менее 24% для марки Б)
сухое вещество
0,15% (по АХ) раствор
0,25%, 0,5%, 1% (по АХ) осветленные растворы
5% (по препарату) осветленные и неосветленные растворы
5. Гипохлорит кальция технический - ГКТ (содержание АХ не менее 35%)
сухое вещество
0,4% (по АХ) осветленный раствор
1,5% (по препарату) осветленный раствор
5% (по препарату) осветленный и неосветленный растворы
6. Двутретьосновная соль гипохлорита кальция - ДТС ГК (содержание АХ не менее 47%)
сухое вещество
0,15%, 0,5% (по АХ) раствор
0,25%, 1% (по препарату) осветленные растворы
5% (по препарату) осветленный и неосветленный растворы
7. Двуосновная соль гипохлорита кальция-ДСГК (содержание АХ не менее 30%)
сухое вещество
1% (по препарату) осветленный раствор
5% (по препарату) осветленный и неосветленный растворы
8. Гипохлорит натрия (содержание АХ не менее 14%)
1% (по АХ) раствор
9. Гипохлорит натрия, получаемый на установке ЭЛМА-1* или ЭДР-01** 0,125%, 0,25% (по АХ) растворы
___________
* - Установки ЭЛМА-1 и ЭДР-01 выпускаются НИИ "Синтез" и МП "Аспо", г.Москва
___________
** - Установки ЭЛМА-1 и ЭДР-01 выпускаются НИИ "Синтез" и МП "Аспо", г.Москва
10. Анолит, получаемый на установке СТЭЛ*, с содержанием 0,05% АХ
___________
* - Установки СТЭЛ и СТЭЛ-МТ-1 выпускаются НПО "Экран", г.Москва
11. Анолит, получаемый на установке СТЭЛ-МТ-1*, с содержанием 0,06%, 0,09% АХ
___________
* - Установки СТЭЛ и СТЭЛ-МТ-1 выпускаются НПО "Экран", г.Москва
12. Анолит, получаемый на установке ЭХА-30*, с содержанием 0,02%, 0,03%, 0,04%, 0,05% АХ
__________
* - Установка ЭХА-30 выпускается ПО "Медфизприбор", г.Казань
13. Сульфохлорантин или сульфохлорантин М (содержащий АХ не менее 15%)
0,1%, 0,2% по препарату растворы
14. ДП-2 (содержание АХ не менее 35%)
0,1%, 0,2% (по препарату) растворы
15. Дезоксон-1 или дезоксон-4 (содержащий не менее 5% надуксусной кислоты - НУК)
1%, 2% (по препарату) растворы
16. Пергидроль (содержание перекиси водорода 30%)
3% раствор перекиси водорода
17. Перекись водорода с моющим средством* (3% раствор перекиси водорода с 0,5% моющего средства)
___________
* - Добавляется к растворам перекиси водорода для придания ей моющих свойств
18. Пероксогидрат фторида калия (ПФК-1)
(содержание перекиси водорода не менее 35%)
3%, 6%, 7%, 9% (по препарату) растворы
19. Полисепт*
1% (по препарату) раствор
___________
* - Полисепт - на основе поверхностно-активных веществ выпускается заводом биопрепаратов г.Покров, Владимирской области
20. Амфолан*
1%, 2%, 3% (по препарату) растворы
___________
* - Амфолан - на основе поверхностно-активных веществ выпускается МП "Синтеко", г.Киев
21. Лизол А (содержание фенолов 50%)
2%, 3%, 10% (по препарату) растворы
22. I-хлор- -нафтол
-нафтол
0,5%, 2% (по препарату) растворы
23. Отходы или полупродукты промышленности, содержащие:
3% крезола или 1% АХ, или 2% щелочи, или 1% кислоты с ПАВ анионного типа в соотношении 1:1 или 0,5:1
24. Едкий натр
10% (по препарату) раствор
25. Формалин
10%, 20%, 40% (по формальдегиду) водные растворы
26. Аммиак
10% водный раствор (для нейтрализации формальдегида в соотношении 1:1)
27. Кипячение
2% содовый раствор
28. Обработка водяным насыщенным паром под давлением (автоклавирование)
0,20 МПА (2,0 кгс/см ), 132±2 °С
), 132±2 °С
0,15 МПА (1,5 кгс/см ), 126±2 °С
), 126±2 °С
0,11 МПА (1,1 кгс/см ), 120±2 °С
), 120±2 °С
29. Спирт 70°
30. Сжигание
31. Прокаливание
32. Обработка в дезинфекционных камерах: паровоздушный метод, пароформалиновый
33. Аэрозольный метод обеззараживания
34. Газовый метод (дезинфекция парами формальдегида)
35. Ультрафиолетовое облучение
II. Бактерии, образующие споры
1. Хлорамин Б или ХБ
1-4% активированные растворы, содержащие 0,25-1% АХ
2. Хлорная известь или белильная термостойкая известь
сухое вещество
20% осветленные растворы, содержащие не менее 5% АХ
4% активированные осветленные растворы, содержащие не менее 1% АХ
3. Двутретьосновная соль гипохлорита кальция (ДТС ГК) или нейтральный гипохлорит кальция (НГК)
сухое вещество
15% осветленные растворы, содержащие не менее 5% АХ
2% активированные осветленные растворы, содержащие не менее 1% АХ
4. Двуосновная соль гипохлорита кальция (ДСГК)
4% активированные растворы, содержащие не менее 1,2% АХ
5. Едкий натр
10% раствор (70 °С)
6. Пергидроль, содержащий 30-35% перекиси водорода
6% раствор перекиси водорода с 0,5% моющего средства ("Прогресс", "Новость", "Лотос", "Астра")
3% раствор перекиси водорода с 0,5% моющего средства при температуре раствора 50 °С
7. Дезоксон-1 или дезоксон-4
раствор, содержащий 1% надуксусной кислоты
8. Формалин
20%, 40% (по формальдегиду) водные растворы
9. Кипячение
10. Прокаливание
11. Сжигание
12. Сухой горячий воздух (180 °С)
13. Обработка паром под давлением 2,0 кгс/см (132±2 °С)
(132±2 °С)
14. Все емкости, в которых проводится обеззараживание, должны быть закрыты крышкой, включая банки из-под животных
15. Обработка в камерах: паровоздушный и пароформалиновый методы
16. Аэрозольный метод обеззараживания
III. Вирусы и хламидии
1. Хлорамин (содержание АХ не менее 26%)
1%, 3% (по препарату) растворы
0,5%, 1,5% (по препарату) активированные растворы хлорамина
2. Хлорная известь (содержание АХ не менее 25%)
сухое вещество
3%, 10% (по препарату) осветленные и неосветленные растворы
20% (по препарату) хлорно-известковое молоко
3. Известь белильная термостойкая (содержание АХ не менее 25%)
сухое вещество
3%, 10% (по препарату) осветленные и неосветленные растворы
4. Двутретьосновная соль гипохлорита кальция - ДТСГК (содержание АХ не менее 47%)
сухое вещество
1,5%, 5% (по препарату) растворы
5. Нейтральный гипохлорит кальция (содержание АХ не менее 52% и 24% для марок А и Б)
сухое вещество
1,5%, 5% (по препарату) растворы
6. Гипохлорит кальция технический - ГКТ (содержание АХ не менее 35%)
сухое вещество
1%, 1,5%, 5% (по препарату) растворы
7. Двуосновная соль гипохлорита кальция (содержание АХ не менее 30%) - ДСГК
1%, 1,5%, 5%, 7% (по препарату) осветленные и неосветленные растворы
8. Сульфохлорантин и сульфохлорантин М (содержание АХ 15,6%)
0,1%, 0,2% (по препарату) растворы
9. ДП-2 (содержание АХ 40%)
0,1%, 0,2%, 0,5% (по препарату) растворы
10. Анолит, получаемый в установке ЭХА-30 с содержанием АХ 0,04% и 0,05%
11. Анолит, получаемый в установке СТЭЛ-МТ-1 с содержанием АХ 0,06% и 0,09%
12. Анолит, получаемый в установке СТЭЛ с содержанием АХ 0,05%
13. Пергидроль с содержанием АДВ 30-35%
6% (по АДВ) раствор перекиси водорода
6% раствор перекиси водорода с 0,5% моющего средства
14. Пероксогидрат фторида калия - ПФК-1
4% (по препарату) раствор
15. Дезоксон-1 или дезоксон-4 с содержанием НУК 5%
0,1%, 0,5% (по НУК) растворы
16. Лизол А
5% и 8% растворы
17. Формалин
40% (по формальдегиду) водный раствор
18. Аммиак
10% (по АДВ) водный раствор
Для нейтрализации формальдегида применяется соотношение 1:1
19. Едкий натр
10% (по препарату) раствор
20. 70° раствор этилового спирта
21. Сода пищевая 2% раствор
22. Сода кальцинированная 2% раствор
23. Обеззараживание водяным насыщенным паром под избыточным давлением в паровом стерилизаторе (автоклаве)
1,1 кгс/см (0,11 МПа), 120±2 °С
(0,11 МПа), 120±2 °С
1,5 кгс/см (0,15 МПа), 126±2 °С
(0,15 МПа), 126±2 °С
2,0 кгс/см (0,20 МПа), 132±2 °С
(0,20 МПа), 132±2 °С
24. Обеззараживание сухим жаром в воздушном стерилизаторе, 180 °С, 60 мин
25. Кипячение
26. Сжигание
27. Обработка в дезинфекционной камере: паровоздушный и пароформалиновый методы
28. Аэрозольный метод обеззараживания
29. Газовый метод (дезинфекций парами формальдегида)
30. Ультрафиолетовое облучение
Примечание:
В качестве активаторов хлорных препаратов могут быть использованы аммонийные соли (хлорит, сульфит или нитрат аммония) в соотношении с активным хлором 1:1 или 1:2, или аммиак в соотношении с активным хлором 1:8 (хлора в 8 раз больше, чем аммиака)
IV. Риккетсии
1. Хлорная известь или белильная термостойкая известь
сухое вещество
20% осветленные и неосветленные растворы, содержащие не менее 5% активного хлора
3% осветленные растворы, содержащие не менее 1% активного хлора
2. Хлорамин Б или ХБ
3% растворы, содержащие не менее 0,6% активного хлора
0,5% активированный раствор хлорамина
3. Двутретьосновная соль гипохлорита кальция (ДТС ГК) или нейтральный гипохлорит кальция (НГК), гипохлорит кальция технический (ГКТ)
сухое вещество
15% осветленный или неосветленный растворы, содержащие не менее 5% активного хлора
1,5% раствор, содержащий не менее 0,5% активного хлора
4. Пергидроль, содержащий около 30-35% перекиси водорода
6% раствор перекиси водорода
3% раствор перекиси водорода с 0,5% моющего вещества
5. Формалин - 20% раствор формальдегида
6. Едкий натр
3%-5%-10% растворы
7. Лизол А
8% раствор
8. Кипячение
9. Сжигание
10. Сухой горячий воздух при 180 °С
11. Обработка паром под давлением (автоклавирование)
2,0 кгс/см (132±2 °С)
(132±2 °С)
1,1 кгс/см (120±2 °С)
(120±2 °С)
11. Спирт 70°
12. Обработка в камерах
а) паровоздушный метод
б) пароформалиновый метод
V. Грибы
1. Хлорамин Б или ХБ (содержащий активного хлора - АХ не менее 26%)
5% по препарату раствор
2. ДТСГК: 2% раствор двутретьосновной соли гипохлорита кальция
3. Сульфохлорантин или сульфохлорантин М (содержащий АХ не менее 15%)
3% раствор
4. Растворы бензилфенола 2-2,5%
5. Растворы лизола 5-10%
6. Растворы формалина 5-10%
7. Иодонат: 1% раствор
8. Кипячение
9. Обработка паром под давлением 1,1 кгс/см - 2 кгс/см
- 2 кгс/см (120±2 °С, 126±2 °С, 132±2 °С)
(120±2 °С, 126±2 °С, 132±2 °С)
10. Сжигание
11. Прокаливание
12. Ультрафиолетовое облучение лампами
13. Аэрозольный метод обеззараживания
14. Обработка в камерах:
а) паровоздушный метод
б) пароформалиновый метод
Приложение 5.4
(обязательное)
Режимы обеззараживания различных объектов,
зараженных патогенными микроорганизмами
|
NN п/п |
Объект, подлежащий обеззараживанию |
Способ обеззараживания |
Обеззараживающее средство |
Время контакта, мин |
Норма расхода | |
|
1 |
2 |
3 |
4 |
5 |
6 | |
|
| ||||||
|
1. |
Ограниченные участки почвы (дороги) |
Орошение |
10% осветленный или неосветленный раствор хлорной или белильной термостойкой извести |
60 |
2 л/м | |
|
|
|
|
5% раствор ДТСГК или НГК, или ДСГК, или ГКТ |
-"- |
-"- | |
|
|
|
|
5% раствор лизола А |
-"- |
-"- | |
|
|
|
|
10% раствор едкого натра |
-"- |
-"- | |
|
|
|
|
1% раствор (по АХ) гипохлорита натрия |
-"- |
-"- | |
|
|
|
|
Отходы или полупродукты промышленности, содержащие 3% крезола, 1% активного хлора, или 2% кислоты, или 2% щелочи, или 1% кислоты с поверхностно-активными веществами (ПАВ) анионного типа в соотношении 1:1 или 0,5:1 |
-"- |
-"- | |
|
2. |
Поверхности помещения (пол, стены, двери), мебель, оборудование, рабочий стол, индивидуальные шкафы и др. мебель, помещение вивария |
Орошение или протирание с последующей влажной уборкой |
1% раствор хлорамина Б или ХБ |
60 |
300 мл/м | |
|
|
|
|
1% осветленный раствор хлорной извести или извести белильной термостойкой |
-"- |
-"- | |
|
|
|
|
0,5% осветленный раствор (по АХ) НГК или ДТС ГК |
-"- |
-"- | |
|
|
|
|
0,4% (по АХ) осветленный раствор ГКТ |
-"- |
-"- | |
|
|
|
|
1% осветленный раствор ДСГК |
-"- |
-"- | |
|
|
|
|
0,25% раствор гипохлорита натрия, получаемого на установках ЭЛМА-1 или ЭДР-01 |
-"- |
-"- | |
|
|
|
|
1% по АХ раствор гипохлорита натрия |
-"- |
-"- | |
|
|
|
|
0,1% раствор ДП-2 |
-"- |
-"- | |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
-"- |
-"- | |
|
|
|
Двукратное протирание с интервалом 30 мин |
Анолит, получаемый на установке ЭХА-30 и содержащий 0,03% АХ |
-"- |
80 мл/м | |
|
|
|
|
Анолит, получаемый на установке СТЭЛ-МТ-1 и содержащий 0,06% АХ |
-"- |
200 мл/м | |
|
|
|
Протирание или орошение |
1% раствор дезоксона-1 или дезоксона-4 |
30 |
300 мл/м | |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
60 |
300 мл/м | |
|
|
|
Протирание |
9% раствор ПФК-1 |
30 |
200 мл/м | |
|
|
|
|
1% раствор Полисепта |
60 |
100 мл/м | |
|
|
|
|
3% раствор амфолана |
30 |
150 мл/м | |
|
|
|
Орошение |
5% раствор лизола А |
20 |
500 мл/м | |
|
|
|
|
3% раствор лизола А |
60 |
| |
|
|
|
|
0,5% раствор 1-хлор- |
60 |
100 мл/м | |
|
| ||||||
|
|
Для экстремальных ситуаций при условии герметизации помещения |
Испарение раствора с последующим проветриванием помещения |
40% раствор формальдегида с последующей нейтрализацией его аммиаком (25% раствор при норме расхода 10 мл/м |
12 часов |
Формалина 17,5-12,5 мл/м | |
|
|
|
Аэрозольный метод дезинфекции помещения с помощью пневматической (ПВАН) или турбулирующей (ТАН) аэрозольных насадок. Источником сжатого воздуха для распыления служит компрессор, имеющий производитель- ность не менее 300 м |
40% водный раствор формальдегида с последующей нейтрализацией его раствором аммиака (при норме расхода 10 мл/м |
12 ч |
Формалина 12,5 мл/м | |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
120 мин |
200 мл/м | |
|
3. |
Защитная одежда персонала (халаты, шапочки, маски, косынки), белье больного без видимых загрязнений |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,1 кГс/см |
30 |
5 л на 1 кг сухого белья | |
|
|
|
Кипячение |
2% содовый раствор или 0,5% раствор любого моющего средства |
15 |
| |
|
|
|
Замачивание в одном из дезрастворов с последующей стиркой и полосканием |
0,5% раствор хлорамина Б или ХБ |
60 |
| |
|
|
|
|
0,1% раствор сульфохлорантина или сульфохлорантина М |
60 |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
30 |
| |
|
|
|
|
0,1% раствор ДП-2 |
30 |
| |
|
|
|
|
0,125% раствор по АХ гипохлорита натрия, получаемого на установках ЭЛМА-1 и ЭДР-01 |
60 |
| |
|
|
|
|
Анолит, получаемый на установке ЭХА-30 и содержащий 0,03% АХ |
60 |
| |
|
|
|
|
Алолит, получаемый на установке СТЭЛ-МТ-1 и содержащий 0,05% АХ |
60 |
| |
|
|
|
|
Анолит, получаемый на установке СТЭЛ и содержащий 0,03% АХ |
60 |
| |
|
|
|
|
1% раствор дезоксона-1 или дезоксона-4 |
30 |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
30 |
| |
|
|
|
|
1% раствор Полисепта |
30 |
| |
|
|
|
|
3% раствор лизола А |
30 |
| |
|
|
|
|
3% раствор ПФК-1 |
60 |
| |
|
|
|
|
1% раствор амфолана |
60 |
| |
|
4. |
Защитная одежда персонала (халаты, шапочки, маски, косынки), белье больного, загрязненное выделениями (мокрота, моча, фекалии и др.), кровью |
Кипячение |
2% раствор соды |
15 |
5 л/кг сухого белья | |
|
|
|
Замачивание с последующим полосканием и стиркой |
1% раствор хлорамина Б или ХБ |
120 |
| |
|
|
|
|
3% раствор хлорамина Б или ХБ |
30 |
| |
|
|
|
|
0,25% раствор по АХ гипохлорита натрия, получаемый на установках ЭЛМА-1 и ЭДР-01 |
60 |
| |
|
|
|
|
0,2% раствор ДП-2 |
120 |
| |
|
|
|
|
Анолит, получаемый на установке ЭХА-30 и содержащий 0,04% АХ |
60 |
| |
|
|
|
|
Анолит, получаемый на установке СТЭЛ-МТ-1 и содержащий 0,09% АХ |
60 |
| |
|
|
|
|
Анолит, получаемый на установке СТЭЛ и содержащий 0,05% АХ |
30 |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
120 |
| |
|
|
|
|
2% раствор дезоксона-1 или дезоксона-4 |
60 |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
120 |
| |
|
|
|
|
7% раствор ПФК-1 |
60 |
| |
|
|
|
|
3% раствор амфолана |
60 |
| |
|
|
|
|
1% раствор Полисепта |
60 |
| |
|
|
|
|
3% раствор лизола А |
120 |
| |
|
|
|
|
2% раствор 1-хлор- |
60 |
| |
|
|
|
|
Водяной насыщенный пар под давлением 1,1 кгс/см |
30 |
| |
|
5. |
Перчатки |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,1 кГс/см |
45 |
| |
|
|
|
Кипячение |
2% раствор соды |
15 |
| |
|
|
|
Погружение |
3% раствор лизола А |
120 |
| |
|
|
|
|
1% раствор хлорамина Б или ХБ |
120 |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
30 |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
120 |
| |
|
|
|
|
0,25% раствор (по АХ) гипохлорита натрия, получаемого на установках ЭЛМА-1 или ЭДР-01 |
60 |
| |
|
|
|
|
0,2% раствор ДП-2 |
60 |
| |
|
|
|
|
0,1% раствор по НУК дезоксона-1 или дезоксона-4 |
15 |
| |
|
6. |
Очки, фонендоскоп и др. |
Двукратное протирание с интервалом 15 мин с последующим обмыванием водой |
3% раствор перекиси водорода с 0,5% моющего средства |
30 |
| |
|
|
|
|
3% раствор перекиси водорода |
30 |
| |
|
|
|
Погружение |
70° спирт |
30 |
| |
|
7. |
Резиновые и кирзовые сапоги, тапочки из кожи и кожзаменителя |
Протирание |
Дезинфицирующие растворы, указанные в п.2 |
|
| |
|
8. |
Ватные куртки, брюки |
Камерное обеззараживание |
Паровоздушная смесь 80-90 °С |
20 |
10 комп- лектов (60 | |
|
|
.....стельные* принадлежности |
Камерное обеззараживание |
Паровоздушная смесь 80-90 °С |
45 |
| |
|
______________________ | ||||||
|
9. |
Полушубки, шапки, кожаная и меховая обувь, тапочки |
Камерное обеззараживание |
Пароформалиновая смесь 57-59 °С |
45 |
Формалина 75,0 мл/м | |
|
10. |
Посуда лабораторная (пипетки, пробирки, колбы; чашки Петри, мазки-отпечатки, гребенки для сушки культур, шприцы и др.) |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
60 |
Полное погружение | |
|
|
|
|
2% раствор соды |
30 |
| |
|
|
|
Погружение |
3% раствор хлорамина Б или ХБ |
60 |
| |
|
|
|
|
0,25% раствор по АХ гипохлорита натрия, получаемого на установках ЭЛМА-1 и ЭДР-01 |
120 |
| |
|
|
|
|
Анолит, получаемый на установке ЭХА-30 и содержащий 0,05% АХ |
60 |
| |
|
|
|
|
Нейтральный анолит, получаемый на установке СТЭЛ-МТ-1 и содержащий 0,09% АХ |
120 |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
60 |
Полное погружение | |
|
|
|
|
2% раствор дезоксона-1 или дезоксона-4 |
60 |
| |
|
|
|
|
3% раствор ПФК-1 |
60 |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
60 |
| |
|
|
|
|
2% раствор амфолана |
60 |
| |
|
|
|
|
3% раствор лизола |
60 |
| |
|
11. |
Посуда больного |
Кипячение |
2% раствор соды |
15 |
| |
|
|
|
Погружение в дезраствор с последующим тщательным обмыванием горячей водой |
Дезинфицирующие растворы, указанные в п.4 (за исключением анолита, получаемого на установке СТЭЛ, и Полисепта) |
|
| |
|
|
|
|
6% раствор ПФК-1 |
60 |
| |
|
12. |
Игрушки |
Кипячение (кроме пластмассовых) |
2% содовый раствор |
15 |
Полное погружение | |
|
|
|
Погружение или протирание с ветошью, смоченной в растворе, с последующим мытьем |
0,5% раствор осветленной хлорной извести, белильной термостойкой извести |
60 |
Полное погружение или протирание (200 мл/м | |
|
|
|
|
0,5% раствор хлорамина Б или ХБ |
60 |
| |
|
|
|
|
0,25% осветленный раствор НГК или ДТ СГК |
60 |
| |
|
|
|
|
0,1% раствор сульфохлорантина или сульфохлорантина М |
60 |
| |
|
|
|
|
0,1% раствор ДП-2 |
30 |
| |
|
|
|
|
1% раствор амфолана |
60 |
| |
|
|
|
|
0,125% (по АХ) раствор гипохлорита натрия, получаемого на установках ЭДР-01 или ЭЛМА-1 |
60 |
| |
|
|
|
|
Нейтральный анолит, получаемый на установке СТЭЛ-МТ-1 и содержащий 0,05% АХ |
30 |
| |
|
|
|
|
Анолит, получаемый на установке ЭХА-30 и содержащий 0,02% АХ |
15 |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
15 |
| |
|
|
|
|
1% раствор дезоксона-1 или дезоксона-4 |
30 |
| |
|
13. |
Бактериологические посевы |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
60 |
| |
|
|
При отсутствии возможности обеззараживания в паровом стерилизаторе погружение на 24 часа в один из дезинфицирующих растворов, указанных в п.4 | |||||
|
|
|
Кипячение |
Температура кипения воды 100 °С |
30 |
| |
|
14. |
Резиновые пробки, шланги, груши для пипетирования зараженного материала |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,5 кГс/см - (126±2 °С), МПа 0,15 |
60 |
| |
|
|
|
Кипячение |
Температура кипения воды 100 °С |
30 |
| |
|
15. |
Петли для пересева зараженного материала |
Прокаливание в пламени горелки |
|
|
| |
|
16. |
Инструменты после вскрытия лабораторных животных |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
30 |
| |
|
|
|
Кипячение |
2% раствор соды |
15 |
| |
|
|
|
|
Вода, температура 100 °С |
30 |
| |
|
|
|
Погружение |
1% раствор хлорамииа |
30 |
| |
|
|
|
|
3% раствор перекиси водорода |
80 |
| |
|
|
|
|
3% раствор формалина (по формальдегиду) |
30 |
| |
|
|
|
|
0,1% раствор по НУК дезоксона-1 или дезоксона-4 |
15 |
| |
|
NN п/п |
Объект, подлежащий обеззараживанию |
Способ обеззараживания |
Обеззараживающее средство |
Время контакта, мин |
Норма расхода | |
|
1 |
2 |
3 |
4 |
5 |
6 | |
|
|
|
|
0,1% раствор сульфохлорантина или сульфохлорантина М |
30 |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
80 |
| |
|
17. |
Руки в резиновых перчатках |
Погружение и мытье |
дезинфицирующие растворы, указанные в п.5 |
2 |
| |
|
18. |
Незащищенные участки кожи, руки |
Моют или протирают тампоном, смоченным раствором, затем моют теплой водой с индивидуальным туалетным мылом, вытирают индивидуальным полотенцем |
0,5% раствор хлорамина Б или ХБ |
2 |
| |
|
|
При попадании инфекционного материала в случае аварии используют: | |||||
|
|
|
|
1% раствор хлорамина Б или ХБ |
10 |
| |
|
|
|
|
70° этиловый спирт |
2 раза по 3 мин |
| |
|
19. |
Банки и бачки для животных, подстилочный материал, выделения животных, остатки корма |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
60 |
| |
|
|
|
Залить до краев и протереть снаружи ветошью, смоченной дезинфицирующим раствором |
3% раствор хлорамина Б или ХБ |
24 часа |
| |
|
|
|
|
1% раствор ДТС ГК или НГК |
24 часа |
| |
|
|
|
|
5% раствор лизола А |
24 часа |
| |
|
|
|
|
0,2% раствор ДП-2 |
24 часа |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
24 часа |
| |
|
20. |
Металлические ящики, садки, бачки из-под вскрытых животных и орудия лова |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
30 |
300 мл/м | |
|
|
|
Воздушный стерилизатор |
Сухой жар температуры 160 °С |
60 |
| |
|
|
|
Погружение |
3% раствор хлорамина Б или ХБ |
120 |
| |
|
|
|
|
5% раствор лизола А |
120 |
| |
|
|
|
Орошение |
3% раствор хлорамина Б или ХБ |
60 |
| |
|
|
|
|
5% раствор лизола А |
60 |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
60 |
| |
|
|
|
|
0,2% раствор ДП-2 |
60 |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
60 |
| |
|
21. |
Воздушные бактериальные фильтры |
Орошают, извлекают, помещают в полиэтиленовый пакет, завязывают, сжигают |
Для орошения применяют средства и режимы, указанные в п.2 |
|
| |
|
|
|
Погружение |
Применяют средства, указанные в п.2 |
48 часов |
| |
|
|
|
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
60 |
| |
|
22. |
Трупы животных, подстилочный материал, выделения животных |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
60 |
| |
|
|
|
Сжигание |
|
|
| |
|
|
|
Поверхностное обеззараживание трупов путем погружения |
5% раствор лизола |
24 ч |
| |
|
|
|
|
5% раствор хлорамина Б или ХБ |
24 ч |
| |
|
|
|
В емкость, содержащую патологический материал, добавляют один из препаратов |
5% раствор лизола А |
60 |
Соотношение 1:2 (для жидких выделений) | |
|
|
|
|
10% раствор лизола Б |
60 |
Соотношение 1:2 | |
|
23. |
Жидкие отходы, смывные воды |
Паровой стерилизатор (автоклав) |
Водяной насыщенный пар под давлением 1,1 кГс/см |
30 |
| |
|
|
|
Кипячение |
|
30 |
| |
|
|
|
Засыпать и размешать |
Сухая хлорная известь или белильная термостойкая известь, или ДТС ГК, или НГК |
60 |
200 г/л | |
|
|
|
|
ДСГК или ГКТ |
120 |
| |
|
24. |
Выделения больного: мокрота, оформленные фекалии, смешанные с мочой или водой в соотношении 1:5, жидкие фекалии, рвотные массы, остатки пищи |
Засыпать и размешать |
Сухая хлорная известь или белильная термостойкая известь, или ДТС ГК, или ДСГК |
60 |
200 г/л | |
|
|
|
|
НГК |
120 |
150 г/л | |
|
|
|
|
|
30 |
200 г/л | |
|
|
|
|
ГКТ |
120 |
200 г/л марки А | |
|
|
|
|
|
250 г/л марки Б | ||
|
|
|
|
5% раствор лизола А |
60 |
В соотношении 2 части дезраствора и 1 часть выделений | |
|
|
|
|
10% раствор лизола Б |
60 |
| |
|
25. |
Моча, ополоски зева |
Залить |
2% раствор хлорной извести или белильной термостойкой извести |
60 |
Соотношение 1:1 | |
|
|
|
|
2% раствор лизола |
60 |
Соотношение 1:1 | |
|
|
|
|
1% раствор ДТС ГК или НГК |
60 |
Соотношение 1:1 | |
|
|
|
|
2% раствор хлорамина Б или ХБ |
60 |
Соотношение 1:1 | |
|
|
|
Засыпать и размешать |
Хлорная известь или известь белильная термостойкая |
15 |
10 г/л | |
|
|
|
|
НГК |
15 |
5 г/л | |
|
|
|
|
ГКТ |
15 |
10 г/л | |
|
26. |
Посуда из-под выделений больного (горшки, подкладные судна, мочеприемники), квачи, используемые для мытья посуды, после обеззараживания хранят в специальной емкости |
Погружение в один из дезрастворов с последующим мытьем |
1% осветленный раствор хлорной извести или белильной термостойкой извести |
30 |
| |
|
|
|
|
0,5% раствор НГК |
30 |
| |
|
|
|
|
1% раствор хлорамина Б или ХБ |
60 |
| |
|
|
|
|
3% раствор хлорамина Б или ХБ |
30 |
| |
|
|
|
|
5% раствор лизола А |
60 |
| |
|
|
|
|
1,5% раствор ГКТ |
30 |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
30 |
| |
|
|
|
|
1% раствор (по АХ) гипохлорита натрия |
30 |
| |
|
|
|
|
0,2% раствор ДП-2 |
30 |
| |
|
27. |
Санитарно-техническое оборудование |
Двукратное протирание ветошью, смоченной в одном из дезрастворов |
Дезрастворы, указанные в п.2 |
60 |
500 мл/м | |
|
|
|
Протирание ветошью, на которую наносят моюще-дезинфици- рующие вещества с последующим мытьем |
Дихлор-1 |
15 |
0,5 г/100 см | |
|
|
|
|
Белка |
15 |
| |
|
|
|
|
Блеск-2 |
25 |
| |
|
|
|
|
Санита |
15 |
| |
|
|
|
|
ПЧД |
15 |
| |
|
|
|
|
Деаус и др. |
15 |
| |
|
28. |
Уборочный материал, ветошь |
Кипячение |
2% содовый раствор |
15 |
Полное погружение | |
|
|
|
Замачивание |
3% раствор хлорамина Б или ХБ |
60 |
| |
|
|
|
|
1,5% раствор ГКТ |
120 |
| |
|
|
|
|
0,6% раствор по АХ НГК |
120 |
| |
|
|
|
|
0,25% раствор по АХ, гипохлорита натрия, получаемого на установках ЭДР-01 или ЭЛМА-1 |
60 |
| |
|
|
|
|
Анолит, получаемый на установке ЭХА-30 и содержащий 0,04% АХ |
60 |
| |
|
|
|
|
Анолит, получаемый на установке СТЭЛ-МТ-1 и содержащий 0,09% АХ |
60 |
| |
|
|
|
|
0,2% раствор ДП-2 |
120 |
| |
|
|
|
|
0,1% раствор сульфохлорантина или сульфохлорантина М |
120 |
| |
|
|
|
|
2% раствор дезоксона-1 или дезоксона-4 |
60 |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства |
120 |
| |
|
29. |
Мусор |
Сжигание |
|
|
На 1 часть мусора 2 части раствора | |
|
|
|
Залить одним из дезрастворов |
10% раствор осветленный хлорной извести или белильной термостойкой извести |
120 |
| |
|
|
|
|
5% раствор НГК |
120 |
| |
|
|
|
|
20% хлорно-известковое молоко |
60 |
| |
|
30. |
Надворные уборные, помойные и мусорные ящики |
Орошают одним из дезрастворов |
10% раствор хлорной извести, белильной термостойкой извести |
60 |
500 мл/м | |
|
|
|
|
5% раствор НГК |
60 |
| |
|
31. |
Транспорт |
Орошение с последующим протиранием сухой ветошью |
При положительных температурах: Дезинфицирующие растворы, указанные в п.2. При отрицательных температурах (0-30° С) 5% раствор ДТС ГК с 15% поваренной солью (хлорида натрия) |
30 |
300 мл/м | |
|
|
|
Аэрозольный метод в помещениях и в палатках, приспособленных для размещения транспортных средств. Распыление растворов проводят с помощью пневматической или турбулирующей аэрозольных насадок, либо аэрозольного генератора АГП |
15% раствор ДТС ГК или НГК, содержащий 5% активного хлора |
60 |
100 мл/м | |
|
|
|
|
6% раствор перекиси водорода |
30 |
400 мл/м | |
|
|
|
|
20% раствор формальдегида |
30 |
100 мл/м | |
|
|
|
|
10% раствор формальдегида |
30 |
200 мл/м | |
|
32. |
Мешочки для транспортирования диких грызунов |
Кипячение |
2% раствор соды |
30 |
| |
|
|
|
|
Вода |
30 |
| |
|
33. |
Мазки-отпечатки, мазки из культур |
Погружение |
96° этиловый спирт, смесь Никифорова с последующим погружением в дезраствор, указанный в п.10 |
20 мин |
| |
|
34. |
Изделия из синтетических материалов |
Камерное обеззараживание |
Паровоздушная смесь 80-90 °С |
30 мин |
60 кг/м | |
|
|
|
Погружение |
1% раствор хлорамина Б или ХБ |
5 ч |
| |
|
|
|
|
0,2% раствор формальдегида при температуре 70 °С |
60 мин |
| |
|
35. |
Фильтрующая коробка противогаза |
Продувание паров формальдегида |
Формалин 40% (подогрев). Воздух, содержащий пары формальдегида, пропускают через коробку, используя вакуумную установку. Остаточные пары формальдегида нейтрализуют парами аммиака: принудительное продувание воздуха через коробку (до исчезновения запаха аммиака). |
5 мин |
| |
|
| ||||||
|
1. |
Ограниченные участки почвы (дороги) |
Орошение |
4% активированный раствор хлорной извести или белильной термостойкой извести, содержащий 1% АХ |
120 |
10 л/м | |
|
|
|
|
2% активированный раствор ДТС ГК |
120 |
10 л/м | |
|
|
|
|
2% активированный раствор НГК |
120 |
10 л/м | |
|
|
|
|
3% активированный раствор ГКТ |
120 |
10 л/м | |
|
|
|
|
4% активированный раствор ДСГК |
120 |
10 л/м | |
|
|
|
|
20% раствор осветленный или неосветлённый хлорной извести, белильной термостойкой извести |
120 |
10 л/м | |
|
|
|
|
15% раствор ДТС ГК или НГК |
120 |
10 л/м | |
|
|
|
|
10% раствор едкого натра |
120 |
10 л/м | |
|
2. |
Помещение (пол, стены, двери, оборудование и другая мебель) |
Протирание двукратно с интервалом 30 мин и с последующей влажной уборкой |
2% осветленный активированный раствор ДТС ГК или НГК |
120 |
500 мл/м | |
|
|
|
|
4% активированный раствор хлорамина Б или ХБ |
120 |
500 мл/м | |
|
|
|
|
4% осветленный активированный раствор хлорной извести или белильной термостойкой извести |
120 |
500 мл/м | |
|
|
|
|
4% активированный раствор ДСГК |
60 |
500 мл/м | |
|
|
|
|
20% осветленный раствор хлорной извести или белильной термостойкой извести |
120 |
500 мл/м | |
|
|
|
|
15% раствор ДТС ГК или НГК |
120 |
500 мл/м | |
|
|
|
Двукратное орошение с интервалом 30 мин |
4% осветленный активированный раствор хлорной извести или белильной термостойкой извести |
120 |
500 мл/м | |
|
|
|
|
15% раствор ДТС ГК или НГК |
120 |
500 мл/м | |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
120 |
500 мл/м | |
|
|
|
|
4% активированный раствор ДСГК |
120 |
500 мл/м | |
|
В случае аварии зараженные поверхности залить одним из выше указанных растворов на 2 часа. | ||||||
|
|
|
Аэрозольный метод дезинфекции с помощью пневматической (ПВАН) или турбулирующей (ТАН) аэрозольных насадок |
20% водный раствор формальдегида с последующей нейтрализацией 25% раствором аммиака |
24 часа |
200 мл/м | |
|
|
|
|
10% раствор перекиси водорода |
60 |
400 мл/м | |
|
3. |
Защитная одежда персонала (халаты, косынки, ватно-марлевые маски, шапочки и белье больного) |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
|
| |
|
|
|
Кипячение |
2% раствор соды |
60 |
| |
|
|
|
Замачивание с последующей стиркой и полосканием |
1% активированный раствор хлорамина Б или ХБ |
120 |
5 л/кг сухой защитной одежды | |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства при температуре 50 °С |
60 |
5 л/кг сухой защитной одежды | |
|
|
|
|
0,2% раствор формальдегида с 0,2% мыла или ОП-10 при температуре 60 °С |
60 |
5 л/кг сухой защитной одежды | |
|
4. |
Перчатки |
Кипячение |
2% раствор соды |
60 |
| |
|
|
|
Погружение в раствор дезинфектанта |
1% активированный раствор хлорамина Б или ХБ |
120 |
| |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
60 |
| |
|
|
|
|
0,2% раствор формальдегида с 0,2% мыла или при температуре 60 °С |
60 |
| |
|
5. |
Очки, фонендоскоп и пр. |
Двукратное протирание с интервалом 30 мин и с последующим промыванием водой |
6% раствор перекиси водорода с 0,5% моющего средства |
60 |
| |
|
6. |
Тапочки (кожаные или из кожзаменителя), резиновые и кирзовые сапоги |
Двукратное протирание или обмывание салфеткой с интервалом 15 мин |
1% активированный раствор хлорамина Б или ХБ |
60 |
| |
|
7. |
Ватные куртки и брюки, постельные принадлежности |
Камерное обеззараживание |
Паровоздушный метод, температура 97-98 °С |
45 |
60 кг/м | |
|
8. |
Шапки, кожаная обувь, полушубки, тапочки (из ткани) |
Камерное обеззараживание |
Паровоздушный метод, температура 57-59 °С |
165 |
250 мл/м | |
|
9. |
Посуда лабораторная (чашки Петри, пробирки, пипетки, колбы и др.) |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
90 |
| |
|
|
|
Кипячение |
2% раствор соды |
60 |
| |
|
|
|
Погружение |
4% активированный раствор хлорамина Б или ХБ |
60 |
| |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
60 |
| |
|
|
|
|
Раствор Дезоксона-1, содержащий не менее 1% надуксусной кислоты |
60 |
| |
|
10. |
Посуда больного |
Кипячение |
2% раствор соды |
60 |
| |
|
|
|
Погружение |
4% активированный раствор хлорамина Б или ХБ |
60 |
2 л на комплект посуды | |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
60 |
2 л на комплект посуды | |
|
|
|
|
4% активированный раствор ДСГК |
60 |
2 л на комплект посуды | |
|
11. |
Игрушки |
Кипячение |
2% раствор соды |
60 |
| |
|
|
|
Протирание двукратное с интервалом 30 мин |
6% раствор перекиси водорода с 0,5% моющего средства |
60 |
| |
|
|
|
|
1% активированный раствор хлорамина Б или ХБ |
60 |
| |
|
12. |
Посевы |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
90 |
| |
|
13. |
Резиновые пробки, груши для пипетирования зараженного материала |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
90 |
| |
|
|
|
Кипячение |
2% раствор соды |
60 |
| |
|
14. |
Петля микробиологическая |
Прокаливание в пламени горелки |
|
|
| |
|
15. |
Инструменты после вскрытия животных |
Паровой стерилизатор (автоклавированне) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
90 |
| |
|
|
|
Кипячение |
2% раствор соды |
60 |
| |
|
16. |
Руки в резиновых перчатках |
Погружение и мытье |
Дезинфицирующие растворы, указанные в п.2 |
2 |
| |
|
17. |
Незащищенные участки кожи, руки* |
Моют или протирают тампоном, смоченным раствором, затем моют теплой водой с индивидуальным мылом, вытирают индивидуальным полотенцем |
1% активированный раствор хлорамина Б или ХБ |
2 |
| |
|
_________________ | ||||||
|
18. |
Банки и бачки для животных (банки из-под животных с подстилочным материалом и выделениями животных) |
Залить до краев и протереть снаружи двукратно с интервалом 3 часа |
4% активированный раствор хлорамина Б или ХБ |
48 часов |
| |
|
|
|
|
2% активированный раствор ДТС ГК или НГК |
48 часов |
| |
|
|
|
|
4% активированный раствор ДСГК |
48 часов |
| |
|
|
|
|
20% раствор хлорной извести или белильной термостойкой извести |
48 часов |
| |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
48 часов |
| |
|
|
|
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
90 |
| |
|
19. |
Металлические ящики, садки, сетчатые крышки и пр. |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
90 |
| |
|
|
|
Обработка горячим воздухом |
180 °С |
60 |
| |
|
20. |
Трупы лабораторных животных |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
90 |
| |
|
|
|
Сжигание |
|
|
| |
|
21. |
Помещение вивария |
Двукратное орошение с интервалом 30 мин |
Одно из дезинфицирующих средств, указанных в п.2 |
|
500 мл/м | |
|
|
|
|
10% раствор едкого натра (70 °С) |
|
| |
|
22. |
Воздушные бактериальные фильтры |
Трехкратное орошение с интервалом 30 мин, после чего фильтр упаковывают в полиэтиленовый мешок, завязывают и сжигают или автоклавируют |
6% раствор перекиси водорода с 0,5% моющего средства |
120 |
500 мл/м | |
|
|
|
|
Водяной насыщенный пар под давлением 2,0 кГс/см |
90 |
| |
|
23. |
Жидкие отходы, смывные воды |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
90 |
| |
|
|
|
Засыпать и размешать |
Сухая хлорная известь или белильная термостойкая известь |
120 |
200 г/л | |
|
|
|
|
Сухие ДТС ГК, ДСГК или НГК |
120 |
100 г/л | |
|
24. |
Выделения больного (моча) |
Засыпать и размешать |
Сухая хлорная известь или белильная термостойкая известь |
120 |
200 г/л | |
|
|
|
|
Сухие ДТС ГК, ДСГК или НГК |
120 |
100 г/л | |
|
25. |
Испражнения, остатки пищи |
Засыпать и размешать |
Сухая хлорная известь или белильная термостойкая известь |
120 |
500 г/кг | |
|
|
|
|
Сухие ДТС ГК, ДСГК или НГК |
120 |
400 г/кг | |
|
26. |
Посуда из-под выделений |
Погружение |
4% активированный раствор хлорамина Б или ХБ |
120 |
| |
|
|
|
|
4% активированный раствор ДСГК |
120 |
| |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
120 |
| |
|
|
|
|
20% осветленный раствор хлорной извести |
120 |
| |
|
|
|
|
15% раствор ДТС ГК или НГК |
120 |
| |
|
27. |
Санитарно-техническое оборудование |
Двукратное протирание с интервалом 30 мин |
Одно из дезинфицирующих средств, указанных в п.26 |
|
300 мл/м | |
|
28. |
Уборочный материал, ветошь |
Кипячение |
2% раствор соды |
60 |
| |
|
|
|
Замачивание |
4% активированный раствор хлорамина Б или ХБ |
120 |
| |
|
|
|
|
2% актипированный раствор ДТС ГК или НГК |
120 |
| |
|
|
|
|
4% активированный раствор ДСГК |
120 |
| |
|
|
|
|
20% раствор хлорной извести или белильной термостойкой извести |
240 |
| |
|
|
|
|
15% раствор ДТС ГК или НГК |
240 |
| |
|
29. |
Мусор |
Сжигание |
|
|
| |
|
30. |
Надворные уборные |
Двукратное орошение с интервалом 30 мин |
Один из дезинфектантов, указанных в п.2 |
|
| |
|
|
|
Засыпать |
Один из сухих дезинфектантов, указанных в п.25 |
|
| |
|
31. |
Транспорт |
Двукратное орошение с интервалом 15 мин |
4% активированный раствор хлорамина Б или ХБ |
120 |
500 мл/м | |
|
|
|
|
2% активированный раствор ДТС ПС, или НГК |
120 |
500 мл/м | |
|
|
|
|
4% активированный раствор ДСГК |
60 |
500 мл/м | |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
60 |
500 мл/м | |
|
|
|
|
4% осветленный активированный раствор хлорной извести или белильной термостойкой извести |
120 |
| |
|
32. |
Мазки-отпечатки, мазки из культур |
Погружение |
96° этиловый спирт с 3% перекиси водорода с последующей обработкой дезраствором (п.9) |
30 мин |
| |
|
NN п/п |
Объект, подлежащий обеззараживанию |
Способ обеззараживания |
Обеззараживающее средство |
Время контакта, мин |
Норма расхода | |
|
1 |
2 |
3 |
4 |
5 |
6 | |
|
| ||||||
|
1. |
Ограниченные участки почвы (дороги) |
Орошение |
10% осветленный или неосветленный активированный раствор хлорной извести, белильной термостойкой извести |
120 мин |
2 л/м | |
|
|
|
|
5% раствор ДТС ГК, или НГК, ДСГК, ГКТ |
120 мин |
| |
|
|
|
|
8% раствор лизола А |
120 мин |
| |
|
|
|
|
10% раствор едкого натра |
120 мин |
| |
|
2. |
Поверхности помещения (стены, двери, подоконники, полы), рабочего стола, стеллажи, индивидуальные шкафы и др. мебель, виварий* |
Двукратное орошение с интервалом 30 мин или двукратное протирание с интервалом 15 мин |
3% раствор хлорамина |
120 мин |
500 мл/м | |
|
|
|
|
3% осветленный раствор хлорной извести или белильной термостойкой извести |
120 мин |
| |
|
|
|
|
1,5% раствор ДТС ГК или НГК, ДСГК, ГКТ |
120 мин |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
120 мин |
| |
|
|
|
|
0,5% раствор ДП-2 |
120 мин |
| |
|
|
|
|
6% раствор перекиси водорода |
120 мин |
| |
|
|
|
|
4% раствор ПФК-1 |
120 мин |
| |
|
|
|
|
0,1% раствор по дезоксона-1 или дезоксона-4 |
120 мин |
| |
|
|
|
|
8% раствор лизола А |
120 мин |
| |
|
______________ | ||||||
|
|
|
Двукратное протирание с интервалом 15 мин |
Анолит, получаемый на установке ЭХА-30 и содержащий 0,05% АХ |
120 мин |
| |
|
|
|
|
Анолит, получаемый на установке СТЭЛ-МТ-1 и содержащий 0,06% АХ |
120 мин |
| |
|
|
Для чрезвычайных ситуаций при условии герметизации помещений |
Испарение раствора, нейтрализация с последующим проветриванием помещений |
40% водный раствор формальдегида с последующей нейтрализацией его аммиаком (25% раствор при норме расхода 100 мл/м |
24 часа |
Формалина 17,5-12,5 мл/м | |
|
3. |
Защитная одежда персонала, белье, халаты, косынки, маски, белье больного (нательное, постельное, полотенца, носовые платки и др.) без видимых загрязнений |
Кипячение |
2% раствор соды или любого моющего средства |
30 |
(5 л/кг) | |
|
|
|
Обеззараживание в паровом стерилизаторе |
Водяной насыщенный пар под избыточным давлением 1,1 кГс/см |
45 мин |
| |
|
|
|
Замачивание в растворе с последующим полосканием в воде и стиркой |
3% раствор хлорамина |
30 мин |
| |
|
|
|
|
0,5% активированный раствор хлорамина |
30 мин |
| |
|
|
|
|
0,1% раствор сульфохлорантина или сульфохлорантина М |
60 мин |
| |
|
|
|
|
0,1% раствор ДП-2 |
120 мин |
| |
|
|
|
|
Анолит, получаемый на установке ЭХА-30 и содержащий 0,04% АХ |
30 мин |
| |
|
|
|
|
Анолит, получаемый на установке СТЭЛ-МТ-1 и содержащей 0,06% АХ |
60 мин |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства при температуре раствора 50 °С |
30 мин |
| |
|
|
|
|
0,1% раствор дезоксона-1 или дезоксона-4 |
30 мин |
| |
|
|
|
|
8% раствор лизола |
90 мин |
| |
|
4. |
Защитная одежда персонала, белье, халаты, косынки, маски, белье больного (нательное, постельное, полотенца, носовые платки и др.), загрязненное кровью, гноем, фекалиями, мокротой и др. |
Кипячение |
2% содовый раствор или любого моющего средства |
30 |
С момента закипания | |
|
|
|
Погружение в раствор с последующим полосканием в воде и стиркой |
3% раствор хлорамина |
120 |
| |
|
|
|
|
0,5% активированный раствор хлорамина |
120 |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
90 мин |
| |
|
|
|
|
0,5% раствор ДП-2 |
120 мин |
| |
|
|
|
|
Анолит, получаемый на установке ЭХА-30 и содержащий 0,05% АХ |
90 мин |
| |
|
|
|
|
Анолит, получаемый на установке СТЭЛ-МТ-1 и содержащий 0,09% АХ |
60 мин |
| |
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства при температуре раствора 50 °С |
180 мин |
| |
|
|
|
|
0,1% раствор по дезоксона-1 или дезоксона-4 |
120 мин |
| |
|
|
|
|
8% раствор лизола |
90 мин |
| |
|
|
|
Обеззараживание в паровом стерилизаторе (автоклаве) |
Водяной насыщенный пар под избыточным давлением 1,1 кГс/см |
45 мин |
| |
|
|
|
Обеззараживание в паровом стерилизаторе (автоклаве) |
Водяной насыщенный пар под избыточным давлением 1,1 кГс/см |
45 мин |
| |
|
5. |
Перчатки |
Обеззараживание в паровом |
Водяной насыщенный пар под избыточным давлением 1,1 кГс/см |
45 мин |
| |
|
|
|
Кипячение |
Температура кипения воды |
30 |
| |
|
|
|
Погружение в раствор |
3% раствор хлорамина |
60 |
| |
|
|
|
|
6% раствор перекиси водорода |
60 |
| |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
60 |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
90 |
| |
|
|
|
|
0,5% раствор ДП-2 |
60 |
| |
|
|
|
|
0,5% раствор дезоксона-1 или дезоксона-4 |
60 |
| |
|
|
|
|
8% раствор лизола А |
60 |
| |
|
6. |
Защитные очки, фонендоскоп |
Двукратное протирание с интервалом 15 мин с последующим обмыванием водой |
6% раствор перекиси водорода |
15 |
| |
|
|
|
Погружение |
70° этиловый спирт |
30 |
| |
|
7. |
Резиновые, кирзовые сапоги, кожаные тапочки |
Двукратное протирание с интервалом 15 мин |
Дезинфицирующие средства и режимы применения, указанные в п.2 |
|
| |
|
9*. |
Полушубки, шапки, кожаная и меховая обувь, тапочки |
Камерное обеззараживание |
Пароформалиновая смесь при температуре 57-59 °С |
45 мин |
Формалина 75 мл/м | |
|
_______________ * Нумерация соответствует оригиналу. Примечание | ||||||
|
10. |
Посуда лабораторная (чашки Петри, пробирки, пипетки, мазки-отпечатки и др.) |
Кипячение |
2% раствор соды |
30 |
| |
|
|
|
Обеззараживание в паровом стерилизаторе |
Водяной насыщенный пар под избыточным давлением 1,5 кГс/см |
60 мин |
| |
|
|
|
Погружение в раствор |
3% раствор хлорамина |
60 мин |
| |
|
|
|
|
3% осветленный раствор хлорной извести или извести белильной термостойкой |
60 мин |
| |
|
|
|
|
0,5% раствор сульфохлорантина или сульфохлорантина М |
60 мин |
| |
|
|
|
|
0,5% раствор ДП-2 |
120 мин |
| |
|
|
|
|
Анолит, получаемый на установке ЭХА-30 с концентрацией 0,05% АХ |
30 мин |
| |
|
|
|
|
Анолит, получаемый на установке СТЭЛ-МТ-1 с концентрацией 0,05% АХ |
30 мин |
| |
|
|
|
|
Анолит, получаемый на установке СТЭЛ с концентрацией 0,05% АХ |
30 мин |
| |
|
|
|
|
6% раствор перекиси водорода |
60 мин |
| |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
60 мин |
| |
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
60 мин |
| |
|
|
|
|
6% раствор ПФК-1 |
60 мин |
| |
|
|
|
|
0,5% раствор дезоксона-1 или дезоксона-4 |
60 мин |
| |
|
|
|
|
5% раствор лизола А |
60 мин |
| |
|
11. |
Посуда больного |
Кипячение вместе с остатками пищи |
2% раствор соды |
30 |
| |
|
|
|
Погружение в раствор дезинфицирующего средства, последующее промывание в горячей мыльной воде, а затем в питьевой воде |
3% раствор хлорамина |
60 мин |
| |
|
|
|
|
0,5% активированный раствор хлорамина |
60 мин |
| |
|
|
|
|
3% осветленный раствор хлорной извести или извести белильной термостойкой |
60 мин |
| |
|
|
|
|
1,5% раствор НГК |
60 мин |
| |
|
|
|
|
1% раствор ГКТ |
120 мин |
| |
|
|
|
|
3% раствор ДСГК |
30 мин |
| |
|
|
|
|
0,2% раствор сульфохлорантина или сульфохлорантина М |
90 мин |
| |
|
|
|
|
0,5% раствор ДП-2 |
120 мин |
| |
|
|
|
|
Анолит, получаемый на установке ЭХА-30 с концентрацией 0,05% АХ |
120 мин |
| |
|
|
|
|
0,1% раствор дезоксона-1 или дезоксона-4 |
120 мин |
| |
|
|
|
|
4% раствор ПФК-1 |
60 мин |
| |
|
12. |
Вируссодержащая жидкость, взвесь зараженной культуры клеток |
Обеззараживание в паровом стерилизаторе |
Водяной насыщенный пар под избыточным давлением 2,0 кГс/см |
45 мин |
| |
|
|
При отсутствии возможности обеззараживания в паровом стерилизаторе: | |||||
|
|
|
Кипячение |
Температура кипения воды |
30 |
| |
|
|
|
Залить раствором |
Дезинфицирующие средства и концентрации растворов, указанные в п.4 |
24 часа |
| |
|
13. |
Резиновые пробки, шланги, груши для пипетирования зараженного материала, гребенки для сушки культур |
Обеззараживание в паровом стерилизаторе |
Водяной насыщенный пар под избыточным давлением 2,0 кГс/см |
20 мин |
| |
|
|
|
Кипячение |
Температура кипения воды |
30 мин |
| |
|
14. |
Инструментарий из металла после вскрытия животных |
Обеззараживание в паровом стерилизаторе |
Водяной насыщенный пар под избыточным давлением 2,0 кГс/см |
20 мин |
| |
|
|
|
Кипячение |
Вода дистиллированная с 2% натрия двууглекислого (сода пищевая) |
15 мин |
| |
|
|
|
Кипячение |
Температура кипения воды |
30 |
| |
|
|
|
Погружение в раствор |
3% раствор хлорамина |
60 мин |
| |
|
|
|
Кипячение |
Температура кипения воды |
30 |
| |
|
|
|
Погружение в раствор |
3% раствор хлорамина |
60 |
| |
|
15. |
Руки в резиновых перчатках |
Мытье в растворе дезинфицирующего средства |
Дезинфицирующие средства и концентрации растворов, указанные в п.5 |
2 мин |
| |
|
|
|
|
1% раствор хлорамина |
2 мин |
| |
|
|
|
|
70° этиловый спирт |
2 мин |
| |
|
16. |
Руки, незащищенные участки кожи при попадании инфекционного материала в случае аварии |
Тщательно обмыть раствором дезинфицирующего средства или протереть тампоном, салфеткой, смоченной в растворе, затем вымыть теплой водой с индивидуальным туалетным мылом, вытереть индивидуальным полотенцем |
1% раствор хлорамина |
10 мин |
| |
|
|
|
|
70° этиловый спирт |
2 раза по 3 мин |
| |
|
17. |
Банки и бачки для животных |
Залить раствором до краев, протереть снаружи ветошью, смоченной в растворе |
3% раствор хлорной извести |
24 часа |
| |
|
|
|
|
3% раствор извести белильной термостойкой |
24 часа |
| |
|
|
|
|
1,5% раствор ДТСГК, ДСГК |
24 часа |
| |
|
|
|
|
15% раствор НГК, ГКТ |
24 часа |
| |
|
|
|
|
8% раствор лизола А |
24 часа |
| |
|
|
|
|
3% раствор хлорамина |
24 часа |
| |
|
18. |
Металлические ящики, садки, орудия для лова грызунов |
Обеззараживание в паровом стерилизаторе |
Водяной насыщенным пар под избыточным давлением 2,0 кГс/м |
20 мин |
| |
|
|
|
Обеззараживание сухим жаром |
Температура 180 °С |
60 мин |
| |
|
|
|
Погружение в раствор |
3% раствор хлорамина |
120 мин |
| |
|
|
|
|
5% раствор лизола А |
120 мин |
| |
|
19. |
Трупы лабораторных животных |
Обеззараживание в паровом стерилизаторе |
Водяной насыщенный пар под избыточным давлением 2,0 кГс/см |
60 мин |
| |
|
|
|
Сжигание |
|
|
| |
|
20. |
Воздушные |
Орошают |
Для орошения применяют средства и режимы, указанные в п.2 "Поверхности помещения и др." |
|
| |
|
|
|
Извлекают, помещают в полиэтиленовый пакет, завязывают, затем сжигают |
|
|
| |
|
|
|
Погружение |
Применяют средства, указанные в п.2 |
48 час |
| |
|
|
|
Обеззараживание в паровом стерилизаторе |
Водяной насыщенный пар под давлением 2,0 кГс/см |
60 мин |
| |
|
21. |
Жидкие отходы, смывные воды |
Обеззараживание в паровом стерилизаторе |
Водяной насыщенный пар под избыточным давлением 1,5 кГс/см |
60 мин |
| |
|
|
|
Кипячение |
|
30 мин |
| |
|
|
|
Засыпать препаратом и размешать |
Хлорная известь |
60 мин |
200 г/л | |
|
|
|
|
Известь белильная термостойкая |
60 мин |
200 г/л | |
|
|
|
|
ДТСГК, ДСГК; НГК, ГКТ |
120 мин |
100 г/л | |
|
22. |
Выделения больного: испражнения, мокрота, рвотные массы, остатки пищи |
Засыпать препаратом и размешать |
Известь белильная термостойкая |
120 мин |
200 г/кг | |
|
|
|
|
Сухая хлорная известь |
120 мин |
400 г/кг | |
|
|
|
|
ДТСГК, ГКТ, НГК, ДСГК |
120 мин |
200 г/кг | |
|
23. |
Посуда из-под выделений (горшки, судна, ведра, баки и др.), квачи |
Погружение в один из дезинфицирующих растворов с последующим промыванием водой |
3% раствор хлорамина |
60 мин |
| |
|
|
|
|
0,5% активированный раствор хлорамина |
60 |
| |
|
|
|
|
3% осветленный раствор хлорной извести или белильной термостойкой извести |
60 мин |
| |
|
|
|
|
1,5% осветленный или неосветленный раствор ДТСГК или НГК, ДСГК, ГКТ |
60 мин |
| |
|
24. |
Моча, ополоски изо рта и зева больного |
Засыпать и размешать |
Сухая хлорная известь, белильная термостойкая известь, ДТСГК, ГКТ, НГК, ДСГК |
60 мин |
70 г/л | |
|
25. |
Санитарно-техническое оборудование (ванны, унитазы, раковины и др.) |
Двукратно протирают ветошью, смоченной в одном из дезинфицирующих растворов |
Дезинфицирующие средства и концентрации растворов, указанные в п.2 |
120 мин |
| |
|
26. |
Уборочный материал (ветошь, мочалки и др.) |
Кипячение |
2% мыльно-содовый раствор или раствор любого моющего средства |
30 мин |
| |
|
|
|
Погружение в один из дезинфицирующих растворов с последующим прополаскиванием в воде |
Дезинфицирующие средства и концентрации растворов, указанные в п.4 |
|
| |
|
27. |
Надворные санитарные установки |
Орошают внутренние поверхности одним из дезинфицирующих растворов |
10% раствор хлорной извести, белильной термостойкой извести |
|
| |
|
|
|
|
5% раствор ДТСГК, НГК, ГКТ или ДСГК |
|
| |
|
28. |
Мусор |
Заливают раствором в соотношении 2 части раствора на 1 часть мусора |
10% осветленный раствор хлорной извести, белильной термостойкой извести |
120 мин |
| |
|
|
|
|
5% раствор НГК |
120 мин |
| |
|
|
|
|
7% раствор ГКТ, ДСГК |
60 мин |
| |
|
|
|
|
20% хлорно-известковое молоко |
60 мин |
| |
|
29. |
Транспорт |
Орошают или двукратно протирают ветошью, смоченной в растворе, с интервалом 15 мин, после чего протирают ветошью, смоченной в воде |
3% раствор хлорамина |
60 мин |
300 мл/м | |
|
|
|
|
0,2% раствор сульфохлорантина |
90 мин |
300 мл/м | |
|
|
|
|
0,5% раствор ДП-2 |
60 мин |
300 мл/м | |
|
|
|
|
8% раствор лизола А |
60 мин |
300 мл/м | |
|
30. |
Подстилочный материал, выделения животных, остатки корма |
Обеззараживание в паровом стерилизаторе |
Водяной насыщенный пар под избыточным давлением 2,0 кГс/см |
60 мин |
| |
|
31. |
Мешочки для транспортирования диких грызунов |
Кипячение |
2% раствор соды |
30 |
| |
|
|
|
|
Вода |
30 |
| |
|
NN п/п |
Объект, подлежащий обеззараживанию |
Способ обеззараживания |
Обеззараживающее средство |
Время контакта, мин |
Норма расхода |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
| |||||
|
1. |
Ограниченные участки почвы (дороги) |
Орошение |
|
120 |
2 л/м |
|
|
|
|
15% раствор ДТСГК, НГК, содержащие не менее 5% активного хлора |
|
|
|
|
|
|
8% раствор лизола А |
120 |
2 л/м |
|
|
|
|
10% раствор едкого натра |
120 |
2 л/м |
|
2. |
Помещение, стены, полы, двери, оборудование и другая мебель |
Двукратное орошение с интервалом 30 мин или двукратное протирание с интервалом 15 мин |
3% раствор хлорамина Б или ХБ |
120 |
500 мл/м |
|
|
|
|
3% осветленный раствор хлорной извести или белильной термостойкой извести |
120 |
500 мл/м |
|
|
|
|
1,5% раствор ДТС ГК или НГК |
120 |
500 мл/м |
|
|
|
|
5% раствор едкого натра |
120 |
500 мл/м |
|
|
|
|
6% раствор перекиси водорода |
120 |
500 мл/м |
|
|
|
|
8% раствор лизола А |
120 |
500 мл/м |
|
| |||||
|
3. |
Защитная одежда: халаты, косынки, маски ватно-марлевые, белье больного (нательное, постельное), полотенца, носовые платки и др. |
Кипячение |
2% раствор соды |
30 |
5 л/кг |
|
|
|
Замачивание |
3% раствор хлорамина Б или ХБ |
120 |
|
|
|
|
|
8% раствор лизола А |
120 |
|
|
|
|
|
3% раствор перекиси водорода с 0,5% моющего средства при температуре 60 °С |
120 |
|
|
|
|
|
0,5% активированный раствор хлорамина |
120 |
|
|
|
|
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 1,1 кГс/см |
60 |
|
|
4. |
Перчатки |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 1,1 кГс/см |
60 |
|
|
|
|
Кипячение |
2% раствор соды |
30 |
|
|
|
|
Погружение |
3% раствор хлорамина Б или ХБ |
60 |
|
|
|
|
|
6% раствор перекиси водорода с 0,5% моющего средства |
60 |
|
|
|
|
|
5% раствор едкого натра |
60 |
|
|
|
|
|
8% раствор лизола А |
30 |
|
|
5. |
Резиновые, кирзовые сапоги |
Двукратное протирание с интервалом 15 мин |
3% раствор хлорамина Б или ХБ |
30 |
|
|
|
|
|
3% раствор едкого натра |
30 |
|
|
|
|
|
8% раствор лизола А |
30 |
|
|
|
|
|
10% раствор едкого натра (для коксиелл Бернета) |
30 |
|
|
6. |
Полушубки, шапки, кожаная и меховая обувь, тапочки |
Камерное обеззараживание |
Паровоздушная смесь при температуре 57-59 °С |
45 |
|
|
7. |
Защитные очки, фонендоскопы и др. |
Двукратное протирание с интервалом 15 мин и последующим промыванием водой |
6% раствор перекиси водорода |
30 |
|
|
|
|
|
70° спирт |
30 |
|
|
8. |
Ватные куртки и брюки |
Камерное обеззараживание |
Пароформалиновая смесь при температуре 80-90 °С |
45 |
|
|
9. |
Посуда лабораторная (чашки Петри, колбы, пробирки, пипетки и т.д.) |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
60 |
|
|
|
|
Кипячение |
2% раствор соды |
60 |
|
|
|
|
Погружение (для риккетсий) |
3% раствор хлорамина Б или ХБ |
24 часа |
|
|
|
|
|
3% раствор осветленной хлорной извести или белильной термостойкой извести |
24 часа |
|
|
|
|
|
1,5% раствор ДТС ГК или НГК, или ГКТ |
24 часа |
|
|
|
|
|
3% раствор едкого натра |
24 часа |
|
|
|
|
|
6% раствор перекиси водорода с моющим средством |
24 часа |
|
|
|
|
Погружение (для коксиелл Бернета) |
10% раствор едкого натра |
48 часов |
|
|
|
|
|
8% раствор лизола А |
48 часов |
|
|
10. |
Посуда больного |
Кипячение вместе с остатками пищи |
2% раствор соды |
30 |
|
|
|
|
Погружение |
6% раствор перекиси водорода с 0,5% моющего средства |
120 |
2 л на компл. посуды |
|
|
|
|
3% раствор хлорамина |
120 |
|
|
|
|
|
0,5% активированный раствор хлорамина |
120 |
|
|
|
|
|
3% раствор осветленной хлорной извести или белильной термостойкой извести |
120 |
|
|
|
|
|
1,5% раствор ДТС ГК или НГК, или ГКТ |
120 |
|
|
11. |
Посевы |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
90 |
|
|
|
|
Кипячение |
2% раствор соды |
60 |
|
|
|
|
Погружение (для риккетсий) |
3% раствор хлорамина Б или ХБ |
24 часа |
|
|
|
|
Погружение (для коксиелл Бернета) |
10% раствор едкого натра |
24 часа |
|
|
12. |
Резиновые пробки, шланги, груши для пипетирования зараженного материала, гребенки для сушки культур |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
45 |
|
|
|
|
Кипячение |
2% раствор соды |
60 |
|
|
13. |
Инструменты после вскрытия животных |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
60 |
|
|
|
|
Кипячение |
2% раствор соды |
60 |
|
|
14. |
Руки в резиновых перчатках |
Протирание или мытье |
70° этиловый спирт |
2 |
|
|
|
|
|
5% раствор лизола А |
2 |
|
|
|
|
|
3% раствор хлорамина Б или ХБ |
2 |
|
|
|
|
|
3% раствор осветленной хлорной извести или белильной термостойкой извести |
2 |
|
|
|
|
|
1,5% раствор ДТС ГК или НГК, или ГКТ |
2 |
|
|
15. |
Руки, открытые участки тела, зараженные при аварии |
Тщательно обмыть или протереть |
1% раствор хлорамина |
не менее 2 раз по 5 мин |
|
|
16. |
Банки для животных, бачки из-под вскрытых животных |
Залить до краев и протереть снаружи |
3% раствор хлорамина Б или ХБ |
24 часа |
|
|
|
|
|
3% раствор осветленной хлорной извести или белильной термостойкой извести |
24 часа |
|
|
|
|
|
1,5% раствор ДТС ГК или НГК, или ГКТ |
24 часа |
|
|
|
|
|
10% раствор едкого натра |
24 часа |
|
|
|
|
|
6% раствор перекиси водорода |
24 часа |
|
|
|
|
|
8% раствор лизола А (для коксиелл Бернета) |
48 часов |
|
|
17. |
Металлические ящики, садки, орудия лова грызунов |
Обработка сухим жаром |
Температура 180 °С |
60 |
|
|
|
|
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 1,5 кГс/см |
45 |
|
|
|
|
Погружение |
Дезинфицирующие растворы, указанные в п.16 |
|
|
|
18. |
Трупы лабораторных животных, подстилочный материал, остатки кормов, выделения животных |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
60 |
|
|
|
|
Сжигание |
|
|
|
|
19. |
Помещение вивария |
Двукратное орошение |
Дезинфицирующие растворы, указанные в п.16 |
2 часа |
500 мл/м |
|
20. |
Жидкие отходы, смывные воды |
Паровой стерилизатор (автоклавирование) |
Водяной насыщенный пар под давлением 2,0 кГс/см |
60 |
|
|
|
|
Кипячение |
Температура кипения |
30 |
|
|
|
|
Засыпать одним из дезсредств и размешать |
Хлорная известь или белильная термостойкая известь |
60 |
200 г/л |
|
|
|
|
ДТС ГК или НГК, или ГКТ |
120 |
200 г/л |
|
21. |
Выделения больного: мокрота, испражнения |
Засыпать одним из дезсредств и размешать |
Сухая хлорная известь или белильная термостойкая известь |
120 |
400 г/кг |
|
|
|
|
ДТС ГК или НГК, или ГКТ |
120 |
500 г/кг |
|
22. |
Моча, ополоски изо рта и зева больного |
Засыпать одним из дезсредств и размешать |
Сухая хлорная известь или белильная термостойкая известь |
60 |
70 г/кг |
|
|
|
|
ДТС ГК или НГК |
60 |
100 г/л |
|
|
|
|
ГКТ |
90 |
100 г/л |
|
23. |
Остатки пищи |
Кипячение |
Температура кипения 100 °С |
30 |
|
|
|
|
Засыпать одним из дезсредств и размешать |
Сухая хлорная известь или белильная термостойкая известь |
120 |
400 г/кг |
|
|
|
|
ДТС ГК или НГК, или ГКТ |
120 |
500 г/кг |
|
24. |
Постельные принадлежности |
Камерное обеззараживание |
Паровоздушная смесь при температуре 80-90 °С |
45 |
60 кг/м |
|
25. |
Концентрированные суспензии риккетсий |
Обеззараживание в паровоздушном стерилизаторе |
Водяной насыщенный пар под избыточным давлением 2,0 кГс/см |
45 |
|
|
|
|
Кипячение |
Температура кипящей воды |
30 |
|
|
26. |
Куриные эмбрионы, инфицированные риккетсиями |
Погружение |
3% раствор едкого натра |
2 суток |
|
|
27. |
Куриные эмбрионы, инфицированные коксиеллами Бернета |
Погружение |
3% раствор едкого натра |
5 суток |
|
|
28. |
Санитарно-техническое оборудование (ванны, унитазы, раковины и др.) |
Двукратно протирают ветошью, смоченной в одном из дезинфицирующих растворов |
Дезинфицирующие средства и концентрации растворов указаны в п.16 |
120 |
|
|
29. |
Уборочный материал (ветошь, мочалки и др.) |
Кипячение |
2% мыльно-содовый раствор или раствор любого моющего средства |
30 |
|
|
|
|
Погружение |
Дезинфицирующие средства и концентрации растворов указаны в п.3 |
120 |
|
|
30. |
Надворные санитарные установки |
Орошают внутренние поверхности одним из дезинфицирующих растворов |
20% раствор хлорной извести или белильной термостойкой извести |
|
|
|
|
|
|
5% раствор ДТС ГК или НГК, или ГКТ |
|
|
|
31. |
Мусор |
Сжигают |
|
|
|
|
|
|
Заливают дезинфицирующим раствором в соотношении 2:1 |
20% раствор хлорной извести или белильной термостойкой извести |
120 |
|
|
|
|
|
5% раствор ДТС ГК или НГК |
120 |
|
|
|
|
|
7% раствор ГКТ |
120 |
|
|
32. |
Транспорт |
Орошают или двукратно протирают ветошью, смоченной в растворе, с интервалом 15 мин, после чего протирают ветошью, смоченной в воде |
3% раствор хлорамина |
60 |
|
|
|
|
|
8% раствор лизола А |
60 |
|
|
|
|
|
5% раствор едкого натра |
60 |
|
|
| |||||
|
1. |
Поверхности помещения, оборудование: стены, подоконники, полы, рабочий стол, стеллажи в помещении для содержания зараженных животных, индивидуальные шкафы, тумбочки и др. мебель |
Протирание |
2% раствор ДТСГК |
60 мин |
2-х кратное протирание с интервалом 30 мин |
|
|
|
Мытье |
3% раствор сульфохлорантина или сульфохлорантина М |
60 мин |
|
|
|
|
|
2,5% раствор бензилфенола |
60 мин |
|
|
|
|
|
5% раствор лизола |
60 мин |
|
|
|
|
|
5% раствор хлорамина |
180 мин |
|
|
2. |
Поверхность термокамер |
Орошение и протирание |
6% раствор перекиси водорода + 0,5% моющего средства |
60 мин |
500 мл/м |
|
3. |
Защитная одежда, белье: |
Обработка в паровом стерилизаторе (автоклаве) |
1,1 кгс/см |
60 |
|
|
|
|
|
1,5 кгс/см |
30 |
|
|
|
|
|
2,0 кгс/см |
20 |
|
|
|
Халаты, косынки |
Кипячение |
2% раствор соды |
30 |
|
|
|
ватно-марлевые маски |
Погружение |
3% сульфохлорантин или сульфохлорантин М |
60 |
|
|
|
|
|
2,5% раствор бензилфенола |
60 |
|
|
|
|
|
5% раствор лизола |
60 |
|
|
|
|
|
5% раствор хлорамина |
120 |
|
|
|
перчатки |
Кипячение |
2% раствор соды |
15 |
|
|
|
защитные очки, тапочки |
Протирание |
одним из растворов, перечисленных выше |
|
2-кратное протирание с интервалом 30 мин |
|
|
ватные куртки |
Камерное обеззараживание |
Паровоздушная смесь 80-90 °С |
15-20 |
8-10 компл. (60 кг/м |
|
|
шапки, кожаная обувь |
Камерное обеззараживание |
Пароформалиновая смесь 57-59 °С |
30 |
5 компл. (30 кг/м |
|
4. |
Посуда лабораторная (чашки Петри, пробирки, Колбы, шланги, груши) |
Обработка в паровом стерилизаторе (автоклаве) |
1,1 кгс/см |
60 |
|
|
|
|
|
1,5 кгс/см |
30 |
|
|
|
|
|
2,0 кгс/см |
20 |
|
|
|
|
Кипячение |
2% раствор соды |
30 |
|
|
|
|
Погружение |
2% раствор ДТС ГК |
120 |
Полное погружение |
|
|
|
|
3% раствор сульфохлорантина или сульфохлорантина М |
120 |
|
|
|
|
|
2,5% раствор бензилфенола |
120 |
|
|
|
|
|
5% раствор лизола |
120 |
|
|
|
|
|
5% раствор хлорамина |
120 |
|
|
5. |
Культуры грибов на плотных питательных средах. Опытные тест-поверхности |
Обработка в паровом стерилизаторе (автоклаве) |
1,1 кгс/см |
60 мин |
|
|
|
|
|
1,5 кгс/см |
30 мин |
|
|
|
|
|
2,0 кгс/см |
20 мин |
|
|
6. |
Руки, зараженные части тела |
Мытье с марлевой салфеткой |
1% раствор йодоната |
1 |
|
|
|
|
|
2% раствор ДТСГК |
|
|
|
7. |
Органы грызунов для гистологического исследования |
Погружение |
10% раствор формалина |
24 часа |
Полное погружение |
|
8. |
Трупы лабораторных животных |
Сжигание |
|
|
|
|
|
|
Обработка в паровом стерилизаторе (автоклаве) |
1,5 кгс/см |
60 мин |
|
|
|
|
Поверхностное обеззараживание путем погружения |
10% раствор лизола |
48 часов |
|
|
9. |
Банки для животных |
Залить до краев и протереть |
2% раствор ДТСГК |
48 часов |
|
|
|
|
|
3% раствор сульфохлорантина или сульфохлорантина М |
48 часов |
|
|
|
|
|
2% раствор бензилфенола |
48 часов |
|
|
|
|
|
5% раствор лизола |
48 часов |
|
|
|
|
|
5% раствор хлорамина |
48 часов |
|
|
10. |
Инструменты после вскрытия животных |
Кипячение |
2% раствор соды |
30 мин |
|
|
11. |
Подстилочный материал, остатки кормов, выделения животных |
Обработка в паровом стерилизаторе (автоклаве) |
1,5 кгс/см |
60 мин |
|
|
12. |
Ветошь, уборочный материал |
Кипячение |
2% раствор соды |
30 мин |
|
|
|
|
Погружение |
2% раствор ДТСГК |
120 мин |
|
|
|
|
|
3% раствор сульфохлорантина или сульфохлорантина М |
120 мин |
|
|
|
|
|
2,5% раствор бензилфенола |
120 мин |
|
|
|
|
|
5% раствор лизола |
120 мин |
|
|
|
|
|
5% раствор хлорамина |
120 мин |
|
|
13. |
Металлические бачки, ящики из-под вскрытых животных |
Обработка в паровом стерилизаторе (автоклаве) |
1,1 кгс/см |
60 мин |
|
|
|
|
|
2,0 кгс/см |
30 мин |
|
|
14. |
Аэрозольный метод дезинфекции помещений с помощью пневматической (ПВАН) или турбулирующей насадок |
|
6% раствор перекиси водорода с 0,5% моющего средства |
Д |
(1500 мл/м |
|
| |||||
Приложение 5.5.
(Справочное)
Химические тесты для контроля температурных параметров режима работы
паровых стерилизаторов (Методические указания по контролю работы паровых
и воздушных стерилизаторов N 15/6-5 от 28.02.91 г.)
|
N рецеп- туры |
Наименование составных частей |
Цвет, форма кристаллов, запах |
Нормативно- техническая документация |
Количество компонентов |
Температурные параметры, подлежащие контролю, °C | |||
|
|
|
|
|
|
110+2 |
120+2 |
126+2 |
132+2 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
1 |
Антипирин (1) |
Бесцветные кристаллы или белый порошок без запаха |
ГФ Х(2), ст.65 |
99,9±0,01 |
+(3) |
- |
- |
- |
|
|
Краситель(4) |
|
ТУ 6-09-3803-82 |
0,1±0,01 |
|
|
|
|
|
2 |
Резорцин |
Белый или со слабым желтоватым оттенком кристаллический порошок со слабым характерным запахом |
ГФ X, ст.577 |
99,9±0,01 |
+ |
- |
- |
- |
|
|
Краситель |
|
|
0,1±0,01 |
|
|
|
|
|
3 |
Сера элементарная |
Желтые кристаллы (5) |
ТУ 6-09-2546-77 |
100,0 |
- |
+ |
- |
- |
|
4 |
Кислота бензойная |
Бесцветные игольчатые кристаллы или белый порошок |
ГФ X, ст.9 |
95,24±0,01 |
- |
+ |
- |
- |
|
|
Краситель |
|
|
4,76±0,01 |
|
|
|
|
|
5 |
Бензамид |
Бесцветные кристаллы |
ТУ 6-09-14-21-04 -81 |
100,0 |
- |
- |
+ |
- |
|
6 |
Сукцинимид |
Бесцветные кристаллы в виде пластинчатых игл |
ТУ 6-09-08-889-83 |
100,0 |
- |
- |
+ |
- |
|
7 |
Кислота бензойная |
Бесцветные игольчатые кристаллы или белый порошок |
ГОСТ 6413-77 ГОСТ 10521-78 |
99,9±0,01 |
- |
+ |
- |
- |
|
|
Краситель |
|
|
0,1±0,01 |
|
|
|
|
|
8 |
D (+) Манноза |
Бесцветные кристаллы в виде ромбических призм |
ТУ 6-09-07-666-76 |
99,9±0,01 |
- |
- |
- |
+ |
|
|
Краситель |
|
|
0,1±0,01 |
|
|
|
|
|
9 |
Никотинамид |
Белый мелкокристал- лический порошок со слабым запахом |
ГФ X, ст.452 ТУ 6-09-08-852-82 |
99,9±0,01 |
- |
- |
+ |
- |
|
|
Краситель |
|
|
0,1±0,01 |
|
|
|
|
|
10 |
Мочевина |
Бесцветные кристаллы |
95,24±0,01 |
- |
- |
- |
+ | |
|
|
Краситель |
|
|
4,76±0,01 |
|
|
|
|
Примечание:
1 - относится к сильнодействующим лекарственным средствам, применение и хранение которых должно проводиться с предосторожностью: хранение в закрытых шкафах, в сухом помещении;
2 - ГФ Х - Государственная фармакопея СССР, Х издание;
3 - "+" - температурный параметр, для контроля используется химическое соединение;
4 - используют любой из красителей, перечисленных в рецептуре 1;
5 - при использовании серы в качестве химического теста добавление красителя нецелесообразно, так как при плавлении вещества не происходит его смешение с красителем.
Химические тесты для контроля температурных параметров режимов работы
воздушных стерилизаторов (1)
|
N п/п |
Наименование химического соединения |
Цвет, форма кристаллов, запах |
Нормативно- техническая документация |
Количество компонента, грамм |
Температурный параметр, подлежащий контролю, °С | |
|
|
|
|
|
|
160-10 °С |
180-10 °С |
|
1 |
Левомицетин (2) |
Белый или белый со слабым желтовато-зеленоватым оттенком кристаллический порошок без запаха |
ГФ Х (3) ст. 371 |
100,0 |
+(4) |
- |
|
2 |
Кислота винная |
Порошок белого цвета или прозрачные бесцветные кристаллы |
100,0 |
- |
+ | |
|
3 |
Гидрохинон |
Бесцветные или светлосерые серебристые кристаллы |
100,0 |
- |
+ | |
|
4 |
Тиомочевина |
Блестящие бесцветные кристаллы |
100,0 |
- |
+ | |
Примечание:
1 - В состав химических тестов, используемых для контроля работы воздушных стерилизаторов, краситель не добавляют, т.к. указанные химические соединения изменяют свой цвет при достижении температуры плавления;
2 - Относится к сильнодейтвующим лекарственным средствам, применение и хранение которых проводится с предосторожностью, хранение в закрытых шкафах в сухом помещении;
3 - ГФ Х - Государственная фармакопея СССР Х издание;
4 - "+" - температурный режим, для контроля используют химическое соединение.
Химические индикаторы в паровом стерилизаторе размещают в каждой обеззараживаемой емкости и два - в самой камере, в воздушных стерилизаторах - от 5 до 15 в зависимости от емкости камеры.
Вместо химических тестов могут быть использованы термовременные индикаторы (ТВИ), контролирующие температуру и время стерилизации (ТВИ ИС-160 и ИС-180) при воздушной стерилизации, а при паровой стерилизации (ИС-120 и ИС-132) и наличия пара. Индикаторы представляют собой полоски длиной 2-3 см, отрываемые от бумажной ленты с нанесенным на нее индикаторным слоем, цвет которого необратимо меняется только при соблюдении режимов стерилизации, утвержденных ГОСТом 22649-83 и ОСТом 42-21-2-85.
Приложение 5.6.
(Обязательное)
Бактериологический метод контроля
эффективности работы парового стерилизатора
(Извлечение из "Методических указаний по контролю работы паровых
и воздушных стерилизаторов" 1991 г. (N 15/6-5 Минздрав СССР)
1. Бактериологический контроль работы стерилизаторов проводят после монтажа и ремонта аппаратуры, а также в процессе его эксплуатации (плановый - 2 раза в год и при получении неудовлетворительных результатов контроля).
Контроль эффективности работы стерилизаторов осуществляют бактериологическим методом, используя биотесты на основании гибели спор тест-культуры. Биотесты представляют собой флаконы из трубки стеклянной для лекарственных средств ФИ/1-5 нс 1 ТУ 64-0709-10-88 (инсулиновые флаконы) или чашечки из алюминиевой фольги (диск размером 14 мм с луночкой-вдавление от неоточенного края карандаша), содержащие высушенные споры тест-культуры Вас. stearothermophilus ВКМ В-718, помещенные в пакеты из упаковочной бумаги (ОСТ 42-21-2-85). Упаковочные тесты нумеруют и размещают в контрольные точки паровых стерилизаторов (5-10 тестов). По окончании стерилизации биотесты подвергают бактериологическому исследованию.
2. Штамм Вас. stearothermophilus ВКМ В-718 подвижная термофильная палочка, по Граму окрашивается положительно, культивируется при температуре 55±1 °С, исключающей развитие других широко распространенных микроорганизмов. Споры овальные, расположенные центрально. На мясопептонном бульоне (рН 7,3±0,1) через 24 часа образует помутнение среды, на мясо-пептонном агаре (рН 7,3±0,1) - слабо выпуклые колонии диаметром 2-4 мм с ровным краем. Штамм непатогенен для человека и животных. Штамм получен из Всесоюзной коллекции микроорганизмов института биохимии и физиологии микроорганизмов, хранится в музее культур НИИ профилактической токсикологии и дезинфекции (117246 г. Москва, Научный проезд, 18).
Приготовление биотеста
В ампулу с лиофилизированной культурой вносят 0,2 мл стерильной водопроводной воды и оставляют в течение 30 минут при комнатной температуре.
Одну-две капли культуры засевают в 2 пробирки с бульоном (МПБ, Хоттингера, питательный сухой) с 0,5% глюкозы. Суточную культуру засевают на пробирки скошенного агара (Хоттингера, мясопептонный, сухой питательный). Для получения спор культуру, выращенную на твердой питательной среде, смывают 5 мл стерильной водопроводной воды и переносят во флаконы со скошенным картофельнопептонным агаром. Взвесь покачиванием флакона равномерно распределяют по поверхности среды, инкубируют при 55° в течение 10-12 суток в наклонном положении агаром вверх. Для создания достаточной влажности в термостат помещают открытые емкости с водой. На 7, 10 и 12 сутки культуру проверяют на интенсивность спорообразования. Достаточным количеством считают 80-90% спор в поле зрения. Культуру смывают стерильной дистиллированной водой. В целях освобождения от вегетативных клеток суспензию прогревают на водяной бане при температуре 65-70° в течение 30 мин, центрифугируют трехкратно с частотой вращения 33, 33 с - 1 (2000 об/мин) по 15 минут, промывая осадок стерильной дистиллированной водой после каждого центрифугирования. Отмытые споры суспендируют в стерильной дистиллированной воде в соотношении 1:1 по объему. Суспензию спор хранят в холодильнике при температуре 4 °С в стерильных пробирках, закрытых ватно-марлевыми пробками с резиновыми колпачками (срок хранения 2 года).
Чистоту культуры на всех этапах культивирования контролируют высевом на агаровые пластинки.
Для определения титра жизнеспособных спор 0,1 мл исходной суспензии десятикратно разводят до 10 стерильной дистиллированной водой, высевая на 3 агаровые пластинки по 0,1 мл ориентировочно из 10
стерильной дистиллированной водой, высевая на 3 агаровые пластинки по 0,1 мл ориентировочно из 10 -10
-10 ) (предел разведения зависит от титра полученных спор). Посевы инкубируют в течение 48 часов, проводят подсчет выросших колоний. Титр жизнеспособных спор в исходной суспензии определяют как среднее арифметическое число колоний с учетом разведения исходной суспензии и объема пробы для посева.
) (предел разведения зависит от титра полученных спор). Посевы инкубируют в течение 48 часов, проводят подсчет выросших колоний. Титр жизнеспособных спор в исходной суспензии определяют как среднее арифметическое число колоний с учетом разведения исходной суспензии и объема пробы для посева.
Пример расчетов. Предположим, что при посеве на три чашки Петри с агаром суспензия в разведении 1:100000 (10 ), подсчитано 140, 110 и 134 колонии. Аналогичные высевы из разведений 10
), подсчитано 140, 110 и 134 колонии. Аналогичные высевы из разведений 10 привели к образованию 12, 14 и 16 колоний; из 10
привели к образованию 12, 14 и 16 колоний; из 10 - 5, 3 и 7 колоний. Вычисляем общее число колоний, а затем среднее количество колоний для каждого разведения 128, 14 и 5.
- 5, 3 и 7 колоний. Вычисляем общее число колоний, а затем среднее количество колоний для каждого разведения 128, 14 и 5.
Из расчета посевной дозы (0,1 мл на каждую чашку) вычисляем титр жизнеспособных спор в 1 мл исходной суспензии с учетом разведения, далее находим среднее арифметическое число колоний:
128х10х10 =12х8х10
=12х8х10 ;
;
14х10х10 =14,0х10
=14,0х10 ;
;
5х10х10 =50,0х10
=50,0х10 .
.
Таким образом, титр исходной суспензии составит:
(12х8+14,0+50,0)х10 :3=2,5х10
:3=2,5х10 спор в 1 мл.
спор в 1 мл.
Исходная суспензия должна содержать не менее
2,5х10 -2,5х10
-2,5х10 спор в 1 мл. Споры в количестве 5х10
спор в 1 мл. Споры в количестве 5х10 -5х10
-5х10 вносят из исходной суспензии с помощью дозатора пипеточного (ТУ 64-1-3329-81) в 0,02 мл в носители (стерильные инсулиновые флакончики с ватно-марлевой пробкой или чашечки из алюминиевой фольги, разложенные в чашки Петри), подсушивают в термостате при 37° или в эксикаторе над осушителем (силикагель, хлористый кальций) при комнатной температуре в течение 24 часов. Для определения фактической обсемененности исследуют не менее 3-х биотестов от каждой группы. Во флаконы (чашечки) вносят по 1,0 мл стерильной дистиллированной воды (чашечки из алюминиевой фольги, отмывают в широкогорлых пробирках с бусами в 10 мл) и встряхивают в течение 10 минут на аппарате для встряхивания жидкостей с последующим высевом на 3 агаровые пластинки по 0,1 мл суспензии из трех последовательных десятикратных разведений.
вносят из исходной суспензии с помощью дозатора пипеточного (ТУ 64-1-3329-81) в 0,02 мл в носители (стерильные инсулиновые флакончики с ватно-марлевой пробкой или чашечки из алюминиевой фольги, разложенные в чашки Петри), подсушивают в термостате при 37° или в эксикаторе над осушителем (силикагель, хлористый кальций) при комнатной температуре в течение 24 часов. Для определения фактической обсемененности исследуют не менее 3-х биотестов от каждой группы. Во флаконы (чашечки) вносят по 1,0 мл стерильной дистиллированной воды (чашечки из алюминиевой фольги, отмывают в широкогорлых пробирках с бусами в 10 мл) и встряхивают в течение 10 минут на аппарате для встряхивания жидкостей с последующим высевом на 3 агаровые пластинки по 0,1 мл суспензии из трех последовательных десятикратных разведений.
3. Определение устойчивости спор тест-культур к действию водяного насыщенного пара под избыточным давлением проводят при температуре 120±2 °С.
Биотесты в упаковочной бумаге помещают в стерилизационной коробке в камеру парового стерилизатора. После набора давления в водопаровой камере 0,11±0,01 МПа (1,1±0,1 кгс/см ) проводят продувку парового стерилизатора (вытеснение воздуха паром из камеры парового стерилизатора) в течение 10 минут при открытом спускном кране и давлении в стерилизационной камере от 0,01 до 0,02 МПа (от 0,1 до 0,2 кгс/см
) проводят продувку парового стерилизатора (вытеснение воздуха паром из камеры парового стерилизатора) в течение 10 минут при открытом спускном кране и давлении в стерилизационной камере от 0,01 до 0,02 МПа (от 0,1 до 0,2 кгс/см ). После продувки доводят давление пара в стерилизационной камере до 0,11±0,01 МПа (1,1±0,1 кгс/см
). После продувки доводят давление пара в стерилизационной камере до 0,11±0,01 МПа (1,1±0,1 кгс/см ) температура 120±2 °С и через 5 минут (времени выживания спор тест-культуры) с момента установления давления спускают пар. Для уменьшения времени воздействия пара до и после экспозиции подъем давления проводят максимум в течение 8 минут, спуск - в течение 3 минут.
) температура 120±2 °С и через 5 минут (времени выживания спор тест-культуры) с момента установления давления спускают пар. Для уменьшения времени воздействия пара до и после экспозиции подъем давления проводят максимум в течение 8 минут, спуск - в течение 3 минут.
Аналогичное исследование проводят в течение 15 минут времени выдержки (время гибели спор тест-культуры). Контроль температуры осуществляют максимальным термометром. По окончании времени выдержки биотесты вынимают из стерилизатора и проводят бактериологическое исследование.
Партию биотестов считают годными для использования, если показатели устойчивости спор тест-культуры соответствуют вышеописанным требованиям.
4. Для определения эффективности работы стерилизатора в обеззараженные биотесты и контрольный (без стерилизации) стерильно вносят по 5 мл питательной среды, инкубируют при 55 °С в течение 7 суток при ежедневном просмотре посевов, делая высевы на агаровые пластинки, из проросших емкостей. При использовании полусинтетической среды с индикатором феноловым красным рост тест-кулътуры определяют по изменению красного цвета среды (рН 7,7±0,1 на желто-оранжевый (рН 6,7±0,1) за счет разложения глюкозы с образованием кислоты.
В целях исключения ложного отрицательного результата (при наличии роста тест-культуры отсутствует изменение цвета питательной среды) флаконы (пробирки) должны быть плотно закрыты стерильными резиновыми пробками (N 7,5; 12,5).
Отсутствие роста тест-культуры указывает на эффективность работы стерилизатора. Рост других культур микроорганизмов относят за счет вторичного обсеменения.
При наличии роста тест-штаммов проводится повторный контроль на удвоенном количестве биотестов. Если и при повторной проверке тест-культуры не инактивируются, осуществляют тщательный контроль технического состояния аппарата и контрольно-измерительных приборов. При отсутствии роста тест-культур в контрольном биотесте (не подвергшемся стерилизации) устанавливается причина (нежизнеспособность тест-культуры, несоблюдение методики приготовления биотестов, питательных сред, условий культивирования).
5. Для спорообразования используют:
- картофельнопептонный агар (пептон - 5,0, мел - 1,0, агар - 25,0, картофельная вода -1000 мл, рН 7,1±0,1. Сырой картофель (200 г очищенного картофеля на 1 л водопроводной воды) тщательно моют, очищают от кожуры и глазков, нарезают мелкими ломтиками, заливают водопроводной водой и кипятят 30 мин после закипания (молодой картофель употреблять нельзя). Отвар отстаивают и фильтруют в холодном состоянии через ватно-марлевый фильтр. Доводят объем фильтрата до первоначального. Устанавливают рН 7,1±0,1. Добавляют пептон и агар. Нагревают, помешивая до полного расплавления агара, фильтруют через ватно-марлевый фильтр, после чего добавляют мел. Разливают по флаконам, стерилизуют при 120 °С в течение 30 мин. После стерилизации среду во флаконах скашивают; - пшеничный агар (пшеничная крупа "Артек" или "Полтавская" - 500,0, агар - 25,0, дистиллированная вода - 1000 мл), рН 7,3±0,1.
Пшеничную крупу "Артек" ("Полтавская") заливают дистиллированной водой. Через 12 часов настой аккуратно сливают, не выжимая, доводят до первоначального объема, добавляют агар и растапливают на водяной бане или в автоклаве (текучим паром 1 час). Остывший агар выкладывают на противень и срезают осадок. Агар растапливают на водяной бане, постоянно помешивая. Устанавливают рН 7,3±0,1. Разливают во флаконы. Стерилизуют текучим паром по 1 часу в течение 3 суток. После стерилизации среду скашивают.
6. Для контроля используют бульон Хоттингера рН 7,3, агар Хоттингера рН 7,3, питательный бульон сухой рН 7,1 (Дагестанский НИИ питательных сред) , питательный агар сухой рН 7,3 (Дагестанский НИИ питательных сред), среда питательная для контроля стерильности сухая (предприятие Центрального НИИВС им. И.М.Мечникова) рН 7,0, бульон из перевара кровяных сгустков, полусинтетическая среда с индикатором феноловым красным рН 7,7 (аммоний фосфорно-кислый однозамещенный -  -1,0 г; магний серно-кислый
-1,0 г; магний серно-кислый  - 0,2 г, калий хлористый -
- 0,2 г, калий хлористый -  - 0,2 г, глюкоза - 5,0 г, феноловый красный - 0,02 г, бульон Хоттингера с содержанием аминного азота - 140-160 мг% - 200 мл, дистиллированная вода - 800 мл, рН 7,7±0,1. Компоненты смешивают и растворяют при нагревании на водяной бане, доводят рН до 7,7±0,1, разливают во флаконы, стерилизуют при 110 °С в течение 30 минут).
- 0,2 г, глюкоза - 5,0 г, феноловый красный - 0,02 г, бульон Хоттингера с содержанием аминного азота - 140-160 мг% - 200 мл, дистиллированная вода - 800 мл, рН 7,7±0,1. Компоненты смешивают и растворяют при нагревании на водяной бане, доводят рН до 7,7±0,1, разливают во флаконы, стерилизуют при 110 °С в течение 30 минут).
Приложение 5.7.
(Обязательное)
Порядок замены фильтров тонкой очистки вытяжной системы вентиляции и определения их защитной эффективности
1. Замену фильтров тонкой очистки (Д-13, Д-15, Д-23 ФТО и др.) вытяжных систем вентиляции проводят согласно графику. При возрастании динамического сопротивления фильтра в 2 раза или при его повреждении проводится его внеплановая замена.
2. Перед снятием фильтра проводят предварительную дезинфекцию фильтра и магистрального воздуховода парами формалина либо аэрозольным способом.
3. Распыление дезинфектанта осуществляется через штуцер в воздуховоде при работающей вентиляции. По окончании распыления вентиляция выключается и по истечении времени экспозиции фильтр может быть снят.
4. Работу по демонтажу фильтра проводят в костюме IV типа с использованием резиновых перчаток (под рабочими рукавицами) и респиратора.
5. Снятый фильтр помещают в крафт-мешок или другую упаковку и переносят для автоклавирования или сжигания установленным порядком.
6. Перед установкой фильтр должен быть проверен на проскок (по масляному туману, с использованием биологического аэрозоля или другим способом). В процессе эксплуатации фильтр проверяется на проскок не реже 1 раза в квартал.
7. Работы по замене фильтра осуществляются техническим персоналом под наблюдением сотрудника подразделения, отвечающего за соблюдение требований биологической безопасности.
8. Для оценки защитной эффективности фильтров используют в качестве модели для создания аэрозоля культуры В.prodigiosum (ser. marcescens, chromobacterum prodigiosum) или Е. Coli. Для создания аэрозоля используют специальные устройства - распылители. В целях минимального рассеивания бактериального аэрозоля в окружающую среду и направления факела аэрозоля в отверстие воздуховода перед фильтром применяют специальную насадку. Для определения счетной концентрации и фракционно-дисперсного состава биологического аэрозоля используют импактор микробиологический БП-50, разработанный научно-исследовательским институтом биологического приборостроения.
9. Отбор проб аэрозоля осуществляют двумя импакторами одновременно до прохождения фильтра (контроль) и после прохождения его (опыт). По результатам роста тест-штамма на агаровых пластинках до и после прохождения фильтра судят об его защитной эффективности. Используют односуточную культуру тест-штамма в концентрации 5х10 -1х10
-1х10 м.к. в мл. Для проведения опыта приборы монтируют в следующей последовательности (см. схему): насадку (4) устанавливают на отверстии воздуховода перед фильтром (2) с помощью болтов, шланги компрессора (9) надевают на конец форсунки распылителя (5). К входному и выходному отверстиям воздуховода после фильтра (2) присоединяют через шланги два микробиологических импактора БП-50(6), подключают к сети компрессор (7) и оба аспиратора (8)-(пылесос бытовой). Перед началом опыта проверяют работу компрессора и скорость движения воздуха через импактор. Опыт проводят при работающей вентиляции.
м.к. в мл. Для проведения опыта приборы монтируют в следующей последовательности (см. схему): насадку (4) устанавливают на отверстии воздуховода перед фильтром (2) с помощью болтов, шланги компрессора (9) надевают на конец форсунки распылителя (5). К входному и выходному отверстиям воздуховода после фильтра (2) присоединяют через шланги два микробиологических импактора БП-50(6), подключают к сети компрессор (7) и оба аспиратора (8)-(пылесос бытовой). Перед началом опыта проверяют работу компрессора и скорость движения воздуха через импактор. Опыт проводят при работающей вентиляции.
10. В колбу распылителя заливают приготовленную взвесь тест-штамма, после чего вставляют форсунку. Устанавливают распылитель на уровне отверстия воздуховода, включают компрессор и оба импактора. Соблюдаются следующие условия: скорость распыления по жидкости  = 1мл/м
= 1мл/м мин, скорость распыления по воздуху
мин, скорость распыления по воздуху  = 50 л/мин, время распыления - 10 минут, средний диаметр аэрозольных частиц
= 50 л/мин, время распыления - 10 минут, средний диаметр аэрозольных частиц  = 2,4 мкм (
= 2,4 мкм ( 0,389), максимальный диаметр частиц
0,389), максимальный диаметр частиц  = 7 мкм при логарифмически нормальном распределении (среднее квадратичное отклонение
= 7 мкм при логарифмически нормальном распределении (среднее квадратичное отклонение  0,229); скорость отбора проб аэрозоля импактором БП-50
0,229); скорость отбора проб аэрозоля импактором БП-50  = 50 л/мин, время отбора проб аэрозоля - 10 минут.
= 50 л/мин, время отбора проб аэрозоля - 10 минут.
По истечении срока отключают сначала компрессор, а затем импакторы. Чашки Петри вынимают из импакторов и инкубируют при 37 °С в течение 2 суток. После проведения опыта установку дезинфицируют.
1.1. Учет результатов проводят через 24 и 48 часов. В популяции В.prodigiosum наряду с типично окрашенными колониями могут появляться различные по цвету варианты: розовые, слабо-розовые, с розовым центром.
Об эффективности задержания аэрозольных частиц исследуемым фильтром судят по отношению числа аэрозольных частиц, осевших до фильтра и после него. Эффективность фильтра выражают в процентах. При исправных фильтрах не должно быть роста колоний тест-культуры на чашках после фильтра, в то время как до фильтра (для обеспечения достоверности испытаний) их должно быть не менее 200 колоний на чашках импактора БП-50.
СХЕМА КОНТРОЛЯ ФИЛЬТРА
при работающей вентиляционной системе
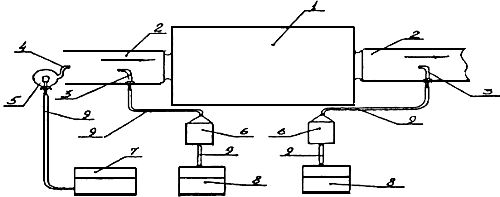
ОБОЗНАЧЕНИЯ:
1. Фильтр Д-13 (Д-15)
2. Воздуховод вентиляционной системы
3. Штуцер для отбора проб
4. Насадка распылителя
5. Распылитель
6. Импактор ДП-80
7. Компрессор
8. Аспиратор отбора пробы
9. Соединительные шланги
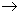 Направление воздушного потока
Направление воздушного потока
Приложение 5.8.
(Обязательное)
Требования к обеззараживанию лабораторной посуды с инфицированными питательными средами в передвижных дезинфекционных камерах
1. Общие положения
1.1. Обеззараживание лабораторной посуды в передвижных дезинфекционных камерах производят только по эпидпоказаниям при массовом обследовании населения на холеру.
1.2. В передвижных дезинфекционных камерах обеззараживание лабораторной посуды производят по паровоздушному методу.
1.3. Действующим агентом при этом методе является паровоздушная смесь (увлажненный горячий воздух) при температуре 97-98°.
1.4. Перед началом работы дезинфекционной камеры дезинфектор обязан проверить ее техническое состояние (обеззараживание лабораторной посуды в неисправной камере не допускается).
2. Порядок работы в передвижных дезинфекционных камерах
2.1. Перед загрузкой лабораторной посуды камеру освобождают от всех перевозимых в ней предметов, за исключением деревянных решеток, уложенных на полу. Не допускается работа в дезинфекционной камере, если отверстие для стока конденсата закрыто.
2.2. Перед загрузкой камеры первой партией лабораторной посуды ее прогревают до 80° и выдерживают при этой температуре в течение 15 мин. После прогрева и последующего проветривания через открытую дверь приступают к загрузке камеры лабораторной посудой.
Загрузку осуществляют со стороны, противоположной фронту управления дезинфекционной установкой (грязная зона).
2.3. Лабораторную посуду емкостью не более 1 л после использования помещают в баки или другую тару с крышками. Эти баки должны иметь мелкие отверстия по бокам на расстоянии 10 см от дна. Баки нумеруют и устанавливают в камере на двух уровнях: внизу на напольные деревянные решетки, не допуская соприкосновения друг с другом, и наверху - подвешивают на высоте 0,9-1 м от уровня пола при помощи 2-3 плечиков, входящих в комплект дезинфекционной установки, на каждый бак (тару) в зависимости от веса. Баки должны быть с открытыми крышками.
2.4. Загруженную камеру прогревают в течение 20 мин до 98 °С. С этого момента производят отсчет экспозиции. Экспозиция дезинфекции 120 мин. В процессе экспозиции поступление пара в камеру должно быть постоянным. Такой режим обеспечивает обеззараживание лабораторной посуды с инфицированными питательными средами. Содержимое внутри баков равномерно прогревается. Показания термометра и экспозицию записывают в специальном журнале.
2.5. По окончании экспозиции открывают дверь со стороны пульта управления (чистая зона), проветривают камеру в течение 5 мин и затем выгружают баки с лабораторной посудой. При этом пользуются брезентовыми рукавицами для предохранения рук от ожогов.
3. Термический и бактериологический контроль
3.1. Эффективность обеззараживания лабораторной посуды с отработанными питательными средами определяют двумя методами: термическим и бактериологическим.
3.2. Термический контроль осуществляют при каждой загрузке камеры максимальными термометрами путем закладывания их в середину каждого бака в специальных мешочках, которые нумеруют в соответствии с нумерацией баков.
3.3. По окончании обеззараживания посуды в камере мешочки извлекают из баков, записывают показания максимальных термометров в специальном журнале.
3.4. При равномерном распределении температуры в обеззараживаемых объектах, находящихся в камере, разница в показаниях термометров при паровоздушном методе допускается в 1-2 °С.
3.5. Бактериологический контроль обеззараживания проводят периодически один раз в месяц с помощью посевов обеззараживаемой жидкости из емкостей максимального объема. Из флаконов после тщательного промешивания пипеткой отбирают 0,5 мл взвеси и засевают в пробирку с мясо-пептонным бульоном, а воду из колб фильтруют в объеме не менее 100 мл. Бактериологические посевы помещают в термостат при температуре 37°. Результаты посевов учитывают через 24-48 ч.
При отсутствии роста культур лабораторную посуду считают обеззараженной.
Приложение 5.9.
(Обязательное)
Требования к исследованию сточных вод на патогенную микрофлору
1. Предприятия (учреждения), проводящие работу с микроорганизмами I-II групп патогенности, должны проводить исследование сточных вод на наличие в них микроорганизмов, используемых в работе.
2. Отбор проб сточных вод необходимо проводить из всех колодцев канализационной системы предприятия (учреждения) перед ее выходом в общий коллектор.
3. Кратность отбора проб определяется руководителем предприятия (учреждения) в зависимости от вида возбудителя, характера и объемов проводимых работ, по согласованию с территориальными органами Госсанэпиднадзора.
4. При наличии на предприятии (учреждении) локальных очистных сооружений необходимо проводить определение остаточной концентрации активного вещества, применяемого дезинфекционного средства, в сточных водах, перед их выходом в общий коллектор.
5. Отбор проб сточных вод и их лабораторное исследование проводят в соответствии с действующими нормативно-методическими документами, при соблюдении требований биологической безопасности.
6. На каждом предприятии (учреждении) должны быть разработаны "Методические рекомендации по исследованию сточных вод" с учетом местных условий и особенностей.
7. Результаты исследований фиксируют в специальном журнале, за подписью лиц, проводивших исследование.
Текст документа сверен по:
официальное издание
М.: Госкомсанэпиднадзор России, 1994

 - окно (дверь) для приема полевого материала
- окно (дверь) для приема полевого материала - шлюз (передаточное окно)
- шлюз (передаточное окно) - проходной автоклав
- проходной автоклав )
) - HH
- HH 6)
6)
 Компьютерное зрение сможет точнее выявлять рак по характеру клеточного...
Компьютерное зрение сможет точнее выявлять рак по характеру клеточного...  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов