- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
МУК 4.2.2123-06
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Контроль сыворотки крови крупного рогатого скота
на присутствие посторонних вирусов и микоплазм
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: ФГУН "Государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов им. Л.А.Тарасевича" Роспотребнадзора (Н.В.Шалунова, З.Е.Бердникова, Е.М.Петручук).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Комиссией по государственному санитарно-эпидемиологическому нормированию Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол N 2 от 11.07.06).
3. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 17 августа 2006 г.
4. ВВЕДЕНЫ ВЗАМЕН: РД 42-28-14-88 "Контроль сыворотки крови крупного рогатого скота на отсутствие вирусов-контаминантов и микоплазм".
1. Область применения
1.1. Методические указания устанавливают методы контроля коммерческой сыворотки крови крупного рогатого скота (далее - сыворотка) на присутствие посторонних вирусов и микоплазм. Сыворотка широко применяется при культивировании органов и тканей животных, используемых для приготовления профилактических и диагностических иммунобиологических препаратов и в научных исследованиях. Сыворотка является одним из компонентов питательных сред, используемых для культивирования первичных и перевиваемых клеточных культур.
1.2. Методические указания предназначены для специалистов органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, выпускающих и контролирующих медицинские иммунобиологические профилактические препараты.
1.3. Методические указания также могут использоваться организациями, зарегистрированными в Российской Федерации, выпускающими и контролирующими медицинские иммунобиологические профилактические препараты, и специалистами научных лабораторий.
2. Общие положения
Контроль сыворотки на присутствие посторонних вирусов предусматривает использование первично-трипсинизированных и перевиваемых клеточных культур, являющихся высокочувствительными и доступными для выявления наиболее часто встречающихся вирусов-контаминантов. В этих культурах хорошо размножаются с развитием цитопатических изменений вирусы парагриппа, инфекционного ринотрахеита, диареи и аденовирусы. Продолжительность контроля 28 сут.
Контроль сыворотки на присутствие микоплазм предусматривает проведение двух методов:
1. Микробиологический метод. Метод основан на выявлении роста микоплазм при внесении испытуемой сыворотки в питательные среды. Продолжительность контроля 21 сут.
2. Метод индикаторной клеточной культуры (цитохимический метод).
Метод основан на выявлении ДНК микоплазм, окрашенных флюорохромом Hoechst-33258 на индикаторной клеточной культуре Vero.
Продолжительность контроля 3-5 сут.
3. Средства измерений, вспомогательные устройства, оборудование,
реактивы и материалы
3.1. При выполнении контроля должны быть применены следующие средства измерений, оборудование и вспомогательные устройства:
|
весы аптечные от 1 до 20 г, погрешность ±20 мг |
ТУ 64-1-2834-80 |
|
колбы стеклянные, конические, вместимостью 50 мл, 100 мл |
|
|
стакан химический вместимостью 1000 мл |
|
|
пипетки градуированные от 1,0 до 10,0 мл |
|
|
пробирки бактериологические вместимостью от 10,0 до 20,0 мл |
|
|
стакан химический, вместимостью 1000 мл |
|
|
флаконы для культивирования из нейтрального стекла (матрасы) |
ГОСТ 5636-70 |
|
флаконы, вместимостью 100, 500 мл |
МРТУ 5031-32 |
|
мешалка магнитная |
МРТУ 64-1-1503-67 |
|
микроскоп биологический (любой модели) |
|
|
микроскоп люминесцентный серии ЛЮМАМ |
|
|
ножницы медицинские |
|
|
пинцеты анатомические |
ТУ 64-1-37-78 |
|
пробки резиновые |
ТУ 38.006269-95 |
|
стекла предметные |
ТУ 9464-001-33016370-95 |
|
чашки Петри (однократного применения) |
ТУ 64-2-19-79 |
|
воронка стеклянная |
|
|
камера Горяева |
ТУ 9443-001-11856833-94 |
|
термостат на температуру 37 °С с погрешностью измерения не более ±1 °С |
|
|
холодильник с температурой от 4 до 10 °С вместимостью 1000 мл |
|
|
холодильник с температурой минус (20±4) °С |
|
|
центрифуга ЦЛС-3 |
МРТУ 42.1778-65 (495) |
3.2. При выполнении контроля должны быть применены следующие реактивы и материалы:
|
бензилпенициллина натриевая соль |
ФСП 42-0048-1083-01 |
|
стрептомицина сульфат |
ФС 42-3726-99 |
|
версена раствор |
ФСП 42-0196-3274-02 |
|
вода дистиллированная |
|
|
гидролизат сердца крупного рогатого скота |
|
|
дрожжи хлебопекарные прессованные |
|
|
глицерин, ч.д.а. |
|
|
масло иммерсионное кедровое (чистое) |
ТУ 81-05-79-75 |
|
мясная вода |
ТУ 42.14.271-82 |
|
натрия гидроокись |
ГОСТ 4228-77 |
|
натрия хлорид |
|
|
раствор Хенкса |
ФСП 42-0343-3541-02 |
|
спирт этиловый ректификованный 96° |
|
|
питательная среда ДМЕМ |
ФСП 42-0343-3544-02 |
|
сыворотка крови крупного рогатого скота, жидкая для культур клеток (предварительно отконтролированная на присутствие посторонних вирусов и микоплазм) |
ФСП 42-0196-4672-03 |
|
тестикулы эмбрионов быка (получают на мясокомбинате, срок хранения не более 1 сут при температуре от 4 до 10 °С) |
|
|
трипсин (0,25%-й раствор) |
ФСП 42-0343-3805-03 |
|
хлороформ |
|
|
бумага фильтровальная |
|
|
вата медицинская гигроскопическая |
ТУ 8195-01116673801-99 |
|
марля медицинская |
ГОСТ 9412-93, |
4. Требования безопасности
Работу с микроорганизмами 3 и 4 групп проводят в соответствии с СП 1.2.731-99 "Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами".
5. Условия проведения контроля
Подготовительные операции и испытания на присутствие посторонних вирусов и микоплазм проводят в чистых помещениях класса А/В (GMP) с ламинарным потоком воздуха при соблюдении правил асептики, при температуре (20±2) °С и относительной влажности 60-70%.
6. Контроль сыворотки на присутствие посторонних вирусов
При выполнении контроля используют два вида клеточных культур: первично-трипсинизированные - тестикулы эмбрионов быка (ТБ) 4-6-месячного возраста и перевиваемые - почки быка (МДВК) или любые другие перевиваемые клеточные культуры почки крупного рогатого скота, в которые вносят исследуемые сыворотки. Принцип метода основан на появлении цитопатического действия (ЦПД) или гемадсорбции под действием вирусов-контаминантов.
6.1. Подготовка к выполнению контроля
При подготовке к выполнению контроля сыворотки на присутствие посторонних вирусов должны быть выполнены следующие операции:
6.1.1. Приготовление первично-трипсинизированной клеточной культуры тестикулов эмбрионов быка (ТБ).
6.1.2. Доставляют тестикулы эмбрионов быков 4-6-месячного возраста с перевязанной мошонкой с мясокомбината в любом стерильном сосуде с 250-270 мл раствора Хенкса с 500 ед/мл бензилпенициллина калиевой или натриевой соли.
6.1.3. Обжигают кожу мошонки над пламенем горелки и обрабатывают тампоном со спиртом.
6.1.4. Срезают ножницами кожу с кончика мошонки и, подтягивая тестикулы за семенные канатики, извлекают их.
6.1.5. Помещают тестикулы в стерильную чашку Петри и удаляют ножницами белочную оболочку.
6.1.6. Переносят тестикулы в чашку Петри с 30-35 мл раствора Хенкса с 100 ед/мл антибиотика.
6.1.7. Разрезают тестикулы вдоль и вылущивают ножницами содержимое в раствор Хенкса.
6.1.8. Промывают ткань тестикулов до просветления жидкости 2-3 раза в растворе Хенкса с 500 ед/мл антибиотика.
6.1.9. Помещают ткань тестикулов в колбу вместимостью 500 мл с перемешивающим стержнем, прилагаемым к магнитной мешалке.
6.1.10. Нагревают 0,2%-й раствор трипсина до температуры (20±2) °С и наливают 100-150 мл в колбу. Колбу ставят на магнитную мешалку и включают ее. Скорость вращения перемешивающего стержня должна быть такой, чтобы жидкость не пенилась и стержень не ударялся о стенки колбы.
Перемешивание проводят 5-6 мин.
6.1.11. Сливают надосадочную жидкость после первого цикла трипсинизации в колбу для отходов.
6.1.12. Проводят 4-5 циклов трипсинизации.
6.1.13. Сливают надосадочную жидкость после каждого цикла во флаконы вместимостью 100 мл.
6.1.14. Помещают флаконы в центрифугу и осаждают клетки при скорости 1000-1500 об/мин в течение 10-15 мин.
6.1.15. Вынимают флаконы из центрифуги, сливают надосадочную жидкость в сосуд для отходов.
6.1.16. Добавляют в каждый флакон к осадку клеток по 10-15 мл среды 0,5%-го гидролизата лактальбумина на растворе Хенкса.
6.1.17. Объединяют полученные суспензии клеток в один флакон и отбирают пипеткой (0,5±0,01) мл.
6.1.18. Добавляют к 0,5 мл этой суспензии 0,5 мл 0,1%-го раствора метиленового синего и подсчитывают окрашенные клетки в камере Горяева при увеличении 70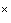 . Для точности результатов подсчет проводят в нескольких пробах. Количество клеток в 1 мл подсчитывают по формуле:
. Для точности результатов подсчет проводят в нескольких пробах. Количество клеток в 1 мл подсчитывают по формуле:
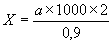 ,
,
где 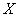 - концентрация клеток в 1 мл исходной суспензии;
- концентрация клеток в 1 мл исходной суспензии;
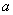 - среднее число клеток в нескольких пробах;
- среднее число клеток в нескольких пробах;
0,9 - объем камеры Горяева в мм ;
;
1000 - число мм в 1 см
в 1 см ;
;
2 - коэффициент разведения суспензии добавленным объемом краски.
6.1.19. Разводят суспензию клеток средой ДМЕМ во флаконе по п.6.1.17 с таким расчетом, чтобы в 1 мл содержалось 4-5х10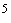 клеток/мл.
клеток/мл.
6.1.20. Вносят в каждый из 2 флаконов вместимостью 1000 мл по 100-120 мл разведенной суспензии клеток и добавляют 10% сыворотки, предварительно отконтролированной на присутствие посторонних вирусов и микоплазм.
6.2. Культивирование и подготовка перевиваемой
клеточной культуры почки быка (МДВК)
6.2.1. Готовят во флаконе вместимостью 100 мл 50 мл смеси, состоящей из равных объемов 0,02%-го раствора версена и 0,25%-го раствора трипсина и нагревают ее до температуры (20±2) °С.
6.2.2. Просматривают флаконы с МДВК вместимостью 1000 мл под микроскопом при увеличении 70 и отбирают с полным монослоем клеток.
и отбирают с полным монослоем клеток.
6.2.3. Сливают питательную среду из флаконов в сосуд для отходов и добавляют смесь версена и трипсина.
6.2.4. Оставляют клетки в смеси версена и трипсина при температуре (20±2) °С и наблюдают за ними визуально.
6.2.5. Когда начнется "набухание" и слабое "отслоение" клеток от стекла (обычно через 15-20 мин), сливают смесь версена и трипсина в сосуд для отходов.
6.2.6. Флаконы с клеточной культурой помещают при температуре (37±1) °С на 30-35 мин.
6.2.7. Добавляют во флаконы по 50 мл среды ДМЕМ и встряхивают их так, чтобы все клетки отделились от стекла.
6.2.8. Подсчитывают клетки в камере Горяева, как указано в п.5.1.18.
6.2.9. Разводят клетки средой ДМЕМ с таким расчетом, чтобы в 1 мл содержалось 2х10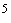 клеток/мл.
клеток/мл.
6.2.10. Вносят в каждый из 2 флаконов по 100-120 мл разведенной суспензии клеток и добавляют 10% сыворотки, предварительно отконтролированной на присутствие посторонних вирусов и микоплазм.
6.2.11. Через 5-6 сут просматривают флаконы под световым микроскопом и отбирают с полным монослоем клеток.
6.3. Выполнение контроля сыворотки на присутствие посторонних вирусов
При выполнении контроля сыворотки на присутствие посторонних вирусов должны быть выполнены следующие операции:
6.3.1. Отбирают по 1 флакону с клеточными культурами ТБ и МДВК для проверки испытуемой сыворотки и по 1 флакону с теми же культурами в качестве контрольных.
6.3.2. Сливают питательную среду из флаконов в сосуд для отходов.
6.3.3. Монослой клеток ТБ и МДВК промывают 3 раза средой ДМЕМ без сыворотки.
6.3.4. Вносят пипеткой в каждый из двух флаконов вместимостью 1000 мл с клеточными культурами ТБ и МДВК по 25 мл испытуемой сыворотки так, чтобы разведение в среде не превышало 1:4 из расчета не менее 3 см площади на 1 мл сыворотки.
площади на 1 мл сыворотки.
Одновременно вносят пипеткой в каждый из двух контрольных флаконов вместимостью 1000 мл с клеточными культурами ТБ и МДВК по 25 мл сыворотки, ранее отконтролированной на присутствие посторонних вирусов и микоплазм.
6.3.5. Инкубируют клеточные культуры ТБ и МДВК при температуре (20±2) °С (60±5) мин.
6.3.6. Сливают сыворотку и добавляют в опытные и контрольные флаконы с культурами ТБ и МДВК по 75 мл среды ДМЕМ.
Инкубируют при температуре (37±1) °С 14 сут.
6.3.7. С целью обнаружения цитопатогенного действия (ЦПД) просматривают опытные и контрольные клеточные культуры под микроскопом на 2, 5, 7, 10 и 14 сут.
6.3.8. Если в опытных и контрольных клеточных культурах не будет наблюдаться ЦПД, через 14 сут их трижды замораживают при температуре минус (20±2) °С и размораживают при температуре (37±2) °С.
6.3.9. После размораживания культуры флаконы встряхивают, отбирают из каждого флакона с клеточными культурами ТБ и МДВК по 25 мл суспензии и вносят во флаконы с клетками того же вида. Два флакона с клеточными культурами ТБ и МДВК оставляют для контроля.
6.3.10. Вносят в опытные и контрольные клеточные культуры ТБ и МДВК по 75 мл среды ДМЕМ.
6.3.11. Клеточные культуры инкубируют при температуре (37±2) °С в течение 14 сут.
Если в течение 14 сут в опытных и контрольных клеточных культурах не наблюдается ЦПД, их проверяют на наличие гемадсорбирующих вирусов.
6.3.12. Сливают из флаконов питательную среду и промывают культуры 3 раза раствором Хенкса.
6.3.13. Добавляют в опытные и контрольные клеточные культуры по 50 мл 0,25%-й взвеси куриных эритроцитов и эритроцитов морской свинки и инкубируют их при температуре (37±2) °С.
6.3.14. Через 30-35 мин эритроциты из флаконов удаляют, а монослой промывают раствором Хенкса и просматривают под микроскопом при увеличении 70 .
.
6.4. Учет результатов
6.4.1. Если в клеточных культурах при первичной инокуляции сыворотки и в пассаже не выявлено ЦПД и не отмечено гемадсорбции, сыворотка признается пригодной.
6.4.2. Если при исследовании наблюдается ЦПД или отмечается гемадсорбция в испытуемых клеточных культурах при отсутствии в контроле, сыворотку бракуют.
6.4.3. Если ЦПД или гемадсорбция появились в контрольных и в опытных клеточных культурах, допускается однократный переконтроль сыворотки.
7. Контроль сыворотки на присутствие микоплазм
7.1. Микробиологический метод контроля сыворотки на присутствие микоплазм
Обнаружение микоплазм микробиологическим методом предусматривает внесение исследуемой сыворотки в бульонную питательную среду, инкубирование в течение 7 сут и последующий высев на питательную среду, содержащую 0,3% агара.
7.2. Чувствительность микробиологического метода
Микробиологический метод контроля сыворотки позволяет обнаруживать одну и более колоний микоплазм в объеме не более 100 мл сыворотки.
7.3. Приготовление бульонной среды
7.3.1. Для приготовления 1 л среды к 200 мл триптического гидролизата бычьего сердца (содержание сухих веществ 8-10%) добавляют 400 мл мясного экстракта 1:2 (содержание сухих веществ 3,0-3,5%), экстракт хлебопекарных дрожжей из расчета 1,5 г сухих веществ на 1 л среды и 5,0 г хлорида натрия.
7.3.2. С помощью 10%-го раствора NaOH устанавливают значение рН бульонной среды от 8,0 до 8,2.
7.3.3. Среду нагревают до кипения, кипятят 2-3 мин, фильтруют через складчатый бумажный фильтр.
7.3.4. Разливают по 300-305 мл во флаконы, закрытые ватно-марлевыми или резиновыми пробками и завальцованные алюминиевыми колпачками, и стерилизуют автоклавированием при температуре 110 °С 30 мин. С помощью 5%-го раствора соляной кислоты устанавливают рН от 7,8 до 8,0.
7.3.5. Для приготовления среды, содержащей 0,3% агара, дополнительно вносят 3,0 г агара.
Готовые среды хранят при температуре от 2 до 8 °С не более 4 мес.
7.4. Стерильность питательной среды
7.4.1. Для испытания на стерильность отбирают не менее 2% от количества емкостей в серии. Определение проводят путем визуального просмотра каждого флакона с питательной средой после выдерживания в течение 44-48 ч при температуре (37±1) °С и 14 сут при температуре 20-25 °С.
7.4.2. В случае пророста хотя бы в одном флаконе бракуют всю серию. Далее питательная среда не используется.
7.5. Определение ростовых свойств среды, содержащей 0,3% агара
Каждую серию приготовленной среды проверяют на ростовые свойства, используя тест-штамм Mycoplasma arginini G 230 (ОСО 42-28-378-05).
Среду считают чувствительной и признают годной, если результаты ее испытания соответствуют Инструкции по применению ОСО 42-28-378-05.
7.6. Подготовка сред для контроля
7.6.1. Перед употреблением полужидкую среду, содержащую 0,3% агара, разогревают в водяной бане до полного расплавления агара и охлаждают до температуры 40-45 °С.
7.6.2. Добавляют 15-20% нормальной сыворотки крови лошади без консерванта, предварительно проверенной на стерильность и присутствие микоплазм, и 100 ед/мл бензилпенициллина натриевой соли.
7.6.3. Разливают по 10 мл в бактериологические пробирки и закрывают ватно-марлевыми пробками. Хранят среду при температуре от 2 до 8 °С не более 7 сут.
7.7. Выполнение контроля сыворотки на присутствие микоплазм
микробиологическим методом
При выполнении контроля сыворотки микробиологическим методом должны быть выполнены следующие операции:
7.7.1. Вносят (300±2) мл бульонной среды во флакон вместимостью 500 мл. Флакон закрывают ватно-марлевой пробкой.
7.7.2. Вносят (100±2) мл исследуемой сыворотки в (300±2) мл бульонной среды. Смесь инкубируют 7 сут при температуре (37±1) °С и относительной влажности 80-90%.
7.7.3. Отбирают 10 пробирок со средой, содержащей 0,3% агара, и вносят в каждую пробирку по (1,0±0,1) мл смеси исследуемой сыворотки и бульонной среды. Посев проводят прокалыванием всего столбика питательной среды, содержащейся в пробирке, концом пипетки вместимостью 1,0 мл, выпуская равномерно ее содержимое, начиная от дна до поверхности.
7.7.4. Инкубируют посевы 14 сут при температуре (37±1) °С и относительной влажности 80-90%.
7.8. Учет результатов
7.8.1. Учет результатов проводят путем визуального просмотра засеянных пробирок в проходящем свете на 4, 7, 10, 14 сут.
7.8.2. Сыворотка считается свободной от микоплазм, если через 14 сут не обнаруживают роста микоплазм ни в одной из засеянных пробирок.
7.8.3. В случае получения сомнительных результатов проводят повторный контроль.
7.8.4. При повторном контроле, при наличии роста микоплазм хотя бы в одной пробирке, сыворотка считается контаминированной микоплазмами.
8. Контроль сыворотки на присутствие микоплазм методом
индикаторной клеточной культуры (цитохимический метод)
Метод обнаружения микоплазм с использованием индикаторной клеточной культуры Vero основан на внесении испытуемой сыворотки в клеточную культуру и обработку препарата специфическим флюоресцирующим красителем Hoechst-33258, окрашивающим ДНК клеток и микоплазм. Возможно применение другого флюорохрома, аттестованного в ГИСК им. Л.А.Тарасевича. Клеточную культуру Vero (или другую чувствительную к микоплазмам) получают из банка клеток, аттестованного в соответствии с требованиями ВОЗ в ГИСК им. Л.А.Тарасевича.
8.1. Подготовка к выполнению контроля на присутствие микоплазм
методом индикаторной клеточной культуры
При подготовке к выполнению контроля сыворотки на присутствие микоплазм методом индикаторной клеточной культуры должны быть выполнены следующие операции: приготовление основного и рабочего раствора красителя Hoechst-33258, подготовка люминесцентного микроскопа, подготовка предметных стекол.
8.1.1. Приготовление основного и рабочего раствора Hoechst-33258
Соблюдая стерильность, 5 мг концентрата Hoechst-33258 растворяют в 100 мл стерильной дистиллированной воды (основной раствор).
Для получения рабочего раствора добавляют концентрат красителя в раствор Хенкса без индикатора в соотношении 1:9 и используют для окраски препаратов немедленно.
8.1.2. Подготовка люминесцентного микроскопа
Используют для анализа препаратов фильтры: ФС1-4, СС15-2, БС8-2. Просматривают препараты при увеличении ок. 10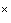 , об. 90
, об. 90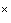 масляная иммерсия, или об. 70
масляная иммерсия, или об. 70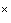 или об. 85
или об. 85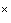 водная иммерсия.
водная иммерсия.
8.1.3. Подготовка предметных стекол
Промывают стекла в проточной водопроводной воде в течение 10-15 мин. Помещают стекла в сосуд с дистиллированной водой и кипятят 5-7 мин. После охлаждения до температуры 20-22 °С извлекают стекла с помощью пинцета и помещают в чашку Петри. Протирают каждое стекло стерильной салфеткой и помещают на 1 сут в смесь Никифорова, состоящую из равных объемов 96° этилового спирта и эфира для наркоза. Извлекают стекла с помощью пинцета из смеси Никифорова и протирают каждое стекло стерильной салфеткой. Стерилизуют стекла (30±2) мин при температуре (120±2) °С.
8.2. Выполнение контроля сыворотки на присутствие микоплазм
методом индикаторной клеточной культуры
При проведении испытания на присутствие микоплазм методом индикаторной клеточной культуры выполняют следующие операции:
8.2.1. Вносят 1 мл испытуемого материала в чашку Петри диаметром 90 мм, содержащую стерильное предметное стекло и 20-23 мл суспензии клеточной культуры Vero в концентрации 10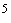 кл/мл.
кл/мл.
8.2.2. Инкубируют чашку Петри с клеточной культурой Vero в течение 3-5 сут при температуре (37±1) °С в анаэробных условиях до формирования 50-70% монослоя. Образование монослоя наблюдают в световом микроскопе при увеличении ок. 10 , об. 20
, об. 20 .
.
8.2.3. Сливают культуральную жидкость, промывают препарат питательной средой или буфером (рН 7,2-7,4).
8.2.4. Помещают предметное стекло на 30-35 мин в 96° этиловый спирт.
Сливают спирт и высушивают препарат на воздухе.
8.2.5. Добавляют рабочий раствор красителя Hoechst-33258 и окрашивают в темноте при температуре (37±1) °С в течение 30-35 мин.
8.2.6. Сливают краситель, промывают препарат стерильной дистиллированной водой, подсушивают на воздухе и микроскопируют.
8.3. Учет результатов
Учет результатов испытания на присутствие микоплазм методом окрашивания ДНК флюорохромом Hoechst-33258 на индикаторной культуре клеток Vero проводят путем просмотра препаратов в люминесцентном микроскопе.
Микоплазмы выглядят, как однородно окрашенные тела сферической формы, имеющие вид отдельных, парных, цепочечных или нитевидных образований яркого зеленоватого свечения. Диаметр обычно находится в пределах 0,1-0,3 микрона.
Микоплазмы в виде ярко светящейся зернистости на фоне темной цитоплазмы выявляют по периферии клеток и в межклеточном пространстве.
Условно интенсивность контаминации микоплазмами обозначают знаками креста:
1 крест - единичные микоплазмы в препарате;
2 креста - небольшие скопления микоплазм в поле зрения;
3 креста - отдельные микоплазмы и скопления в 20-50% клеток;
4 креста - максимальное количество микоплазм в виде скоплений в межклеточном пространстве в каждом поле зрения.
В качестве положительных контрольных образцов используют заведомо контаминированные микоплазмами клеточные культуры.
Отрицательными контрольными образцами служат клеточные культуры, в которых описанные выше светящиеся образования не выявлены.
Обнаружение микоплазм в препаратах на индикаторной клеточной культуре Vero свидетельствует о контаминации испытуемого материала микоплазмами.
В случае получения сомнительных результатов следует проводить повторный контроль.
Окончательный ответ о присутствии микоплазм в сыворотке будет учитывать результаты двух методов: микробиологического и метода индикаторной клеточной культуры.
В случае обнаружения микоплазм хотя бы одним методом сыворотка считается контаминированной и бракуется.
Приложение
Таблица 1
Контроль сыворотки крови крупного рогатого скота на присутствие посторонних вирусов
|
Клеточные культуры |
Результаты контроля | |
|
ЦПД |
Гемадсорбция | |
|
Первично-трипсинизированная клеточная культура ТБ |
не обнаружено |
не обнаружено |
|
Перевиваемая клеточная культура МДВК |
не обнаружено |
не обнаружено |
Таблица 2
Контроль сыворотки крови крупного рогатого скота на присутствие микоплазм
|
Методы |
Результаты контроля |
|
Микробиологический (посев на питательные среды) |
Отсутствие роста |
|
Цитохимический |
Отсутствие люминесцентного свечения в индикаторной клеточной культуре Vero |

 В аэропорту г. Сочи пресечен незаконный вывоз валюты
В аэропорту г. Сочи пресечен незаконный вывоз валюты  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов