- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
МУ 9467-015-05749470-98
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ГРАФИЧЕСКОЕ ОФОРМЛЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ.
ОБЩИЕ ТРЕБОВАНИЯ
(в ред. писем Минздрава РФ от 28.10.1999 N 293-22/70,
от 20.03.2000 N 293-22/47, от 04.12.2000 N 291-22/159)
Дата введения 1999-05-01
Предисловие
1. РАЗРАБОТАН НПО "Прогресс"
РАЗРАБОТЧИКИ Р.Я.Слуцкая, Л.А.Воронецкая, И.К.Ковш, Г.Ф.Емельянова.
2. УТВЕРЖДЕН Департаментом государственного контроля качества, эффективности, безопасности лекарственных средств и медицинской техники Минздрава России.
3. РЕКОМЕНДОВАН Департаментом экономики химической, микробиологической и медицинской промышленности Минэкономики России.
4. СОГЛАСОВАН Фармакопейным государственным комитетом Минздрава России.
5. ВВЕДЕН В ДЕЙСТВИЕ Департаментом государственного контроля качества, эффективности, безопасности лекарственных средств и медицинской техники Минздрава России, письмо N 293-22/11 от 15.03.99.
6. ВЗАМЕН РД 9467-015-05749470-97.
1. Область применения
Настоящие методические указания распространяются на графическое оформление потребительских упаковок лекарственных средств, поставляемых на внутренний рынок, и устанавливают:
1) требования к содержанию и написанию текстов графического оформления упаковок лекарственных средств;
2) общие технические требования к оригиналу графического оформления;
3) требования к качеству полиграфического исполнения оригинала графического оформления.
Методические указания обязательны также при разработке раздела "Маркировка" нормативно-технической документации на лекарственные средства.
2. Требования к содержанию и написанию текстов
графического оформления лекарственных средств
2.1. Содержание и написание текстов графического оформления должно соответствовать настоящим методическим указаниям, а также требованиям Государственной фармакопеи или другой нормативно-технической документации на лекарственные средства.
2.2. Требования к содержанию текстов
2.2.1. Содержание текстов на упаковке лекарственных средств должно соответствовать требованиям приложения А.
2.2.2. Для ядовитых и сильнодействующих лекарственных средств (список А и Б) должно быть указано ПРИМЕНЯТЬ ПО НАЗНАЧЕНИЮ ВРАЧА.
2.2.3. Условия хранения лекарственных средств необходимо указывать, если они оговорены в утвержденной нормативно-технической документации на данное лекарственное средство.
Пример - ХРАНИТЬ В ПРОХЛАДНОМ, ЗАЩИЩЕННОМ ОТ СВЕТА МЕСТЕ.
2.2.4. Предупредительные надписи КАПЕЛЬНО, ПЕРЕД УПОТРЕБЛЕНИЕМ ВЗБАЛТЫВАТЬ и т.п. необходимо указывать, если они оговорены в утвержденной нормативно-технической документации на лекарственное средство.
2.2.5. Допускается условия хранения и предупредительные надписи в случаях, указанных в графе 19 приложения А, наносить только на пачку или коробку.
2.2.6. Способ применения лекарственного средства указывается в рекламно-сопроводительной документации (листок-вкладыш, инструкция). При наличии свободного места на потребительской упаковке нанесение краткого содержания способа применения предпочтительно.
2.2.7. На упаковке лекарственного растительного сырья должно быть указано назначение, масса при влажности в % и наличие радиационного контроля.
Пример - ПРОДУКЦИЯ ПРОШЛА РАДИАЦИОННЫЙ КОНТРОЛЬ СанПиН 2.3.2.560-96*.
__________________
* На территории Российской Федерации действует СанПиН 2.3.2.1078-01. - Примечание изготовителя базы данных.
2.2.8. Если в нормативно-технической документации указано, что лекарственное средство контролируется ежегодно, на упаковке следует наносить соответствующую надпись.
2.2.9. На упаковку лекарственных средств должен быть нанесен штриховой код международной системы нумерации EAN или соответствующий уникальный номер, присвоенный лекарственному средству, и зарегистрированный в установленном порядке.
Штриховой код наносится типографским способом непосредственно на упаковку лекарственных средств: этикетки, пачки, коробки, пакеты, тубы и т.д.
Допускается наносить штриховой код на отдельную этикетку, дополнительно наклеиваемую на упаковку. Нанесение штрихового кода на упаковку в отдельных случаях, представляющих технические трудности, регламентируется соответствующим информационным письмом Управления Госконтроля МЗ России.
Примечание: Требование о наличии штрихового кода на упаковке вводится в действие в порядке и сроки, устанавливаемые Указанием Минздрава России N 388-У от 26 июня 1997 г.
2.2.10. Лекарственные средства гомеопатические, для детей, для клинических исследований, ветеринарии, полученные на основе генетически модифицированных источников должны содержать специальные надписи согласно указанным в приложении Б.
(в ред. письма Минздрава РФ от 20.03.2000 N 293-22/47)
2.2.11. При оформлении упаковки лекарственного растительного сырья допускается нанесение тематического рисунка.
2.2.12. Допускается текст листков-вкладышей наносить непосредственно на потребительскую упаковку лекарственных средств: на этикетки, пачки, пакеты, коробки.
2.2.13. На упаковку лекарственных средств в соответствии с нормативно-технической документацией на лекарственное средство должны быть нанесены условия отпуска.
2.2.14. При расфасовке лекарственных средств "ангро", изготовленных зарубежными и отечественными фирмами, на упаковке указывают:
1) название фирмы и страну - изготовитель лекарственного средства "ангро", если оно ввезено из-за рубежа;
2) наименование и товарный знак предприятия - изготовителя "ангро", если оно произведено в России;
3) наименование, товарный знак и реквизиты (адрес, телефон, факс) предприятия, производящего расфасовку;
4) номер серии расфасованного лекарственного средства присваивается предприятием, осуществившем расфасовку;
5) дату изготовления расфасованного лекарственного средства /дата изготовления лекарственного средства "ангро"/;
6) срок годности расфасованного лекарственного средства /исчисляется от даты его изготовления "ангро"/.
Пример - Индометацин
Индометацин
произведено: KRKA, Словения
расфасовано: ОАО "АИ СИ ЭН Полифарм"
454899, Россия, г.Челябинск, ул.Елькина, 32
факс (3512) 66-70-84
2.2.15. Если отечественные предприятия осуществляют только упаковку лекарственных средств, на упаковке указывают:
1) название фирмы и страну - изготовитель лекарственного средства, если оно ввезено из-за рубежа;
2) наименование и товарный знак предприятия-изготовителя, если оно произведено в России;
3) наименование, товарный знак и реквизиты (адрес, телефон, факс) предприятия, осуществляющего упаковку;
4) номер серии упаковываемого лекарственного средства присваивается предприятием - изготовителем лекарственного средства;
5) дату изготовления лекарственного средства предприятием-изготовителем;
6) срок годности упакованного лекарственного средства (исчисляется от даты изготовления).
2.2.16. При совместном изготовлении лекарственных средств "под заказ" на упаковке указывают:
а) наименование и товарный знак предприятия-изготовителя;
б) наименование, товарный знак и реквизиты (адрес, телефон, факс) предприятия, по заказу которого произведено лекарственное средство.
Пример - АО "Уралбиофарм"
Произведено по заказу АО "Новатор"
Тел./факс (812) 311-78-93, 310-00-31
2.2.17. При изготовлении лекарственных средств по лицензии другой фирмы на упаковке указывают:
а) наименование, товарный знак и реквизиты (адрес, телефон, факс) предприятия-изготовителя;
б) наименование фирмы и страну, по лицензии которой изготовлено лекарственное средство.
Пример - ОАО "АИ СИ ЭН Полифарм", г.Челябинск
факс (3512) 66-70-84
по лицензии фирмы
Knoll AG, Ludwigshafen, Deutchland
2.3. Требования к нанесению текстов:
2.3.1. Наименование и адрес предприятия - изготовителя лекарственного средства следует указывать полностью или сокращенно.
Пример - "Нижфарм", 603600, г.Нижний Новгород
ГСП-459, ул.Салганская, 7
факс (8312) 37-07-38, 37-08-80
или
АО "Нижфарм", Н.Новгород, факс (8312) 37-07-38, 37-08-80
или
АО "Нижфарм", Н.Новгород
(в ред. писем Минздрава РФ от 28.10.1999 N 293-22/70, от 20.03.2000 N 293-22/47)
2.3.2. На упаковке следует указывать название лекарственного средства на русском языке и международное непатентованное название (если оно имеется или не совпадает с названием лекарственного средства).
Русское название указывается в именительном падеже, а далее лекарственная форма, количество, дозировка и состав.
(в ред. письма Минздрава РФ от 20.03.2000 N 293-22/47)
При наличии у производителя патента на изобретение или свидетельства на товарный знак допускается после наименования лекарственного средства наносить предупредительную маркировку R или "ТМ", с обязательным нанесением на упаковку номера патента на изобретение или свидетельства на товарный знак.
(абзац введен ред. письмом Минздрава РФ от 04.12.2000 N 291-22/159)
2.3.2.1. Для лекарственного растительного сырья название указывается на русском и латинском языках.
На упаковке лекарственного растительного сырья первым должно быть указано в именительном падеже название растительного сырья или торговое название, а затем указание вида фасованной продукции.
Пример: 1. ЛИПЫ ЦВЕТКИ
Flores Tiliae (пачки, пакеты, брикеты, фильтр-пакеты)
2. ПОДОРОЖНИКА БОЛЬШОГО ЛИСТЬЯ
Folia plantaginis majoris (пачки, брикеты, фильтр-пакеты)
3. Мочегонный N 2 сбор
Species diureticae N 2 (пачки, брикеты)
(в ред. письма Минздрава РФ от 20.03.2000 N 293-22/47)
2.3.2.2. Торговое название лекарственного средства необходимо указывать на русском языке, а затем количество, состав и дозировка.
Пример - Папазол 10 таблеток
Состав: дибазола 0,03 г
папаверина гидрохлорида 0,03 г.
2.3.2.3. Для многокомпонентного лекарственного средства, если оно не имеет торгового названия, должна указываться его лекарственная форма, затем состав и дозировка каждого лекарственного средства.
Пример - Таблетки
теобромина 0,025 г
амидопирина 0,3 г
сальсолина гидрохлорида 0,03 г
Состав должен указываться в порядке, установленном Государственной фармакопеей или другой нормативно-технической документацией только на русском языке в родительном падеже.
Допускается для лекарственного средства в случаях, предусмотренных утвержденной нормативно-технической документацией и приложением А (графа 19), состав не указывать.
2.3.2.4. Для лекарственных средств, применяемых в ветеринарии, допускается название лекарственного средства указывать только на русском языке.
2.3.3. Концентрация и содержание действующего вещества в лекарственном средстве должны быть в весовых, объемных или относительных величинах, как это предусмотрено для лекарственного средства утвержденной нормативно-технической документацией.
2.3.4. Активность лекарственного средства следует указывать в единицах действия.
Пример - 1 В 1 мл 15 ЕД
2 В 1 г 180 ЛЕД
3 В 1 мл 28 КЕД
4 В 1 г 4773 ГЕЛ
5 В 1 мл 44000 ME
2.3.5. Количество лекарственных средств в упаковке должно быть в следующих единицах:
1) по массе - в микрограммах (мкг), миллиграммах (мг), граммах (г), килограммах (кг). Масса лекарственного растительного сырья указывается при определенной влажности в %;
2) по объему - в миллилитрах (мл), литрах (л);
3) по количеству в потребительской таре - в ампулах, таблетках, флаконах, капсулах, штуках.
2.3.6. Стерильность следует указывать для стерильных лекарственных средств только на русском языке словом стерильно.
2.3.7. Для инъекционных лекарственных средств следует указывать способ введения на русском языке.
Пример - 1 Внутривенно.
2 Внутримышечно.
3 Подкожно.
4 Внутримышечно и подкожно.
Если инъекционное лекарственное средство может вводиться всеми способами, то указывается для инъекций.
2.3.8 Регистрационный номер следует указывать буквой Р и арабскими цифрами. Первые две цифры обозначают год издания приказа Министерства здравоохранения, разрешающего применение и промышленный выпуск данного лекарственного средства, следующая группа цифр - номер приказа и последняя группа цифр - номер пункта в приказе. Указанные группы цифр разделяются точками или косой чертой ("/").
Пример - Регистрационный номер Р 98.211.14
или
Р 98/211/14,
где: 98 (1998) - год издания приказа,
211 - номер приказа,
14 - номер пункта в приказе.
2.3.9. Номер серии обозначается арабскими цифрами слитно, слово "серия" не проставляется. Последние четыре цифры в номере обозначают месяц и год изготовления лекарственного средства. Цифры, предшествующие последним четырем, являются производственным номером серии. Размеры цифр по высоте должны быть не более 5 мм.
Пример - 16140301
где: 0301 - март 2001 года - дата изготовления,
1614 - производственный номер серии.
При производстве лекарственного средства в 2000 году дата изготовления проставляется шестью цифрами:
Пример - 1614032000
где: 032000 - март 2000 г. - дата изготовления,
1614 - производственный номер серии.
Допускается при производстве лекарственного средства в 2000 году, при недостаточном печатном поле упаковки, дату изготовления проставлять четырьмя шифрами.
Пример - 16140300
где: 0300 - март - 2000 г. - дата изготовления,
1614 - производственный номер серии.
(в ред. письма Минздрава РФ от 20.03.2000 N 293-22/47)
2.3.10. Срок годности следует указывать:
Годен до X 01 или Годен до Х01 или до X01, или до Х01.
Римскими цифрами проставляется месяц, арабскими - две последние цифры года. Размеры цифр по высоте должны быть не более 5 мм. Допускается проставлять месяц арабскими цифрами. Срок годности в 2000 г. следует указывать:
Годен до X 2000 или Годен до Х2000, или до X 2000 или до Х2000.
Допускается при производстве лекарственных средств, в 2000 году, при недостаточном печатном поле упаковки срок годности указывать:
Годен до X 00 или Годен до Х00, или до X 00, или до Х00.
(в ред. письма Минздрава РФ от 20.03.2000 N 293-22/47)
2.3.11. При маркировке комплекта антибиотика с растворителем на пачке следует указывать номер серии антибиотика и номер серии растворителя, а также срок годности лекарственного средства, входящего в комплект, с наименьшим сроком годности.
2.3.12. Введение требований, не включенных в настоящие методические указания, а также сокращения при маркировке лекарственных средств устанавливаются и утверждаются Федеральным органом контроля качества лекарственных средств.
3. Общие технические требования к оригиналу графического оформления
3.1. При разработке оригинала графического оформления следует исходить из необходимости решения следующих основных задач:
создания фирменного (единого) стиля оформления всех выпускаемых лекарственных средств (регламентирование цветового и шрифтового решения; наглядность, рекламность, информативность оформления и современный товарный вид);
информационности упаковки, обеспечивающей четкость, контрастность, читаемость надписей;
эстетическое воздействие на потребителя;
создание высокого художественного уровня;
технологичности изготовления печатных изделий.
3.2. Методы разработки оригинал-макета графического оформления не регламентируются.
3.3. Международное непатентованное название и латинское название должны выполняться более мелким кеглем по сравнению с русским названием.
3.4. Оформление всех элементов упаковки одного лекарственного средства должно иметь единое шрифтовое, композиционное и цветовое решение.
3.5. Для лекарственных средств одного наименования, но разного содержания действующего вещества, художественное решение должно быть единым, а цветовое - разным.
Для лекарственных средств одного наименования и разных лекарственных форм - основное художественное решение должно быть единым.
4. Требования к качеству полиграфического
исполнения оригинала графического оформления
4.1. При воспроизведении оригинала полиграфическим способом тиражные оттиски должны соответствовать утвержденному оригиналу.
4.2. Качество полиграфического исполнения оригинала должно соответствовать требованиям технологических инструкций по процессам полиграфического производства и утвержденной нормативно-технической документации на полиграфическое воспроизведение оригиналов.
4.3. Контролировать качество тиражных оттисков на соответствие оригиналу должны как предприятия-изготовители, так и предприятия-заказчики.
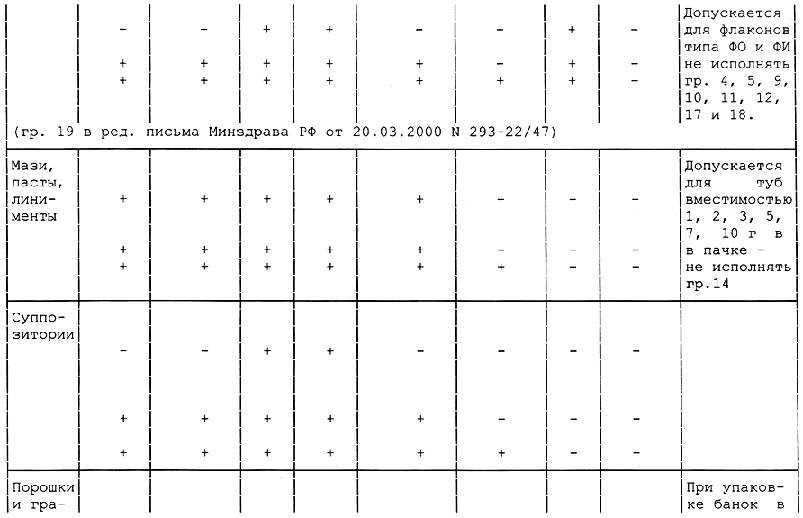
Приложение А
(обязательное)
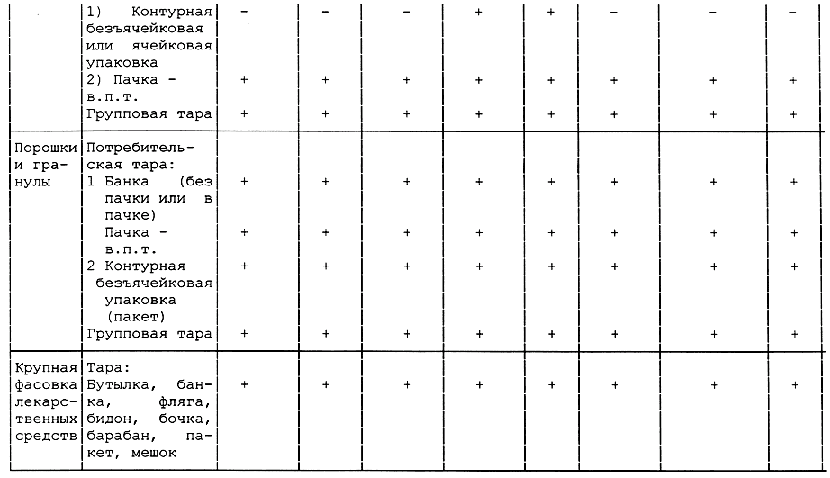
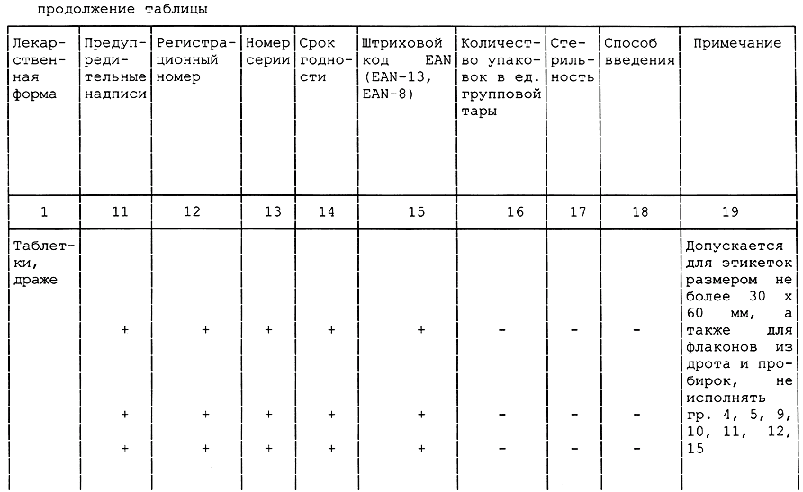
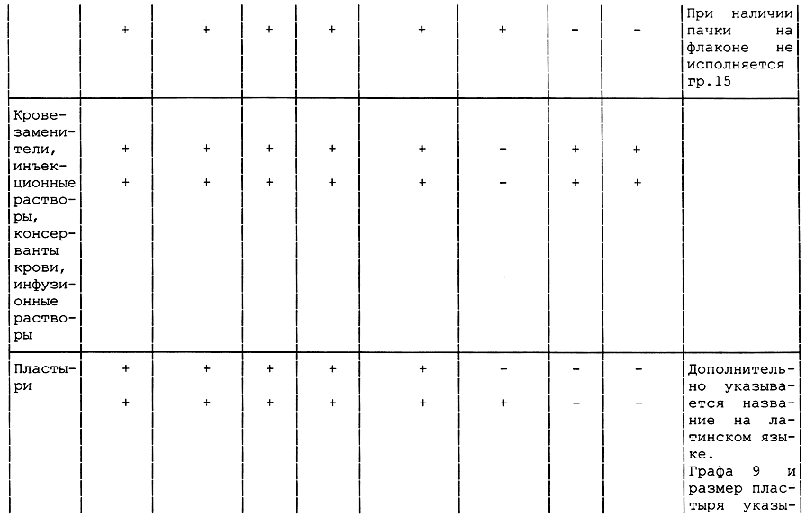
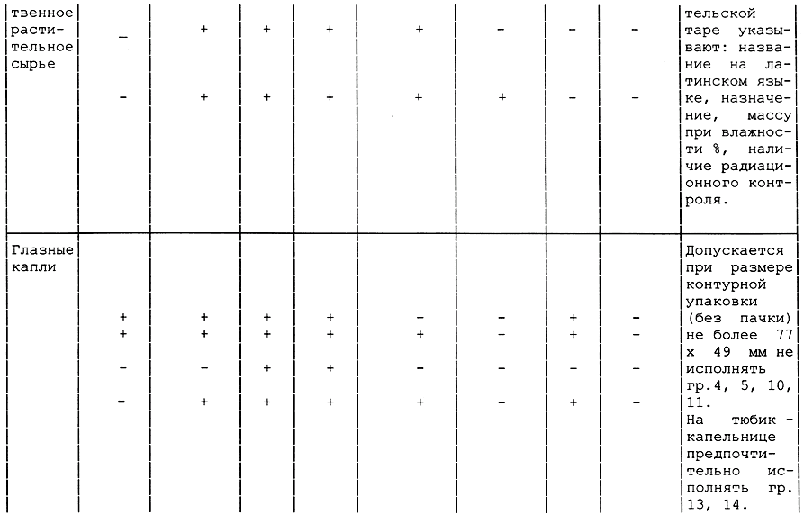
Таблица А.1 - Требования к содержанию текстов графического оформления упаковки лекарственных средств
(в ред. письма Минздрава РФ от 20.03.2000 N 293-22/47)
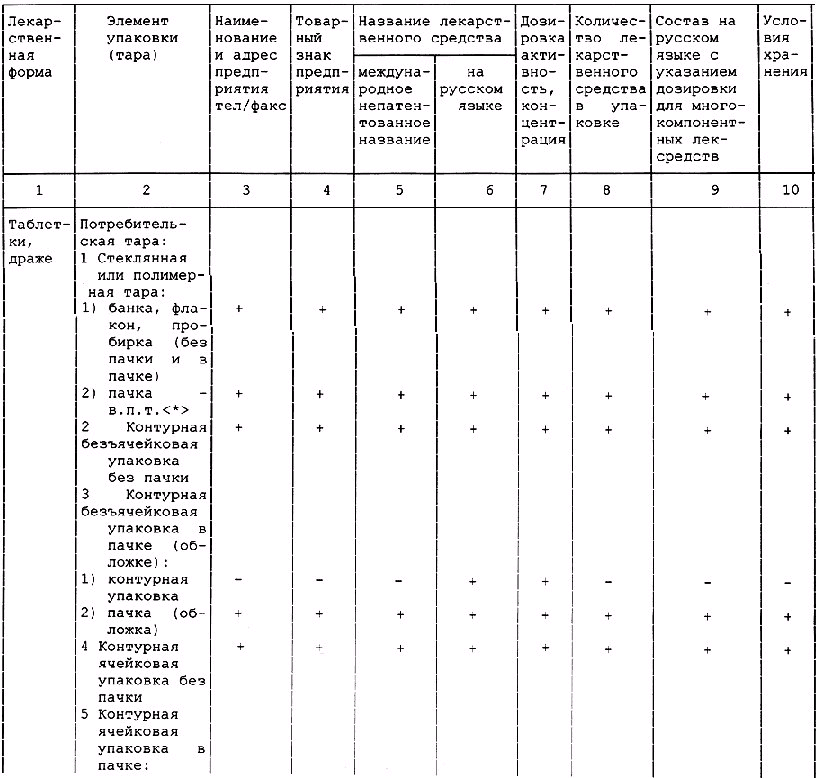

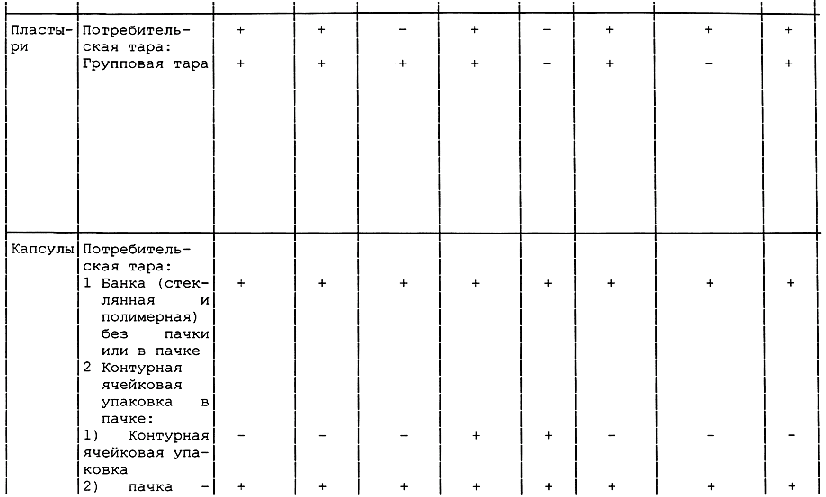
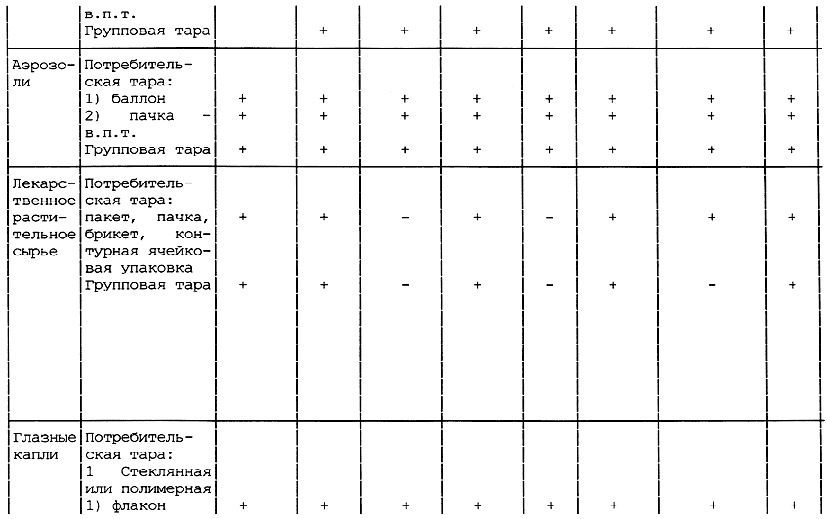
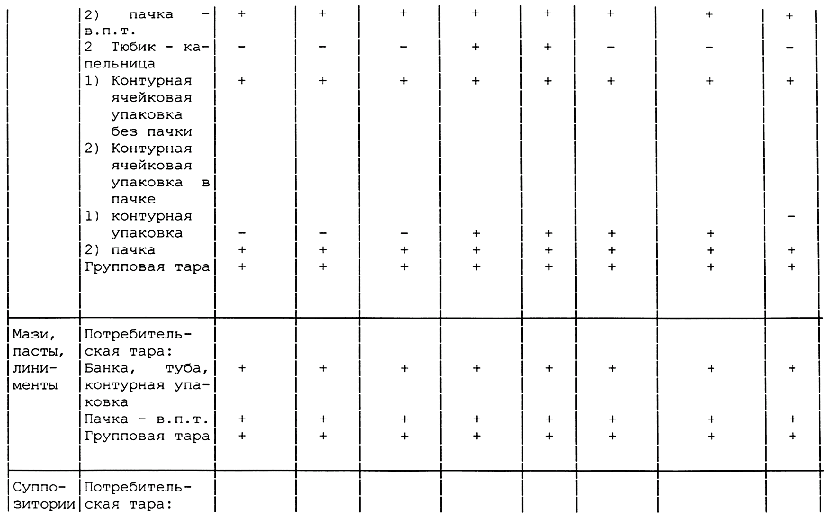




________________
<*> в.п.т. - вторичная потребительская тара. Применение тары без в.п.т. по разрешению МЗ России.
Примечания:
1 Знак "+" обозначает наличие данного текста на таре; знак "-" обозначает отсутствие данного текста на таре.
2 Допускается вносить изменение в содержание текста при условии его соответствия требованиям нормативно-технического документа на конкретное лекарственное средство, а также с разрешения Минздрава России.
Приложение Б
(обязательное)
ПЕРЕЧЕНЬ
СПЕЦИАЛЬНЫХ ТРЕБОВАНИЙ К СОДЕРЖАНИЮ ТЕКСТОВ ГРАФИЧЕСКОГО
ОФОРМЛЕНИЯ УПАКОВОК ЛЕКАРСТВЕННЫХ СРЕДСТВ
(в ред. письма Минздрава РФ от 20.03.2000 N 293-22/47)
1. Все лекарственные средства, полученные из крови, плазмы крови, а также из органов тканей человека, имеют надпись: Антитела к вирусу иммунодефицита человека отсутствуют.
2. Лекарственные средства, зарегистрированные как гомеопатические, имеют надпись: Гомеопатическое.
3. Лекарственные средства, предназначенные для лечения животных, имеют надпись: Для ветеринарии.
4. Лекарственные средства, предназначенные для клинических исследований, имеют надпись: Для клинических исследований.
5. Лекарственные средства, предназначенные для лечения детей, имеют надпись: Для детей.
6. Лекарственные средства, полученные на основе генетически модифицированных источников, имеют надписи:
- генетически модифицированные;
- на основе генетически модифицированных источников;
- содержащие компоненты, полученные из генетически модифицированных источников.
(п.6 введен письмом Минздрава РФ от 20.03.2000 N 293-22/47)
Приложение В
(справочное)
СПОСОБЫ НАНЕСЕНИЯ ПЕРЕМЕННЫХ ИНФОРМАЦИОННЫХ ДАННЫХ
(дата изготовления, годен до, номер серии)
|
Способ нанесения маркировки |
Виды маркируемых упаковок (тары) |
Характеристика |
|
Печать с резиновых форм |
Пачки и коробки картонные. Этикетки бумажные. Контурные безъячейковые упаковки |
Традиционная, применяемая в химфармпроизводстве |
|
Шелкотрафаретная печать |
Тара стеклянная, пластмассовая, металлическая |
Традиционная, применяемая в промышленности |
|
Тиснение |
Тубы металлические. Контурные ячейковые упаковки. Пачки картонные. Крышки полиэтиленовые |
Традиционная, применяемая в промышленности |
|
Струйная - лазерная печать <*> |
Упаковки из любых материалов и любой конструкции |
Надежная, бесконтактная, скоростная маркировка. |
|
Электрокаплеструйная печать <**> |
Упаковки из любых материалов и любой конструкции |
Возможность встроить маркиратор в любую технологическую линию. Нанесение маркировки в любой плоскости упаковки (тары). Возможность многоцветной печати. |

 Турбо из «Слова пацана» раскрыл правду о личной жизни
Турбо из «Слова пацана» раскрыл правду о личной жизни  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов