- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ОБНАРУЖЕНИЕ И ИДЕНТИФИКАЦИЯ PSEUDOMONAS AERUGINOSA
В ОБЪЕКТАХ ОКРУЖАЮЩЕЙ СРЕДЫ (ПИЩЕВЫХ ПРОДУКТАХ,
ВОДЕ, СТОЧНЫХ ЖИДКОСТЯХ)
Методические рекомендации разработаны сотрудниками Московского ордена Трудового Красного Знамени научно-исследовательского института гигиены им. Ф.Ф.Эрисмана (Г.П.Калина, Г.М.Трухина, Н.Б.Комзолова, Т.И.Графова).
Ответственный редактор - академик АМН СССР А.П.Шицкова.
Рассмотрены Лабораторным советом при Главном санитарно-эпидемиологическом управлении Минздрава СССР и рекомендованы к утверждению для внедрения в практику лабораторий НИИ и для использования по показаниям в бактериологических лабораториях республиканских, краевых, областных санэпидстанций.
УТВЕРЖДЕНЫ Начальником Главного управления карантинных инфекций Минздрава СССР В.П.Сергиевым 24 мая 1984 г.
Введение
В последние годы возрастает значение Ps. aeruginosa в патологии человека. Обнаружение Ps. aeruginosa в объектах окружающей среды сигнализирует одновременно об эпидемическом (как патоген) и санитарном (как индикатор биологического загрязнения) неблагополучии. Известны острые кишечные инфекции псевдомонадной этиологии водного происхождения и различные формы заболеваний (отиты, поражения кожного покрова) у купающихся в бассейнах, септические заболевания грудных детей с летальным исходом в результате купания в питьевой воде централизованного водоснабжения, содержавшей Ps. aeruginosa.
Описаны вспышки пищевых токсикоинфекций псевдомонадной этиологии и обнаружение Ps. aeruginosa в пищевых продуктах, особенно богатых белками (мясо, рыба), что характеризует последние как возможный источник пищевой токсикоинфекции. Острые кишечные инфекции псевдомонадной этиологии клинически протекают в виде диаррей той или иной тяжести, особенно тяжело у детей, пожилых людей и больных хроническими заболеваниями, а при пищевых токсикоинфекциях - со всеми признаками этиопатогенеза этого типа заболеваний.
В то же время, в природе существует до 200 видов псевдомонад - сапрофитов или фитопаразитов, не представляющих медицинский или санитарный интерес, и широкое применение простых надежных способов отличия Ps. aeruginosa от этих видов приобретает большое практическое значение.
Настоящие методические рекомендации предназначены для использования в практике бактериологических лабораторий гигиенического и эпидемиологического профиля и распространяются на объекты окружающей среды - пищевые продукты, воду централизованного снабжения и водоемов, используемых в качестве источников централизованного, хозяйственно-питьевого водоснабжения или для рекреационных целей (плавательные бассейны, бани, прибрежные воды курортных мест, минеральные воды, используемые для питья и лечебных процедур, смывы с посуды, инвентаря и рук персонала общественного питания).
Методические рекомендации не распространяются на патологический материал при внутрибольничных инфекциях и на предметы окружения больных, воздух больничных помещений, лекарственные средства, методы исследования которых на Ps. aeruginosa существенно отличаются от методов, применяемых при исследованиях окружающей среды. Разница методических приемов определяется:
а) необходимостью при исследованиях окружающей среды использовать преимущественно предварительное накопление Ps. aeruginosa в самом исследуемом материале или среде накопления, в то время, как при исследованиях патологического материала и предметов окружения больных применяют, как правило, непосредственный посев на плотные селективно-дифференциальные среды;
б) малой результативностью сред, эффективность которых доказана при исследованиях патологического материала, при использовании применительно к объектам окружающей среды;
в) различиями Ps. aeruginosa, обнаруживаемых в объектах окружающей среды, от выделяемых из патологического материала и окружения больных, по большей стабильности культуральных, биологических и биохимических свойств, меньшей частоте утраты пигмента феназина (смеси пигментов цианина, рубрина, меланина), в результате чего идентификация штаммов Ps. aeruginosa, выделяемых из объектов окружающей среды, значительно упрощается.
Предлагаемая схема исследования и идентификации Ps. aeruginosa применительно к объектам окружающей среды впервые разработана в СССР, а за рубежом имеются лишь отдельные рекомендации или стандартные методы исследования отдельных объектов - воды, пищевых продуктов, почвы, без объединения в общую универсальную сводку методических приемов.
1. Лабораторное оборудование, реактивы, материалы
1.1. Лабораторное оборудование
1.1.1. Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры. ГОСТ 25336-82 (СТ СЭВ 2945-81).
1.1.2. Проволока из никелевого и медноникелевых сплавов для удлиняющих проводов к термоэлектрическим преобразователям. ГОСТ 1791-67.
1.2. Основы питательных сред.
1.2.1. Агар микробиологический. ГОСТ 17206-71*.
_______________
* На территории Российской Федерации действует ГОСТ 17206-96. - Примечание изготовителя базы данных.
1.2.2. Дрожжи хлебопекарные прессованные. ГОСТ 171-81.
1.2.3. Молоко коровье пастеризованное. ГОСТ 13277-79*.
_______________
* На территории Российской Федерации действует ГОСТ Р 52090-2003. - Примечание изготовителя базы данных.
1.2.4. Пептон сухой ферментативный для бактериологических целей. ГОСТ 13805-76.
1.3. Реактивы.
1.3.1. Альфа нафтол. ГОСТ 5838-79.
1.3.2. Диметил-пара-фенилондиамин. ТУ 6-09-18-28-72.
1.3.3. Калия гидроокись. ГОСТ 24363-80.
1.3.4. Карбонат кальция. ГОСТ 4530-76.
1.3.5. Калий азотнокислый. ГОСТ 4144-79.
1.3.6. Калий сернокислый. ГОСТ 4145-74.
1.3.7. Магний сернокислый 7-водный. ГОСТ 4523-77.
1.3.8. 2-, 3-, 5-трифенилтетразол хлористый. ТУ 6-09-3838-74.
1.3.9. Калий фосфорнокислый двузамещенный 3-водный. ГОСТ 2493-75.
1.3.10. Натрий-аммоний фосфорнокислый двузамещенный 4-водный. ТУ 4170-78.
1.3.11. Магний хлористый, 6-водный. ГОСТ 4209-77.
1.3.12. Натрий хлористый. ГОСТ 4233-77.
1.3.13. * -аргинин гидрохлорид. ТУ 6-09-2100-72.
________________
* Соответствует оригиналу. - Примечание изготовителя базы данных.
1.3.14. Натрий лимоннокислый трехзамещенный. ГОСТ 22280-76.
1.4. Углеводы и спирты.
1.4.1. Глицерин. ГОСТ 6824-76.
_______________
* На территории Российской Федерации действует ГОСТ 6824-96. - Примечание изготовителя базы данных.
1.4.2. Д-глюкоза. ГОСТ 6038-79.
1.4.3. Ксилоза. ТУ 6-09-20-45-77.
1.4.4. Мальтоза. ВТУ 257-59.
1.5. Красители, индикаторы.
1.5.1. Бромтимоловый синий. ТУ 6-09-2045-77.
1.5.2. Кристаллический фиолетовый. ТУ 6-09-4119-75.
1.5.3. Феноловый красный. ГОСТ 4599-73.
2. Питательные среды
2.1. Питательные среды обогащения первого этапа. Различны в зависимости от исследуемого объекта, их выбор определяется уровнем и составом усвояемых компонентов в исследуемом объекте.
2.1.2. Минеральная среда Бонде (модификация). Трехзамещенного цитрата натрия 0,28 г, фосфата натрий-аммония 0,15 г, однозамещенного фосфата калия 0,1 г, сульфата магния 0,02 г, дист. воды до 100,0 мл. Стерилизация при 1 атм. 20 мин. Непосредственно перед посевом прибавить 2,0 мл 0,01% водного р-ра кристаллического фиолетового.
2.1.2. Концентрат среды Бонде. Все компоненты, кроме воды в 10-кратном размере. Концентрат прибавлять к объекту в соотношении 1:10.
2.1.3. Среда с хлоридом трифенилтетразола (ТТХ): пептона 2,0 г, дрожжевого экстракта по Г.Г.Калине* 15 мл (или сухого 0,3 г, двузамещенного фосфата калия 0,2 г, ТТХ 0,8 г, воды дист. до 100,0 мл. Стерилизация при 0,5 атм. 15 мин, рН 7,1.
2.1.4. Дрожжевой экстракт жидкий по Г.Г.Калине*.
________________
* Методические указания по санитарно-микробиологическому анализу воды поверхностных водоемов. МЗ СССР, М., 1981 г.
2.1.5. 8% водный раствор ТТХ в дистиллированной воде. В жидкие объекты прибавляют в соотношении 1:10.
2.2. Селективно-дифференциальная среда (СДС) второго этапа.
2.2.1. Среда "Блеск". Мясопептонного стерильного 2% агара 100,0 мл, молока нормализованного 10,0 мл, 10% водного раствора трифенилтетразола хлорида 8,0 мл, L-аргинина гидрохлорида 0,3 г, в расплавленный мясопептонный агар прибавить аргинин, р-р трифенилтетразол хлорида (самостерилизуется после хранения при комнатной температуре 2-3 дня) и стерильное снятое молоко размешать, разлить в 6-7 чашек.
2.2.2. При отсутствии мясопептонного агара возможно применение упрощенного варианта среды "блеск": к 100,0 мл дистиллированной воды прибавить питательный сухой агар Дагестанского НИИ питательных сред, после стерилизации при 0,5 атм., 15 мин, внести 10,0 мл стерильного снятого молока и 8,0 мл 10% водного р-ра трифенилтетразола хлорида, смешать, разлить в 6-7 чашек. Следует учесть, что такая упрощенная среда несколько теряет в интенсивности образования блеска (вместо сплошного золотистого налета колонии содержат мелкие золотистые вкрапления или ободок по периметру колонии).
2.3. Среды и тесты идентификации.
2.3.1. Среда Кинг-А. Пептон 2,0 г, агар 1,5 г, глицерин - 1,0 г, сульфат калия 1,0 г, хлорид магния 0,14 г, вода дистиллированная до 100,0 мл рН 7,2. Стерилизация при 0,5 атм. 15 мин, разлить в 6 чашек.
2.3.3. Среда для определения оксидации мальтозы. Пептон 0,2 г, хлорид натрия 0,5 г, мальтоза 2,0 г, 1,6% спиртовой или щелочной раствор бромтимолового синего 1,0 мл, вода дистиллированная до 100,0 мл рН 7,2. Стерилизация при 0,5 атм. 15 мин, разлить в 6 чашек.
2.3.4. Среда для определения теста Хью и Лейфсона (оксидация, ферментация). Модификация в одной пробирке. Пептон 2,0 г, хлорид натрия 5,0 г, глюкоза 5,0 г, K![]() HPO
HPO![]() 0,3 г, агар - 4,0-6,0 г, 1,6% р-р фенолового красного 2,5 мл, вода 1000,0 мл. После растворения в водяной бане или автоклаве разлить в пробирки ровно высотой столбика 6 см (независимо от диаметра пробирки), стерилизовать при 0,5 атм. 15 мин, застудить столбиком.
0,3 г, агар - 4,0-6,0 г, 1,6% р-р фенолового красного 2,5 мл, вода 1000,0 мл. После растворения в водяной бане или автоклаве разлить в пробирки ровно высотой столбика 6 см (независимо от диаметра пробирки), стерилизовать при 0,5 атм. 15 мин, застудить столбиком.
2.3.5. Среда для определения нитрат-нитритредуктазы и роста при 42 °С. Пептон 2,0 г, хлорид натрия 0,5 г, нитрат калия 0,2 г, агар 0,1 г, дрожжевой экстракт жидкий 20,0 мл, вода 80,0 мл (дрожжевой экстракт и вода могут быть заменены мясопептонным бульоном, в этом случае содержание пептона уменьшить до 1,0 г). После растворения компонентов в водяной бане разлить в пробирки по 4-5 мл, стерилизовать при 0,5 атм. 15 мин, застудить столбиком.
2.3.6. Реакция цитохромоксидазы по Гэби и Хедли. В СССР принят метод определения цитохромоксидазы с использованием диметилпарафенилендиамина (пара-аминодиме.....*аланина хлорида или оксалата), который в сочетании с альфанафтолом образует за счет оксидации цитохрома индофеноловый синий. 1% водный раствор реактива смешать с 1% спиртовым раствором альфа-нафтола в пропорции 2:1 непосредственно перед применением. Хранение обоих реактивов обязательно раздельно в холодильнике. Смесь реактивов наносят петлей (платиновой или нихромной, но не железной) на периферический участок макроколонии на среде Кинг-А или на изолированную колонию на среде "блеск". Пигментированные колонии на среде Кинг-А и покрытые золотистым налетом на среде "блеск" предпочтительно наносить на фильтровальную бумагу, смоченную смесью реактивов. Положительный результат - посинение колонии или мазка на фильтровальной бумаге в течение 20-40 секунд. Позднюю реакцию, как и посинение агаровой среды, не учитывать.
________________
* Брак оригинала. - Примечание изготовителя базы данных.
2.3.7. Тест Грегерсена. Простой, быстрый способ, заменяющий окраску по Граму и не требующий оптики. В капле 3% водного р-ра KОН на предметном стекле эмульгируют бактерийную массу, взятую с плотной среды. После нескольких секунд перемешивания петлей взвесь ослизняется и за петлей тянутся слизистые нити, что указывает на принадлежность испытуемой культуры или колонии к грам-отрицательному виду. У грам-положительных микробов, за редкими исключениями, реакция отрицательна.
3. Отбор проб
3.1. Вода питьевая.
3.1.1. Пробы воды поверхностных водоемов (водохранилищ, проточной речной, прудовой, озерной, плавательных бассейнов, рекреационных биотопов) отбирают в количестве 500,0 мл.*
3.1.2. Пробы воды централизованного водоснабжения (водопроводной) после очистки и хлорирования отбирают в количестве 1000,0 мл* со следующими изменениями и дополнениями в соответствии со спецификой:
а) воду из крана отбирают двукратно, сразу после открывания крана и после спуска воды в течение 10-15 мин; б) к исследуемой воде дехлоратор не прибавляют.
________________
* ГОСТ 18963-73 "Методы санитарно-бактериологического анализа".
3.1.3. Пробы грунтовой и артезианской воды отбирают в количестве 500,0 мл, руководствуясь в основном п.3.1.2.
3.1.4. Воду каптажную минеральную отбирают согласно п.3.1.3.
3.1.5. Воду индивидуального пользования (из графинов, бачков, цистерн) отбирают в количестве всего содержимого небольших емкостей, но не более 500,0 мл.
3.1.6. Воду минеральную расфасованную из торговой сети отбирают в количестве не менее трех емкостей одновременно.
3.2. Сточные жидкости.
3.2.1. Сточные жидкости нативные (до очистки и обеззараживания) отбирают в утренние часы (от 7 до 9) в количестве 10-20 мл.
3.2.2. Сточные жидкости после биологической очистки отбирают в количестве не более 50,0 мл во второй половине дня.
3.2.3. Сточные жидкости после обеззараживания отбирают в количестве 100,0 мл.
3.3. Смывы с оборудования, посуды, рук персонала предприятий общественного питания.
3.3.1. Пробы отбирают в соответствии с инструкцией* тампонами, смоченными средой с ТТХ (п.2.1.3), после чего тампон погружают в пробирки с 10,0 мл среды.
________________
* "О порядке расследования учета и проведения лабораторных исследований в учреждениях санитарно-эпидемиологической службы при пищевых отравлениях", МЗ СССР, 1975 г.
3.3.2. Отбор проб производят до начала работы предприятий и после обеденного перерыва, но не ранее, чем через 4-5 часов после первого отбора.
3.4. Пищевые продукты.
3.4.1. Продукты, богатые животными белками, жидкие (молоко пастеризованное в пакетах и фляжное, из торговой сети) отбирают в количестве трех пакетов или из трех емкостей (фляг) по 150 мл.
3.4.2. Продукты, богатые животными белками, плотные (мясо, рыба, мясные и рыбные полуфабрикаты, кулинарные изделия) отбирают из разных участков объекта в количестве не менее 10, общим весом 50,0 г, готовят 10% взвесь в физиологическом растворе хлорида натрия, с последующим отстаиванием в течение 30-60 мин и декантированием отстоя.
3.4.3. Детские питательные смеси отбирают соответственно методическим указаниям*.
________________
* "По микробиологическому контролю детских сухих молочных смесей и их компонентов N 2692-83".
3.4.4. Продукты растительные (овощные), винегреты, полуфабрикаты, не подвергаемые термической обработке, а также смешанные, полужидкие и жидкие (майонезы, соусы, соки и т.п.) отбирают в количестве 250 мл.
4. Ход исследования
4.1. Исследование объектов окружающей среды на Ps. aeruginosa состоит из трех этапов: I. Накопление Ps. aeruginosa в жидкой среде обогащения, II. Выделение Ps. aeruginosa на плотной селективно-дифференциальной среде, III. Идентификация Ps. aeruginosa с использованием ограниченного набора наиболее надежных тестов.
4.1.1. Схема исследования феназин-положительных Ps. aeruginosa
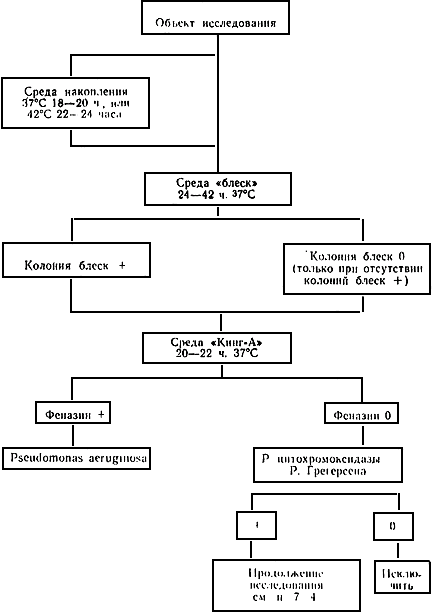
4.2. В отдельных случаях, при заранее предполагаемой обильной обсемененности объекта Ps. aeruginosa, посев объекта осуществляется непосредственно на среду "блеск", минуя среду обогащения.
4.3. Исследования на Ps. aeruginosa может быть качественным и количественным.
4.3.1. Качественное исследование является сигнальным и применяется при исследовании объектов, в которых обнаружение Ps. aeruginosa имеет существенное эпидемиологическое значение или гигиеническое: пищевых продуктов детского питания (питательных смесей), минеральных вод и напитков в расфасовке в торговой сети, соусов, прованса.....*, майонезов, винегретов, высокопитательных пищевых продуктов, употребляемых без термической обработки (пастеризованного молока, овощных блюд, продуктов, в которых при нарушении правил хранения и сроков использования можно предполагать интенсивное размножение Ps. aeruginosa) мясных полуфабрикатов, термическая обработка которых может быть недостаточной для уничтожения Ps. aeruginosa, смывов с оборудования, посуды, рук обслуживающего персонала предприятий общественного питания, столовых, буфетов, кафе, ресторанов и др., а также при необходимости возможно быстрого проведения анализа при угрожающей эпидобстановке.
________________
* Брак оригинала. - Примечание изготовителя базы данных.
4.3.2. Количественное определение является основным при исследовании объектов окружающей среды, в которых степень обсемененности Ps. aeruginosa, как и индекс фекальных кишечных палочек и сальмонелл, характеризует санитарное состояние объекта и уровень его эпидемический опасности: воды источников водоснабжения, питьевой воды централизованного водоснабжения, рекреационных вод - прибрежных пляжных акваторий, плавательных бассейнов и т.п., пищевых продуктов, подлежащих термической обработке, в которых высокий уровень обсемененности Ps. aeruginosa может повлечь при нарушениях условий хранения нежелательные органолептические изменения, а также продукцию токсаминов за счет декарбоксилирования и дезаминирования аминокислот продукта; сточных жидкостей при оценке качества биологической очистки и обеззараживания.
4.4. В зависимости от вида и химического состава продукта ход первого этапа исследования может быть различным как по отбору и объему проб, так и по выбору сред обогащения. Последующие этапы однотипны по применению СДС и тестов идентификации независимо от исследуемого объекта.
5. Первый этап исследования
5.1. Для объектов, бедных питательными ресурсами (воды различных категорий) обеспечивают развитие Ps.аеruginosa при исключении или затруднении развития грам-положительной и дистрофной грам-отрицательной микрофлоры, применяя концентрат среды Бонде с кристаллическим фиолетовым.
5.2. В объектах, в которых наличие питательных веществ сочетается с богатым набором сопутствующей микрофлоры, конкурирующей с Ps. aeruginosa (сточные жидкости), посев производят в среду с ТТХ и ингибирующим красителем, температура инкубации 42 °С для сточных жидкостей.
5.3. В объектах, обеспечивающих Ps. aeruginosa полноценным питанием (пищевые продукты, кроме соков и напитков), основным является торможение развития сопутствующей микрофлоры, для чего достаточно введения в исследуемый объект или его взвесь трифенилтетразолий хлорида.
5.4. Объемы исследуемых объектов и применяемые среды:
|
Объекты* |
Объемы при исследовании |
Среда |
Инкубация | ||
|
качественном |
количественном |
Т° |
длительность | ||
|
1. |
- |
летом: 2х100,0; 2х10,0; 2x1,0 |
концентрат среды Бонде |
37° |
20 ч |
|
осенью, зимой, весной: 5х100,0 |
42 ч | ||||
|
2. |
500,0 |
4х100,0; 5х20,0 |
то же |
то же | |
|
3. |
- |
4х100,0; 5х20,0 |
то же |
то же | |
|
4. |
500,0 |
- |
концентрат среды Бонде |
42° |
20 ч |
|
5. |
3х500,0 |
- |
то же |
37° |
42 ч |
|
6. |
- |
2х0,1; 2х0,01; 2х0,001; 2х0,0001 |
среда с ТТХ |
42° |
24 ч |
|
7. |
- |
2х10,0; 2х1,0; 2х0,1; 2х0,01 |
то же |
42° |
24 ч |
|
8. |
100,0 |
- |
то же, удвоен. концен. |
37° |
24 ч |
|
9. |
100,0 |
2х100; 2х10,0; 2х1,0 |
8% р-р ТТХ |
37° |
24 ч |
|
10. |
100,0 и 10,0 взвеси цельной |
2х100,0; 2х10,0; 2х1,0 декантированной взвеси |
то же |
37° |
то же |
|
11. |
100,0 |
- |
то же |
37° |
то же |
|
12. |
100,0 |
2х100,0; 2х10,0; 2х1,0; 2х0,1 декантированной взвеси |
то же |
37° |
то же |
|
13. |
100,0 |
2х100; 2х10,0; 2х1,0 |
среда с ТТХ |
37° |
то же |
________________
1) Посев 1,0 мл и последующих разведений производится в 10,0 мл неконцентрированной среды Бонде (п.2.1.2.)
* Объекты: 1. Вода поверхностных водоемов, 2 - вода централизованного водоснабжения и плавательных бассейнов, 3 - вода грунтовая, артезианская и минеральная каптажная, 4 - вода индивидуального пользования, 5 - вода минеральная из торговой сети (3 объема одновременно), 6 - сточная жидкость нативная 7 - суточная жидкость после биологической очистки, 8 - сточная жидкость после обеззараживания, 9 - пищевые продукты жидкие, богатые животными белками, 10 - то же, плотные (10% взвесь), 11 - детские питательные смеси, 12 - растительные и смешанные продукты, полуфабрикаты, винегреты, плотные (10% взвеси), 13 - то же жидкие (соки, напитки, соусы).
6. Второй этап исследования
6.1. Второй этап исследования унифицирован вне зависимости от исследуемого объекта.
6.2. Из среды обогащения производят высев на среду "блеск". Для высевов из больших объемов объекта для каждого объема используют одну чашку со средой, для высевов из меньших объемов можно посев производить на ![]() чашки, что особенно удобно при количественных исследованиях в двух рядах (по два одинаковых объема на чашку).
чашки, что особенно удобно при количественных исследованиях в двух рядах (по два одинаковых объема на чашку).
6.3. Высевы следует производить с расчетом получения максимального количества изолированных колоний: минимальное количество посевного материала, захватываемого разогнутой или тщательно стряхнутой петлей, распределяют первоначально в виде макроколонии 1х4 см у борта чашки, затем наносят остаток материала частыми многочисленными штрихами по поверхности среды.
6.4. Засеянную среду помещают в термостат при 37 °С на 24-42 часа, с предварительным просмотром через 24 часа.
6.5. Металлический блеск колоний Ps. aeruginosa - явление уникальное, обнаруживаемое, как правило, только у этого микроба, но не у других видов псевдомонад. При принятой концентрации ТТХ среда бактерицидна для всех грам-положительных и большинства грам-отрицательных бактерий и лишь некоторые ТТХ-резистентные штаммы клебсиелл, серратий, энтеробактерий могут развиваться на среде "блеск" в виде темно-красных разного размера, лишенных блеска, или выпуклых блестящих ярко-красных колоний. Колонии Ps. aeruginosa либо сплошь покрыты золотистым налетом, либо содержат многочисленные вкрапления, иногда окружены светло-красным ободком или бесцветным "венчиком". Часто колонии Ps. aeruginosa принимают веретенообразную форму, как бы распространяясь по вдавлению в агаре от штриха петлей. Появление блеска можно наблюдать уже через 20-22 часа инкубации при 37 °С, но максимального развития феномен достигает через 42-44 часа. Даже при отсутствии блеска колонии Ps. aeruginosa на этой среде можно различить по более светло-красной окраске и характерной (см. выше) форме.
6.6. При наличии множественного роста колоний с золотистым блеском достаточно отобрать для последующего исследования 1-2 наиболее типичных колонии. При росте единичных колоний с блеском или с золотистыми вкраплениями следует отбирать все типичные колонии, но не более 5-6. Только при отсутствии колоний с металлическим блеском или вкраплениями отбирают наиболее типичные по форме и цвету (плоские шероховатые, с неровными краями, веретенообразные, светло-красные) колонии.
6.7. При предположении массивного обсеменения объекта Ps. aeruginosa (сточные жидкости, белковые пищевые продукты после просроченного срока годности и органолептически недоброкачественные) исследование может быть начато непосредственно со второго этапа, т.е. с посева исследуемого объекта на среду "блеск" как при качественном, так и при количественном исследовании. При последнем материал распределяется шпателем по поверхности среды.
7. Третий этап исследования
7.1. Отобранные на среде "блеск" наиболее типичные колонии с золотистым блеском, или при отсутствии таковых, колонии с золотистыми вкраплениями, а при отсутствии последних - характерные по форме и цвету колонии без блеска, отсевают макроколониями (бляшками) на среду Кинг-А в чашке (можно поместить на одной чашке от 12-18 до 24 макроколоний), которую помещают на 22-24 часа при 37 °С.
7.2. После инкубации при 37 °С в течение 22-24 часов и, особенно после дополнительного хранения чашки при комнатной температуре 18-20 часов, макроколонии Ps. aeruginosa, как правило, имеют характерную уплощенную, шероховатую форму с неровными краями и кружевным венчиком в результате ограниченного роения, реже - гладкую с ровными краями. Образующийся феназин, результат сочетания цианина, рубрина и меланина, имеет, в зависимости от преобладания того или иного пигмента, буроватый оттенок с вариантами от сине-зеленого до коричнево-красного, диффундирует в агар.
7.3. При наличии продуцирующий феназин колонии характерной формы исследование можно считать законченным с положительным результатом. При наличии феназин-положительной колонии не типичной формы, но дававшей на среде "блеск" золотистый налет, также определяется наличие Рs.aeruginosa.
7.4. При наличии атипичных колоний, феназин-отрицательных, не дававших на среде "блеск" золотистый блеск, исследование проводится дальше: определяются реакции цитохромоксидазы и Грегерсона, при положительном результате той и другой исследования ведут по схеме:
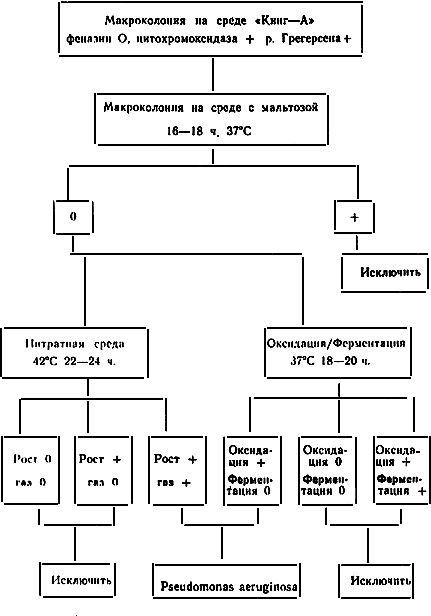
7.5. Посев на среду с мальтозой макроколониями (бляшками) в количестве до 12-18 на чашке. После инкубации при 37 °C 16-18 ч определяется результат: цвет не изменен - реакция отрицательна, пожелтение макроколонии и подлежащей среды - реакция положительна.
7.6. Мальтоза - отрицательные колонии засевают одновременно в нитратную среду с уколом до дна пробирки иглой не короче 6 см в среду ![]() , (оксидация-ферментация).
, (оксидация-ферментация).
7.7. В нитратной среде после инкубации при 42 °С Ps. aeruginosa развивается в толще всей среды и продуцирует обильное количество свободного азота в виде пены на поверхности среды и иногда - пузырьков газа в толще среды.
7.8. В среде ![]() после инкубации 16-18 часов при 37 °С для Ps. aeruginosa характерны положительная оксидация (пожелтение верхней части среды) и оранжевое окрашивание нижних
после инкубации 16-18 часов при 37 °С для Ps. aeruginosa характерны положительная оксидация (пожелтение верхней части среды) и оранжевое окрашивание нижних ![]() столбика. Положительные оксидация и ферментация - пожелтение всего столбика, отрицательные оксидация и ферментация - малиновая окраска верхней части столбика и оранжевая нижних
столбика. Положительные оксидация и ферментация - пожелтение всего столбика, отрицательные оксидация и ферментация - малиновая окраска верхней части столбика и оранжевая нижних ![]() .
.
8. Условные критерии качества
8.1. Для Ps. aeruginosa отсутствуют общепринятые нормативные документы. Приводимые ниже величины позволяют наметить лишь ориентировочные параметры, основанные на:
а) многочисленных, хотя и разрозненных данных зарубежных источников,
б) материалах Московского НИИ гигиены им. Эрисмана и некоторых других научных и практических лабораторий СССР.
8.2. Нормирование Ps. aeruginosa осложняется их двойственной ролью как индикаторных и патогенных микроорганизмов, что требует раздельного подхода к параметрам как с санитарной, так и с эпидемиологической позиций. В зависимости от объекта, в одних случаях Ps. aeruginosa должен рассматриваться как индикатор, в других - как патоген.
8.3. Предлагаемые параметры являются критериями определения качества объектов окружающей среды и основой для коллективной разработки нормативов содержания Ps. aeruginosa в этих объектах. Они могут быть также использованы как сигнальные для проведения мероприятий по выявлению причин, приведших к нарушению рекомендуемых параметров, и их устранения.
8.4. Ps. aeruginosa должны отсутствовать в:
8.4.1. Воде центрального водоснабжения в 1000,0 мл при обязательной дифференциации от других видов псевдомонад и от аэромонад (аспект эпидемиологический).
8.4.2. Воде индивидуального пользования (вода графинов, бачков, цистерн) - в 100,0 мл (аспект эпидемиологический).
8.4.3. Воде бассейнов - в 100,0 мл (аспект эпидемиологический).
8.4.4. Сточной жидкости после биологической очистки - в 10,0 мл, но не более 10% содержания в нативной сточной жидкости одновременного изъятия проб (аспект санитарный).
8.4.5. Сточной жидкости после обеззараживания - в 100,0 мл (аспект эпидемиологический и санитарный).
8.4.6. Молоке пастеризованном - в 100,0 мл (аспект эпидемиологический).
8.4.7. Детских питательных смесях - в 100,0 мл (аспект эпидемиологический).
8.4.8. Мясе, рыбе - в 10,0 мл 10% взвеси (аспект эпидемиологический).
8.4.9. Полуфабрикатах мясных, рыбных - в 1,0 мл взвеси (аспект эпидемиологический).
8.4.10. Растительных продуктах, полуфабрикатах, используемых без термической обработки - в 25,0 г (аспект эпидемиологический).
8.4.11. Напитках, соках, воде минеральной в расфасовках из торговой сети - в трех емкостях, взятых на выбор из серии, но не менее, чем в 100 мл (аспект эпидемиологический).
8.4.12. Свежемороженных растительных продуктах - в 25,0 г.
8.4.13. Смывах с рук, посуды, инвентаря предприятий общественного питания. Наличие Ps. aeruginosa свидетельствует об антисанитарной обстановке адекватно проценту положительных проб.
8.5. Количественный учет Ps. aeruginosa имеет значение в объектах окружающей среды, в которых этот микроорганизм имеет индикаторное значение и может играть решающую роль при различиях в индексах других показателей санитарной обстановки.
8.5.1. Вода поверхностных водоемов, водохранилищ, проточных водоемов, озер, прудов, прибрежных морских биотопов. В зависимости от уровня содержания в таких водах Ps. aeruginosa можно различать следующие градации:
8.5.1.1. В воде, санитарная характеристика которой соответствует ГОСТам 17.1.3.03.-77, 17.1.5.02-80, при содержании БГ КП от 500 до 10000 мк в 1000 мл, Ps. aeruginosa обнаруживается в среднем не более чем в 50% исследованных проб и уровень обсемененности составляет до 10 мк/л. Однако как и находки сальмонелл в такой воде, их обнаружение (при низком индексе других индикаторов) может иметь эпидемическое значение. Известны случаи обнаружения в такой воде при низком уровне БГ КП и энтерококков, Ps. aeruginosa и сальмонелл.
8.5.1.2. В воде, не соответствующей ГОСТам 17.1.3.03-77, 17.1.5.02-80 (содержание БГ КП выше 10000 мг в 1000 мл), Ps. aeruginosa обнаруживается в 100% исследованных проб и индекс составляет от 10 до 100 мк/л. В этих условиях обнаружение Ps. aeruginosa приобретает уже определенное эпидемическое значение, особенно при использовании такой воды в рекреационных целях.
8.5.1.3. При резком повышении уровня обсемененности воды общепринятыми индикаторами (БГ КП и энтерококки) утрачивается сопряженность между БГ КП, Ps. aeruginosa и энтерококком: увеличение индекса БГ КП может сопровождаться снижением индекса энтерококков и Ps. aeruginosa или только Ps. aeruginosa, при корреляционном сдвиге индекса энтерококков, а иногда все три индекса возрастают, причем взлет отдельных показателей может превосходить одновременный рост других индикаторных микроорганизмов. В условиях такого возрастания индексов наличие Ps. aeruginosa приобретает уже четко выраженное эпидемическое значение и известны биотопы, в которых обнаружение Ps. aeruginosa при такой общей высокой обсемененности совпадало с находками сальмонелл.
8.5.2. Вода грунтовая, артезианская, минеральная каптажная. Основные положения, изложенные в п.8.5.1. с подпунктами, приложимы и к подземным водам. Качественный учет должен сопровождаться тщательной идентификацией Ps. aeruginosa, т.к. в таких водах очень часто обнаруживаются псевдомонады других видов, не имеющие медицинского и санитарного значения. То же относится и к количественному учету, причем такие воды могут считаться благополучными при отсутствии Ps. aeruginosa в объеме не менее 1000 мл, т.е. при индексе 1,0 уже необходимо тщательное полное бактериологическое и химическое исследование воды.
9.1. Определение ![]() двухрядовым способом
двухрядовым способом
|
Определение индексов в 1000 мл |
Определение индексов в 1 мл | ||||||||
|
Положительных пробирок в мл |
В абсолютных числах |
в |
Положительных пробирок в мл |
В абсолютных числах |
в | ||||
|
10,0 |
1,0 |
0,1 |
0,1 |
0,01 |
0,001 |
||||
|
0 |
0 |
1 |
45 |
1,65 |
0 |
0 |
1 |
4,5 |
0,65 |
|
0 |
0 |
2 |
90 |
1,95 |
0 |
0 |
2 |
9,0 |
0,95 |
|
0 |
1 |
0 |
46 |
1,66 |
0 |
1 |
0 |
4,6 |
0,66 |
|
0 |
1 |
1 |
92 |
1,96 |
0 |
1 |
1 |
9,2 |
0,96 |
|
0 |
1 |
2 |
140 |
2,15 |
0 |
1 |
2 |
14,0 |
1,15 |
|
0 |
2 |
0 |
94 |
1,97 |
0 |
2 |
0 |
9,4 |
0,97 |
|
0 |
2 |
1 |
140 |
2,15 |
0 |
2 |
1 |
14,0 |
1,15 |
|
0 |
2 |
2 |
190 |
2,28 |
0 |
2 |
2 |
19,0 |
1,28 |
|
1 |
0 |
0 |
60 |
1,78 |
1 |
0 |
0 |
6,0 |
0,78 |
|
1 |
0 |
1 |
120 |
2,08 |
1 |
0 |
1 |
12,0 |
1,08 |
|
1 |
0 |
2 |
190 |
2,28 |
1 |
0 |
2 |
19,0 |
1,28 |
|
1 |
1 |
0 |
130 |
2,11 |
1 |
1 |
0 |
13,0 |
1,11 |
|
1 |
1 |
1 |
200 |
2,30 |
1 |
1 |
1 |
20,0 |
1,30 |
|
1 |
1 |
2 |
280 |
2,45 |
1 |
1 |
2 |
28,0 |
1,45 |
|
1 |
2 |
0 |
210 |
2,32 |
1 |
2 |
0 |
21,0 |
1,32 |
|
1 |
2 |
1 |
256 |
2,41 |
1 |
2 |
1 |
25,6 |
1,41 |
|
1 |
2 |
2 |
370 |
2,57 |
1 |
2 |
2 |
37,0 |
1,57 |
|
2 |
0 |
0 |
230 |
2,36 |
2 |
0 |
0 |
23,0 |
1,36 |
|
2 |
0 |
1 |
500 |
2,70 |
2 |
0 |
1 |
50,0 |
1,70 |
|
2 |
0 |
2 |
950 |
2,98 |
2 |
0 |
2 |
95,0 |
1,98 |
|
2 |
1 |
0 |
620 |
2,79 |
2 |
1 |
0 |
62,0 |
1,79 |
|
2 |
1 |
1 |
1300 |
3,11 |
2 |
1 |
1 |
130,0 |
2,11 |
|
2 |
1 |
2 |
2100 |
3,32 |
2 |
1 |
2 |
210,0 |
2,32 |
|
2 |
2 |
0 |
2400 |
3,38 |
2 |
2 |
0 |
240,0 |
2,38 |
|
2 |
2 |
1 |
7000 |
3,85 |
2 |
2 |
1 |
700,0 |
2,85 |
|
2 |
2 |
2 |
24000 |
4,38 |
2 |
2 |
2 |
2400,0 |
3,38 |
9.2. Таблица для расчета наиболее вероятного числа при исследовании 1000 мл воды
(5 флаконов по 220 мл)
|
Число положительных проб |
1 |
2 |
3 |
4 |
5 | |
|
|
2,2 |
5,1 |
9,2 |
16,0 |
33,4 | |
|
Доверительные границы |
нижняя |
0,1 |
0,3 |
0,8 |
1,7 |
3,6 |
|
верхняя |
6,3 |
8,6 |
14,7 |
26,5 |
| |
9.3. Таблица для расчета наиболее вероятного числа при исследовании 500 мл воды
(5 флаконов по 110 мл)
|
Число положительных проб |
1 |
2 |
3 |
4 |
5 | |
|
|
2,2 |
5,1 |
9,2 |
16,0 |
33,4 | |
|
Доверительные границы |
нижняя |
0,1 |
0,5 |
1,6 |
3,3 |
6,9 |
|
верхняя |
12,6 |
19,2 |
29,4 |
52,9 |
| |
9. 4. Таблица определения наиболее вероятного числа при исследовании в двух рядах
(9 флаконов по 100 мл и 10 пробирок по 10 мл или 4 флакона по 200 (100) мл
и 5 пробирок по 20 (10) мл)
|
Из 9 объемов по 100 мл положительны |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 | |
|
Из 10 объемов по 10 мл положительны |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 | |
|
НВЧ |
1,05 |
2,2 |
3,6 |
5,1 |
6,9 |
9,2 |
12,0 |
16,1 |
23,0 | |
|
Из 9 объемов по 100 мл положительны |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 | |
|
Из 10 объемов по 10 мл положительны |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 | |
|
НВЧ |
2,2 |
3,6 |
5,1 |
6,9 |
9,2 |
12,0 |
16,1 |
23,0 |
32,2 | |
|
Из 9 объемов по 100 мл положительны |
1-7 |
8-9 |
1-9 |
1-9 |
1-9 |
1-9 |
1-9 |
1-9 |
1-9 | |
|
Из 10 объемов по 10 мл положительны |
2 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
НВЧ |
23,0 |
33,4 |
36 |
51 |
69 |
92 |
120 |
161 |
230 |
322 |
|
Из 4 объемов по 100 (200) мл положительны |
1 |
2 |
3 |
4 |
1 |
2 |
3 |
4 |
| |
|
Из 5 объемов по 10 (20) мл положительны |
0 |
0 |
0 |
0 |
1 |
1 |
1 |
1 |
| |
|
НВЧ |
2,2 |
5,1 |
9,2 |
16,0 |
5,1 |
9,2 |
16,0 |
33,4 |
| |
|
Из 4 объемов по 100 (200) мл положительны |
1-4 |
1-4 |
1-4 |
1-4 |
| |||||
|
Из 5 объемов по 10 (20) мл положительны |
2 |
3 |
4 |
5 |
| |||||
|
НВЧ |
51 |
92 |
160 |
334 |
| |||||
ОТРЫВНОЙ ЛИСТ УЧЕТА ЭФФЕКТИВНОСТИ ИСПОЛЬЗОВАНИЯ МЕТОДОВ ПРОФИЛАКТИКИ,
ДИАГНОСТИКИ И ЛЕЧЕНИЯ
|
Направить в отдел научной организации и планирования | |||||||||
|
1. | |||||||||
|
(наименование методического документа) | |||||||||
|
| |||||||||
|
(кем и когда утвержден) | |||||||||
|
3. При выполнении каких видов работ использованы настоящие материалы | |||||||||
|
| |||||||||
|
| |||||||||
|
4. Кем использованы | |||||||||
|
(наименование учреждения, подразделения) | |||||||||
|
5. Результаты применения метода: | |||||||||
|
- положительные | |||||||||
|
(количество наблюдений) | |||||||||
|
- неопределенные | |||||||||
|
(количество наблюдений) | |||||||||
|
- отрицательные | |||||||||
|
(количество наблюдений) | |||||||||
|
Общее количество наблюдений | |||||||||
|
6. Сроки внедрения | |||||||||
|
7. Эффективность их внедрения в практику | |||||||||
|
| |||||||||
|
| |||||||||
|
8. Замечания и пожелания (текст) | |||||||||
|
Подпись | |||||||||
|
должность, ф., и., о. лица, заполнившего листок | |||||||||

 “В последний раз, когда при мне девочки разбирались, это очень плохо...
“В последний раз, когда при мне девочки разбирались, это очень плохо...  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов