ГОСТ 17.1.4.02-90
Группа Т32
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ВОДА
Методика спектрофотометрического определения хлорофилла ![]()
Water.
Spectrophotometric determination of chlorophyll ![]()
ОКСТУ 2209
Дата введения 1991-01-01
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Институтом океанологии АН СССР, соисполнитель - Гидрохимический институт Госкомгидромета СССР
РАЗРАБОТЧИКИ
М.Е.Виноградов, член-корр. АН СССР; Б.В.Коновалов, канд. биол. наук (руководители темы); В.А.Кимстач, д-р хим. наук; А.А.Назарова, канд. хим. наук; Т.О.Гончарова, канд. хим. наук
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по охране природы от 03.07.90 N 28
3. ВВЕДЕН ВПЕРВЫЕ
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначение НТД, на который дана ссылка |
Номер раздела, пункта |
|
ГОСТ 8.513-84 |
11 |
|
12 | |
|
12 | |
|
ГОСТ 17.1.5.04-81 |
2 |
|
5.10 | |
|
ГОСТ 2603-79 |
4.2 |
|
ГОСТ 3118-77 |
4.4 |
|
ГОСТ 3956-76 |
4.1 |
|
ГОСТ 4158-80 |
4.5 |
|
ГОСТ 6419-78 |
4.6 |
|
4.3 | |
|
ГОСТ 9147-80 |
5.4 |
|
5.9 | |
|
ИСО 5667-2-83 |
2 |
ВВЕДЕНИЕ
Хлорофилл ![]() - основной пигмент зеленых растений, в том числе одноклеточных водорослей (фитопланктона). Из нескольких десятков пигментов, содержащихся в фотосинтетическом аппарате водорослей, хлорофиллу
- основной пигмент зеленых растений, в том числе одноклеточных водорослей (фитопланктона). Из нескольких десятков пигментов, содержащихся в фотосинтетическом аппарате водорослей, хлорофиллу ![]() отведена важнейшая роль в процессе фотосинтеза. Информация о концентрации хлорофилла
отведена важнейшая роль в процессе фотосинтеза. Информация о концентрации хлорофилла ![]() и ее изменчивости в водном объекте служит критерием при оценке запасов биомассы фитопланктона и его продукции, а также индикатором загрязнения вод. Соотношение между концентрацией хлорофилла
и ее изменчивости в водном объекте служит критерием при оценке запасов биомассы фитопланктона и его продукции, а также индикатором загрязнения вод. Соотношение между концентрацией хлорофилла ![]() и продуктами его превращений, а также другими пигментами (хлорофилл
и продуктами его превращений, а также другими пигментами (хлорофилл ![]() , хлорофилл
, хлорофилл ![]() , каротиноиды) характеризует физиологическое состояние водорослей.
, каротиноиды) характеризует физиологическое состояние водорослей.
1. НАЗНАЧЕНИЕ И ОБЛАСТЬ РАСПРОСТРАНЕНИЯ
1.1. Методика регламентирует определение содержания хлорофилла ![]() фитопланктона в пробах вод морских и поверхностных суши. Допускается использовать данную методику для определения хлорофилла
фитопланктона в пробах вод морских и поверхностных суши. Допускается использовать данную методику для определения хлорофилла ![]() микрофитобентоса и микрофлоры льда. Результаты определений по данному стандарту могут быть использованы для калибровки непрямых методов оценки содержания хлорофилла
микрофитобентоса и микрофлоры льда. Результаты определений по данному стандарту могут быть использованы для калибровки непрямых методов оценки содержания хлорофилла ![]() , в том числе при космическом зондировании состояния водных объектов, а также при регистрации роста водорослей в биохимических экспериментах.
, в том числе при космическом зондировании состояния водных объектов, а также при регистрации роста водорослей в биохимических экспериментах.
1.2. Методика предназначена для органов государственного контроля за состоянием водных объектов, ведомственных научно-исследовательских экологических и промысловых работ.
1.3. Диапазон определяемых концентраций хлорофилла ![]() , для которого устанавливаются пределы допускаемой погрешности определений, выполняемых по данной методике, составляет от 0,05 мг·м
, для которого устанавливаются пределы допускаемой погрешности определений, выполняемых по данной методике, составляет от 0,05 мг·м![]() до любых максимальных значений, встречающихся в природных водах.
до любых максимальных значений, встречающихся в природных водах.
1.4. Основными компонентами, мешающими анализу, являются хлорофилл ![]() , хлорофилл
, хлорофилл ![]() , феофитин
, феофитин ![]() , феофорбид
, феофорбид ![]() и хлорофиллид
и хлорофиллид ![]() . Содержание хлорофилла
. Содержание хлорофилла ![]() , хлорофилла
, хлорофилла ![]() , суммарное содержание феофитина
, суммарное содержание феофитина ![]() и феофорбида
и феофорбида ![]() соизмеримо с содержанием хлорофилла
соизмеримо с содержанием хлорофилла ![]() , поэтому поправка на присутствие этих пигментов вносится при расчете концентрации хлорофилла
, поэтому поправка на присутствие этих пигментов вносится при расчете концентрации хлорофилла ![]() . Содержание хлорофиллида
. Содержание хлорофиллида ![]() обычно несоизмеримо мало по сравнению с содержанием хлорофилла
обычно несоизмеримо мало по сравнению с содержанием хлорофилла ![]() , поэтому поправка на его присутствие не вносится.
, поэтому поправка на его присутствие не вносится.
1.5. Определяемое вещество - хлорофилл ![]() - легко разрушается под воздействием света, при повышении температуры и в кислой среде, поэтому при проведении любых процедур, начиная с момента отбора пробы и до окончания спектрофотометрирования, следует обеспечить нахождение объекта анализа (пробы, фильтра с осадком или экстракта) в затемненном прохладном месте при отсутствии паров кислоты.
- легко разрушается под воздействием света, при повышении температуры и в кислой среде, поэтому при проведении любых процедур, начиная с момента отбора пробы и до окончания спектрофотометрирования, следует обеспечить нахождение объекта анализа (пробы, фильтра с осадком или экстракта) в затемненном прохладном месте при отсутствии паров кислоты.
1.6. Продолжительность анализа одной пробы от момента ее отбора до окончания спектрофотометрирования без учета времени хранения пробы, фильтра с осадком и экстракта не должна превышать 3 ч.
2. ССЫЛКИ НА СТАНДАРТЫ, СОВМЕСТНО
С КОТОРЫМИ ДОЛЖЕН ПРИМЕНЯТЬСЯ НАСТОЯЩИЙ СТАНДАРТ
ГОСТ 17.1.5.04 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия.
ИСО 5667-2 Качество воды. Отбор проб. Часть 2. Руководство по технике отбора проб.
3. СУЩНОСТЬ МЕТОДА
В основе метода - спектрофотометрирование экстракта пигментов до и после его подкисления раствором соляной кислоты. Расчеты концентрации хлорофилла ![]() основаны на известных удельных спектральных показателях поглощения света хлорофиллом
основаны на известных удельных спектральных показателях поглощения света хлорофиллом ![]() и основными компонентами, мешающими анализу.
и основными компонентами, мешающими анализу.
Для приготовления экстракта пробу воды фильтруют через мембранный фильтр с нанесенным на нем слоем углекислого бария или магния, осадок размельчают (гомогенизируют), пигменты экстрагируют водным ацетоном из гомогената и удаляют центрофугированием из экстракта светорассеивающую взвесь.
4. РЕАКТИВЫ И МАТЕРИАЛЫ
4.1. Силикагель по ГОСТ 3956.
4.2. Ацетон ч.д.а. по ГОСТ 2603.
4.3. Вода дистиллированная по ГОСТ 6709.
4.4. Кислота соляная х.ч. по ГОСТ 3118.
4.5. Барий углекислый ч.д.а. по ГОСТ 4158.
4.6. Магний углекислый основной ч.д.а. по ГОСТ 6419.
4.7. Бумага фильтровальная - по нормативно-технической документации (НТД).
4.8. Фильтры мембранные размерами пор 0,6-0,9 мкм: отечественного производства "Владипор" типа МФА-МА NN 6-9 (0,6-0,9 мкм) (см. приложение 1, п.2) или типа МФЦ N 4 (0,6 мкм) по НТД; производства зарубежных фирм Synpor N 4 (0,85 мкм) или N 5 (0,6 мкм), Millipore НА, Whatman GF/F.
5. СРЕДСТВА ИЗМЕРЕНИЙ И ОБОРУДОВАНИЕ
5.1. Спектрофотометр. Выделяемый спектральный интервал должен быть не более 2-3 нм, точность установки длин волн в диапазоне 430-750 нм не ниже ±2 нм, погрешность измерений по шкале оптических плотностей не более 0,01 Б. Например спектрофотометры: двухлучевой типа СФ-18 или однолучевой типа СФ-46 по НТД.
5.2. Центрифуга лабораторная. Вместимость пробирок 10 см![]() , число гнезд 6(12), ускорение 4000-5000
, число гнезд 6(12), ускорение 4000-5000 ![]() . Например типа ЦЛН-2 или ОПн-ВУХЛ 4.2 по НТД.
. Например типа ЦЛН-2 или ОПн-ВУХЛ 4.2 по НТД.
5.3. Установка фильтровальная с воронками под фильтры мембранные диаметром от 35 до 142 мм (см. приложения 3 и 4).
5.4. Гомогенизатор механический с вместимостью 10-15 см![]() . Ступка фарфоровая N 1-3 (диаметр 50-90 мм) с пестиком N 2 (диаметр 22-34 мм) по ГОСТ 9147. Рекомендуется также устройство из стекла, схема которого дана в приложении 5.
. Ступка фарфоровая N 1-3 (диаметр 50-90 мм) с пестиком N 2 (диаметр 22-34 мм) по ГОСТ 9147. Рекомендуется также устройство из стекла, схема которого дана в приложении 5.
5.5. Насос вакуумный, типа НВР-1 или ЗНВР-1Д, или отсасыватель хирургический ОХ-10 по НТД.
5.6. Батометр (см. приложение 1, п.1).
5.7. Канистры полиэтиленовые черного цвета вместимостью 3, 5, 10 и 20 дм![]() .
.
5.8. Ведро полиэтиленовое или эмалированное.
5.9. Эксикатор диаметром 140, 190 или 250 мм по ГОСТ 25336.
5.10. Пробирки стеклянные градуированные с притертой пробкой на 10 см![]() с ценой деления 0,1 см
с ценой деления 0,1 см![]() по ГОСТ 1770 и НТД.
по ГОСТ 1770 и НТД.
6. ПОДГОТОВКА РЕАКТИВОВ И ФИЛЬТРОВ
6.1. Порошок углекислого бария (![]() ) тщательно растирают в фарфоровой ступке с добавлением небольшого количества дистиллированной воды или фильтрованной природной. Из полученной массы удаляют самую грубую фракцию, оседающую со скоростью более 0,5 см·с
) тщательно растирают в фарфоровой ступке с добавлением небольшого количества дистиллированной воды или фильтрованной природной. Из полученной массы удаляют самую грубую фракцию, оседающую со скоростью более 0,5 см·с![]() , после чего эту массу используют для приготовления суспензии. Рекомендуемая концентрация
, после чего эту массу используют для приготовления суспензии. Рекомендуемая концентрация ![]() в суспензии 30 г·дм
в суспензии 30 г·дм![]() . Порция суспензии, добавляемой в фильтровальную воронку перед фильтрованием, берется из расчета 20 мг
. Порция суспензии, добавляемой в фильтровальную воронку перед фильтрованием, берется из расчета 20 мг ![]() на 1 см
на 1 см![]() поверхности фильтра.
поверхности фильтра.
6.2. Мембранные фильтры готовят в зависимости от типа материала фильтра. Некоторые типы фильтров выпускают готовыми к использованию (например, стекловолокнистые фильтры типа GF/F), другие требуют предварительного вымачивания или даже кипячения в воде. Например фильтры типа Synpor необходимо трижды прокипятить по 10-15 мин в свежих порциях дистиллированной воды. После кипячения следует провести выбраковку деформированных фильтров. Готовые фильтры хранят в сухом состоянии.
6.3. Приготовление 1 дм![]() 90%-ного водного ацетона проводят смешением 0,9 дм
90%-ного водного ацетона проводят смешением 0,9 дм![]() 100%-ного ацетона и 0,1 дм
100%-ного ацетона и 0,1 дм![]() дистиллированной воды. В приготовленный раствор добавляют порцию
дистиллированной воды. В приготовленный раствор добавляют порцию ![]() из расчета 1-2 г на 1 дм
из расчета 1-2 г на 1 дм![]() раствора, суспензию тщательно перемешивают в течение 20-30 с и хранят не более 3-5 сут в склянках из темного стекла.
раствора, суспензию тщательно перемешивают в течение 20-30 с и хранят не более 3-5 сут в склянках из темного стекла.
6.4. 0,5 см![]() концентрированной соляной кислоты растворяют в 10 см
концентрированной соляной кислоты растворяют в 10 см![]() ацетона. Приготовленный раствор хранят не более суток.
ацетона. Приготовленный раствор хранят не более суток.
7. ФИЛЬТРОВАНИЕ ПРОБ ВОДЫ И ХРАНЕНИЕ ФИЛЬТРОВ
7.1. Объем пробы зависит от ожидаемой концентрации хлорофилла ![]() в конкретном водном объекте и определяется в соответствии с приложением 2, при этом количество хлорофилла в пробе должно составлять от 2 до 20 мкг.
в конкретном водном объекте и определяется в соответствии с приложением 2, при этом количество хлорофилла в пробе должно составлять от 2 до 20 мкг.
Из этих же соображений выбирается объем пробы грунта или льда при анализе микрофитобентоса или ледовой микрофлоры.
7.2. После отбора пробу необходимо немедленно профильтровать. При отсутствии такой возможности допускается хранить ее в холодильнике при температуре от 2 до 6 °С. Максимально допустимая продолжительность хранения с момента отбора - не более 2-3 ч. После хранения, перед началом фильтрования, пробу необходимо осторожно перемешать. К материалу емкости для хранения пробы предъявляются те же требования, что и к материалу для изготовления устройства для отбора пробы (см. приложение 1).
7.3. Проба воды фильтруется через мембранный фильтр (см. п.4.8), покрытый слоем ![]() (или
(или ![]() ). Фильтрование проводится под вакуумом или под давлением (в том числе самотеком), перепад давления - 0,15-0,2 атм.
). Фильтрование проводится под вакуумом или под давлением (в том числе самотеком), перепад давления - 0,15-0,2 атм.
Для получения на фильтре достаточно плотного и равномерного по толщине слоя ![]() и во избежание его взмучивания фильтрование необходимо проводить в следующей последовательности: заполнить фильтровальную воронку смесью фильтрата с порцией суспензии
и во избежание его взмучивания фильтрование необходимо проводить в следующей последовательности: заполнить фильтровальную воронку смесью фильтрата с порцией суспензии ![]() , создать перепад давления, пропустить через фильтр некоторое количество фильтрата для полного осаждения
, создать перепад давления, пропустить через фильтр некоторое количество фильтрата для полного осаждения ![]() , после чего приступить к фильтрованию отобранной пробы.
, после чего приступить к фильтрованию отобранной пробы.
В процессе фильтрования необходимо следить за уровнем воды в фильтровальной воронке и не допускать размывания слоя ![]() струей, поступающей в воронку.
струей, поступающей в воронку.
После окончания фильтрования для подсушки фильтра следует поддержать перепад давления в течение еще 5-10 с.
7.4. При значительной мутности пробы допускается применение фильтров с диаметром пор до 2,5 мкм и перепад давления до 0,5-0,6 атм. При этом допускается для последующего приготовления экстракта (см. разд.8) использовать слой ![]() вместе с фильтром. В этом случае необходимо убедиться в отсутствии потерь водорослей вследствие их продавливания через слой
вместе с фильтром. В этом случае необходимо убедиться в отсутствии потерь водорослей вследствие их продавливания через слой ![]() и фильтр. Контрольное определение содержания хлорофилла рекомендуется проводить, отфильтровывая мутную пробу на фильтр большого диаметра (или на несколько фильтров того же диаметра) с порами 0,6-0,9 мкм при перепаде давления 0,2 атм. Допускается контролировать присутствие хлорофилла в фильтрате с помощью флуориметра.
и фильтр. Контрольное определение содержания хлорофилла рекомендуется проводить, отфильтровывая мутную пробу на фильтр большого диаметра (или на несколько фильтров того же диаметра) с порами 0,6-0,9 мкм при перепаде давления 0,2 атм. Допускается контролировать присутствие хлорофилла в фильтрате с помощью флуориметра.
7.5. Продолжительность фильтрования не должна превышать 40-60 мин.
7.6. Сразу же после фильтрования необходимо подсушить фильтр с помощью фильтровальной бумаги, подкладывая ее в несколько слоев под фильтр и меняя 2-3 раза в течение 10-15 мин. Затем осадок с фильтра снять и перенести в гомогенизатор.
При невозможности начать гомогенизацию и экстрагирование немедленно фильтр с осадком необходимо тщательно высушить, поместив его в эксикатор с силикагелем, и хранить в холодильнике при температуре минус 10-0 °С. Во избежание потерь вследствие рассыпания осадка с фильтров при их хранении и транспортировке допускается хранить фильтры свернутыми пополам осадком внутрь.
7.7. Срок хранения должен быть по возможности сокращен и не превышать 1 мес (в морозильной камере при температуре ниже минус 20 °С - до 3 мес).
8. ПРОВЕДЕНИЕ АНАЛИЗА
8.1. Гомогенизация и экстрагирование. Слой ![]() , содержащий отфильтрованную взвесь, снимают скальпелем с мембранного фильтра и количественно переносят в механический гомогенизатор. После добавления туда же нескольких кубических сантиметров 90%-ного ацетона в течение 1 мин взвесь растирают. Для экстрагирования пигментов гомогенат в течение 30 мин выдерживают при комнатной температуре. Полученный экстракт сливают в центрифужную пробирку. Осадок повторно растирают в гомогенизаторе в течение 1 мин при добавлении новой порции 90%-ного ацетона. Через 30 мин вторую порцию экстракта вместе с осадком сливают в ту же центрифужную пробирку. Остатки экстракта и взвеси со ступицы и пестика смывают минимальным количеством 90%-ного ацетона и также сливают в центрифужную пробирку с экстрактом.
, содержащий отфильтрованную взвесь, снимают скальпелем с мембранного фильтра и количественно переносят в механический гомогенизатор. После добавления туда же нескольких кубических сантиметров 90%-ного ацетона в течение 1 мин взвесь растирают. Для экстрагирования пигментов гомогенат в течение 30 мин выдерживают при комнатной температуре. Полученный экстракт сливают в центрифужную пробирку. Осадок повторно растирают в гомогенизаторе в течение 1 мин при добавлении новой порции 90%-ного ацетона. Через 30 мин вторую порцию экстракта вместе с осадком сливают в ту же центрифужную пробирку. Остатки экстракта и взвеси со ступицы и пестика смывают минимальным количеством 90%-ного ацетона и также сливают в центрифужную пробирку с экстрактом.
При анализе фитопланктона, богатого зелеными и сине-зелеными водорослями с толстыми оболочками или слизью, для повышения полноты гомогенизации при растирании допускается добавить кварцевый песок или толченое стекло марки "пирекс".
Взвесь, осажденную на фильтр из стекловолокна, допускается гомогенизировать вместе с фильтром. В этом случае следует использовать гомогенизатор со сферическими рабочими поверхностями.
Кроме механического растирания, допускаются другие способы гомогенизации, например с помощью ультразвука. При этом способе необходимо следить за отсутствием чрезмерного, выше 40 °С, нагрева обрабатываемой взвеси.
Высокая степень гомогенизации достигается также продавливанием замороженной взвеси под большим давлением через узкое отверстие (фильеру).
8.2. Центрифугирование. Светорассеивающую взвесь удаляют из экстракта центрифугированием при 4000-5000 ![]() в течение 15 мин, например на центрифуге типа ЦЛН-2 при 8000 об/мин. Чистота экстракта контролируется по оптической плотности на 750 нм. Последняя не должна превышать 0,005 Б на каждый сантиметр рабочей длины кюветы. При более высокой плотности центрифугирование следует повторить.
в течение 15 мин, например на центрифуге типа ЦЛН-2 при 8000 об/мин. Чистота экстракта контролируется по оптической плотности на 750 нм. Последняя не должна превышать 0,005 Б на каждый сантиметр рабочей длины кюветы. При более высокой плотности центрифугирование следует повторить.
После центрифугирования экстракт следует перенести в стеклянную мерную пробирку, при необходимости, добавляя 90%-ный ацетон, довести его объем до объема фотометрической кюветы и закрыть пробирку притертой пробкой (см. приложение 2, табл.5).
Подготовленный к фотометрированию экстракт допускается хранить в холодильнике при температуре 0-5 °С не более 1 сут.
8.3. Спектрофотометрирование и подкисление экстракта. При спектрофотометрировании используются кюветы с рабочей длиной от 0,5 до 5 см в зависимости от объема экстракта и его оптической плотности. Последняя должна находиться в диапазоне 0,05-0,8 Б.
Отсчеты оптических плотностей берутся на четырех длинах волн - 664, 647, 630 и 750 нм. Фотометрирование проводится дважды: до и после подкисления экстракта несколькими каплями приготовленного раствора соляной кислоты в ацетоне.
Количество кислоты, добавляемой в экстракт, зависит от его объема и рассчитывается таким образом, чтобы концентрация кислоты в нем равнялась 3-5 ммоль·дм![]() . Такая концентрация будет получена, если к каждому кубическому сантиметру экстракта добавить 0,01 см
. Такая концентрация будет получена, если к каждому кубическому сантиметру экстракта добавить 0,01 см![]() приготовленного заранее раствора
приготовленного заранее раствора ![]() (см. п.6.4). После добавления кислоты экстракт необходимо перемешать в течение 2-3 мин.
(см. п.6.4). После добавления кислоты экстракт необходимо перемешать в течение 2-3 мин.
При фотометрировании подкисленного экстракта отсчеты берутся на двух длинах волн 664 и 750 нм.
Одновременно с определением концентрации хлорофилла ![]() допускается определять концентрации и других пигментов: феофитина
допускается определять концентрации и других пигментов: феофитина ![]() , хлорофиллов
, хлорофиллов ![]() и
и ![]() , суммарную концентрацию каротиноидов, а также пигментный индекс (см. п.9.3). С этой целью необходимо до подкисления экстракта дополнительно взять отсчеты еще на двух длинах волн - 430 и 480 нм.
, суммарную концентрацию каротиноидов, а также пигментный индекс (см. п.9.3). С этой целью необходимо до подкисления экстракта дополнительно взять отсчеты еще на двух длинах волн - 430 и 480 нм.
9. ОБРАБОТКА РЕЗУЛЬТАТОВ
9.1. Концентрацию хлорофилла ![]() в пробе (
в пробе (![]() ) вычисляют по формуле
) вычисляют по формуле
![]() , (1)
, (1)
где ![]() и
и ![]() - оптические плотности экстракта в белах на длине волны 664 нм до и после его подкисления. Концентрации хлорофилла
- оптические плотности экстракта в белах на длине волны 664 нм до и после его подкисления. Концентрации хлорофилла ![]() в пробе, мкг·дм
в пробе, мкг·дм![]() , без поправки на присутствие феофитина
, без поправки на присутствие феофитина ![]() (
(![]() ) вычисляют по формуле
) вычисляют по формуле
![]() , (2)
, (2)
где ![]() и
и ![]() - оптические плотности экстракта в белах на длинах волн 630 и 647 нм;
- оптические плотности экстракта в белах на длинах волн 630 и 647 нм;
![]() - объем экстракта, см
- объем экстракта, см![]() ;
;
![]() - объем пробы, дм
- объем пробы, дм![]() ;
;
![]() - длина кюветы, см.
- длина кюветы, см.
9.2. Концентрации других пигментов (![]() ,
, ![]() ,
, ![]() ,
, ![]() ), мкг·дм
), мкг·дм![]() , рассчитывают по формулам:
, рассчитывают по формулам:
![]() ; (3)
; (3)
![]()
![]() ; (4)
; (4)
![]() . (5)
. (5)
В том случае, если в пробе содержатся преимущественно зеленые или сине-зеленые водоросли, то концентрации каротиноидов (![]() ), мкг·дм
), мкг·дм![]() , вычисляют по формуле
, вычисляют по формуле
![]() . (6)
. (6)
При доминировании диатомовых, перидиней, золотистых и разножгутиковых - по формуле
![]() . (7)
. (7)
9.3. Пигментный индекс в экстракте вычисляют по формуле
![]() . (8)
. (8)
9.4. Все оптические плотности, входящие в формулы (1)-(8), берутся с учетом поправки, которая равна оптической плотности на длине волны 750 нм. Эта поправка вычитается из значения измеренной оптической плотности.
За результат определений принимают единичный результат для каждой пробы.
10. ПОГРЕШНОСТЬ ОПРЕДЕЛЕНИЙ
При соблюдении требований, предусмотренных данным стандартом, погрешность текущих определений хлорофилла ![]() ±
±![]() в процентах не будет превышать значений, указанных в табл.1.
в процентах не будет превышать значений, указанных в табл.1.
Таблица 1
|
Концентрация хлорофилла |
Ориентировочная концентрация хлорофилла |
|
|
<0,02 |
<0,25 |
100 |
|
0,02-0,07 |
0,25-0,5 |
50 |
|
0,07-0,2 |
0,5 -1,5 |
30 |
|
0,2 -0,7 |
1,5 -2,5 |
20 |
|
>0,7 |
>2,5 |
10 |
11. РЕГУЛЯРНЫЙ КОНТРОЛЬ ПОГРЕШНОСТИ ТЕКУЩИХ ОПРЕДЕЛЕНИЙ
Строгое соблюдение требований настоящего стандарта обеспечивает исключение всех составляющих погрешности, кроме тех, которые возникают при фотометрировании экстракта. Поэтому для обеспечения текущих определений с регламентированной погрешностью наряду с соблюдением требований, установленных методикой, следует регулярно контролировать погрешность, возникающую при спектрофотометрировании.
С этой целью в соответствии с требованиями ГОСТ 8.513 необходимо ежегодно проводить обязательную государственную поверку спектрофотометра. Кроме того, перед каждой серией текущих определений, но не реже одного раза в месяц следует оценивать погрешность определений оптической плотности и установки шкалы длин волн путем сравнения спектров контрольных светофильтров, входящих в комплект прибора, с их спектрами, указанными в паспорте.
12. ТРЕБОВАНИЯ К ЭКОЛОГИЧЕСКОЙ БЕЗОПАСНОСТИ ОТХОДОВ
АНАЛИЗА, К БЕЗОПАСНОСТИ И КВАЛИФИКАЦИИ ОПЕРАТОРА
Слив отходов анализа в канализацию допускается после их предварительного разбавления не менее чем в 100 раз.
В процессе анализа требуется соблюдение мер предосторожности, регламентируемых при работе с вредными веществами (для ацетона, соляной кислоты и углекислого бария) по ГОСТ 12.1.005 и ГОСТ 12.1.007.
Лица, допускаемые к выполнению измерений, должны обладать опытом проведения типовых биохимических анализов, а также навыками обращения со спектрофотометрами.
13. ФОРМА ОТЧЕТА О ПРОВЕДЕННОМ ОПРЕДЕЛЕНИИ
В отчете должна быть следующая информация:
место, время и устройство отбора проб;
результаты должны быть выражены в соответствии с разд.9;
любые отклонения от данной методики и другие обстоятельства, которые могут повлиять на результаты определений;
ссылка на настоящий стандарт.
ПРИЛОЖЕНИЕ 1
Справочное
БАТОМЕТРЫ И ФИЛЬТРЫ
1. Устройства для отбора проб
Устройствами для отбора проб могут служить:
батометр, срабатывающий от посыльного грузика или электрического импульса на заданной глубине;
батометр для отбора "интегральной" пробы, снабженный устройством для обеспечения равномерного поступления воды при равномерном движении батометра в слое отбора;
шланг (с насосом или без насоса);
ведро (для отбора проб с поверхности).
Материал для изготовления рабочих емкостей устройств для отбора, с которыми непосредственно контактирует отобранная проба, должен быть непрозрачным, нетоксичным, коррозийно-стойким. Оптимально удовлетворяет этим требованиям черный полиэтилен. Для батометра допускается винипласт, оргстекло, другие пластмассы, стекло. При этом прозрачные материалы должны иметь снаружи непрозрачное покрытие. Перед началом работ устройство для отбора необходимо в течение нескольких дней выдержать в воде и тщательно отмыть.
Для изготовления батометров можно воспользоваться конструкторскими разработками, осуществленными в ОКБ океанологической техники Института океанологии АН СССР (см. табл.2). Вместимость и марки батометров указаны в табл.2.
Таблица 2
|
Вместимость батометра, дм |
Марка батометра по спецификации ОКБ ОТ ИОАН СССР |
Вместимость барометра, дм |
Марка батометра по спецификации ОКБ ОТ ИОАН СССР |
|
1 |
БП-1-63 |
10 |
БМ |
|
2,5 |
ОА-07.00.00.00 |
30 |
БМ |
|
2,5 |
2БМ |
130 |
2А.011.00.00.00 |
|
7 |
Б4-С7-65 |
150 |
0А.285.00.00.00 |
Кроме того, выпускается "барометр морской" вместимостью 1 дм![]() марки БМ-48.
марки БМ-48.
Для защиты этих барометров от коррозии рекомендуется двухразовое покрытие их внутренней поверхности лаком марки ЭДН-1 по нормативно-технической документации или аналогичным.
2. Размеры мембранных фильтров отечественного производства (мембраны "ВЛАДИПОР" типа МФА-МА ПО "ТАСМА") указаны в табл.3.
Таблица 3
|
Диаметр диска, мм |
Минимальный объем партии, шт. |
Диаметр диска, мм |
Минимальный объем партии, шт. |
|
35 |
10000 |
90 |
1500 |
|
47 |
6000 |
142 |
500 |
ПРИЛОЖЕНИЕ 2
Справочное
ОПРЕДЕЛЕНИЕ ОБЪЕМОВ ПРОБ
Ориентировочно оценить объем пробы при заданной величине ожидаемой концентрации хлорофилла ![]() в пробе можно по табл.4.
в пробе можно по табл.4.
Таблица 4
|
Концентрация хлорофилла |
|
|
|
|
|
|
|
|
|
Объем пробы, дм |
Более 40 |
20-50 и более |
5-50 |
2-20 |
0,4-4 |
0,2-2 |
0,04-0,4 |
0,02-0,2 |
Примечание. Приведенные объемы проб рассчитаны, исходя из оптимального диапазона оптических плотностей экстракта на длине волны 664 нм (0,05-0,8 Б) и характерного отношения объема к рабочей длине для кювет, обычно используемых при фотометрировании. Это отношение может меняться от 2,5 до 4. При использовании специальных кювет с меньшим отношением объема к длине объем проб следует уменьшить пропорционально уменьшению указанного отношения. Ориентировочные соотношения между количеством хлорофилла ![]() в экстракте, длиной кюветы (
в экстракте, длиной кюветы (![]() ), объемом экстракта в кювете (
), объемом экстракта в кювете (![]() ), концентрацией хлорофилла
), концентрацией хлорофилла ![]() в экстракте (
в экстракте (![]() ) и оптической плотностью
) и оптической плотностью ![]() приведены в табл.5.
приведены в табл.5.
Таблица 5
|
Количество хлорофилла |
|
|
|
| ||||||||
|
|
1 |
2 |
5 |
1 |
2 |
5 |
1 |
2 |
5 |
1 |
2 |
5 |
|
|
4 |
8 |
20 |
4 |
8 |
20 |
4 |
8 |
20 |
4 |
8 |
20 |
|
|
0,5 |
0,25 |
0,1 |
1,25 |
0,625 |
0,25 |
2,5 |
1,25 |
0,5 |
5 |
2,5 |
1 |
|
|
0,05 |
0,125 |
0,25 |
0,5 | ||||||||
ПРИЛОЖЕНИЕ 3
Рекомендуемое
Схема фильтровальной установки для фильтрования самотеком
в полевых условиях
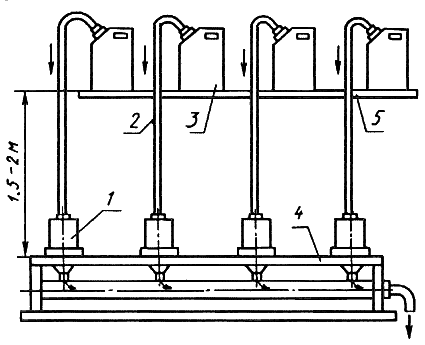
1 - воронка фильтровальная (например, В-67, разработка ОКБ ОТ ИОАН СССР, см. приложение 1); 2 - трубка полиэтиленовая; 3 - канистра полиэтиленовая; 4 - штатив для воронок; 5 - полка для канистр
ПРИЛОЖЕНИЕ 4
Рекомендуемое
Схема установки для получения сжатого воздуха, используемого
при завершении фильтрования самотеком или при фильтровании
проб малого объема в полевых условиях
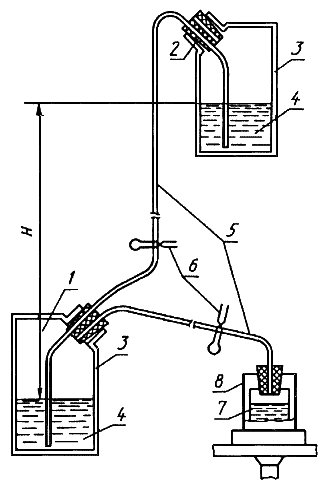
1 - сжатый воздух; 2 - пробка; 3 - канистра; 4 - вода; 5 - трубка;
6 - зажим; 7 - анализируемая проба; 8 - воронка фильтровальная
Черт.2
Примечания:
1. Предпочтительнее использовать дюралевые канистры, однако при небольшом давлении (до 0,15-0,2 атм) пригодны канистры из твердого полиэтилена.
2. Для получения запаса сжатого воздуха в нижней канистре следует:
а) собрать установку по схеме, изображенной на черт.2, заполнить верхнюю канистру водой до уровня, не доходящего до пробки на несколько сантиметров;
б) разжать верхний зажим и зажать нижний;
в) наклонить верхнюю канистру так, чтобы вода начала поступать по трубке в нижнюю, после чего возвратить ее в нормальное положение;
г) после перетекания воды в нижнюю канистру в ней образуется запас сжатого воздуха, давление в котором будет определяться разностью уровней воды в канистрах - Н.
3. Для создания давления можно использовать любую чистую воду (фильтрованную или водопроводную), в дюралевых канистрах - желательно пресную.
ПРИЛОЖЕНИЕ 5
Рекомендуемое
Схема гомогенизатора
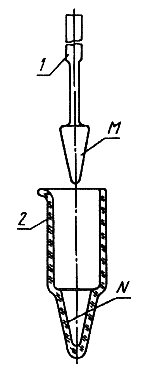
1 - пестик; 2 - ступица
Черт.3
Примечание. Наружная коническая поверхность ![]() пестика и внутренняя поверхность
пестика и внутренняя поверхность ![]() ступицы взаимно пришлифованы.
ступицы взаимно пришлифованы.
Текст документа сверен по:
официальное издание
Государственный контроль качества воды. Сб. ГОСТов. -
М.: ИПК Издательство стандартов, 2001