МУК 4.1.1393-03
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств Мезотриона в воде, почве, зеленой массе
и зерне кукурузы методом газожидкостной хроматографии
Дата введения 2003-06-30
1. ПОДГОТОВЛЕНЫ: Федеральным научным центром гигиены им. Ф.Ф.Эрисмана (чл.-корр. РАМН, проф. В.Н.Ракитский, проф. Т.В.Юдина); Московской сельскохозяйственной академией им. К.А.Тимирязева (проф. В.А.Калинин, к. хим. н. А.В.Довгилевич); при участии Департамента госсанэпиднадзора Минздрава России (А.П.Веселов). Разработчики методик указаны в конце каждой из них.
2. РЕКОМЕНДОВАНЫ к утверждению Комиссией по госсанэпиднормированию при Минздраве России.
3. УТВЕРЖДЕНЫ Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации, академиком РАМН Г.Г.Онищенко 24 июня 2003 г.
4. ВВЕДЕНЫ ВПЕРВЫЕ.
5. ВВЕДЕНЫ с 30 июня 2003 г.
1. Вводная часть
Фирма-производитель: ООО Сингента.
Торговое название: WF 2795
Название действующего вещества по ИСО: Мезотрион
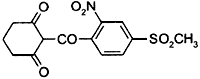
Название действующего вещества по ИЮПАК: 2-(4-мезил-2-нитробензоил)циклогексан-1,3-дион
Структурная формула:
|
Эмпирическая формула: C |
M.м. 339,3 |
Химически чистый Мезотрион представляет собой бледно-желтый порошок без запаха.
Давление паров: 5,69х10![]() мПа при 20 °С.
мПа при 20 °С.
Температура плавления: 165,3 °С.
Растворимость в воде - 2,2 (рН 4,8), 15 (рН 6,9), 22 (рН 9) г/л (при 20 °С).
Растворимость в органических растворителях: 1,2-дихлорэтан - 66,3; этилацетат - 18,6; метанол - 4,6; толуол - 3,1 г/кг.
Константа диссоциации рКа - 3,12 при 20 °С.
Стабилен к гидролизу в стерильных условиях при рН 5-9 и фотолизу в воде.
Сохранность и подвижность в почве сильно зависит от рН и содержания органического вещества. ![]() колеблется от 387 при рН - 4,6 до 19 при рН - 7,0; ДТ
колеблется от 387 при рН - 4,6 до 19 при рН - 7,0; ДТ![]() - от 4 дн. при рН 7,7 и % орг. угл. 0,9 до 31,5 дн. при рН 5,0 и % орг. угл. 2,0.
- от 4 дн. при рН 7,7 и % орг. угл. 0,9 до 31,5 дн. при рН 5,0 и % орг. угл. 2,0.
Краткая токсикологическая характеристика. Мезотрион относится к малоопасным для человека и теплокровных животных веществам по оральной (ЛД![]() для крыс >5000 мг/кг) дермальной токсичности (ЛД
для крыс >5000 мг/кг) дермальной токсичности (ЛД![]() для крыс >2000 мг/кг) и к умеренно опасным веществам по ингаляционной токсичности (ЛК
для крыс >2000 мг/кг) и к умеренно опасным веществам по ингаляционной токсичности (ЛК![]() для крыс >5 мг/л).
для крыс >5 мг/л).
В России гигиенические нормативы не установлены.
Область применения. Мезотрион - системный гербицид из класса трикетонов, хорошо проникающий в растение через корни и листья и передвигающийся в растениях в обоих направлениях - базипетально и акропетально. Эффективно подавляет двудольные однолетние и некоторые злаковые сорняки путем ингибирования биосинтеза каратиноидов в посевах кукурузы при нормах расхода 100-25* г/га (до всходов культуры) и 70-150 г/га (по всходам кукурузы).
_______________
* Соответствует оригиналу. - Примечание .
2. Методика определения остаточных количеств Мезотриона в воде, почве,
зеленой массе и зерне кукурузы газохроматографическим методом
2.1. Основные положения
2.1.1. Принцип метода
Методика основана на определении Мезотриона методом газожидкостной хроматографии с использованием детектора по захвату электронов (ДПР, ДЭЗ) после его экстракции из объектов анализа органическим растворителем, очистки экстракта перераспределением действующего вещества между несмешивающимися фазами, гидролиза Мезотриона до 4-(метилсульфонил)-2-нитробензойной кислоты с последующим получением ее метилового эфира.
Идентификация вещества проводится по времени удерживания, а количественное определение - методом абсолютной калибровки.
2.1.2. Избирательность метода
В предлагаемых условиях метод специфичен в присутствии пестицидов, применяемых при возделывании кукурузы.
2.1.3. Метрологическая характеристика метода
Метрологическая характеристика метода представлена в табл.1-2.
Таблица 1
Метрологическая характеристика метода
|
|
Метрологические параметры, | ||||
|
Анализируемый объект |
предел обнаружения, мг/кг |
диапазон определяемых концентраций, мг/кг |
среднее значение определения, % |
стандартное отклонение, |
доверительный интервал среднего результата %, ± |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
вода |
0,005 |
0,005-0,05 |
88,5 |
0,97 |
1,81 |
|
почва |
0,01 |
0,01-0,10 |
84,0 |
0,96 |
1,68 |
|
зеленая масса |
0,05 |
0,05-0,50 |
81,3 |
1,07 |
1,83 |
|
зерно |
0,05 |
0,05-0,50 |
82,6 |
1,47 |
2,54 |
Таблица 2
Доверительный интервал и полнота определения Мезотриона в воде, почве,
зеленой массе и зерне кукурузы
|
Среда |
Добавлено Мезотриона, мг/кг |
Обнаружено Мезотриона, мг/кг |
Доверительный интервал, ± |
Полнота определения, % |
|
1 |
2 |
3 |
4 |
5 |
|
Вода |
0,050 |
0,044 |
0,003 |
88,3 |
|
|
0,020 |
0,018 |
0,001 |
89,6 |
|
|
0,010 |
0,009 |
0,001 |
86,6 |
|
|
0,005 |
0,005 |
0,0003 |
89,6 |
|
Почва |
0,20 |
0,169 |
0,005 |
84,6 |
|
|
0,10 |
0,088 |
0,003 |
87,7 |
|
|
0,02 |
0,017 |
0,001 |
82,4 |
|
|
0,01 |
0,008 |
0,0002 |
81,2 |
|
зеленая масса |
0,50 |
0,400 |
0,008 |
79,9 |
|
|
0,20 |
0,162 |
0,005 |
80,9 |
|
|
0,10 |
0,083 |
0,006 |
83,1 |
|
|
0,05 |
0,041 |
0,004 |
81,2 |
|
зерно |
0,50 |
0,401 |
0,017 |
80,2 |
|
|
0,20 |
0,165 |
0,005 |
81,9 |
|
|
0,10 |
0,084 |
0,003 |
83,4 |
|
|
0,05 |
0,043 |
0,006 |
85,1 |
2.2. Реактивы, растворы, материалы и оборудование
2.2.1. Реактивы, материалы и растворы
|
Мезотрион, аналитический стандарт фирмы Сингента |
|
|
Азот, осч |
ГОСТ 9293-74 |
|
Ацетон |
ГОСТ 2603-79 |
|
Ацетонитрил |
ТУ 6-09-3534-87 |
|
Вода бидистиллированная, деионизированная* |
ГОСТ 7602-72 |
|
________________ | |
|
Гелий марки "А" |
ТУ 51-940-80 |
|
Калия гидроксид, чда |
ГОСТ 24363-80 |
|
Кислота серная, концентрированная, хч |
ГОСТ 4204-77 |
|
Кислота хлороводородная, концентрированная, хч |
ГОСТ 3118-77 |
|
Медь серно-кислая, ч |
ГОСТ 19347-84Е |
|
Метиламин соляно-кислый, ч |
ТУ 6-09-2088-77 |
|
Мочевина, чда |
ГОСТ 6691-77 |
|
Натрия нитрит, хч |
ГОСТ 4197-74 |
|
Натрий серно-кислый, безводный, хч |
ГОСТ 4166-76 |
|
Натрий хлористый, хч |
ГОСТ 4233-77 |
|
Толуол, хч |
ГОСТ 5789-78 |
|
Хромовый ангидрид, ч |
ГОСТ 3776-68 |
|
Этилацетат, хч |
ГОСТ 22300-76 |
|
Эфир диэтиловый, хч |
ГОСТ 6265-74 |
2.2.2. Приборы, аппаратура, посуда
|
Аппарат для встряхивания, или аналогичный |
ТУ 64-1-1081-73 |
|
Баня водяная |
ТУ 46-22-603-75 |
|
Банки с крышками для экстракции на 250 мл, полипропилен, |
|
|
Весы аналитические ВЛА-200, или аналогичные |
ГОСТ 34104-80Е |
|
Весы лабораторные |
ГОСТ 19491-74 |
|
Виалы (пузырьки) с тефлоновыми прокладками емкостью 40 мл, |
|
|
Водоструйный насос |
ГОСТ 10696-75 |
|
Воронки делительные на 250 и 500 мл |
|
|
Воронки для фильтрования, стеклянные |
ГОСТ 8613-75 |
|
Испаритель ротационный, вакуумный ИР-1М, или аналогичный |
ТУ 25-11-917-4 |
|
Колонка капиллярная кварцевая НР-5 (Crosslinked 5% РН ME Siloxane), длина 15 м |
|
|
Колбы конические плоскодонные на 100 и 250 мл, КПШ-250 |
ГОСТ 10394-72 |
|
Колбы мерные на 10, 25, 50, 100 мл |
|
|
Концентраторы грушевидные НШ29 КГУ-100 (250) |
ГОСТ 10394-72 |
|
Микропипетки на 0,1 мл |
|
|
Микрошприц на 10 мкл |
ТУ Е-2.833.0.24 |
|
Нагревательный блок для виал, Dri-Block DB-3, Tecam |
|
|
Насос водоструйный |
ГОСТ 10696-75 |
|
Пипетки мерные на 1,0; 2,0 и 5,0 мл |
ГОСТ 20292-74 |
|
Пипетки Пастеровские длиной 230 мм, Z 31,073-5, Aldrich. |
|
|
Стаканы химические на 250 мл |
|
|
Фильтры бумажные "красная лента" |
ТУ 6-09-1678-86 |
|
Хроматограф газовый "Кристалл 2000М" с электронно-захватным детектором (ЭЗД) с пределом детектирования по Линдану не выше 4·10 |
|
|
Центрифуга, или аналогичная |
МРТУ 42-219-69 |
|
Цилиндры мерные на 25, 50 и 100 мл |
2.3. Подготовка к определению
2.3.1. Подготовка и кондиционирование колонки для газожидкостной хроматографии
Капиллярную колонку устанавливают в термостате хроматографа, не подсоединяя к детектору, и стабилизируют в токе гелия при температуре на 20 °С ниже предельного значения для выбранной неподвижной фазы в течение 8-10 ч.
2.3.2. Приготовление реактивов
2.3.2.1. Приготовление реактива Джонса для гидролиза.
В колбу объемом 250 мл наливают 154 мл дистиллированной воды, добавляют 14 мл концентрированной серной кислоты и 53,6 г хромового ангидрида (СrО![]() ) и тщательно перемешивают. Хранят раствор при комнатной температуре.
) и тщательно перемешивают. Хранят раствор при комнатной температуре.
2.3.2.2. Приготовление реактива А.
В колбу объемом 250 мл наливают 200 мл дистиллированной воды, добавляют 14 мл концентрированной серной кислоты и 10 г сульфата меди, перемешивают до полного растворения соли. В полученный раствор добавляют 80 г сульфата натрия, перемешивают содержимое колбы 5-10 мин. Хранят при комнатной температуре.
2.3.2.3. Получение N-нитрозо-N-метилмочевины.
При отсутствии готового препарата N-нитрозометилмочевины осуществляют его синтез. Все работы необходимо проводить в вытяжном шкафу! В круглодонную колбу со шлифом емкостью 1 л, снабженную обратным холодильником, помещают 80 г метиламина гидрохлорида и 300 г мочевины, растворяют содержимое в 400 мл воды и кипятят 3 ч с обратным холодильником на водяной бане. По истечении срока раствор в колбе охлаждают до комнатной температуры и добавляют в него 110 г нитрита натрия. Затем раствор охлаждают в бане со льдом или снегом, содержащим поваренную соль, до 0 °С. Охлажденный раствор медленно (Осторожно! Вспенивание!) при перемешивании переливают в стакан емкостью 2 л, содержащий смесь 600 г льда и 60 мл концентрированной серной кислоты, охлаждаемый снаружи смесью льда с поваренной солью, следя за тем, чтобы температура внутри стакана не поднималась выше 2 °С.
Всплывшие кристаллы нитрозометилмочевины немедленно отфильтровывают через фильтр в воронке Бюхнера под вакуумом и промывают на фильтре ледяной водой.
Внимание! Нитрозометилмочевину хранят во влажном состоянии в темной склянке с пластмассовой пробкой в морозильнике, т.к. под действием света и тепла она может взорваться.
2.3.2.4. Приготовление раствора диазометана.
Внимание! Диазометан взрывоопасен и очень ядовит. Все работы необходимо проводить в вытяжном шкафу!
В коническую колбу на 100 мл вносят 20 мл 40%-ного раствора гидроксида калия и 50 мл диэтилового эфира, колбу помещают в баню со льдом и охлаждают до температуры 2-4 °С. В охлажденную смесь порциями при перемешивании на магнитной мешалке или стеклянной палочкой вносят 5 г нитрозометилмочевины. Реакционную смесь выдерживают на холоде 10 мин. Затем эфирный слой сливают в чистую коническую колбу емкостью 100 мл, добавляют 10-15 гранул гидроксида калия и колбу оставляют в бане со льдом или холодильнике на 2-3 ч для осушения раствора.
Раствор диазометана в эфире хранят в морозильнике в течение 1-2 суток. При хранении сосуды с раствором нельзя плотно закрывать!
2.3.3. Приготовление стандартных растворов
Взвешивают 50 мг Мезотриона в мерной колбе на 50 мл, растворяют навеску в ацетоне и доводят объем до метки ацетоном (стандартный раствор N 1, концентрация 1 мг/мл).
Стандартный раствор N 1 можно хранить в холодильнике в течение 6 мес.
Методом последовательного разбавления готовят стандартные растворы Мезотриона в ацетоне с концентрацией 0,5; 1,0; 2,0; и 5,0 мкг/мл для построения калибровочного графика и внесения в контрольный образец.
2.3.3.1. Гидролиз стандартных растворов и проб.
Из полученных стандартных растворов Мезотриона отбирают по 1 мл и помещают в виалы или пузырьки с плотно закрывающимися крышками, имеющими тефлоновые прокладки. Содержимое виал высушивают в токе теплого воздуха, затем в каждый пузырек добавляют по 2 мл реактива Джонса (см. п.2.3.2.1), закрывают виалы крышками и перемешивают содержимое, обмывая стенки виал. Помещают виалы в песчаную баню или драй-блок, нагретый до температуры 88-89 °С, и выдерживают их в течение 13 мин. Через 5 мин после начала гидролиза содержимое виал быстро перемешивают еще раз и продолжают гидролиз. Внимание! При гидролизе температура не должна опускаться ниже 85 °С.
По окончании гидролиза виалы охлаждают при комнатной температуре. В каждую виалу добавляют по 10 мл деионизированной бидистиллированной воды, 2-3 г сульфата натрия и 10 мл этилацетата, плотно закрывают крышками, встряхивают содержимое виал в течение 30 с и оставляют на 5 мин для полного разделения слоев. Из верхнего слоя этилацетата пипеткой отбирают 8-9 мл и переносят в чистую виалу (следить за тем, чтобы конец пипетки не касался нижнего слоя! Использовать каждый раз чистые пипетки!).
К отобранной порции этилацетата добавляют 2 мл реактива А (п.2.3.2.2), закрывают виалу крышкой, встряхивают 20 с и оставляют на 5 мин. Из верхнего слоя отбирают 6-7 мл этилацетата, переносят в чистую виалу, добавляют 2 мл реактива А, встряхивают 30 с и оставляют на 5 мин. Затем отбирают из верхнего слоя 5 мл этилацетата и переносят в концентратор емкостью 100 мл. Этилацетат в концентраторе упаривают досуха на ротационном вакуумном испарителе при температуре 50 °С.
При гидролизе Мезотриона получают 4-(метилсульфонил)-2-нитробензойную кислоту - MNBA.
Гидролиз проб, содержащих Мезотрион, проводится аналогичным образом.
2.3.3.2. Метилирование стандартных растворов и проб.
Для получения метилового эфира MNBA (MNBA-Me) к сухому остатку в концентраторе добавляют 2 мл раствора диазометана в диэтиловом эфире, плотно закрывают концентратор, перемешивают содержимое, обмывая стенки концентратора, и оставляют при комнатной температуре на 30 мин. По окончании метилирования эфир из концентратора удаляют током воздуха или азота. Сухой остаток в концентраторе разводят в 5 мл толуола.
Метилирование проб, содержащих MNBA, проводится аналогичным образом.
2.3.4. Построение калибровочного графика
Для построения калибровочного графика вводят в хроматограф последовательно по 1 мкл каждого из полученных четырех растворов (для каждой концентрации делают не менее 3 вводов) и измеряют высоту или площадь пиков. По полученным данным рассчитывают среднее значение высоты пика или его площади для каждой концентрации и строят график зависимости высоты пика или его площади от концентрации Мезотриона в мкг/мл.
2.4. Отбор проб
Отбор проб производится в соответствии с "Унифицированными правилами отбора проб сельскохозяйственной продукции, пищевых продуктов и объектов окружающей среды для определения микроколичеств пестицидов" (N 2051-79 от 21.08.79).
Пробы воды и почвы хранятся в холодильнике в закрытых бутылках и запаянных пластиковых пакетах соответственно; пробы зеленой массы кукурузы хранятся в запаянных пластиковых пакетах в замороженном виде при температуре -18 °С. Пробы зерна кукурузы подсушивают до стандартной влажности и хранят в закрытой стеклянной или полиэтиленовой таре при комнатной температуре.
Почву растирают в ступке и просеивают через сито с размером отверстий 3 мм. Зерно измельчают на лабораторной мельнице, зеленую массу измельчают ножницами.
2.5. Описание определения
2.5.1. Вода
Отбирают 200 мл анализируемой пробы воды в стакан объемом 250 мл, подкисляют ее концентрированной хлороводородной кислотой до рН=2 при интенсивном перемешивании стеклянной палочкой или на механической мешалке и переливают пробу в делительную воронку емкостью 500 мл. Добавляют в воронку 5 г хлорида натрия, 50 мл этилацетата и встряхивают содержимое воронки в течение 1-2 мин. После разделения слоев нижний водный слой сливают в стакан емкостью 250 мл, а этилацетат собирают в концентратор, пропуская его через безводный сульфат натрия. Водную фазу возвращают в делительную воронку и повторяют экстракцию еще два раза порциями этилацетата по 30 мл. Объединенные в концентраторе порции этилацетата выпаривают досуха на ротационном вакуумном испарителе при температуре 50 °С*.
_______________
* При необходимости, анализ можно прервать на данном этапе. Концентраторы или виалы закрывают пробками и оставляют до следующего дня в холодильнике.
Сухой остаток растворяют в 1-2 мл ацетона, тщательно обмывают стенки концентратора и переносят раствор Пастеровской пипеткой в виалу. Концентратор ополаскивают небольшими порциями ацетона еще 2 раза, собирая ацетон в ту же виалу. Из виалы ацетон удаляют током теплого воздуха.*
_______________
* При необходимости, анализ можно прервать на данном этапе. Концентраторы или виалы закрывают пробками и оставляют до следующего дня в холодильнике.
После этого сухой остаток заливают 2 мл реактива Джонса (п.2.3.2.1), плотно закрывают крышками и проводят гидролиз пробы, как указано в п.2.3.3.1 и ее метилирование, как указано в п.2.3.3.2.
По окончании метилирования эфир из концентратора удаляют током воздуха или азота. Сухой остаток в концентраторе разводят в 10 мл толуола. В хроматограф вводят 1 мкл пробы.
2.5.2. Почва
2.5.2.1. Экстракция. Навеску почвы 25 г помещают в пластиковую банку емкостью 250 мл, заливают 50 мл смеси ацетонитрил:вода - 1:1 и экстрагируют Мезотрион в течение 30 мин на встряхивателе. По окончании встряхивания пробу центрифугируют 10 мин со скоростью 2000 об/мин. Экстракт фильтруют через бумажный фильтр в концентратор емкостью 250 мл. Экстракцию повторяют еще раз, используя 50 мл экстрагирующей смеси и встряхивая пробу в течение 30 мин, центрифугируют и отфильтровывают экстракт в тот же концентратор. Объединенный экстракт упаривают до водного остатка на ротационном вакуумном испарителе при температуре не выше 40 °С.
2.5.2.2. Очистка экстракта, гидролиз и метилирование. К водному остатку в концентраторе добавляют 10 мл 5%-ного бикарбоната натрия, подщелачивая раствор до рН=8, перемешивают содержимое и переносят в делительную воронку емкостью 250 мл. Концентратор обмывают 50 мл воды и сливают ее в ту же делительную воронку. К содержимому воронки добавляют 50 мл дистиллированной воды, 5 г хлорида натрия и 20 мл диэтилового эфира. Встряхивают воронку в течение 30 с, промывая водную фазу эфиром. После разделения фаз нижнюю водную фазу сливают в стакан емкостью 250 мл, а эфир отбрасывают. Водную фазу возвращают в делительную воронку и промывают 20 мл эфира еще раз. Эфирную фракцию отбрасывают.
Промытую эфиром водную фазу сливают в стакан, и подкисляют ее концентрированной хлороводородной кислотой до рН=2, добавляя кислоту по каплям при интенсивном перемешивании пробы стеклянной палочкой или механической мешалкой. (Осторожно! Возможно вспенивание!)
Подкисленную водную фазу переносят в чистую делительную воронку и встряхивают, удаляя остатки СО![]() . После этого в делительную воронку наливают 50 мл этилацетата и реэкстрагируют Мезотрион в этилацетат, встряхивая воронку 1-2 мин. После разделения фаз нижнюю водную фазу сливают в стакан емкостью 250 мл, а этилацетат собирают в концентратор, пропуская его через безводный сульфат натрия. Водную фазу возвращают в делительную воронку и повторяют экстракцию еще два раза порциями этилацетата по 50 мл. Объединенные в концентраторе порции этилацетата упаривают досуха на ротационном вакуумном испарителе при температуре 50 °С.
. После этого в делительную воронку наливают 50 мл этилацетата и реэкстрагируют Мезотрион в этилацетат, встряхивая воронку 1-2 мин. После разделения фаз нижнюю водную фазу сливают в стакан емкостью 250 мл, а этилацетат собирают в концентратор, пропуская его через безводный сульфат натрия. Водную фазу возвращают в делительную воронку и повторяют экстракцию еще два раза порциями этилацетата по 50 мл. Объединенные в концентраторе порции этилацетата упаривают досуха на ротационном вакуумном испарителе при температуре 50 °С.
Сухой остаток растворяют в 1-2 мл ацетона, тщательно обмывают стенки концентратора и переносят раствор Пастеровской пипеткой в виалу. Концентратор ополаскивают небольшими порциями ацетона еще 2 раза, собирая ацетон в ту же виалу.
Из виалы ацетон удаляют током теплого воздуха. После этого сухой остаток заливают 2 мл реактива Джонса (п.2.3.2.1), виалу плотно закрывают крышкой и проводят гидролиз пробы с последующей переэкстракцией продуктов гидролиза в этилацетат, как указано в п.2.3.3.1 и ее метилирование, как указано в п.2.3.3.2.
По окончании метилирования эфир из концентратора удаляют током воздуха или азота. Сухой остаток в концентраторе разводят в 5 мл толуола.
2.5.3. Зеленая масса кукурузы
Навеску измельченного растительного материала 10 г помещают в пластиковую банку емкостью 250 мл, заливают 50 мл смеси ацетонитрил: вода - 1:1 и экстрагируют Мезотрион в течение 30 мин на встряхивателе. Экстракт фильтруют через бумажный фильтр в концентратор емкостью 250 мл. Экстракцию повторяют еще раз, используя 50 мл экстрагирующей смеси, и встряхивая пробу в течение 30 мин. Экстракт фильтруют в тот же концентратор. Объединенный экстракт упаривают на ротационном вакуумном испарителе до водного остатка при температуре не выше 40 °С. (Осторожно! При интенсивном вскипании пробы возможен ее переброс в приемную колбу!).
К водному остатку в концентраторе добавляют 30 мл 5%-ного водного раствора бикарбоната натрия, подщелачивая раствор до рН=8, перемешивают содержимое и отфильтровывают через бумажный фильтр в делительную воронку емкостью 500 мл. Концентратор обмывают 50 мл дистиллированной воды и отфильтровывают ее в ту же делительную воронку. К содержимому воронки добавляют еще 100 мл дистиллированной воды, 5 г хлорида натрия и 30 мл диэтилового эфира.
Далее анализ проводят по схеме, указанной в п.2.5.2.2.
2.5.4. Зерно кукурузы
Навеску измельченного зерна 10 г помещают в пластиковую банку емкостью 250 мл, заливают 50 мл смеси ацетонитрил:вода - 1:1 и экстрагируют Мезотрион, как указано в п.2.5.2. Объединенный экстракт упаривают на ротационном вакуумном испарителе до водного остатка при температуре не выше 40 °С. (Осторожно! При интенсивном вскипании пробы возможен ее переброс в приемную колбу!).
Далее анализ проводят по схеме, указанной в п.2.5.2.2.
2.6. Условия хроматографирования и обработка результатов
2.6.1. Условия хроматографирования
Хроматограф "Кристалл 2000 м" с электронозахватным детектором (ЭЗД ![]() Ni) с пределом детектирования по Линдану 5·10
Ni) с пределом детектирования по Линдану 5·10![]() г/см
г/см![]() .
.
Колонка капиллярная кварцевая НР-5 (Crosslinked 5% РН ME Siloxane), длина 15 м, внутренний диаметр 0,32 мм, толщина пленки 0,25 мкм.
Температура термостата колонки программированная. Начальная температура - 180 °С, выдержка 3 мин; нагрев колонки по 2 градуса в минуту до температуры 200 °С, выдержка 7 мин; нагрев колонки по 30 градусов в минуту до температуры 260 °С выдержка 4 мин.
Температура испарителя - 250 °С, детектора - 320 °С.
Газовый режим - Нормальный.
Газ-носитель - гелий (Г1). Тип регулятора расхода гелия - РРГ 11, линейная скорость - 20 см/с, давление на входе 28,56 кПа.
Газ 2 (Г2) - гелий (продувка испарителя), расход 1 мл/мин, сброс 1:20.
Газ 3 (Г3) - азот (поддув в детектор), расход во время анализа - 35 мл/мин.
Продувка системы после анализа при температуре 260 °С в течение 4 мин: продувка испарителя гелием - 50 мл/мин; продувка детектора азотом - 65 мл/мин.
Абсолютное время удерживания Мезотриона - 9 мин 52 с - 10 мин 05 с.
Объем вводимой пробы - 1 мкл.
Линейность детектирования сохраняется в пределах 0,05-0,5 нг.
Образцы, дающие пики большие, чем стандартный раствор с концентрацией 0,5 мкг/мл, разбавляют.
2.6.2. Обработка результатов анализов
Содержание Мезотриона в пробах воды, почвы, зеленой массе и зерне кукурузы рассчитывают методом абсолютной калибровки по формуле:
![]() ,
,
где ![]() - содержание Мезотриона в пробе, мг/кг или мг/л;
- содержание Мезотриона в пробе, мг/кг или мг/л;
![]() - высота пика образца, мм;
- высота пика образца, мм;
![]() - высота пика стандарта, мм;
- высота пика стандарта, мм;
![]() - концентрация стандартного раствора по Мезотриону, мкг/мл;
- концентрация стандартного раствора по Мезотриону, мкг/мл;
![]() - объем экстракта, подготовленного для хроматографирования (мл);
- объем экстракта, подготовленного для хроматографирования (мл);
![]() - масса или объем анализируемого образца, г или мл.
- масса или объем анализируемого образца, г или мл.
![]() - содержание Мезотриона в аналитическом стандарте.
- содержание Мезотриона в аналитическом стандарте.
3. Требования техники безопасности
Необходимо соблюдать общепринятые правила безопасности при работе с органическими растворителями, токсичными веществами, электронагревательными приборами и сжатыми газами.
4. Разработчики
Калинин В.А., проф., к. с-х. н., Калинина Т.С., к. с-х. н., Довгилевич А.В., к. хим. н., Фролова Н.С.
Московская сельскохозяйственная академия им. К.А.Тимирязева. Учебно-научный консультационный центр "Агроэкология пестицидов и агрохимикатов", 127550, Москва, Тимирязевская ул., д.53, стр.1, телефон/факс: 976-37-68 / 976-43-26.
Текст документа сверен по:
официальное издание
Определение остаточных количеств пестицидов
в пищевых продуктах, сельскохозяйственном сырье
и объектах окружающей среды: Сб. метод. указаний. Вып.3. Ч.2. -
М.: Федеральный центр госсанэпиднадзора
Минздрава России, 2004