ИНСТРУКЦИЯ
ПО ЛАБОРАТОРНОМУ КОНТРОЛЮ ОЧИСТНЫХ СООРУЖЕНИЙ
НА ЖИВОТНОВОДЧЕСКИХ КОМПЛЕКСАХ
Часть I
Организация лаборатории.
Методы санитарно-бактериологического
и гельминтологического анализа сточных вод
В разработке инструкции приняли участие научно-исследовательские институты и организации: Гипронисельхоз (Н.Г.Ковалев, М.М.Еселевич, Н.С.Максимовский, И.К.Глазков, С.Д.Дурдыбаев, С.А.Кабанкова), Свинопром РСФСР (Ю.М.Ревякин), совхоз "50 лет СССР" Калининской обл., (П.П.Смирнов), Укрниигипросельхоз (О.П.Смирнов), НИПТИМЭСХ Нечерноземной зоны РСФСР (В.Н.Афанасьев), ЛИСИ (Б.Г.Мишуков), ВНИИМЖ (Ю.Е.Щуть, В.И.Нетеча), ВНИИВС (И.Д.Гришаев), Росгипрониисельстрой (И.П.Можайцев), ВИГИС (А.А.Черепанов).
Инструкция включает правила организации лабораторий по контролю за работой очистных сооружений, методики отбора и хранения проб жидкого навоза и продуктов его переработки, проведение химических, санитарно-бактериологических и гельминтологических анализов, методы оценки результатов контрольных измерений, правила техники безопасности при работе в лаборатории и предназначена для использования в лабораториях действующих и строящихся комплексов по производству животноводческой продукции.
Инструкция согласована с Главным управлением ветеринарии Министерства сельского хозяйства CCCP, Главживпромом СССР, Главсельстройпроектом, Минздравом СССР.
УТВЕРЖДЕНА Министерством сельского хозяйства СССР 17 ноября 1980 г.
1. ВВЕДЕНИЕ
В соответствии с постановлением ЦК КПСС и Совета Министров СССР "О развитии производства продуктов животноводства на промышленной основе" (1971 г.) и "Основными направлениями развития народного хозяйства СССР на 1975-1980 гг." в девятой пятилетке в нашей стране развернуто строительство крупных животноводческих ферм и комплексов по производству молока, говядины и свинины.
Концентрация большого количества животных на ограниченной территории потребовала принципиально нового подхода к проблеме удаления отходов из помещений, их переработки и использования. В этой связи возникла необходимость создания единой инструкции по проведению химического и санитарно-бактериологического контроля за работой очистных сооружений и обработки животноводческих стоков. При обработке стоков используют разнообразные механические, биологические, физические и химические методы, позволяющие последовательно очистить их от механических примесей, коллоидных и растворенных органических соединений, обезвредить от патогенной микрофлоры, яиц гельминтов и очистить от семян сорных растений.
Очистные сооружения для обработки животноводческих стоков можно условно разделить на следующие группы:
установки и сооружения для механической обработки жидкого навоза (механические решетки, вибросита, виброгрохоты, дуговые сита, барабанные сепараторы, отстойники);
установки для биологической очистки жидкой фракции навоза (аэротенки, окислительные лагуны);
сооружения и установки для доочистки сточных вод (биопруды, поля орошения);
сооружения и установки для дезинфекции стоков (установки с пароструйными аппаратами, установки для контактного нагрева, озонаторы, источники ионизирующих излучений);
установки для обработки осадков, в том числе для обезвоживания (центрифуги, вакуум-фильтры, илоуплотнители, дуговые сита) и сушки (барабанные и распылительные сушилки).
В условиях животноводческого комплекса очистные сооружения могут включать все вышеперечисленные группы установок и сооружений или часть из них, в зависимости от требований к степени очистки сточных вод, почвенно-климатических условий хозяйства, обеспеченности их энергией, топливом, кадрами.
В зависимости от схемы очистки стоков руководитель лаборатории определяет необходимый объем контрольных анализов и места отбора проб.
Контроль за качественным и количественным составом жидкого навоза при переработке позволяет регулировать процесс его очистки, следить за состоянием очистных сооружений и установок и давать рекомендации о пригодности получаемых продуктов к утилизации.
Данная инструкция предназначена для инженерно-технических работников очистных сооружений животноводческих промышленных комплексов, специалистов проектных и научных институтов, связанных с проектированием и строительством животноводческих ферм и комплексов промышленного типа, сотрудников государственных органов водного, санитарного и ветеринарного надзора.
2. ОРГАНИЗАЦИЯ ЛАБОРАТОРИИ ПО КОНТРОЛЮ ЗА РАБОТОЙ СООРУЖЕНИЙ
ПО ОБРАБОТКЕ НАВОЗА НА ЖИВОТНОВОДЧЕСКИХ КОМПЛЕКСАХ
2.1. Месторасположение лаборатории
Лаборатории должны быть организованы на комплексах по выращиванию и откорму 54 тыс. свиней в год и более при наличии сооружений с искусственной биологической очисткой навозных стоков.
Для небольших ферм при наличии сооружений по обработке жидкого навоза, включающих установки для биологической очистки навозных стоков, доочистки и дезинфекции сточных вод, обработки осадка, рекомендуется построить межхозяйственную лабораторию в пределах одного района, обязав ее проводить ежемесячный контроль качественного состава подготовленных к утилизации стоков на мелких и средних фермах (по договоренности с местными государственными органами санитарного надзора).
2.2. Помещение для лаборатории
Контрольную лабораторию следует располагать на территории очистных сооружений. Размеры лабораторного помещения зависят от типа и размера комплекса и схемы очистных сооружений. На крупных свинокомплексах по выращиванию и откорму (108-216 тыс. голов в год) с биологической очисткой навозных стоков следует иметь помещения для физико-химической лаборатории по контролю сточных вод и осадков (25-30 м![]() ), весовой (6 м
), весовой (6 м![]() ), бактериологической и гельминтологической лаборатории (15-20 м
), бактериологической и гельминтологической лаборатории (15-20 м![]() ), моечной и автоклавной (10 м
), моечной и автоклавной (10 м![]() ), склада для хранения посуды и реактивов (10 м
), склада для хранения посуды и реактивов (10 м![]() ). Минимальная площадь помещения для лаборатории 20 м
). Минимальная площадь помещения для лаборатории 20 м![]() . Помещение лаборатории должно быть обеспечено центральным отоплением, электрическим освещением, вводом электротока, газа, воздуха, приточно-вытяжной вентиляцией, водопроводом, канализацией.
. Помещение лаборатории должно быть обеспечено центральным отоплением, электрическим освещением, вводом электротока, газа, воздуха, приточно-вытяжной вентиляцией, водопроводом, канализацией.
При проведении бактериологических и гельминтологических анализов необходимо предусмотреть комнату для бактериологических исследований с застекленным боксом (площадь 3-5 м![]() ), оборудованным бактерицидными лампами.
), оборудованным бактерицидными лампами.
Помещение лаборатории должно быть оборудовано лабораторными столами и столами для приборов, шкафами для хранения аппаратуры, посуды, реактивов.
Лабораторные столы устанавливают из расчета не менее 1,5х0,9 м для каждого сотрудника. Освещенность поверхности столов должна быть не менее 500 лк. Стены помещений до высоты 170 см следует облицевать плиткой или покрыть светлой масляной краской, а пол - линолеумом.
2.3. Ориентировочный перечень приборов, оборудования и реактивов,
необходимых для лаборатории (табл.1, 2)
Таблица 1
|
Наименование |
Тип, марка. |
ГОСТ или ТУ |
Количество, шт. |
|
1 |
2 |
3 |
4 |
|
Приборы и оборудование | |||
|
Стол лабораторный каркасный |
СЛК-1 |
- |
4 |
|
Стол титровальный с полкой |
1,20x0,65x1,80 |
- |
1 |
|
Столик инструментальный |
СН-4 |
- |
4 |
|
Шкафы для хранения реактивов и посуды |
1,10x0,40x2,0 |
- |
4 |
|
Вытяжной шкаф |
2,05x0,75x2,75 |
- |
1 |
|
Шкаф для хранения ядов |
- |
- |
2 |
|
Стол письменный |
- |
- |
1 |
|
Табуретки |
- |
- |
2 |
|
Стулья |
- |
- |
2 |
|
Калориметр-нефелометр фотоэлектрический |
ФЭК-56М |
- |
1 |
|
Дистиллятор |
Д-4 |
- |
2 |
|
Весы лабораторные |
ВЛП-200 |
- |
2 |
|
Весы аналитические |
АДВ-200 |
- |
1 |
|
Весы технические I класса |
ВТ-1 |
- |
1 |
|
Разновесы к аналитическим и техническим весам |
- |
- |
2 |
|
Лабораторная центрифуга |
ЦЛН-2, ЛС-49 |
- |
1 |
|
Электропечь муфельная |
МП-27М |
- |
2 |
|
Термостат электрический суховоздушный |
ТС-80 |
- |
2 |
|
Шкаф сушильный электрический круглый |
2В-151 |
- |
2 |
|
Водяная баня многогнездная |
- |
- |
2 |
|
рН-метр милливольтметр |
РН-340 |
- |
1 |
|
Автоклав вертикальный |
- |
- |
1 |
|
Холодильник |
- |
- |
1 |
|
Песочная баня |
- |
- |
2 |
|
Электроплитки |
- |
- |
20 |
|
Штатив лабораторный с набором лап и колец |
- |
- |
10 |
|
Колбонагреватель |
- |
- |
5 |
|
Набор сверл для пробок |
- |
- |
1 |
|
Щипцы тигельные |
- |
- |
3 |
|
Ножницы |
- |
- |
3 |
|
Шпатели металлические |
- |
- |
5 |
|
Груши резиновые, разные |
- |
- |
10 |
|
Зажимы винтовые (Гофмана) |
- |
- |
20 |
|
Зажимы пружинные (Мора) |
- |
- |
20 |
|
Перчатки резиновые: |
|||
|
аналитические |
- |
- |
50 |
|
анатомические |
- |
- |
20 |
|
Аппарат Боброва |
- |
- |
10 |
|
Компрессор |
- |
- |
2 |
|
Ведро эмалированное |
10 л |
- |
3 |
|
Пробоотборник-батометр |
- |
- |
2 |
|
Термометр на 50 °С |
- |
- |
5 |
|
" " 10-200 °С |
- |
- |
5 |
|
Часы песочные (на 3, 5, 10 мин) |
- |
- |
10 |
|
Оборудование для бактериологической и гельминтологической лаборатории | |||
|
Микроскоп биологический |
МБ-3 |
- |
1 |
|
Биолам Р-6 в комплекте с осветителем |
- |
- |
1 |
|
Осветитель к микроскопу |
МБС-1 |
- |
1 |
|
Аппарат для счета колоний |
- |
- |
1 |
|
Спиртовые горелки |
- |
- |
5 |
|
Центрифуга ЦЛС-31 с комплектом пробирок |
- |
- |
1 |
|
Стеклянная посуда и аппаратура | |||
|
Колба мерная с притертой пробкой |
1000 мл |
1770-64* |
5 |
|
________________ | |||
|
|
500 " |
То же |
10 |
|
|
250 " |
" |
20 |
|
|
200 " |
" |
20 |
|
|
100 " |
" |
20 |
|
|
50 " |
" |
20 |
|
Бюретка прямая с оливой |
25 " |
" |
20 |
|
Воронка лабораторная |
56 " |
8613-64 |
20 |
|
|
75 " |
То же |
20 |
|
|
100 " |
" |
10 |
|
Насос водоструйный (пластмассовый) |
- |
1069-63 |
5 |
|
Колбы конические с нормальным шлифом на 250 мл |
КНШ-29-250 |
1770-64 |
50 |
|
Колбы плоскодонные с нормальным шлифом |
ПНШ-29-250 |
То же |
50 |
|
Колбы плоскодонные с нормальным шлифом |
ПНШ-29-500 |
" |
20 |
|
Колба для фильтрования под вакуумом (Бюхнера) |
500 мл |
6514-63 |
2 |
|
|
1000 " |
То же |
2 |
|
Воронка для фильтрования под вакуумом (Бюхнера) |
60 мл |
- |
2 |
|
Пробки пустотелые |
100 " |
- |
2 |
|
п-29 |
50 | ||
|
Стаканы высокие с носиком |
ВН (500 мл) |
10394-63 |
20 |
|
Стаканы низкие с носиком |
НН (400 мл) |
То же |
10 |
|
|
НН (100 мл) |
" |
20 |
|
|
НН (50 мл) |
" |
20 |
|
Холодильник шариковый со шлифом НШ-29 |
4-6 шар. |
- |
10 |
|
Цилиндр мерный |
10 мл |
1770-64 |
15 |
|
|
25 " |
То же |
15 |
|
|
50 " |
" |
15 |
|
|
100 " |
" |
50 |
|
|
250 " |
" |
10 |
|
Эксикатор |
Э-190 мм |
6771-64 |
5 |
|
|
Э-250 " |
То же |
3 |
|
Кружки фарфоровые |
500 мл |
- |
10 |
|
|
1000 " |
- |
10 |
|
Каплеуловитель-насадка (ловушка Кьельдаля) |
- |
29-300 |
15 |
|
Колбы Кьельдаля |
500 мл |
10 | |
|
Пипетки мерные Мора |
100 мл |
- |
10 |
|
|
50 " |
- |
10 |
|
|
25 " |
- |
20 |
|
|
20 " |
- |
20 |
|
|
10 " |
- |
20 |
|
|
5 " |
- |
20 |
|
Пипетки мерные, градуированные |
10 мл |
- |
30 |
|
|
5 " |
- |
20 |
|
|
2 " |
- |
30 |
|
|
1 " |
- |
20 |
|
Тигли и чашки фарфоровые |
50 мл |
- |
200 |
|
|
25 " |
- |
50 |
|
Стаканы фарфоровые |
500 мл |
- |
10 |
|
|
250 " |
- |
10 |
|
Бюксы с крышкой |
0,40x0,40 |
- |
20 |
|
|
0,35x0,30 |
20 | |
|
Склянки для определения БПК |
250 мл |
- |
100 |
|
Шпатели фарфоровые |
- |
- |
20 |
|
Капельницы с притертой пробкой |
- |
- |
10 |
|
Кристаллизаторы |
100-500 мм |
- |
5 |
|
Часовые стекла |
Разные |
- |
по 10 |
|
Стекла предметные |
- |
- |
100 |
|
Стекла покровные |
- |
- |
500 |
|
Прочие материалы | |||
|
Шланги резиновые |
|
- |
5 кг |
|
Пробки резиновые: |
|||
|
N 16 |
- |
- |
0,5 кг |
|
N 20 |
- |
- |
0,5 " |
|
N 22 |
- |
- |
0,5 " |
|
N 27 |
- |
- |
2 " |
|
N 29 |
- |
- |
2,5 " |
|
N 32 |
- |
- |
2 " |
|
N 42 |
- |
- |
1 " |
|
N 45 |
- |
- |
1 " |
|
Ерши для мытья посуды |
20 шт. | ||
|
Фильтры беззольные (синяя и красная полоса) |
|
50 пачек | |
|
Фильтровальная бумага |
- |
- |
10 кг |
|
Карандаш по стеклу |
- |
- |
2 кор. |
|
Мыло хозяйственное |
- |
- |
1 кг |
Таблица 2
|
Номенклатурный номер |
Наименование |
Квалификация |
Количество, кг, л |
|
1 |
2 |
3 |
4 |
|
Реактивы | |||
|
010015 |
Азотная кислота |
ч.д.а. |
10 |
|
010101 |
Алюминий сернокислый |
ч.д.а. |
10 |
|
010316 |
Аммоний хлористый |
ч.д.а. |
20 |
|
010217 |
Аммиак водный, 26% |
ч.д.а. |
20 |
|
010717 |
Аммоний роданистый |
х.ч. |
3 |
|
022541 |
Борная кислота |
ч.д.а. |
10 |
|
320007 |
Бромфеноловый синий |
ч.д.а. |
0,20 |
|
040138 |
Глицерин |
ч. д. а. |
3 |
|
330010 |
Йод, 0,1 н. |
- |
3 |
|
100063 |
Кали едкое |
ч.д.а. |
20 |
|
100073 |
Калий азотнокислый |
ч.д.а. |
1 |
|
100070 |
Калий азотистокислый |
ч.д.а. |
2 |
|
100125 |
Калий йодистый |
ч.д.а. |
30 |
|
100187 |
Калий роданистый |
ч.д.а. |
2 |
|
100232 |
Калий фосфорнокислый (двузамещенный) |
ч.д.а. |
10 |
|
100148 |
Калий марганцовокислый |
ч.д.а. |
10 |
|
100229 |
Калий фосфорнокислый однозамещенный |
ч.д.а. |
10 |
|
130142 |
Калий двухромовокислый |
ч.д.а. |
10 |
|
330012 |
Калий двухромовокислый, фиксанал, 0,1 н. |
20 кор. | |
|
100167 |
Калий-натрий виннокислый |
ч.д.а. |
5 |
|
100360 |
Кальций хлористый кристаллический |
ч.д.а. |
5 |
|
100479 |
Крахмал растворимый |
ч.д.а. |
10 |
|
120124 |
Марганец хлористый |
ч.д.а. |
10 |
|
120114 |
Марганец сернокислый |
ч.д.а. |
10 |
|
120194 |
Медь сернокислая |
ч.д.а. |
5 |
|
120283 |
Метилоранж |
ч.д.а. |
0,25 |
|
120053 |
Магний сернокислый |
ч.д.а. |
2 |
|
330023 |
Метиленовый голубой |
ч.д.а. |
1 |
|
320017 |
Метиленовый красный |
ч.д.а. |
1 |
|
130315 |
Натрий хлористый |
х.ч. |
2 |
|
130224 |
Натрий салициловокислый |
ч.д.а. |
2 |
|
130300 |
Натрий фосфорнокислый двузамещенный |
ч.д.а. |
2 |
|
130109 |
Натрий едкий |
ч.д.а. |
10 |
|
130280 |
Натрий уксуснокислый |
ч.д.а. |
10 |
|
130242 |
Гипосульфит натрия |
х.ч. |
2 |
|
330027 |
Натрий серноватистокислый, 0,1 н., фиксанал |
20 кор. | |
|
010261 |
Аммоний молибденовокислый |
ч.д.а. |
2 |
|
070064 |
Железо хлорное |
ч.д.а. |
1 |
|
250002 |
Кислота щавелевая |
ч.д.а. |
5 |
|
200037 |
Кислота фенилантраниловая |
ч. |
1 |
|
200201 |
Кислота фосфорная |
ч.д.а. |
2 |
|
170344 |
Кислота сульфаминовая |
ч. |
1 |
|
170394 |
Кислота сульфаниловая |
ч.д.а. |
2 |
|
170211 |
Кислота серная, конц. |
ч.д.а. |
100 |
|
330031 |
Кислота серная, 0,1 н. |
- |
10 кор. |
|
190022 |
Кислота уксусная |
ч.д.а. |
20 |
|
330035 |
Кислота уксусная, 0,1 н. |
- |
20 кор. |
|
140047 |
Олово двухлористое |
ч.д.а. |
0,2 |
|
160004 |
Реактив Грисса |
ч.д.а. |
1 |
|
160008 |
Реактив Несслера |
ч.д.а. |
1 |
|
130348 |
Альфанафтиламин |
ч.д.а. |
0,5 |
|
170164 |
Серебро азотнокислое |
- |
0,2 |
|
320027 |
Фенолфталеин |
ч.д.а. |
0,5 |
|
260085 |
Этилентиомочевина |
ч.д.а. |
2 |
|
|
Фенол |
х.ч. |
2 |
|
|
Соль Мора |
ч.д.а. |
10 |
2.4. Состав сотрудников
|
Лаборатория объединений (межхозяйственная): |
||
|
1. |
Инженер-химик-технолог (зав. лабораторией) |
- 1 |
|
2. |
Инженер-химик-аналитик |
- 1 |
|
3. |
Микробиолог (гельминтолог) |
- 1 |
|
4. |
Лаборанты-химики (третий разряд) |
- 4 |
|
5. |
Пробоотборщик |
- 1 |
|
Лаборатория комплексов на 54 и более голов свиней в год: | ||
|
1. |
Инженер-химик-технолог (зав. лабораторией) |
- 1 |
|
2. |
Старший лаборант (техник-аналитик) |
- 1 |
|
3. |
Микробиолог (гельминтолог) |
- 1 |
|
4. |
Лаборанты-химики (третий разряд) |
- 3 |
2.5. Права и обязанности сотрудников лаборатории
Сотрудники контрольной лаборатории непосредственно подчиняются начальнику очистных сооружений и дирекции комплекса.
Права, обязанности и ответственность сотрудников определяются в соответствии с "Положением о санитарной лаборатории на промышленном предприятии", "Инструкцией по методическому руководству ведомственными лабораториями контроля качества вод", "Типовой должностной инструкцией для заведующего лабораторией водопроводных очистных сооружений" и "Должностной инструкцией лаборанта очистных сооружений", разрабатываемой на каждом комплексе.
3. МЕТОДИКА ОТБОРА ПРОБ ДЛЯ ЛАБОРАТОРНОГО ХИМИЧЕСКОГО АНАЛИЗА
3.1. Цель и периодичность проведения анализов, объекты наблюдений
Контроль за работой очистных сооружений по обработке навоза на животноводческих комплексах осуществляется по технологическим показателям машин и установок, по количественным, физико-химическим, санитарно-бактериологическим характеристикам жидкого навоза и продуктов его переработки на всех стадиях очистки, с целью регулирования процесса количественного и качественного учета работы отдельных узлов и механизмов.
Для правильной оценки работы необходимо учитывать общий объем стоков, количество осадка (с сит, сепараторов, виброгрохотов, отстойников и навозонакопителей), объем циркулирующего и избыточного активного ила, а также объем воздуха, поступающего в аэротенки, количество израсходованной энергии (механической, электрической и тепловой) на каждом сооружении или установке, количество хлора или другого дезинфицирующего средства, применяемого для обеззараживания стоков.
Контроль перечисленных параметров технологического процесса осуществляют с помощью специальных устройств, механизмов и приборов (автоматических пробоотборников, расходомеров типа ИР-11, ИР-14 и т.д.).
Схема контроля процесса по физико-химическим показателям принимается в зависимости от состава очистных сооружений по обработке навозных стоков. Для служб по эксплуатации очистных сооружений рекомендуется следующая ориентировочная карта химического лабораторного контроля (табл.3).
Таблица 3
Химический лабораторный контроль
|
Место отбора проб |
Вид пробы |
Проводимые анализы |
Периодичность проведения анализов |
|
1 |
2 |
3 |
4 |
|
Анализ исходного жидкого навоза и его жидкой фракции | |||
|
Приемный резервуар |
Среднесуточная, взболтанная |
Расход сточных вод |
Ежедневно |
|
|
Температура |
" | |
|
|
Запах, окраска |
" | |
|
|
Взвешенные вещества |
" | |
|
|
рН |
" | |
|
|
Сухой остаток |
" | |
|
|
ХПК* |
" | |
|
|
БПК** полная |
1 раз в неделю | |
|
|
Азот общий |
То же | |
|
|
Азот аммонийный |
" | |
|
|
Фосфор общий |
" | |
|
|
Влажность |
" | |
|
|
Бактериологический |
1 раз в месяц | |
|
Первичные отстойники |
Разовая |
Температура |
Ежедневно |
|
|
рН |
" | |
|
|
Взвешенные вещества |
" | |
|
|
ХПК |
" | |
|
|
Растворенный кислород |
" | |
|
Осветлители |
Разовая |
Взвешенные вещества до и после осветления |
1 раз в неделю |
|
|
ХПК* |
То же | |
|
|
Растворенный кислород |
" | |
|
Виброгрохот, вибросита, дуговые сита, вибропрессы |
Среднесуточная |
Взвешенные вещества |
Ежедневно |
|
|
ХПК* |
" | |
|
|
Расход фильтрата |
" | |
|
Центрифуги |
Среднепропорциональная (во время работы) |
Взвешенные вещества |
" |
|
|
ХПК* |
" | |
|
|
Расход фугата |
" | |
|
|
Сухой остаток |
" | |
|
Аэротенки (I, II и III ступени) |
Среднесуточная |
рН |
" |
|
|
Температура |
" | |
|
|
ХПК* |
" | |
|
|
Запах |
Ежедневно | |
|
|
Азот общий |
1 раз в неделю | |
|
|
Азот аммонийный |
То же | |
|
|
Нитриты |
" | |
|
|
Нитраты |
" | |
|
|
Фосфор общий |
" | |
|
|
Взвешенные вещества |
Ежедневно | |
|
Для каждого аэротенка |
Доза ила по сухому или беззольному веществу |
" | |
|
Растворенный кислород |
" | ||
|
|
Иловый индекс |
" | |
|
|
Зольность ила |
" | |
|
Вторичные отстойники, контактные резервуары |
Среднесуточная |
Взвешенные вещества |
" |
|
|
ХПК* |
" | |
|
|
Азот аммонийный |
" | |
|
|
Нитриты |
" | |
|
|
Нитраты |
" | |
|
|
рН |
" | |
|
|
Температура |
" | |
|
|
Фосфор общий |
1 раз в неделю | |
|
|
Азот общий |
То же | |
|
|
БПК** полный |
" | |
|
|
Растворенный кислород |
" | |
|
Микробиологические и гельминтологические анализы |
1 раз в месяц | ||
|
Илоуплотнитель |
Среднесуточная |
Концентрация избыточного ила |
Ежедневно |
|
Взвешенные, вещества и ХПК* надиловой жидкости |
" | ||
|
Биопруды (для каждой секции отдельно), дренажная вода с полей орошения, полевые навозохранилища |
Разовая |
Запах |
" |
|
|
рН |
" | |
|
|
Температура |
" | |
|
|
ХПК* |
" | |
|
|
Растворенный кислород |
" | |
|
|
Взвешенные вещества |
" | |
|
|
БПК** полная |
1 раз в неделю | |
|
|
Нитраты |
То же | |
|
|
Нитриты |
" | |
|
Микробиологические и гельминтологические анализы |
1 раз в месяц | ||
|
Анализ осадков | |||
|
Виброгрохот, вибросита, прессы, центрифуги, дуговые сита |
Среднепропорциональная |
Влажность |
То же |
|
|
Азот общий |
" | |
|
|
Фосфор общий |
" | |
|
|
Зольность |
" | |
|
Осадок первичных отстойников или илоуплотнителя |
Среднедропорциональная |
Влажность |
" |
|
|
Зольность |
" | |
|
|
Азот общий |
" | |
|
|
Фосфор общий |
" | |
|
Осадок со вторичных отстойников |
Среднепропорциональная |
Влажность |
1 раз в неделю |
|
|
Зольность |
То же | |
|
|
Гельминтологический анализ |
1 раз в месяц | |
_______________
* Химическая потребность в кислороде.
** Биохимическая потребность в кислороде.
Определение калия на пламенном фотометре, санитарно-бактериологические исследования сточных вод животноводческого комплекса, гельминтологические исследования навозных стоков и продуктов их переработки, гидробиологический анализ активного ила, определение дегидрогеназной активности ила, а также зон сапробности при спуске сточных вод в водоемы проводят работники лабораторий объединений или лаборатории районных и областных санитарно-эпидемиологических станций (СЭС).
Водоемы и грунтовые воды находятся под контролем государственных органов по регулированию использования и охране вод, санитарно-эпидемиологической службы и органов рыбоохраны. Для учета влияния очищенных сточных вод, используемых для орошения, на качество речной воды берут пробы в двух местах - по течению реки выше и ниже прилегающих орошаемых площадей, а грунтовые воды - выше и ниже по течению грунтового потока. Периодичность взятия проб - не реже 1 раза в месяц. Порядок проведения контроля согласовывается с государственными органами по регулированию использования и охране вод и СЭС.
3.2. Техника отбора и транспортирования проб
Место и время отбора проб для анализа выбирают только после подробного ознакомления с технологией производства.
Необходимо правильно брать пробы для анализа. Для полного анализа берут не менее 3 л сточных вод и 1 л для сокращенного анализа.
Отбираемые пробы из поступающих и очищенных стоков должны быть по возможности из одного потока. Для этого следует учитывать время прохождения сточных вод через очистные сооружения (определяется вычислением).
Навозные стоки и продукты их переработки отличаются непостоянным составом, поэтому разовые пробы берутся редко и в основном для определения в них отдельных характерных компонентов. Обычно берется среднесменная или среднесуточная проба, которая отбирается равными порциями через 3-4 ч в течение суток или смены, или среднепропорциональная проба, отбираемая через равные промежутки времени, при этом количество отбираемого образца всегда должно быть пропорционально расходу сточных вод или осадка в момент отбора пробы.
Пробы отбирают в отдельные склянки с широким горлом (не менее 35 мм) емкостью 250-300 мл, для чего используют химически стойкую посуду из стекла или полиэтилена. Вся используемая посуда должна быть вымыта моющими средствами, ополоснута соляной кислотой и высушена. Сосуд для отбора пробы предварительно ополаскивают 2-3 раза исследуемой водой. Отдельные пробы сливают в общий сосуд (бутыль или ведро) и перед анализом тщательно перемешивают.
Для взятия проб можно использовать бутыль, прикрепленную к шесту. При необходимости взятия проб с определенной глубины следует использовать батометр или другие специальные пробоотборные устройства.
Отбор проб в разных местах очистных сооружений имеет свои особенности. Пробы исходного жидкого навоза и очищенных сточных вод отбирают из подающего канала или подающей (отводящей) трубы в месте, где не оседают взвешенные вещества. Отбирать пробы из лотков и каналов следует при помощи специального пробоотборника, позволяющего брать пробу воды с глубины лотка или канала. При отсутствии доступных для взятия проб подводящих и отводящих каналов пробу отбирают в местах интенсивного перемешивания стоков (быстротоки, перепады, гребень водосливной перегонки, водослив поперечного желоба, водослив сборного желоба и т.д.).
При наличии нескольких параллельно работающих секций очистных сооружений для одних и тех же стоков пробы для текущего контроля следует отбирать в общих подводящих или отводящих каналах. Для определения качества работы отдельных секций очистных сооружений пробы для анализа отбирают из каждой исследуемой секции.
Отбор проб очищенных стоков рекомендуется производить автоматическими пробоотборниками в местах, заранее определенных технологом лаборатории очистных сооружений, и на заданной глубине потока. Для ручного отбора проб можно использовать ковши с длинной ручкой.
При анализе работы виброгрохота, вибросит, дуговых сит, пресса, центрифуги исходные пробы отбирают до подачи на установки осадков с ленты транспортера и жидкости со сборных лотков.
Пробы осадков из отстойников и илоуплотнителей берут во время их выпуска через каждые 10 мин, по 100-150 мм, и выливают в общую емкость. Количество взятых проб и продолжительность выпуска осадка регистрируют. Пробы сточных вод отбирают из подводящего и сборного лотков через 3-4 ч в течение смены или суток.
Процесс очистки стоков в аэротенках контролируют определением дозы активного ила и его качества, содержанием растворенного кислорода в смеси жидкости и ила, а также по количеству минерализируемых органических загрязнений, величинам ХПК и БПК очищенной жидкости.
Пробы для определения доз активного ила отбирают в сборных каналах, чашах деаэраторов или распределительных чашах вторичных отстойников в количестве 250-300 мл 1 раз в сутки или каждые 4 ч во время проведения полного анализа. Местом отбора избыточного ила может быть эрлифт или подающий лоток в илоуплотнителе. Местом отбора проб для определения концентрации растворенного кислорода для аэротенков-отстойников является специальное отверстие в щите над карманом-отстойником. Для аэротенков-смесителей пробу на растворенный кислород отбирают на выходе из аэротенка.
Для определения концентрации растворенного кислорода в аэротенке пробы отбирают батометром или литровой бутылкой со специальной насадкой, представляющей собой резиновую пробку, в которую вставлены две стеклянные трубки разной длины, одна оканчивается у дна бутылки, другая у пробки. Сосуд, закрытый резиновой пробкой, опускают на заданную глубину, после заполнения иловой жидкостью его поднимают на поверхность и закрывают стеклянной притертой пробкой, так чтобы в сосуде не было пузырьков воздуха.
Пробы ила берут из дренажных выпусков, а влажность ила определяют по расчетам влажности средних проб осадка, взятых с глубины ила в разных местах иловых площадок.
Для определения эффективности работы биологических прудов отбор проб следует проводить на месте водосливной перегородки каждой секции пруда. Качество сточных вод, очищенных в биологических прудах, при выпуске их в водоем должно отвечать требованиям Правил охраны поверхностных вод от загрязнения сточными водами* (М., 1974).
________________
* В настоящее время действующими документами в области охраны поверхностных вод являются СанПиН 2.1.5.980-00, ГН 2.1.5.1315-03, ГН 2.1.5.1316-03. Здесь и далее по тексту. - Примечание изготовителя базы данных.
Пробы твердой фракции навоза и компоста по 4-5 кг берут из 10-12 мест, не допуская снижения влаги. Средняя масса всей исходной пробы должна быть не менее 50 кг. Взятые пробы тщательно перемешивают, отбирают примерно 1/3 часть, укладывают на клеенку и разравнивают слоем на толще 10-12 см. Затем из 10-12 мест со всей глубины слоя берут пробы массой 200-300 г, из которых составляют среднюю пробу массой 2-3 кг. Стеклянные банки или полиэтиленовые мешки с отобранными средними пробами помещают в ящик со льдом и кислотой в кристаллизованном состоянии или добавляют по 3-5 мл толуола к каждой пробе, чтобы приостановить развитие микробиологических процессов. Для анализа среднюю пробу навоза массой 2-3 кг разравнивают ровным слоем в большом фарфоровом, стеклянном или эмалированном сосуде и из разных мест шпателем берут навески.
При необходимости транспортировки склянки с пробами перевозят в ящиках, обитых войлоком. При этом принимают меры против нагревания или замерзания проб.
3.3. Хранение и консервирование проб
Пробы следует хранить в холодильнике или консервировать. Однако консервация не обеспечивает длительного хранения пробы. Анализ проб необходимо делать не позже 24 ч с момента их взятия (допустимый срок хранения сточной воды 48 ч).
Температуру, окраску, запах, рН, содержание растворенного кислорода определяют сразу на месте взятия пробы.
Для определения БПК, сухого остатка, взвешенных веществ, влажности пробы необходимо хранить при 3-4 °С и делать анализ не позднее чем через 24 ч.
При определении ХПК пробу хранят при 3-4 °С не более суток. Для длительного хранения прибавляют 1 мл концентрированной серной кислоты на 1 л пробы.
Для определения общего азота, аммонийного, нитритов, нитратов, фосфора пробы можно консервировать - добавляют 1 мл концентрированной серной кислоты или 2-4 мл хлороформа на 1 л пробы, хранят при 3-4 °С не более суток.
4. ЛАБОРАТОРНЫЙ ЖУРНАЛ И ОЦЕНКА ПОЛУЧАЕМЫХ РЕЗУЛЬТАТОВ
4.1. Запись химико-технологических результатов контроля
Каждый лаборант должен иметь личный блокнот для записи расчетов и результатов проводимых им химических и санитарно-бактериологических анализов.
Начальник лаборатории отвечает за ведение общего лабораторного журнала. Для лабораторий объединений (межхозяйственных) и крупных комплексов (по выращиванию и откорму 108-216 тыс. голов свиней в год) рекомендуется вести лабораторный журнал для каждой установки или этапа очистки (см. приложения 1, 2, 3, 4, 5, 6).
При наличии более простых систем очистки навозных стоков следует вести сводный лабораторный журнал (см. приложение 7).
4.2. Оценка получаемых результатов
Задача лабораторного контроля при очистке животноводческих стоков состоит в определении характеристик исходных навозных стоков, подвергаемых обработке, сточной воды и осадков на разных стадиях очистки и обработки, а также в том, чтобы вовремя выявлять нарушения процесса очистки стоков или отдельных его звеньев и решать вопросы о возможных способах его утилизации.
Во всех случаях проводят качественный и количественный анализ навозных стоков и продуктов его переработки до поступления на сооружения и после очистки. Каждый показатель имеет определенное значение для характеристики работы очистных сооружений.
Температура влияет на процессы охлаждения, растворимость кислорода и скорость биологических процессов в первичных отстойниках и аэротенках. Степень задержания взвешенных веществ и очистки по БПК в отстойниках увеличивается с повышением, температуры (от 7 до 25 °С). В аэротенках при понижении температуры скорость биохимических процессов снижается, но увеличивается растворимость кислорода в воде, поэтому производительность аэротенков зимой незначительно снижается.
Температура стоков, поступающих в аэротенки, колеблется от 6 до 10 °С, во вторичных отстойниках - от 16 до 21 °С. Работа вторичных отстойников также зависит от колебаний температуры стоков. Вынос взвешенных веществ в отстойниках летом на 20-25% меньше, чем зимой, при прочих равных условиях эксплуатации.
Окраска, запах, прозрачность - показатели общей загрязненности животноводческих стоков. Резкое усиление запаха, изменение окраски могут свидетельствовать о залповом сбросе стоков или нарушении работы одного из узлов системы очистки.
Реакция среды (рН). Для развития большинства микроорганизмов, участвующих в процессе биохимической очистки стоков, оптимальное значение рН 7,0-8,0. Отклонение от этих пределов может привести к нарушению процесса очистки сточных вод.
Сухой остаток - дает представление о загрязнениях, которые находятся в исследуемом объеме навозных стоков, за исключением тех веществ, которые улетучиваются при выпаривании и сушке. Прокаливание сухого остатка позволяет определить примерное соотношение минеральной и органической частей загрязнения.
Взвешенные вещества - один из основных санитарных показателей загрязненности сточных вод. Количество взвешенных веществ в животноводческих стоках и очищенных сточных водах колеблется в широких пределах и зависит от времени суток (коэффициент неравномерности достигает двух). Этот показатель определяет пригодность очищенных сточных вод к спуску в открытые водоемы.
Биохимическая потребность в кислороде (БПК полная и БПК![]() ). БПК
). БПК![]() - количество кислорода, необходимого для полного биохимического окисления органических загрязнений сточной воды за 5 суток, БПК полная - количество потребленного кислорода при биохимическом окислении воды, доведенном до начала нитрификации (0,1 мг/л нитритов в воде).
- количество кислорода, необходимого для полного биохимического окисления органических загрязнений сточной воды за 5 суток, БПК полная - количество потребленного кислорода при биохимическом окислении воды, доведенном до начала нитрификации (0,1 мг/л нитритов в воде).
Учитывая длительность определения БПК полной (20 суток), на практике в основном определяют БПК![]() , которая принята в качестве стандартной характеристики. Для животноводческих стоков БПК
, которая принята в качестве стандартной характеристики. Для животноводческих стоков БПК![]() колеблется от 1,5 до 10,5 г/л и изменяется как по времени года, так и в течение суток. Однако при расчетах очистных сооружений БПК
колеблется от 1,5 до 10,5 г/л и изменяется как по времени года, так и в течение суток. Однако при расчетах очистных сооружений БПК![]() пересчитывают на БПК полную, коэффициент пересчета для свиного навоза 2, для навоза КРС - 2,8. Для жидкого свиного навоза БПК полная составляет 0,84 от химической потребности в кислороде. Показатель БПК стоков свинокомплексов, прошедших биологическую очистку, должен составлять приблизительно 0,25 от ХПК, при величине ХПК до 500 мг/л.
пересчитывают на БПК полную, коэффициент пересчета для свиного навоза 2, для навоза КРС - 2,8. Для жидкого свиного навоза БПК полная составляет 0,84 от химической потребности в кислороде. Показатель БПК стоков свинокомплексов, прошедших биологическую очистку, должен составлять приблизительно 0,25 от ХПК, при величине ХПК до 500 мг/л.
Химическая потребность в кислороде (ХПК) определяется по содержанию в стоках органических веществ, способных к окислению. Отношение массы органических веществ к ХПК составляет 1,2 для свиного навоза и 1,4 для навоза КРС. Этот показатель определяется быстро и точно и в отдельных случаях может заменить более длительное определение БПК![]() .
.
Разность между ХПК и БПК полной позволяет получить представление о содержании в пробе веществ, трудноокисляемых в условиях биологической обработки.
Значение ХПК для стоков свинокомплексов колеблется в пределах от 3 до 30 г/л, для прошедших биологическую очистку сточных вод - от 40 до 500 мг/л, для незагрязненных водоемов - от 2 до 4 мг/л, слабозагрязненных - 10-20 мг/л, сильно загрязненных - от 20 до 65 мг/л. Не следует сбрасывать сточные воды, прошедшие биологическую очистку, в открытые водоемы без дополнительной очистки.
Растворенный кислород - нормируемый показатель качества очистки сточных вод, содержание которого зависит от степени загрязненности стоков. В животноводческих стоках с высокой концентрацией органических загрязнений идет усиленное потребление растворенного кислорода. Поэтому в исходных стоках растворенного кислорода либо не бывает совсем, либо его концентрация не превышает 0,5-1,0 мг/л. В очищенной воде его содержится 2-6 мг/л. Для нормальной жизнедеятельности микроорганизмов в аэротенке растворенного кислорода не должно быть меньше 2 мг/л.
Азот. При характеристике животноводческих стоков анализируют четыре формы азота: общий, аммонийный, нитратный и нитритный. В сточных водах до переработки присутствует лишь общий и аммонийный азот. Присутствие окисленных форм азота и сопоставление их содержания с общим количеством азота в биологически очищенных стоках указывают на происходящие окислительные процессы в аэротенках. Обычно при нагрузках на активный ил 400-500 мг/г по БПК![]() нитрификации аммонийного азота не наблюдается. При нагрузках 100-150 мг по БПК
нитрификации аммонийного азота не наблюдается. При нагрузках 100-150 мг по БПК![]() на 1 г ила большая часть азота переходит в нитриты. Общее содержание азота в животноводческих стоках колеблется от 200 до 800 мг/л.
на 1 г ила большая часть азота переходит в нитриты. Общее содержание азота в животноводческих стоках колеблется от 200 до 800 мг/л.
Фосфаты. Они необходимы для биологической очистки стоков. Чем выше БПК сточной жидкости, тем больше их требуется. При недостатке фосфатов их добавляют в виде солей для ускорения процесса биологической очистки.
В навозе свиней фосфора содержится 2,1%, КРС - 2% от веса сухого вещества.
Исследование активного ила. Самая многочисленная группа микроорганизмов в активном иле - бактерии. Их содержится от 10![]() до 10
до 10![]() клеток в 1 г сухого ила. Активный ил очистных сооружений животноводческих комплексов представляет собой скопление микроорганизмов, состоящих из большого числа флокулированных, окруженных слизью клеток (зооглей). Способность к образованию слизи (капсулы) зависит от состава сточных вод, режима аэрации и т.д. Зооглеи имеют высокую ферментативную активность. Исследования показали, что видовой состав активного ила, его внешний вид и способность к отстаиванию могут служить индикаторами его состояния.
клеток в 1 г сухого ила. Активный ил очистных сооружений животноводческих комплексов представляет собой скопление микроорганизмов, состоящих из большого числа флокулированных, окруженных слизью клеток (зооглей). Способность к образованию слизи (капсулы) зависит от состава сточных вод, режима аэрации и т.д. Зооглеи имеют высокую ферментативную активность. Исследования показали, что видовой состав активного ила, его внешний вид и способность к отстаиванию могут служить индикаторами его состояния.
Основной метод анализа организмов активного ила - это исследование их в живом состоянии под микроскопом не позднее чем через 20-30 мин с момента взятия пробы. Каплю свежего ила наносят на предметное стекло, накрывают покровным стеклом и просматривают под микроскопом. Повторность 10-кратная. Для количественного учета микроорганизмов в иле применяют счетные камеры. Микроскопирование активного ила с каждого работающего сооружения выполняют ежедневно. Ниже приводится биологическая характеристика активного ила при различных условиях работы установок для биологической очистки стоков животноводческих комплексов.
Удовлетворительно работающий ил характеризуется большим разнообразием простейших микроорганизмов по видовому составу при незначительном количественном преобладании некоторых видов. Постоянно присутствуют брюхореснитчатые и круглореснитчатые инфузории. Эти организмы достаточно подвижны и активны. Иногда присутствуют единичные экземпляры коловраток.
Бактерии находятся в зооглейных скоплениях, хлопья ила плотные, компактные, быстро оседают. Вода над илом прозрачная.
Ил при повышенной загрязненности стоков имеет небольшое качественное разнообразие видов микроорганизмов при количественном преобладании двух-трех из них.
При недостатке кислорода наблюдается массовое развитие нитчатых бактерий, что приводит к вытеснению зооглейных скоплений, плохому оседанию активного ила и выносу его из вторичных отстойников. Встречается много дисперсных палочковидных бактерий, большое количество мелких жгутиковых, присутствуют единичные экземпляры прикрепленных инфузорий (operkyilaria, vorticela). Хлопья ила мелкие, темного цвета, почти неоседающие. Ил загрязнен разнообразными включениями органических аморфных частиц, волокон. Вода над илом с опалесценцией.
Ил при незначительной загрязненности стоков содержит много дисперсных, единичных, мелких, прозрачных бактериальных клеток с преобладанием жгутиковых, инфузорий и коловраток. Хлопья ила мелкие, распыленные. Вода над илом имеет мелкую, неоседающую муть.
Исходя из результатов микроскопического анализа активного ила, увеличивают или уменьшают его концентрацию, расход воздуха, количество подаваемых на очистку стоков.
5. ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ В ЛАБОРАТОРИИ
К работе в лаборатории допускаются лица, которые имеют достаточную квалификацию, практические навыки и знают правила техники безопасности. Вновь поступающие на работу должны пройти инструктаж по технике безопасности. Со всеми работающими такой инструктаж проводится 2 раза в год, что регистрируется в специальном журнале.
Размещать лабораторию следует в специальном типовом здании, что обеспечивает надлежащее санитарное состояние рабочих помещений: площадь лаборатории, освещенность рабочих мест, размещение оборудования, вентиляции. Все сотрудники лаборатории обязаны знать названия реактивов и оборудования, с которыми им приходится работать, тщательно выполнять правила по технике безопасности на рабочем месте, должны быть обеспечены спецодеждой (халаты, фартуки), средствами индивидуальной защиты (перчатки, очки), нейтрализующими растворами (кислоты, щелочи), огнетушителями, песком, листовым асбестом, аптечкой первой помощи с набором необходимых медикаментов, перевязочных средств.
Категорически запрещается:
пробовать на вкус химические реактивы, растирать их руками, пользоваться битой или грязной посудой, неисправными приборами, оборудованием, работать на недостаточно освещенных рабочих местах;
проводить опыты в лаборатории одному сотруднику, так как при необходимости ему не может быть оказана немедленная медицинская помощь; оставлять какие-либо вещества без этикеток; наклоняться над сосудом, в котором кипит или налита какая-либо жидкость, для отбора жидкости необходимо пользоваться резиновой грушей или другими приспособлениями;
при взбалтывании растворов в колбах закрывать отверстие пальцем (следует пользоваться пробками или прокладками);
при взвешивании помещать сыпучие вещества на чашки весов, для этого необходимо пользоваться специальной тарой.
Все работы с кислотами, щелочами и сточными водами необходимо проводить в спецодежде. Запрещается загромождать проходы к противопожарному оборудованию, ящикам с песком, водопроводным кранам.
Пролитые на пол концентрированные кислоты, щелочи и другие токсичные вещества следует нейтрализовать (кислоту - раствором соды, щелочь - раствором уксусной кислоты), засыпать песком (песок удалить совком), смывать водой и вытирать.
При приготовлении растворов кислот, щелочей следует:
надевать спецодежду, средства индивидуальной защиты;
все работы проводить под тягой;
едкие щелочи растворять небольшими порциями при постоянном помешивании;
кислоту или щелочь наливать в воду тонкой струей, запрещается лить воду в кислоту, щелочь.
Выдача едких, ядовитых и легковоспламеняющихся веществ проводится только ответственными лицами в количестве, не превышающем потребности для выполнения работы. После выполнения работы остаток ядохимикатов немедленно возвращается ответственному за хранение этих веществ.
Запрещается мыть лабораторные столы керосином, скипидаром, бензином, эфиром и другими легковоспламеняющимися растворами.
При проведении анализов сточных вод животноводческих комплексов сотрудники лаборатории постоянно соприкасаются с необеззараженным материалом, который может содержать патогенные культуры возбудителей инфекционных и инвазионных заболеваний. Поэтому они должны соблюдать следующие правила:
не входить в помещение лаборатории без спецодежды;
не принимать пищу в помещении лаборатории;
посуду с пробами необходимо обтирать снаружи дезинфицирующими растворами и ставить на подносы или в кюветы;
при проведении санитарно-бактериологических исследований следует строго соблюдать общепринятые в бактериологической практике приемы, исключающие возможность соприкосновения с заразным материалом. Чашки с посевами культур после учета необходимо подвергать обеззараживанию одним из известных способов (автоклавирование). Используемые в работе инструменты и поверхность рабочего стола продезинфицировать, строго следить за чистотой рук, после окончания работы со стоками руки дезинфицируют и тщательно моют горячей водой с мылом.
Помещение лаборатории необходимо убирать ежедневно влажным способом. Поверхность рабочего стола следует протирать 5%-ным раствором хлорамина или 90%-ным спиртом.
6. МЕТОДЫ САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОГО
И ГЕЛЬМИНТОЛОГИЧЕСКОГО АНАЛИЗА СТОЧНЫХ ВОД
6.1. Методы санитарно-бактериологических исследований
Постоянный контроль за сточными водами животноводческих комплексов на наличие патогенной микрофлоры осуществляют микробиологи в контрольной лаборатории, периодический контроль - сотрудники санитарно-эпидемиологических станций, районных и областных ветеринарных лабораторий, органов по регулированию использования и охране вод (Министерство водного хозяйства СССР).
Санитарно-бактериологический анализ сточных вод животноводческих комплексов по этапам очистки (определение общего количества бактерий, коли-титра, наличие патогенных эшерихий и сальмонелл) рекомендуется проводить 1 раз в месяц.
Контроль качества хлорирования сточных вод по коли-титру проводят 1 раз в декаду, а в случае выпуска сточных вод после хлорирования в водоем - еженедельно.
При возникновении инфекционных заболеваний на животноводческом комплексе рекомендуется еженедельный анализ сточных вод на наличие бактерий группы кишечных палочек (БГКП) и стафилококков. При контроле качества обеззараженных сточных вод тепловым методом - еженедельный анализ на наличие стафилококков и аэробных спорообразующих микроорганизмов.
Пробы сточных вод отбирают в стерильные склянки (объемом 500 мл![]() ), транспортируют и хранят по общепринятым методикам.
), транспортируют и хранят по общепринятым методикам.
В лабораториях, где проводятся бактериологические и гельминтологические анализы, кроме обычной лабораторной посуды применяют специальную (бактериологические пробирки, пипетки, чашки Петри, предметные и покровные стекла). Лабораторную посуду, вату, марлю и бумагу следует стерилизовать в автоклаве при 1,5 атм в течение 30 мин или обрабатывать в сушильном шкафу при 160 °С в течение 2 ч, а уничтожать посевной материал - в автоклаве при 1,5 атм в течение 40 мин. Применять хлорирование и кипячение для обеззараживания посевного материала не следует.
6.1.1. Определение количества бактерий группы кишечных палочек (БГКП) 3-этапным бродильным методом. Бродильные сосуды (различные по объему) с глюкозо-пептонной средой заполняют исследуемой сточной водой. К 1 мл глюкозо-пептонной среды добавляют 10 мл сточной воды, к 10 мл среды - 100 мл сточной воды. Посевы - 0,1-1 мл и по 1 мл из последующих 10-кратных разведений проводят в глюкозо-пептонную среду обычного состава. Посевы инкубируют 24 ч при 43 °С.
Отсутствие помутнения, образования кислоты и газа на глюкозо-пептонной среде позволяет сделать заключение, что БГКП в исследуемом объеме сточной воды нет, и закончить исследования через 24 ч.
Из каждого сосуда с глюкозо-пептонной средой, где отмечено помутнение, кислотообразование и образование газа, делают посевы петлей штрихами на поверхности среды Эндо, разделенной на 3-4 сектора. Посевной материал следует брать с таким расчетом, чтобы получить изолированные колонии. Чашки с посевами помещают в термостат и инкубируют 16-18 ч при 37 °С.
При отсутствии роста колоний на среде Эндо, а также при наличии нехарактерных для БГКП колоний получают отрицательный результат, исследований на БГКП.
При росте на среде Эндо темно-красных колоний с металлическим блеском (или без него) их принадлежность к БГКП подтверждают микроскопированием и постановкой оксидазного теста. Наличие мелких, неспорообразующих грамотрицательных палочек в мазках и отрицательный оксидазный тест позволяют дать заключение о наличии БГКП в анализируемом объеме сточной воды.
При росте на среде Эндо нехарактерных для БГКП колоний из 2-3 разных типов колоний приготовляют мазки, окрашивают их по Граму, микроскопируют и проверяют на оксидазную активность. При наличии только грамположительных спорообразующих бактерий получают отрицательный результат. Наличие активной оксидазы у всех изучаемых культур бактерий также позволяет дать заключение об отсутствии БГКП в анализируемом объеме сточной воды.
При росте на среде Эндо грамотрицательных и оксидазоотрицательных бактерий засевают по 2-3 изолированные колонии разного типа с каждого сектора в полужидкую среду с глюкозой и инкубируют 24 ч при 37 °С. Ферментация глюкозы с образованием кислоты и газа говорит о наличии БГКП, отсутствие кислоты и газа - БГКП нет.
Результаты исследований выражают в виде коли-титра (или коли-индекса) в абсолютных числах, пользуясь таблицами 4, 5.
Таблица 4
Определение индекса и титра бактерий группы кишечных палочек
при исследовании сточных вод по этапам очистки
|
Объем сточных вод, мл |
Коли-индекс |
Коли-титр | |||||
|
0,01 |
0,001 |
0,0001 |
0,00001 |
|
| ||
|
1 |
2 |
3 |
4 |
5 |
6 | ||
|
- |
- |
- |
- |
Менее |
90000 |
Более |
0,0111 |
|
- |
- |
- |
+ |
90000 |
0,0111 | ||
|
- |
- |
+ |
- |
90000 |
0,0111 | ||
|
- |
+ |
- |
- |
95000 |
0,0105 | ||
|
- |
- |
+ |
+ |
180000 |
0,0056 | ||
|
- |
+ |
- |
+ |
190000 |
0,0053 | ||
|
- |
+ |
+ |
- |
220000 |
0,0046 | ||
|
+ |
- |
- |
- |
230000 |
0,0043 | ||
|
- |
+ |
- |
+ |
280000 |
0,0036 | ||
|
+ |
- |
- |
+ |
920000 |
0,0011 | ||
|
+ |
- |
+ |
- |
940000 |
0,0010 | ||
|
+ |
- |
+ |
+ |
1800000 |
0,0006 | ||
|
+ |
+ |
- |
- |
2300000 |
0,0004 | ||
|
+ |
+ |
- |
+ |
9600000 |
0,0001 | ||
|
+ |
+ |
+ |
- |
23000000 |
0,00004 | ||
|
+ |
+ |
+ |
+ |
Более |
23000000 |
Менее |
0,00004 |
Таблица 5
Определение индекса и титра бактерий группы кишечных палочек при контроле качества обеззараживания сточных вод
|
Объем сточных вод, мл |
Коли-индекс |
Коли-титр | |||
|
10,0 |
1,0 |
0,1 |
0,01 |
||
|
- |
- |
- |
- |
Менее 90 |
Более 11,1 |
|
- |
- |
- |
+ |
90 |
11,1 |
|
- |
- |
+ |
- |
90 |
11,1 |
|
- |
+ |
- |
- |
95 |
10,5 |
|
- |
- |
+ |
+ |
180 |
5,6 |
|
- |
+ |
- |
+ |
190 |
5,3 |
|
- |
+ |
+ |
- |
220 |
4,6 |
|
+ |
- |
- |
- |
230 |
4,3 |
|
- |
+ |
+ |
+ |
280 |
3,6 |
|
+ |
- |
- |
+ |
920 |
1,1 |
|
+ |
- |
+ |
- |
940 |
1,0 |
|
+ |
- |
+ |
+ |
1800 |
0,6 |
|
+ |
- |
+ |
- |
2300 |
0,4 |
|
+ |
+ |
- |
+ |
9600 |
0,1 |
|
+ |
+ |
+ |
- |
23800 |
0,04 |
|
+ |
+ |
+ |
+ |
Более 23800 |
Менее 0,04 |
Обязательным условием при заполнении бродильных сосудов сточными водами (исследуемый объем) является использование данных таблиц согласно схемам анализа.
6.1.2. Постановка оксидазного теста. Две-три изолированные колонии микроорганизмов каждого типа, выросшие на среде Эндо, снимают петлей и наносят штрихом на фильтровальную бумагу, смоченную соответствующим реактивом для определения оксидазной активности бактерий. Если получают отрицательный оксидазный тест, фильтровальная бумага не изменяет цвета после нанесения бактериальной массы. Если бактерии образуют активную оксидазу, фильтровальная бумага синеет в течение 1 мин. В сомнительных случаях колонии отсевают на МПА и после получения культуры повторяют оксидазный тест.
6.1.3. Исследования на энтеропатогенные кишечные палочки. Бродильные сосуды с глюкозо-пептонной средой заполняют исследуемой сточной водой (разными объемами). Посевы микроорганизмов стоков в объемах 10 и 100 мл проводят соответственно в 1 мл и 10 мл концентрированной глюкозо-пептонной среды. Посевы сточной воды от 0,1 мл до 1 мл проводят последовательно в 10 мл глюкозо-пептонной среды обычного состава. Посевы инкубируют 24 ч при 43 °С.
Из каждого сосуда с глюкозо-пептонной средой, где отмечено помутнение, образование газа и кислоты, делают посевы петлей штрихами на поверхность среды Эндо, в чашки, разделенные на 3-4 сектора. Посевной материал следует брать с таким расчетом чтобы получить изолированные колонии. Чашки с посевами помещают в термостат и инкубируют 16-18 ч при 37 °С.
Типичные колонии БГКП, получаемые на среде Эндо, круглой формы, гладкие, выпуклые или со слегка приподнятой в центре поверхностью, с ровными краями, розового, красного или малинового цвета с металлическим блеском или без него.
Выросшие на среде Эндо изолированные колонии S-формы, типичные для БГКП (2-3 колонии с каждого сектора) пересевают на МПА и инкубируют при 37 °С в течение 16-24 ч. Культуры используют для приготовления мазков, постановки оксидазного теста, приготовления антигена.
При анализе сточных вод после обеззараживания учитывают и бесцветные колонии, выросшие на среде Эндо. Из двух-трех типов колоний микроорганизмов приготовляют мазки, окрашивают по Граму и микроскопируют, а также проверяют оксидазную активность.
Колонии бесцветных оксидазоотрицательных и грамотрицательных бактерий засевают в полужидкую глюкозную среду и инкубируют 24 ч при 37 °С. Сбраживание сахара с образованием кислоты и газа указывает на наличие БГКП. Выделенные культуры БГКП подвергают серологической типизации. Для установления серологической группы выделенных культур ставят реакцию агглютинации с О-коли сыворотками и ОК-сыворотками.
Для идентификации культур по О-антигену испытуемую культуру смывают физиологическим раствором, переносят в сухие стерильные пробирки, маркируют этикетками из пергаментной бумаги, прогревают в течение часа в водяной бане при температуре 100 °С для разрушения поверхностной оболочки термолабильных L- и В-антигенов или автоклавируют при температуре 120 °С в течение двух часов для разрушения термостабильного А-антигена. При нагревании в водяной бане вода должна полностью закрывать культуры микроорганизмов в пробирках. Нарушение режима прогревания недопустимо.
Если во взвеси бактерий после кипячения или автоклавирования образуются хлопья или зернистость (R-форма),то раствор не используют для анализа.
Прогретые взвеси бактерий центрифугируют при 3000 об/мин в течение 20 мин, надосадочную жидкость сливают, а осадок используют в качестве антигена для постановки анализа на стекле. Оставшуюся часть антигена разводят стерильным физиологическим раствором по оптическому стандарту мутности до концентрации 500 млн. микробных тел в 1 мл и используют для постановки пробирочной реакции агглютинации.
Определение принадлежности культур к серогруппе начинают с постановки реакции агглютинации на стекле с групповыми поливалентными сыворотками.
Для постановки реакции на чистое обезжиренное стекло наносят по капле поливалентные сыворотки и в каждую каплю петлей вносят осажденную центрифугированием культуру и хорошо перемешивают. Реакция протекает при комнатной температуре в течение 3 мин. Положительная реакция характеризуется образованием мелкозернистого агглютината и полным или частичным просветлением жидкости. При отрицательном результате антиген остается в капле сыворотки в виде равномерной взвеси.
Реакцию агглютинации следует контролировать при хорошем освещении, используя вогнутое зеркало или лупу.
Каждый антиген, агглютинирующийся одной из поливалентных сывороток, исследуют в реакции агглютинации на стекле с моновалентными разведенными сыворотками (1:10), входящими в состав данной поливалентной сыворотки, а затем - в пробирочной реакции агглютинации с каждой сывороткой, давшей положительную реакцию на стекле.
Пробирочную реакцию агглютинации ставят в обычных серологических или бактериологических пробирках в объеме 1 мл.
Сыворотку разводят стерильным физиологическим раствором (1:25) до титра, указанного на этикетке ампулы. Для приготовления исходного раствора к 2,4 мл физиологического раствора добавляют 0,1 мл сыворотки. Во все другие пробирки разливают по 0,5 мл физиологического раствора. Из исходного раствора переносят 0,5 мл смеси во вторую пробирку, из второй - в третью и т.д. Каждое разведение готовят отдельной пипеткой. Содержимое каждой пробирки смешивают. Из первой пробирки удаляют 1,5 мл, из последней 0,5 мл смеси. В пробирки с разведенной сывороткой добавляют по 0,5 мл антигена, имеющего концентрацию 500 млн. микробных тел в 1 мл. Одновременно ставят контрольные реакции: а) антиген+физиологический раствор (для исключения самоагглютинации); б) сыворотка в разведении 1:25 без антигена (для исключения флокуляции).
Пробирки встряхивают и выдерживают 16-18 ч при температуре 37 °С и 6-8 ч при комнатной температуре. Результаты опыта определяют при помощи агглютиноскопа.
Реакцию оценивают положительной, если есть просветление жидкости и образование на дне пробирки осадка бактерий в форме раскрытого зонтика, который при встряхивании распадается на мелкие хлопья или комочки. Реакцию считают отрицательной, когда на дне пробирки образуется дискообразный осадок, который при встряхивании превращается в равномерную взвесь.
В контрольных пробирках после встряхивания также должна быть равномерная взвесь бактерий.
В случае, когда поливалентные О-коли сыворотки не агглютинируют в реакции на стекле антиген, прогретый при температуре 100 °С, суспензию из исследуемых бактерий выдерживают в автоклаве при температуре 120 °С в течение двух часов (для разрушения А-антигена).
Полученный антиген исследуют в реакции агглютинации с сыворотками серогрупп 08, 09 и 0101, как указано выше.
Для идентификации культур по К-антигену ставят реакцию агглютинации на стекле с поливалентными ОК-сыворотками. Штаммы бактерий, давшие с поливалентной ОК-сывороткой в течение двух минут отчетливо выраженную крупнохлопчатую агглютинацию, отбирают для постановки реакции на стекле с каждой ОК-сывороткой, входившей в состав поливалентной смеси. Контролем реакции служит взвесь микробов в капле изотонического раствора хлорида натрия. Реакция агглютинации на стекле с живой культурой имеет только ориентировочное значение, указывая на наличие в ней соответствующего К-антигена, и не может служить основанием для отнесения выделенного штамма к О-группе.
Для окончательной идентификации культур по К-антигену ставят реакцию агглютинации в пробирках с той ОК-сывороткой, которая агглютинировала культуру на предметном стекле. Если положительная агглютинация на стекле наблюдалась с несколькими типовыми сыворотками, реакцию агглютинации в пробирках ставят со всеми сыворотками. Принадлежность культуры к серологическому типу тогда определяют по наивысшему титру с той или иной сывороткой. При постановке реакции агглютинации делают разведения типовой агглютинирующей ОК-сыворотки (1:50) до титра, указанного на этикетке ампулы. Разведенную сыворотку разливают по 0,5-1 мл. Для определения К-антигенов в каждую пробирку добавляют культуру кишечной палочки по коли-индексу (3 млрд.). Оставляют две контрольные пробирки: контроль антигена (КА) - исследуемая культура в изотоническом растворе хлорида натрия и контроль сыворотки (КС) - сыворотка в разведении 1:50. Пробирки встряхивают для лучшего перемешивания сыворотки с антигеном и ставят в термостат на 20 ч.
Положительным считают результат в том случае, если выделенная культура по антигенному строению соответствует какой-либо серологической группе энтеропатогенных эшерихий. При этом живая культура образует крупнохлопчатый агглютинат с полным просветлением жидкости над осадком не менее чем в двух-трех разведениях сыворотки.
6.1.4. Исследования на сальмонеллы. Сточные воды (100 мл) заливают в колбы со средами обогащения - магниевой средой и селенитовым бульоном (1:5). После 18-20 ч инкубирования при 37 °С из культур в обогатительных средах проводят посевы бактериологической петлей на чашки с твердыми дифференциально-диагностическими средами. Посевы инкубируют при 37 °С в течение 48 ч. Засеянные чашки просматривают через 16, 24, 48 ч.
На висмут-сульфитном агаре S. typhi и S. para typhi растут в виде мелких, нежных, серовато-зеленых колоний с черным центром, S. choleraesuis - в виде зеленых колоний.
Колонии почти всех других сальмонелл крупнее, темно-коричневого или черного цвета с металлическим блеском, цвет участка среды под колонией черный.
При обнаруживании колоний, похожих на сальмонеллезные, засевают 3-5 из них в комбинированную среду Ресселя, в двухсахарный, а лучше в трехсахарный (лактоза, глюкоза, сахароза) агар с мочевиной.
Посевы при этом делают сначала штрихом на скошенной поверхности агара, а затем уколом в глубину его. При разложении лактозы косая поверхность окрашивается в синий цвет (при индикаторе ВР). При разложении глюкозы окрашивается только столбик среды и происходит разрыв агара со скоплением в нем пузырьков газа. При разложении мочевины окраска среды меняется на оранжевую при индикаторе ВР и на коричнево-фиолетовую при индикаторе тимоловый синий в сочетании с индикатором Андраде. Посевы инкубируют при температуре 37 °С 16-18 ч.
Культуры, не ферментирующие глюкозу, лактозу и сахарозу и не расщепляющие мочевину, подлежат дальнейшему исследованию. Их пересеивают на МПА и изучают морфологические и культурально-биохимические свойства.
Морфологию бактерий изучают в мазках, окрашенных по Граму, подвижность бактерий определяют в висячей капле или по характеру роста их в 0,3%-ном растворе полужидкого МПА.
Для определения культурально-биохимических свойств бактерий используют среды Гисса с лактозой, глюкозой и сахарозой, бульон Хоттингера (для определения индола и сероводорода) и др.
Культуры, представляющие грамотрицательные подвижные мелкие палочки, ферментирующие глюкозу с образованием газа, не ферментирующие лактозу и сахарозу, не разлагающие мочевину и не образующие индола, подвергают серологическому исследованию в реакциях агглютинации на стекле с набором агглютинирующих монорецепторных О- и Н-сывороток.
Для этого используют культуры, выращенные на среде Ресселя, в двухсахарном или трехсахарном агаре. Для реакции агглютинации с О-сыворотками культуру следует брать из верхней части скошенного среза агара, а для реакции агглютинации с Н-сыворотками - из самой нижней части (конденсационной воды), где микробы наиболее подвижны. Исследование культур начинают в реакции агглютинации с поливалентной адсорбированной О-сывороткой для определения их серогрупповой принадлежности. Культуры, дающие положительную реакцию агглютинации с поливалентной сывороткой, проверяют с монорецепторными агглютинирующими сыворотками.
Установив с помощью монорецепторных групповых О-сывороток принадлежность культуры к той или иной серологической группе, культуру проверяют монорецепторными О- и Н-сыворотками, определяя серологический тип бактерий, в соответствии со схемой Кауфмана-Уайта.
6.1.5. Контроль качества обеззараживания сточных вод по стафилококку и спорообразующим микроорганизмам. Пробу сточных вод (10 мл) разбавляют с МПБ (1:5). Посевы инкубируют 24-48 ч при 37 °С, затем делают пересевы на агар Чапмена (для выделения стафилококков) и МПА (для обнаружения микробов рода Bacillus). Посевы инкубируют 24-48 ч при 37 °С.
Наличие стафилококков и спорообразующих аэробных микроорганизмов определяют микроскопированием.
6.1.6. Оценка результатов исследований. Стоки считаются обеззараженными при отсутствии патогенной микрофлоры.
Обеззараживание сточных вод химическими методами считается эффективным при отсутствии стафилококков в 10 мл стоков.
Показателями эффективности обеззараживания сточных вод тепловым методом в отношении неспорообразующей микрофлоры служит отсутствие стафилококков в 10 мл стоков, при обеззараживании от споровой микрофлоры - отсутствие стафилококков и микробов рода Bacillus в 10 мл стоков.
Очищенные стоки при спуске в водоемы должны соответствовать требованиям, изложенным в "Правилах охраны, поверхностных вод от загрязнения сточными водами" (М., 1974).
6.2. Методы гельминтологического анализа
6.2.1. Методы отбора, транспортирования, хранения проб жидкого и полужидкого навоза и его фракций, предназначенных для гельминтологического исследования. В технологической системе обработки жидкого навоза, включающей механическое разделение его на фракции и биологическую обработку жидкой фракции, пробы отбирают в следующей последовательности: исходный (поступающий из производственной зоны) жидкий навоз, жидкая и твердая фракции, получаемые после его разделения, избыточный ил и осветленная жидкая фракция после биологической очистки.
Пробы исходного жидкого навоза отбирают из коллектора или непосредственно из приемного резервуара.
На фермах и комплексах, где применяют выдерживание жидкого и полужидкого навоза в резервуарах-накопителях, а также в хранилищах, оборудованных под решетчатыми полами животноводческих помещений, или в отстойниках, отбирают пробы из самих сооружений.
Пробы полужидкого навоза, твердой и жидкой фракции отбирают в процессе их обработки и хранения, а также перед выгрузкой и в период внесения навоза на сельскохозяйственные угодья.
Пробы жидкого, полужидкого навоза, его фракций и ила отбирают с помощью пробоотборника (пробоотборник конструкции А.А.Черепанова, рис.1). Он может быть изготовлен по представленному чертежу в механических мастерских. Пробоотборник имеет разъемную штангу, промежуточную рукоятку и рабочий цилиндр емкостью до 0,7 л, позволяет отбирать пробы из верхних и глубоких (до 3 м) слоев навоза, выдерживаемого в резервуарах и отстойниках-накопителях. При необходимости длина штанги пробоотборника может быть увеличена за счет дополнительного звена. Для отбора проб в зимний период нижняя часть его имеет коническое заострение, изготовленное из стали.
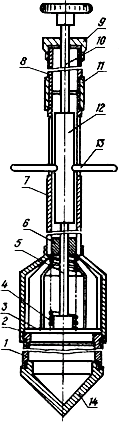
Рис.1. Пробоотборник:
1 - цилиндр; 2 - стакан; 3 - клапан; 4 - пружина; 5 - шток первой секции; 6 - втулка направляющая;
7 - труба второй секции; 8 - труба первой секции; 9 - гайка; 10 - шток второй секции; 11 - муфта;
12 - направляющая; 13 - ручка; 14 - корпус цилиндра.
Пробы из резервуаров-накопителей, а также из буртов с твердой фракцией отбирают из трех-пяти мест верхнего, среднего и нижнего слоев.
Разовый объем одной средней пробы жидкого навоза (влажность 96-98%) составляет 10 л, полужидкого (влажность 85-87%) - 1 л, жидкой фракции, прошедшей биологическую очистку, - 10 л, а при высокой степени ее очистки - 20-30 л, ила - 1-5 л, твердой фракции - не менее 1 кг. Пробы больших объемов жидкого навоза и жидкой фракции (10-30 л) из поверхностных слоев резервуаров-накопителей отбирают с помощью ведер с выверенным рабочим объемом.
Пробы твердой фракции, получаемой сразу после механического разделения навоза, а также из буртов, отбирают совками или пробоотборниками и помещают их в полиэтиленовые пакеты или емкости, которые герметично закрывают.
Пробы жидкой консистенции, объем которых не превышает 1 л, сразу после отбора сливают из пробоотборников в емкости соответствующего объема (стеклянные или полиэтиленовые банки с герметично закрывающимися крышками). А пробы большого объема (10 л и более), предназначенные для исследования на яйца гельминтов, предварительно обрабатывают непосредственно на очистных сооружениях. Цель такой обработки - уменьшение массы и объема доставляемых в лаборатории проб, снижение затрат времени на лабораторные исследования и утилизацию основной массы отработанного материала на месте отбора проб. Для этого пробы отстаивают в ведрах не менее 30 мин, после чего жидкость сливают, а осадок переносят на двойной марлевый фильтр и промывают водой. Полученный фильтрат отстаивают, жидкость сливают, а осадок переливают в литровые емкости.
Во избежание потерь яиц гельминтов, содержащихся в пробах, первоначально сливают 2/3 верхнего слоя отстоявшейся жидкости, затем после вторичного отстаивания сливают оставшуюся часть, оставляя небольшой надосадочный слой.
Емкости с пробами нумеруют карандашом-стеклографом. Номера проб заносят в опись, в которой указывают дату, место, технологическую точку отбора и объем пробы (первоначальный и доставляемый на исследование).
Количество отбираемых проб из основных технологических мест очистных сооружений 6-8. Емкости с пробами транспортируют в ящике, имеющем гнезда для стандартной посуды. В теплое время года в пробы добавляют 3-4 капли толуола. Хранят их при температуре 3-4 °С в холодильнике.
С целью стандартизации проб во время их отбора и исследования с помощью оттарированных емкостей измеряют первоначальный и исследуемый объемы жидкого, полужидкого навоза, его фракций и осадка, определяют их влажность. Для этого исходные образцы отбирают в герметично закрывающиеся емкости и исследуют по общепринятой методике.
Периодичность отбора проб жидкой фракции из сооружений, включающих механическое разделение навоза и биологическую очистку, - один раз в декаду; твердой фракции, выдерживаемой в буртах, - не реже одного раза в месяц. Для определения суточного колебания количества яиц гельминтов в исходном навозе и его фракциях пробы отбирают трижды в течение дня, через равные промежутки времени, учитывая принятую технологию удаления и обработки навоза. Более точные средние показатели загрязнения навоза яйцами и личинками гельминтов получают при трехкратном отборе проб в течение двух-трех суток.
6.2.2. Обработка и гельминтологическое исследование проб жидкого навоза и его фракций. Доставленные в лабораторию пробы жидкого навоза, жидкой фракции и иловой смеси отстаивают, сливают надосадочный слой, осадок промывают и удаляют грубые включения через двойной марлевый фильтр. Если первичное промывание осадка проводили на месте отбора проб, то его сразу переносят в центрифугу, добавляют чистую воду и центрифугируют при 1000 об/мин 2-3 мин. Твердую фракцию обрабатывают и исследуют по той же методике, что и осадок. После центрифугирования жидкость сливают, а осадок исследуют с применением центрифужного флотационного метода. Перед центрифугированием пробирки с исследуемыми пробами уравновешивают на специальных или приспособленных для этой цели весах, добавляя при необходимости насыщенный раствор нитрата натрия или воду, и устанавливают в гнезда ротора центрифуги. Объем одной пробы в расчете на центрифужную пробирку емкостью 250 мл составляет 100 мл![]() для твердой фракции и 25-50 мл для осадка.
для твердой фракции и 25-50 мл для осадка.
К осадку, находящемуся в центрифужных пробирках (после центрифугирования его с водой), добавляют до 150 мл насыщенного раствора нитрата натрия. После перемешивания стеклянной палочкой смесь центрифугируют в течение 3 мин при 1000-1500 об/мин.
Насыщенный раствор нитрата натрия готовят из расчета одна весовая часть соли на одну весовую часть воды. Раствор доводят до кипения и считают готовым, если на его поверхности образуется кристаллическая пленка. Перед применением раствор охлаждают до комнатной температуры. Удельный вес приготовленного раствора 1,38.
По окончании центрифугирования в пробирки добавляют тот же по объему раствор нитрата натрия до образования выпуклого мениска и накрывают большими предметными стеклами 70x70 мм. Стекла предварительно обезжиривают смесью спирта и эфира или нашатырным спиртом или моют в горячей воде с моющим порошком типа "Гигиена". Обрабатывают обе стороны стекол и просушивают. На сухой поверхности стекол стеклографом наносят 3-4 тонких линии, делящие его на равные части.
Стекла с пробирок снимают через 20 мин и просматривают под микроскопом пленку жидкости, образующуюся на их поверхности, соприкасавшейся с раствором. Покрытие пробирок стеклами и микроскопирование повторяют 2-3 раза. Для просветления пленки и предотвращения выпадения в ней кристаллов соли на ее поверхность наносят 3-4 капли водного раствора глицерина (соотношение воды и глицерина 1:1).
Под микроскопом подсчитывают число обнаруженных яиц и личинок гельминтов в пробе. Затем пересчитывают их количество на стандартную единицу объема исследуемой массы - на 1-10 л жидкого навоза или жидкой фракции, 100-1000 см![]() или на 1 кг твердой фракции навоза данной влажности.
или на 1 кг твердой фракции навоза данной влажности.
Этот метод позволяет выявлять яйца и личинки стронгилят, стронгилоидов, яйца аскарид, власоглавов, мониезий, крысиного цепня, личиночные стадии паразитических и свободноживущих нематод, а также их половозрелые формы.
6.2.3. Экспресс-метод гельминтологического исследования осадков навоза жидкой и твердой фракций. Берут 25-50 мл осадка жидкого навоза или его фракций, полученного после первичного отстаивания проб, удаляют из него грубые включения путем промывания, переносят осадок на марлевый или капроновый фильтр. Промывают его 200 мл насыщенного раствора нитрата натрия, поваренной соли или аммиачной селитры. Оставшуюся в осадке на фильтре влагу тщательно отжимают в те же емкости, фильтрат выдерживают 15-20 мин, после чего поверхностную пленку жидкости переносят гельминтологической петлей на предметные стекла и просматривают под микроскопом. Можно пользоваться и большими предметными обезжиренными стеклами, накрывая их поверх мениска флотационного раствора. Метод менее точен, чем центрифужный, однако более прост по выполнению, не требует сложного оборудования и может быть применим для экспресс-диагностики загрязнения навоза и его фракций яйцами и личинками гельминтов.
Для выполнения указанной методики необходимы: емкости для фильтрата (стаканы), насыщенный раствор соли, предметные стекла, марля или капроновая ткань с ячейками 0,1 мм и микроскоп.
6.2.4. Особенности исследования навоза крупного рогатого скота. В навозе крупного рогатого скота, помимо яиц стронгилят, трихоцефалов, мониезий, могут содержаться яйца фасциол и дикроцелиев. Для выделения их из проб пользуются общепринятым методом последовательного промывания.
Крупные частицы удаляют из пробы путем промывания осадка через фильтр, фильтрат отстаивают, надосадочный слой жидкости сливают, а осадок смешивают с чистой водой и вновь отстаивают. Так повторяют до получения просветленного осадка. Для ускорения промывки осадка применяют центрифугирование.
Просветленный осадок по частям переносят на предметные стекла или в чашки Петри и просматривают под микроскопом. Яйца фасциол, имеющие сравнительно большие размеры (0,13x0,7 мм), просматривают с помощью микроскопа МБС-1. Яйца дикроцелиев мельче (0,03x0,02 мм), поэтому необходимо более внимательно просматривать препараты под большим увеличением микроскопа.
Определение жизнеспособности яиц и личинок гельминтов
1) Метод световой микроскопии. Под большим увеличением микроскопа выявляют резко выраженные признаки гибели яиц: деформация оболочек, вакуолизация плазмы зародыша, прогибание оболочек внутрь, разрушение оболочек и зародыша, смещение плазмы зародыша к боковой поверхности яйца или к его полюсу. Признаками гибели яиц гельминтов, находящихся на стадии дробления бластомеров, являются: образование вакуолей в виде мелких и крупных пузырьков воздуха, неравномерность шаров дробления, рыхлая, комковатая зернистость плазмы. Погибшие в яйцах личинки гельминтов неподвижны, имеют вакуоли, деформированы (рис.2-6). Подвижность личинок устанавливают путем легкого надавливания на препарат через покровное стекло препаровальной иглой, резким изменением освещения или слабым подогревом препарата. Погибшими считают также личинки (вышедшие из яиц), если они выпрямлены, неподвижны, имеют разрушения и деформацию оболочек.
Рис.2. Яйца свиной аскариды:
жизнеспособные: 1 - стадия до дробления бластомеров; 2 - стадия личинки; погибшие:
3, 4, 5, 6 - последовательные стадии разрушения.
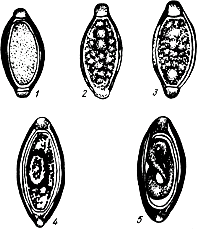
Рис.3. Яйца власоглава:
жизнеспособные: 1 - стадия до дробления бластомеров; 2 - личинки;
погибшие: 3, 4, 5 - разрыхление плазмы зародыша и его вакуолизация.
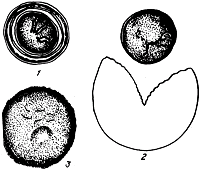
Рис.5. Яйца крысиного цепня:
жизнеспособные: 1 - онкосфера внутри яйца; 2 - онкосфера вне оболочек яйца; 3 - погибшие.

Рис.6. Яйца эзофагостом:
1 - жизнеспособные (стадия дробления бластомеров); 2 - погибшие.
Яйца цестод, мониезий, крысиного цепня считают жизнеспособными, если отмечают подвижность онкосферы и крючьев зародыша. Для определения их подвижности применяют метод слабого подогревания препарата или помещают в теплый раствор желчи крупного рогатого скота, разбавленного водой в соотношении 1:20.
2) Метод окрашивания. Применяют краситель - метиленовый синий (метиленового синего 0,05 г, нитрата натрия 0,5 г, молочной кислоты 15 мл). Зародыши погибших яиц аскарид окрашиваются в синий цвет, а жизнеспособные - не окрашиваются.
3) Культивирование яиц гельминтов в оптимальных условиях. Создают условия для развития жизнеспособных яиц гельминтов (аскарид, трихоцефал, стронгилят, фасциол) и формирования в них личинок. Культивируют их в термостате при температуре 26-28 °С во влажной камере (чашка Петри).
Культивировать яйца гельминтов можно несколькими способами. Собранные на предметные и часовые стекла или фильтры яйца аскарид, фасциол, власоглавов, стронгилят помещают в чашки Петри. На дно чашки для создания влажности кладут вату, смоченную в воде или в 1%-ном растворе соляной кислоты. Чашку закрывают крышкой и помщаают в термостат.
Чтобы сократить время на сбор яиц гельминтов для культивирования, пленку с предметных стекол, снятых с центрифужных пробирок, содержащую яйца гельминтов, смывают струей воды из пипетки в конические стаканы и добавляют в них чистую воду. Отстоявшийся осадок с яйцами гельминтов, отмытый от соли, переносят в чашки Петри, наливают в них до слоя 0,5 см дехлорированную воду или 0,1%-ный раствор соляной кислоты и ставят в термостат. Чашки аэрируют один раз в 2-3 дня. Для этого открывают их крышки и встряхивают жидкость или подают в них воздух с помощью резиновой груши. Не допускают высыхания жидкости в чашках, при необходимости добавляют свежую воду. В процессе культивирования яйца гельминтов периодически просматривают под микроскопом на предметных стеклах или непосредственно в чашке. Развившиеся жизнеспособные личинки гельминтов имеют мелкую зернистую структуру. Слабый подогрев препарата или надавливание препаровальной иглой через покровное стекло вызывает их подвижность.
Погибшими считают личинки деформированные, с мутной и глыбчатой структурой плазмы, вакуолями.
Инвазионность яиц и личинок аскарид определяют по наличию чехлика (оболочка после линьки) на головном и хвостовом конце, у личинок власоглавов - по стилету на головном конце. Для подтверждения инвазионных свойств личинок аскарид применяют метод биопробы на белых мышах.
Для оценки жизнеспособности яиц аскарид и власоглавов достаточно двух недель. За этот период основная часть яиц аскарид, фасциол, стронгилят, власоглавов достигает стадии личинок. Для установления инвазионных свойств яиц аскарид культивируют их в течение 30 суток.
6.2.5. Оценка результатов санитарно-гельминтологических исследований. В специальном журнале учитывают объем, число исследованных проб, взятых из очистных сооружений, а также указывают пробы, в которых обнаружены жизнеспособные яйца и личинки гельминтов. Для сопоставления получаемых результатов в течение всего периода гельминтологического контроля пересчитывают количество обнаруженных яиц и личинок гельминтов в пробах на стандартную единицу объема. Количественный показатель загрязнения необходим для определения возможного источника инвазии. Сопоставление количества погибших яиц и личинок гельминтов к общему их числу, обнаруженному в пробах, свидетельствует об эффективности дегельминтизации навоза и его фракций в очистных сооружениях. В сомнительных случаях проводят повторное исследование. Результаты исследований необходимы для разработки мер по предотвращению загрязнения внешней среды возбудителями инвазионных болезней. В зависимости от принятой в хозяйстве технологии переработки и хранения навоза и его фракций выбирается метод дегельминтации в соответствии с ОНТП 17-81 и гельминтологическими рекомендациями.
Результаты гельминтологического исследования записывают в журнале (см. приложение 8).
6.2.6. Техника безопасности при работе с инвазионным материалом. Сотрудники, выполняющие работу по отбору, доставке и исследованию проб навоза, должны иметь рабочую спецодежду (халаты, фартуки, резиновые перчатки, резиновую обувь).
Все отработанные в лаборатории пробы складывают в специальную урну, из которой их ежедневно отправляют к месту утилизации. Внутреннюю поверхность урны обрабатывают после механической очистки горячим 3%-ным раствором едкого натрия. Химическую посуду, бывшую в употреблении, необходимо кипятить. В период проведения исследований штативы с центрифужными пробирками следует устанавливать в эмалированные кюветы. Кюветы после работы необходимо тщательно вымыть горячей водой, пробирки и предметные стекла прокипятить.
Особое внимание должно быть обращено на соблюдение правил личной гигиены (в особенности мытья рук). Руки необходимо мыть в теплой воде с мылом, ногти очищать с помощью щеток. Вымытые руки дезинфицируют 1%-ным раствором хлорамина или гидролизным спиртом.
Рабочие халаты следует менять не реже одного раза в неделю. Спецодежду и обувь нужно хранить в шкафах.
6.2.7. Гельминтологическая оценка растительных кормов. В первую очередь на наличие яиц и личинок гельминтов исследуют траву и корнеплоды, выращенные на участках, удобряемых навозом и его фракциями. Гельминтологической оценке подвергают сено, силос, травяную муку и резку, приготовленные из растений с угодий, орошаемых или удобряемых стоками или навозом. Корма растительного происхождения исследуют до их скармливания животным, а также в процессе их заготовки и приготовления. Образцы растений в период их вегетации отбирают с двух-трех участков площадью 25-50 м![]() из пяти мест. При этом учитывают месторасположение и радиус действия агрегатов или установок, с помощью которых вносят навоз и его фракции на поля. При отборе проб учитывают, что на участках с высокой густотой стояния растений длительное время сохраняются яйца и личинки гельминтов. На стеблях и листьях обнаруживают чаще всего личинки стронгилят, способных мигрировать по растению в горизонтальном и вертикальном направлениях. В засушливый период они мигрируют в прикорневую систему. Близость грунтовых вод благоприятствует развитию яиц и личинок гельминтов.
из пяти мест. При этом учитывают месторасположение и радиус действия агрегатов или установок, с помощью которых вносят навоз и его фракции на поля. При отборе проб учитывают, что на участках с высокой густотой стояния растений длительное время сохраняются яйца и личинки гельминтов. На стеблях и листьях обнаруживают чаще всего личинки стронгилят, способных мигрировать по растению в горизонтальном и вертикальном направлениях. В засушливый период они мигрируют в прикорневую систему. Близость грунтовых вод благоприятствует развитию яиц и личинок гельминтов.
Яйца других нематод (аскарид, трихоцефал) меньше задерживаются на стеблях, попадая чаще на почву и в верхние слои ее.
Для обнаружения гельминтов требуются специальные исследования. Яйца гельминтов можно обнаружить на растениях в первые дни после орошения полей стоками.
Для обнаружения личинок гельминтов, на траве и сене проводят исследование по методу Бермана. Аппарат Бермана состоит из воронки диаметром 20-50 см, на конец которой надета резиновая трубка, сжатая зажимом. В воронку укладывают металлическую сетку, на нее помещают исследуемую пробу (около 500 г), наливают теплую (комнатной температуры) воду. Пробу в воде встряхивают несколько раз. Через 3-4 ч (можно и позднее) открывают зажим трубки и осадок собирают в чашку Петри или по частям переносят на предметные стекла и микроскопируют. При этом яйца гельминтов выпадают в осадок и обнаруживаются в нем.
Такие растительные корма, как корнеплоды, также исследуют на наличие яиц гельминтов.
Траву, сено разрезают ножницами на части, погружают их в емкости с водой и промывают. Корнеплоды промывают в воде, очищая щеткой. Жидкость отстаивают, затем осторожно сливают надосадочный слой, а осадок исследуют, применяя центрифужный флотационный метод.
Приложение 1
Журнал для ежедневного химико-технологического
контроля работы виброгрохота (вибросита, дугового сита)
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
Приложение 2
Журнал для ежедневного химико-технологического контроля
работы центрифуг
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
Приложение 3
Журнал для ежедневного химико-технологического контроля
работы первичных отстойников
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
Приложение 4
Журнал по учету работы илоуплотнителя
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
Приложение 5
Журнал по учету работы вторичных отстойников
после биологической очистки сточных вод
|
|
|||||||||
|
|
|||||||||
|
|
|||||||||
|
|
|||||||||
|
|
|||||||||
|
|
|||||||||
|
|
|||||||||
|
|
|||||||||
|
|
|||||||||
|
|
|||||||||
|
|
|||||||||
_______________
* Биохимическая потребность в кислороде за 5 суток.
Приложение 6
Журнал для ежедневного химико-технологического контроля
работы аэротенков
|
Ступени аэрации аэротенков | |||||||||
|
I |
II |
III | |||||||
|
N 1 |
N 2 |
N 3 |
N 1 |
N 2 |
N 3 |
N 1 |
N 2 |
N 3 | |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Дата проведения контроля |
|||||||||
|
Поступающие стоки: |
|||||||||
|
взвешенные вещества, г/л |
|||||||||
|
ХПК, мг/л |
|||||||||
|
азот, мг/л: |
|||||||||
|
общий |
|||||||||
|
аммонийный |
|||||||||
|
нитратный |
|||||||||
|
фосфор общий, мг/л |
|||||||||
|
рН |
|||||||||
|
Выходящие стоки: |
|||||||||
|
взвешенные вещества, г/л |
|||||||||
|
ХПК, мг/л |
|||||||||
|
БПК |
|||||||||
|
азот, мг/л: |
|||||||||
|
общий |
|||||||||
|
аммонийный |
|||||||||
|
нитратный |
|||||||||
|
фосфор общий, мг/л |
|||||||||
|
рН |
|||||||||
|
Продолжительность аэрации, ч |
|||||||||
|
Концентрация активного ила, г/л |
|||||||||
|
Прирост активного ила, % |
|||||||||
|
Иловый индекс |
|||||||||
|
Содержание растворенного кислорода, мг/л |
|||||||||
|
Температура стоков, °С |
|||||||||
|
Объем рециркуляционного ила, л |
|||||||||
|
Удельный расход воздуха, м |
|||||||||
|
Примечание |
|||||||||
|
Замечания по смене |
|||||||||
Приложение 7
Лабораторный журнал для ежедневного химико-технологического контроля
работы очистных сооружений комплекса
|
Место отбора проб |
Рас- ход сточ- ных вод, л |
Тем- пера- тура, °С |
Запах |
Взве- шен- ные веще- ства, мг/л |
Сухой остаток, мг/л |
ХПК и БПК |
Азот общий, мг/л |
Азот амми- ачный, мг/л |
Нит- риты, мг/л |
Нит- раты, мг/л |
Фос- фор об- щий, мг/л |
Влаж- ность, % | ||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 | ||||
|
Дата и время отбора проб | ||||||||||||||||
|
Приемный резервуар (исходный навоз) |
||||||||||||||||
|
Установки механического разделения: |
||||||||||||||||
|
твердая фракция |
||||||||||||||||
|
жидкая фракция |
||||||||||||||||
|
I ступень биологической очистки: |
||||||||||||||||
|
сточные воды |
||||||||||||||||
|
активный ил |
||||||||||||||||
|
II ступень биологической очистки: |
||||||||||||||||
|
сточные воды |
||||||||||||||||
|
активный ил |
||||||||||||||||
|
Установки для обезвоживания осадка и ила: |
||||||||||||||||
|
осадок |
||||||||||||||||
|
фугат |
||||||||||||||||
|
Контактный резервуар: |
||||||||||||||||
|
сточные воды |
||||||||||||||||
|
Иловые площадки |
||||||||||||||||
|
Пруд-накопитель (вода на орошение) |
||||||||||||||||
Приложение 8
|
Дата отбора проб |
Место отбора проб |
Объем взятой пробы (мл/см |
Дата иссле- |
Объем иссле- |
Количество обнаруженных |
Количество экземпляров яиц |
Приложение 9
Рецепты основных питательных сред
для санитарно-бактериологического анализа сточных вод
1. Селенитовая среда
|
Однозамещенный кислый селенистокислый натрий (без теллурита) |
4,0 г |
|
Пептон (производство ЧССР, ВНР или ГДР) |
5,0 г |
|
Натрий фосфорнокислый двузамещенный (безводный) |
7,0 г |
|
Натрий фосфорнокислый однозамещенный (безводный) |
3,0 г |
|
Лактоза |
4,0 г |
|
Вода дистиллированная |
1000 мл |
К дистиллированной воде добавляют фосфаты, пептон и лактозу, растворяют их и стерилизуют при 112 °С в течение 30 мин. Отдельно в стерильной дистиллированной воде готовят 10%-ный раствор кислого селенистокислого натрия, который добавляют к среде перед употреблением из расчета 0,4 мл на 10 мл среды. Готовая среда должна иметь рН 6,8-7,1.
2. Магниевая среда
I
|
Пептон |
4,2 г |
|
Хлористый натрий |
7,0 г |
|
Калий фосфорнокислый однозамещенный (безводный) |
1,5 г |
|
Дрожжевой экстрат |
20,0 г |
|
Вода дистиллированная |
890 мл |
Растворяют эти вещества при кипячении, затем добавляют растворы - II и III.
II
|
Хлористый магний кристаллический |
36,0 г |
|
Вода дистиллированная |
90,0 мл |
III
|
0,1%-ный водный раствор бриллиантового зеленого |
5,0 мл |
Магниевую среду разливают в колбы и стерилизуют при 112 °С в течение 20 мин.
3. Трехсахарный агар с мочевиной
|
На 100 мл питательного агара (рН 7,2-7,4) берут: |
|
|
лактозы |
1,0 г |
|
сахарозы |
1,0 г |
|
глюкозы |
0,1 г |
|
мочевины |
1,0 г |
|
соли Мора |
0,02 г |
|
гипосульфита |
0,63 г |
|
фенолового красного (фенолрота) |
0,4-0,6 мл |
Все ингредиенты, кроме фенолрота, растворяют в небольшом количестве дистиллированной воды (10 мл) на водяной бане и вносят в расплавленный агар, фильтруют через марлю и доводят до рН 7,2-7,4. Затем добавляют фенолрот и разливают в пробирки по 5-6 мл. Стерилизуют в прогретом автоклаве при 0,5 атм в течение 20 мин.
4. Агар Чапмена
|
МПА |
100 мл |
|
Хлористый натрий |
8,0 г |
|
Маннит |
1,0 г |
|
Фенольный красный |
0,0025 г |
Среду разливают в колбы и стерилизуют при 0,5 атм в течение 20 мин.
5. Глюкозо-пептонная среда
Среду готовят двух видов: нормальную и концентрированную. Среда нормальной концентрации содержит:
|
пептон |
10,0 г |
|
хлористый натрий |
5,0 г |
|
глюкозу |
5,0 г |
|
дистиллированную воду |
1000 мл |
После растворения указанных ингредиентов прибавляют индикатор (2 мл 1,6%-ного спиртового раствора бромтимолового синего или 10 мл индикатора Андраде), устанавливают рН 7,4-7,6 и разливают среду по 10 мл в пробирки с поплавками, стерилизуют в автоклаве при 112 °С (0,5 кг/см![]() ) в течение 12 мин.
) в течение 12 мин.
При приготовлении концентрированной среды количество всех ингредиентов, кроме воды, увеличивают в 10 раз.
6. Среда Эндо
Готовят из сухого препарата по рецепту на этикетке.
7. Полужидкая среда с индикатором ВР и глюкозой
Готовят по рецепту на этикетке. Срок хранения - не более 7 суток.
8. Приготовление реактива для определения оксидазной активности бактерий
30-40 мг ![]() -нафтола растворяют в 2,5 мл ректифицированного этилового спирта, добавляют 7,5 мл дистиллированной воды и 40-60 мг диметил-
-нафтола растворяют в 2,5 мл ректифицированного этилового спирта, добавляют 7,5 мл дистиллированной воды и 40-60 мг диметил-![]() -фенилендиамина. Раствор готовят непосредственно перед определением.
-фенилендиамина. Раствор готовят непосредственно перед определением.
Электронный текст документа