МУК 4.2.1793-03
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика заболеваний, вызываемых парагемолитическими и другими патогенными для человека вибрионами
Дополнение к методическим указаниям
"Лабораторная диагностика холеры"
МУК 4.2.1097-02
Дата введения 2003-11-02
1. РАЗРАБОТАНЫ: Департаментом госсанэпиднадзора Минздрава России (Н.Я.Жилина); Федеральным центром госсанэпиднадзора Минздрава России (Э.Ф.Опочинский); Ростовским-на-Дону научно-исследовательским противочумным институтом (Ю.М.Ломов, Л.М.Смоликова, Л.Г.Воронежская, Л.С.Подосинникова, Т.А.Кудрякова, Б.Л.Мазруко, Б.Н.Мишаньник, Е.П.Авдеева, Е.Б.Данилкина, Е.М.Санамянц, Н.В.Божко, Е.Н.Голенищева); Противочумным центром Минздрава России (С.М.Иванова, Ю.С.Королев); Причерноморской противочумной станцией Минздрава России (Г.В.Гальцева); Противочумной станцией Минздрава Украины (А.Б.Хайтович).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Комиссией по государственному санитарно-эпидемиологическому нормированию при Министерстве здравоохранения Российской Федерации (протокол N 19 от 19 сентября 2003 г.).
3. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Главным государственным санитарным врачом Российской Федерации - Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 2 ноября 2003 г.
4. ВВЕДЕНЫ ВЗАМЕН "Методических рекомендаций по лабораторной диагностике, эпидемиологии, клинике, лечению и профилактике заболеваний, вызываемых парагемолитическими и другими условно-патогенными морскими вибрионами", утв. зам. начальника Главного управления карантинных инфекций МЗ СССР от 17.07.85 N 28-6 /11.
1. Область применения
Дополнение к методическим указаниям предназначено для специалистов бактериологических лабораторий центров государственного санитарно-эпидемиологического надзора, лечебно-профилактических и противочумных учреждений для лабораторной диагностики заболеваний, вызываемых парагемолитическими и другими патогенными для человека вибрионами.
2. Характеристика возбудителей заболеваний, вызываемых патогенными для человека вибрионами
2.1. Классификация вибрионов
В соответствии с современными представлениями о таксономии вибрионов в состав семейства Vibrionaceae входит 5 родов:
Vibrio, Aeromonas, Plesiomonas, Photobacterium, Enhydrobacter (рис.1). Род Vibrio включает более 30 видов. Классификация вибрионов совершенствуется по мере накопления научных знаний.
Рис.1
Классификация вибрионов*
________________
* Таксономия вибрионов представлена по Bergey's manual of Determinative Bacteriology, 1994.
|
Семейство Vibrionaceae, Veron 1965. | |
|
Род Vibrio. Pacini, 1854 (типовой род семейства) | |
|
Род Aeromonas, Kluyver and Van Niel, 1936 | |
|
Род Plesiomonas, Habs and Schubert, 1962 | |
|
Род Photobacterium Beijerinc, 1889 | |
|
Род Enhydrobacter, Staley et al, 1987 |
Род Vibrio
|
1. |
Вид Vibrio cholerae (типовой вид рода) | ||
|
|
a) V. cholerae O1 (два биовара - классический и эльтор) | ||
|
|
б) V. cholerae non O1 (от O2 до O200 серогруппы). | ||
|
2. |
" V. metschnikovii |
18. |
" V. logei |
|
3. |
" V. harveyi |
19. |
" V. proteolyticus |
|
4. |
" V. campbellii |
20. |
" V.gazogenes |
|
5. |
" V. parahaemolyticus |
21. |
" V. marinus |
|
6. |
" V. alginolyticus |
22. |
" V. costicola |
|
7. |
" V. natriegens |
23. |
" V. mimicus |
|
8. |
" V. vulnificus |
24. |
" V. damsela* |
|
9. |
" V. nereis |
25. |
" V. hollisae |
|
10. |
" V. fluvialis |
26. |
" V. aestuarianus |
|
11. |
" V. furnissii |
27. |
" V. diazotrophicus |
|
12. |
" V. splendidus I |
28. |
" V. orientalis |
|
|
" V. splendidus II |
29. |
" V. cincinnatiensis |
|
13. |
" V. pelagius I* |
30. |
" V. salmonicida |
|
|
" V. pelagius II* |
31. |
" V. tubiashi |
|
14. |
" V. nigripulchritudo |
32. |
" V. mediterranei |
|
15. |
" V. anguillarum* |
33. |
" V. carchariae |
|
16. |
" V. ordalii |
|
|
|
17. |
" V. fischeri |
||
________________
* V. anguillarum, V. damsela, V. pelagius рекомендовано отнести в новый род Listonella (Mac Donell M.T., Colwell R.R., 1985).
Род Vibrio представляют прямые или изогнутые грамотрицательные палочки 0,5-0,8 мкм в диаметре и 1,4-2,6 мкм длиной, не образующие эндоспор и микроцист, в жидкой среде подвижны с помощью одного или многих полярно расположенных жгутиков, некоторые штаммы отдельных видов при росте на плотных средах способны образовывать латеральные жгутики. Растут в аэробных и анаэробных условиях. Вибрионы всех видов, за исключением V. metschnikovii, продуцируют оксидазу, ферментируют глюкозу, некоторые с выделением газа. Чувствительность к вибриостатику О/129 (2,4-диамино-6,7-диизопропилптеридин) у разных видов варьирует. Ионы натрия стимулируют рост вибрионов.
Из всех известных видов вибрионов к патогенным для человека в настоящее время отнесены 12. Их основные признаки приведены в табл.1.
Таблица 1
Дифференциация патогенных для человека видов рода Vibrio
|
Признаки и тесты |
Наличие признака (%) | |||||||||||
|
V.chol- erae |
V.mi- micus |
V.met- schnik- ovii |
V.cin- cinna- tiensis |
V.hol- lisae |
V.dam- sela |
V.flu- vialis |
V.fur- nissii |
V.algi- nolyti- cus |
V.para- haemo- lyticus |
V.vul- nificus |
V.car- chariae | |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
Подвижность |
99 |
98 |
74 |
86 |
0 |
25 |
70 |
89 |
99 |
99 |
99 |
0 |
|
Роение на агаре |
- |
- |
- |
+ |
- |
- |
- |
- |
+ |
+ |
- |
+ |
|
Оксидаза |
100 |
100 |
0 |
100 |
100 |
95 |
100 |
100 |
100 |
100 |
100 |
100 |
|
Образование: |
||||||||||||
|
газа из глюкозы |
0 |
0 |
0 |
0 |
0 |
10 |
0 |
100 |
0 |
0 |
0 |
0 |
|
Индола |
99 |
98 |
20 |
8 |
97 |
0 |
13 |
11 |
85 |
98 |
97 |
100 |
|
H |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Ацетилметил-карбинола |
75 |
9 |
96 |
0 |
0 |
95 |
0 |
0 |
95 |
0 |
0 |
50 |
|
Образование кислоты из: |
||||||||||||
|
глюкозы |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
лактозы |
7 |
21 |
50 |
0 |
0 |
0 |
3 |
0 |
0 |
1 |
85 |
0 |
|
мальтозы |
99 |
99 |
100 |
100 |
0 |
100 |
100 |
100 |
100 |
99 |
100 |
100 |
|
арабинозы |
0 |
1 |
0 |
100 |
97 |
0 |
93 |
100 |
1 |
80 |
0 |
0 |
|
маннозы |
78 |
99 |
100 |
100 |
100 |
100 |
100 |
100 |
99 |
100 |
98 |
50 |
|
сахарозы |
100 |
0 |
100 |
100 |
0 |
5 |
100 |
100 |
99 |
1 |
15 |
50 |
|
целлобиозы |
8 |
0 |
9 |
100 |
0 |
0 |
30 |
11 |
3 |
5 |
99 |
50 |
|
маннита |
99 |
99 |
96 |
100 |
0 |
0 |
97 |
100 |
100 |
100 |
45 |
50 |
|
салицина |
1 |
0 |
9 |
100 |
0 |
0 |
0 |
0 |
4 |
1 |
95 |
0 |
|
Аргининдигидролаза |
0 |
0 |
60 |
0 |
0 |
95 |
93 |
100 |
0 |
0 |
0 |
0 |
|
Лизиндекарбоксилаза |
99 |
100 |
35 |
57 |
0 |
50 |
0 |
0 |
99 |
100 |
99 |
100 |
|
Орнитиндекарбоксилаза |
99 |
99 |
50 |
0 |
0 |
0 |
0 |
0 |
50 |
95 |
55 |
0 |
|
В галактозидаза |
94 |
90 |
0 |
86 |
0 |
0 |
40 |
35 |
0 |
5 |
75 |
0 |
|
Нитратредуктаза |
99 |
100 |
0 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
Рост в 1% пептонной воде с: |
||||||||||||
|
0% NaCI |
100 |
100 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
3% NaCI |
100 |
100 |
100 |
100 |
99 |
100 |
99 |
99 |
99 |
100 |
99 |
100 |
|
6% NaCI |
53 |
49 |
78 |
100 |
83 |
95 |
96 |
100 |
100 |
99 |
65 |
100 |
|
8% NaCI |
1 |
0 |
44 |
62 |
0 |
0 |
71 |
78 |
94 |
80 |
0 |
0 |
|
10% NaCI |
0 |
0 |
4 |
0 |
0 |
0 |
4 |
0 |
69 |
2 |
0 |
0 |
|
Гидролиз мочевины |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
15 |
1 |
0 |
|
Тест тяжа |
100 |
100 |
100 |
80 |
100 |
80 |
100 |
100 |
91 |
64 |
100 |
100 |
|
O/129, зона ингибирования |
99 |
95 |
90 |
25 |
40 |
90 |
31 |
0 |
19 |
20 |
98 |
100 |
+ - большинство штаммов (90-100%) по данному признаку позитивны;
- - большинство штаммов негативны по данному признаку.
Патогенные для человека вибрионы, кроме возбудителей холеры, могут быть причиной острых кишечных инфекций, не имеющих тенденции к эпидемическому распространению, или заболеваний с внекишечной локализацией возбудителя. Виды вибрионов, имеющие значение в патологии человека, и обусловливаемые ими синдромы заболеваний приведены в табл.2.
Таблица 2
Виды патогенных вибрионов и связанные с ними синдромы заболеваний
|
Виды вибрионов |
Клинические синдромы заболеваний | |||
|
гастроэнтерит |
раневая инфекция |
инфекция уха |
септицемия | |
|
V. cholerae O1 и O139 |
+++ |
+ |
- |
- |
|
V.cholerae non O1/O139 |
+++ |
++ |
+ |
++ |
|
V. mimicus |
++ |
+ |
+ |
- |
|
V. fluvialis |
++ |
+ |
- |
- |
|
V. parahaemolyticus |
+++ |
+ |
- |
+ |
|
V. alginolyticus |
(+) |
++ |
++ |
+ |
|
V. cincinnatiensis |
- |
+ |
- |
+ |
|
V. hollisae |
++ |
- |
- |
+ |
|
V. vulnificus |
(+) |
++ |
- |
++ |
|
V. furnissii |
(+) |
- |
- |
- |
|
V. damsela |
- |
++ |
- |
+ |
|
V. metschnikovii |
(+) |
- |
- |
+ |
|
V. carchariae |
- |
+ |
- |
- |
Обозначения:
+++ - часто встречается, ++ - менее часто, + - редко, (+) - описаны, но этиологическая роль инфекции не была подтверждена, - - нет сообщений.
К группе вибрионов, вызывающих преимущественно острые кишечные инфекции, относят V. cholerae non O1, V. parahaemolyticus, V. fluvialis, V. mimicus, V. hollisae. Заболевания, вызываемые ими, по международной статистической классификации болезней (МКБ-10) 1995 года, относят к уточненным бактериальным инфекциям (А04.8), пищевым отравлениям, вызванным V. parahaemolyticus (A05.3) и другим уточненным бактериальным пищевым отравлениям (А05.8); V. vulnificus, V. alginolyticus, V. damsela, V. cincinnatiensis, V. carchariae чаще обусловливают раневые инфекции и септицемии.
Вибрионы широко распространены на земном шаре и являются естественными обитателями пресных и соленых водоемов, а также гидробионтов, обитающих в них. Вибрионы многих видов являются галофильными. К негалофильным относят V. cholerae и V. mimicus. Для роста этих микроорганизмов достаточны следовые количества соли в среде. Вибрионы остальных видов, за исключением отдельных штаммов V. fluvialis и V. metschnikovii, не способны расти в 1%-ной пептоновой воде в отсутствие натрия хлорида и устойчивы к значительным его концентрациям.
Галофильные вибрионы обитают в морях, океанах, озерах, в воде которых концентрация соли колеблется от 5 до 30%. Эти микроорганизмы могут длительно выживать в воде с концентрацией соли ниже 5% при условии повышенного содержания в ней органических веществ. С другой стороны, летом концентрация соли в пресных водоемах повышается за счет испарения воды, что создает благоприятные условия для существования в ней галофильных вибрионов. Эти наблюдения подтверждены обнаружением галофильных вибрионов и в пресных водоемах. Их выделяют из воды, ила, от гидробионтов, водоплавающих птиц. Некоторые виды вибрионов патогенны для морских животных и рыб. Инфицирование людей связано с купанием в морской воде, употреблением в пищу продуктов моря, ловлей и разделкой рыбы, моллюсков. Заболевания, обусловленные патогенными вибрионами, регистрируют в основном в прибрежных районах в теплое время года, зачастую в момент массового отлова обитателей водоемов.
2.2. Галофильные патогенные вибрионы
Среди галофильных вибрионов по частоте и тяжести вызываемых ими острых кишечных заболеваний особое место занимают парагемолитические вибрионы.
V. parahaemolyticus. Впервые вспышка пищевой токсикоинфекции, обусловленной V. parahaemolyticus, при которой из 272 заболевших умерло 20, зарегистрирована в Японии в 1950 г. Заболевание было связано с употреблением в пищу слабосоленой рыбы. Парагемолитические вибрионы в Японии обусловливают до 70% случаев пищевых токсикоинфекций в летние месяцы. Заболевания, вызванные парагемолитическими вибрионами, зарегистрированы также во многих странах Европы, Азии, Америки, Африки, в Австралии и Новой Зеландии. Опасность заражения парагемолитическими вибрионами существует везде, где население использует в питание продукты моря. Вспышки заболеваний возникают в теплое время года в основном в прибрежных районах, но могут встречаться и в местах, удаленных от побережья, что связано с завозом инфицированных продуктов моря.
Чаще болеют взрослые, чем дети, в рационе которых морепродукты присутствуют реже. Вспышки носят, как правило, пищевой характер. Основными факторами передачи являются инфицированные гидробионты.
Больной человек не представляет опасности для окружающих, если исключена возможность инфицирования им пищевых продуктов. Единого мнения о здоровом носительстве парагемолитических вибрионов нет. Инкубационный период колеблется от 1 до 96 ч.
Заболевания, вызываемые парагемолитическими вибрионами, могут протекать в виде одной из трех клинических форм: гастроэнтеритической, дизентерие- и холероподобной. Основные симптомы - абдоминальная схваткообразная боль, диарея, тошнота, рвота, головная боль, озноб, повышение температуры тела до 38-39 °С. Для гастроэнтеритической формы характерен жидкий водянистый стул без примеси слизи и крови; для дизентериеподобной - стул с примесью слизи и крови; для холероподобной - стул очень частый и обильный, частая рвота, обезвоживание организма. Течение болезни чаще бывает среднетяжелым, но явления интоксикации даже при легких формах резко выражены. Продолжительность заболевания от нескольких часов до 10-15 дней. Летальные исходы наблюдаются очень редко. Известны случаи инфицирования V. parahaemolyticus ран, ушей, связанные с пребыванием в морской воде. Имеются сообщения о пневмонии, хроническом посттравматическом отите, вызванных V. parahaemolyticus.
Патогенность парагемолитических вибрионов обусловлена продукцией энтеротоксина, термолабильного и прямого термостабильного гемолизина, который обладает кардиотоксическим и энтеротоксическим действием.
В основу серологической классификации парагемолитических вибрионов положены различия в строении О- и К-антигенов. Известно 12 типов O-антигена и 66 К-антигена. Каждый К-антиген сочетается с одним и тем же O-антигеном, образуя ту или иную серогруппу.
У нас в стране парагемолитические вибрионы обнаружены в морях, соленых озерах и продуктах моря. Крупные вспышки, протекавшие по типу пищевых токсикоинфекций, зарегистрированы в 1984-1986 гг. в районах Черного и Азовского морей, в 1997 г. - на побережье Японского моря в г.Владивостоке. В России, на Украине при групповых заболеваниях от больных чаще выделяли вибрионы серогрупп O4:К12, O4:К8, O3:К6, при спорадичесих случаях - O3:К33, O3:К57, O5:К47, O6:К46, O10:К52. В 1996-2000 гг. парагемолитические вибрионы серогруппы O3:К6 явились причиной крупных вспышек пищевой токсикоинфекции в Японии, республике Корее, на Тайване, в США, в странах Юго-Восточной Азии (Индия, Бангладеш, Лаос, Тайланд) и в России на Дальнем Востоке.
Галофильные вибрионы видов V. fluvialis, V. furnissii, V. hollisae, обусловливающие диарейные заболевания, менее значимы в патологии человека.
К группе галофильных вибрионов, которые вызывают преимущественно септицемии или раневые инфекции, относят V. vulnificus, V. alginolyticus, V. damsela.
V. vulnificus широко распространен в прибрежных морских водах. V. vulnificus вызывает у людей первичный сепсис, раневые инфекции и сравнительно редко острые кишечные заболевания. Синдром первичного сепсиса развивается после употребления в пищу сырых моллюсков, как правило, у лиц с иммунодефицитом и ослабленных хроническими заболеваниями, особенно печени. Быстроразвивающаяся септицемия сопровождается лихорадкой, ознобом, гипотензией, появлением на коже вторичных очагов воспаления вплоть до некроза мягких тканей. Более чем в 50% случаев первичная септицемия заканчивается летально.
Раневые инфекции возникают зачастую после контакта с морской водой или при разделке морских гидробионтов. Заболевание сопровождается геморрагической сыпью, лихорадкой, отеком, воспалением подкожной клетчатки (целлюлитом) и некрозом в месте заражения. Возможные исходы заболевания - хирургическое удаление пораженной ткани, ампутация конечностей, вторичная септицемия и гибель больного.
Острые кишечные инфекции, обусловленные V. vulnificus, встречаются гораздо реже двух указанных выше форм и заканчиваются, как правило, выздоровлением. Известны случаи менингита и пневмонии, этиологическими факторами которых явились вибрионы этого вида.
V. alginolyticus первоначально классифицирован как биовар V. parahaemolyticus. Известен преимущественно как возбудитель раневых и реже кишечных инфекций. Заболевания протекают обычно в легкой форме.
V. damsela. Случаи раневых инфекций, вызванные V. damsela, как правило, связаны с пребыванием в морской воде. Эти микроорганизмы выделены из раны рыб damselfish, откуда и произошло их название. Описан случай септицемии у человека, порезавшего руку во время разделки рыбы.
V. metschnikovii обнаружен в пресных и соленых водоемах, выделен из сточных вод. Описан случай холецистита, осложненный септицемией, вызванный V. metschnikovii.
Патогенные вибрионы видов V. cincinnatiensis, V. carchariae описаны в 80-90-х годах. Имеются единичные сообщения о заболеваниях, обусловленных ими.
2.3. Негалофильные патогенные вибрионы
V. cholerae non O1/O139 широко распространены в природе, являются естественными обитателями пресных и умеренно соленых водоемов, их обнаруживают в различных климато-географических зонах мира, но наиболее часто в Южном, Юго-Восточном и Юго-Западном регионах с жарким, тропическим и умеренным климатом.
Сходство холерных вибрионов O1 и не O1 групп по основным таксономическим признакам послужило основанием для отнесения их к виду холерных вибрионов.
Среди холерных вибрионов, по данным зарубежных исследователей, определено около 200 серогрупп.
Холерные вибрионы не O1/O139 групп способны вызывать у людей заболевания, варьирующие по характеру клинических проявлений от диарей различной степени тяжести до так называемых системных заболеваний с внекишечной локализацией возбудителя, в т.ч. септицемии. Вызванные этими микроорганизмами диареи в виде спорадических случаев или групповых вспышек токсикоинфекций зарегистрированы во многих странах мира. Пути передачи инфекции - пищевой, водный, реже контактный. В случае реализации пищевого пути передачи возникают групповые вспышки, а водного - преимущественно спорадические.
В России, Молдове, Беларуси, Узбекистане, Туркменистане и на других территориях бывшего Союза имели место спорадические и групповые заболевания, обусловленные этими микроорганизмами.
При широком ареале распространения холерных вибрионов не O1 в окружающей среде вызываемые ими заболевания регистрируют довольно редко среди диарей другой этиологии. Заболевания чаще протекают в легкой или средне-тяжелой форме и не склонны к эпидемическому распространению.
Заболевания, связанные с инфицированием различных органов и тканей, протекающие в виде ринитов, отитов, эндометритов, пневмоний, менингитов, септицемий и других клинических форм, регистрируют преимущественно в прибрежных зонах США, Южной и Центральной Америки, Японии, Вьетнама и др. Зарегистрированы случаи септицемии в Литве, Китае с летальным исходом. Септицемии, связанные с холерными вибрионами не O1, обычно регистрируют у пациентов с иммунодефицитными состояниями. Заболевания протекают крайне тяжело с высоким уровнем летальности. Вибрионы, обусловившие случай септицемии, выявленный в Израиле, принадлежали к O23 серогруппе, в Литве и Италии - к O2, в Китае - к O13. В остальных случаях серогруппы выделенных от больных септицемией холерных вибрионов не O1 не были установлены. Ни в одном из известных случаев септицемии не наблюдали эпидемического распространения.
У больных с диареями различной степени тяжести обнаруживают холерные вибрионы преимущественно O2, O5, O6, O8, O9, O10, O13, O17, O23, O28, O34, O37, O40, O41, O42, O47 и O50 серогрупп, часть из них вызывают диареи, сопровождающиеся обезвоживанием II-III, a иногда IV степени и выраженными явлениями общей интоксикации.
Холерные вибрионы не O1 способны продуцировать термолабильный токсин, сходный, но не идентичный холерному энтеротоксину, цитолизин, гемолизин, термостабильные токсины, ответственные за развитие диарей. Описаны отдельные штаммы холерных вибрионов не O1, не O139, продуцирующие холерный токсин (СТ) и содержащие в геноме ctx-ген, относящиеся к O9, O13, O28, O37, O41 серогруппам или не типирующиеся сыворотками известных серогрупп.
Среди энтеропатогенных вибрионов известна группа широко распространенных микроорганизмов, которые способны к биолюминесценции. Такие вибрионы обозначают в литературе как V. phosphorescens или V. albensis, таксономическое положение их окончательно не определено. Описаны случаи острых кишечных заболеваний, обусловленных V. albensis. Имеется сообщение о постоперационном эндофтальмите, вызванном этими микроорганизмами.
V. mimicus до 1981 года считали сахарозонегатавным вариантом V. cholerae. Проведенные таксономические исследования позволили отнести их в отдельный вид, который получил свое название (mimicus - подобный) из-за сходства с холерными вибрионами. V. mimicus вызывет у людей преимущественно диареи, реже раневые инфекции, эндометрит. Заболевания с поражением желудочно-кишечного тракта связывают с употреблением в пищу сырых продуктов моря, а инфицирование мягких тканей - с пребыванием в морской воде.
3. Бактериологическая диагностика заболеваний, обусловленных патогенными для человека вибрионами
При проведении диагностических исследований следует иметь в виду, что группами риска в возникновении заболеваний, обусловленных патогенными вибрионами, являются рыбаки, работники рыбообрабатывающих предприятий, жители прибрежных районов умеренного и жаркого климата. Среди них наиболее подвержены заболеваниям лица с ослабленным иммунным статусом или с хроническими заболеваниями, особенно печени.
Исследование клинического материала на различные виды патогенных вибрионов проводят по предлагаемой в настоящем документе схеме в случаях:
- возникновения спорадических или групповых острых кишечных заболеваний по типу пищевых токсикоинфекций (ПТИ), связанных с употреблением в пищу морепродуктов, ловлей и обработкой рыбы или купанием в море;
- выявления больных септицемией, менингитом, пневмонией, с инфицированными ранами мягких тканей, особенно среди лиц указанных выше групп риска.
Исследования проводят в баклабораториях лечебно-профилактических, противочумных учреждений, центров госсанэпиднадзора и других, имеющих разрешение на работу с бактериальными возбудителями III-IV групп патогенности в установленном порядке, в первом случае - параллельно на патогенные энтеробактерии, а во втором - наряду с поиском общепризнанных возбудителей заболеваний с внекишечной локализацией возбудителя.
Исходя из многообразия клинических проявлений заболеваний исследуют различный материал: от больных ОКЗ - испражнения, рвотные массы, желчь, промывные воды желудка; в случае раневой инфекции - отделяемое ран; при септицемии, менингите - кровь, спинно-мозговую жидкость.
По эпидпоказаниям исследуют также пищевые продукты, воду открытых водоемов, гидробионтов.
Кроме того, в плановом порядке контролируют на присутствие парагемолитических вибрионов рыбу, морских беспозвоночных и продукты, вырабатываемые из них в соответствии с методическими указаниями (п.2.5).
Способы отбора и доставка проб от больных и из внешней среды описаны в МУ 4.2.1097-02 (п.2.4).
В случаях заболеваний с внекишечной локализацией возбудителя применяют методы отбора и доставки материала, принятые в практике бактериологической диагностики соответствующих заболеваний.
Исследования проводят с соблюдением требований СП 1.2.036-95, СП 1.2.731-99, СП 1.3.1318-03.
3.1. Порядок исследования
Материал от больных исследуют по схеме, представленной на рис.2. Предлагаемая схема предусматривает выделение, как галофильных, так и негалофильных вибрионов, в т.ч. возбудителей холеры (холерные вибрионы O1 и O139). Для выделения как галофильных, так и негалофильных вибрионов используют жидкие и плотные питательные среды, содержащие 1,5% натрия хлорида. При исследовании только на галофильные вибрионы концентрацию натрия хлорида в средах рекомендуется увеличить до 2-3%. Для идентификации галофильных вибрионов применяют те же среды, что и для возбудителей холеры, но с увеличенным до 1,5% содержанием натрия хлорида. Рецептура и способ изготовления питательных сред указаны в МУ 4.2.1097-02 (п.2.4).
Рис.2
Схема бактериологического исследования материала от больных на патогенные для человека вибрионы
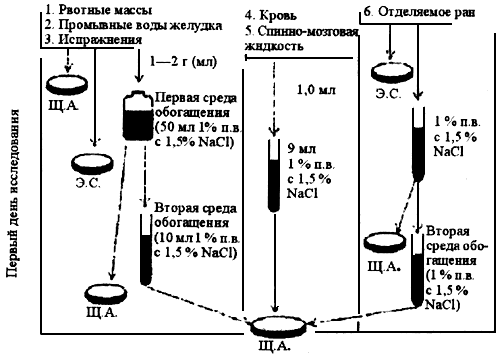
|
1-2-й день |
1. Посев на щелочной агар (Щ.А.) и на одну из элективных сред (Э.С.) |
|
|
2. Отбор колоний, подозрительных на вибрионы, с посевов предыдущего дня: |
|
а) подозрительные на холерные вибрионы колонии агглютинируют холерными O1 и O139 сыворотками, в случае положительного результата проводят исследования, направленные на выделение возбудителя холеры; | |
|
б) подозрительные на холерные не O1 группы и другие виды вибрионов колонии на щелочном агаре и элективной среде отсевают одной петлей на полиуглеводную среду (ПУС) и в 1%-ную пептонную воду без NaCl. | |
|
3-й день |
1. Изучение посевов со 2-го пептона и выделение подозрительных культур проводят так же, как и с 1-го пептона. |
|
|
2. Учет роста в 1%-ной пептонной воде без NaCl и на ПУС. |
|
3. Постановка пробы на индофенолоксидазу с культурой с ПУС и р.агглютинации с холерными O1 и O139 сыворотками на стекле с культурами, выросшими в 1%-ной пептонной воде без NaCl и давшие характерные изменения на ПУС. | |
|
4. Изучение морфологии клеток в мазках, окрашенных по Граму. | |
|
5. Посев отобранных культур (галофильных и негалофильных вибрионов) в дифференциально-диагностические среды, содержащие 1,5% NaCl. | |
|
|
6. Определение чувствительности культур к антибиотикам. |
|
4-5-й день |
1. Учет результатов тестов идентификации. Определение вида выделенных культур вибрионов. |
|
2. Идентификация культур, выделенных со второго пептона. | |
|
3. Учет результатов исследования. Выдача окончательного ответа. |
При бактериологическом исследовании используют следующие питательные среды:
- в качестве накопительной - 1%-ную пептонную воду с 1,5% натрия хлорида;
- для выделения патогенных вибрионов:
неэлективные среды - щелочной агар АООТ "Биомед" им. Мечникова или другие плотные щелочные среды с добавлением натрия хлорида до 1,5%;
элективные среды - диагностическая сухая для выделения холерного вибриона производства Ростовского НИПЧИ (СЭДХ) и TCBS и другие;
- на средах Эндо и Плоскирева возможно обнаружение вибрионов отдельных штаммов, но как специальные среды для выделения вибрионов патогенных видов их не рекомендуют;
- среды для идентификации с 1,5% натрия хлорида: 0,3%-ный щелочной агар, полиуглеводные (Ресселя, Клиглера и др.), Хью-Лейфсона с глюкозой, Гисса с арабинозой, маннозой, сахарозой, лактозой, целлобиозой, мальтозой, салицином, маннитом; бульон Кларка - для определения ацетилметилкарбинола; агар с 10% лактозы - для определения 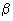 -галактозидазы; среды с аминокислотами; бульон с индикаторными бумажками на индол и сероводород; бульон с 0,1% КNО
-галактозидазы; среды с аминокислотами; бульон с индикаторными бумажками на индол и сероводород; бульон с 0,1% КNО - для определения нитратредуктазы; 1%-ная пептонная вода без NaCl, с 3, 6, 8, 10% NaCl - для оценки галофильности, среда Кристенсена - для выявления гидролиза мочевины и другие. Кроме того, для определения способности к роению используют 1,5%-ный щелочной агар с 3% NaCl, а для выявления гемолитической активности парагемолитических вибрионов - среду Вагатцума.
- для определения нитратредуктазы; 1%-ная пептонная вода без NaCl, с 3, 6, 8, 10% NaCl - для оценки галофильности, среда Кристенсена - для выявления гидролиза мочевины и другие. Кроме того, для определения способности к роению используют 1,5%-ный щелочной агар с 3% NaCl, а для выявления гемолитической активности парагемолитических вибрионов - среду Вагатцума.
Первый день исследования. Рвотные массы, промывные воды желудка, фекалии в количестве 1-2 г (мл) вносят в 50 мл 1%-ной пептонной воды с 1,5% натрия хлорида; кровь, спинно-мозговую жидкость - по 1,0 мл в 9 мл той же среды; отделяемое ран, взятое стерильным тампоном, помещают в пробирку с 10 мл накопительной среды. Посевы рвотных масс, содержимого желудка, фекалий и отделяемого ран инкубируют 6-8 ч при (37,0±0,5) °С, крови - 18-20 ч при той же температуре. Материал от больных, исключая кровь, одновременно засевают на щелочной агар и одну из элективных сред. Через 6-8 ч от начала исследования делают пересев на вторую среду обогащения, для чего материал из первой среды переносят петлей диаметром 5 мм в 10 мл 1%-ной пептонной воды с 1,5% натрия хлорида и инкубируют при комнатной температуре до следующего дня или 6-8 ч при (37,0±0,5) °С - в случае круглосуточной работы лаборатории. Из первой пептонной воды делают высев на щелочной агар, а при исследовании отделяемого ран, крови, спинно-мозговой жидкости по истечении сроков инкубации - и на агар с 5% крови барана. На этой среде вибрионы, за исключением гемолитических штаммов V. cholerae O1 и V. damsela, не проявляют гемолитической активности.
Второй день исследования. Пересевают материал со 2-го пептона, а при исследовании крови - с первого на щелочной агар и одну из элективных сред. Просматривают невооруженным глазом посевы на плотных средах. Холерные вибрионы на щелочном агаре образуют прозрачные, голубоватые колонии. Вибрионы других видов формируют полупрозрачные и плотные колонии размером от 1-1,5 мм у таких видов, как V. mimicus, V. damsela, и более крупные (от 2 до 5 мм) - у остальных видов патогенных вибрионов. На СЭДХ колонии вибрионов гладкие с ровным краем, желтоватые или цвета среды, в зависимости от отношения к сахарозе, и достигают в размере 2-6 мм. С подозрительными на холерные вибрионы колониями ставят ориентировочную реакцию агглютинации на стекле с холерными O1 и O139 сыворотками. В случае положительного результата их изучают в соответствии с МУ 4.2.1097- 02 "Лабораторная диагностика холеры".
Лаборатории, не имеющие разрешения на работу с возбудителем холеры в установленном порядке, в случае выделения культур вибрионов, реагирующих в слайд-агглютинации с холерными сыворотками O1 или O139, немедленно сообщают в территориальный центр госсанэпиднадзора, а культуру доставляют в специализированную лабораторию в установленном порядке.
Колонии, вибрионы которых не агглютинировались холерными O1 и O139 сыворотками, проверяют на наличие индофенолоксидазы. Все патогенные виды вибрионов, кроме V. metschnikovii, а также аэромонады, псевдомонады, в отличие от энтеробактерий, дают положительные результаты в этом тесте. Далее оксидазопозитивные и оксидазонегативные колонии отсевают одной петлей в пептонную воду без добавления натрия хлорида и на полиуглеводную среду (Ресселя, Клиглера и др.).
Третий день исследования. Изучают посевы со 2-го пептона так же, как и с первого. Учитывают наличие роста в 1%-ной пептонной воде без натрия хлорида и характер изменения окраски полиуглеводной среды. Изучают морфологию клеток в мазках с полиуглеводной среды, окрашенных по Граму. Для дальнейшего исследования отбирают грамнегативные культуры:
1) оксидазопозитивные, дающие характерные изменения на полиуглеводной среде, выросшие и не выросшие в 1%-ной пептонной воде без натрия хлорида;
2) оксидазопозитивные, ферментирующие глюкозу с образованием газа, выросшие и не давшие роста в пептонной воде без соли;
3) оксидазонегативные, расщепляющие глюкозу до кислоты без газа, независимо от роста в 1%-ной пептонной воде, не содержащей натрия хлорида.
Среди культур первой группы, выросших в 1%-ной пептонной воде без натрия хлорида, могут быть негалофильные вибрионы: V. cholerae, V. mimicus, а также Aeromonas, Plesiomonas и некоторые штаммы V. fluvialis. Культуры, не выросшие в 1%-ной пептонной воде без натрия хлорида, подозрительны на принадлежность к галофильным вибрионам.
Среди культур второй группы возможны отдельные штаммы V. damsela, V. furnissii, ферментирующие глюкозу с образованием газа.
В третьей группе культур могут оказаться V. metschnikovii, а также не образующие газ энтеробактерии.
С оксидазопозитивными культурами, выросшими в пептонной воде без соли и дающими на полиуглеводной среде характерные для вибрионов изменения, ставят ориентировочную реакцию агглютинации с холерными O1 и O139 сыворотками в разведении 1:50. В положительном случае их изучают как подозрительные на принадлежность к V. cholerae O1 и O139. Все остальные отобранные культуры отсевают в дифференционально-диагностические среды для изучения признаков, указанных в табл.1.
Четвертый день исследования. Учитывают изменения в средах, засеянных в предыдущий день. Культуры, выделенные со 2-го пептона, изучают по плану 3-го дня исследования. По тестам идентификации определяют видовую принадлежность культур, выделенных из первого пептона.
У выделенных от больных культур вибрионов определяют антибиотикограмму (п.2.4).
В специализированных лабораториях парагемолитические и холерные вибрионы не O1 и не O139 групп изучают методами серо- и фаготипирования и определяют факторы патогенности.
Пятый день исследования. Учитывают результаты идентификации и выдают окончательный ответ.
3.2. Идентификация культур патогенных вибрионов
Выделенные культуры идентифицируют с целью определения принадлежности к одному из видов рода Vibrio. Классификация вибрионов и их характеристика приведены на рис.1 и в табл.1.
Наличие индофенолоксидазы и потребность в натрии хлориде отличает вибрионы от представителей семейства Enterobacteriaceae. Аэромонады, в отличие от вибрионов, не нуждаются в натрии хлориде, но устойчивы к O/129. Некоторые штаммы плезиомонад чувствительны к вибриостатику O/129, но в отличие от вибрионов обладают лизиндекарбоксилазой и аргининдигидролазой.
Дальнейшая межвидовая дифференциация вибрионов возможна с помощью дифференцирующих тестов, указанных в табл.1 или с использованием микробиологического ключа (рис.3).
Рис.3
Дифференциация вибрионов, патогенных для человека (идентификационный ключ)
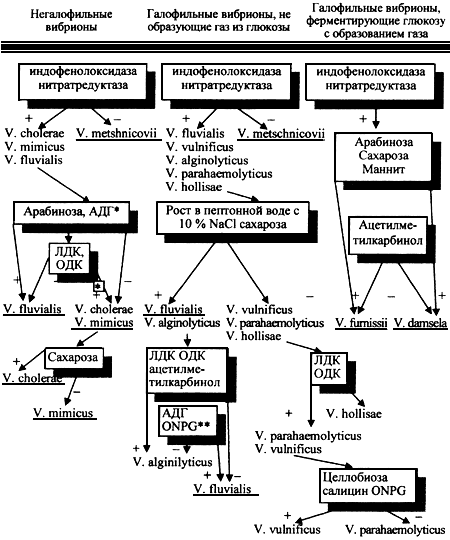
________________
* АДГ, ЛДК и ОДК - аргининдигидролаза, лизин- и орнитиндекарбоксилазы.
** ONPG - тест на 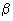 -галактозидазу.
-галактозидазу.
Ключ состоит из трех частей. В первой - предусмотрена дифференциация негалофильных вибрионов: V. cholerae не O1, V. mimicus, также негалофильных штаммов: V. metschnikovii и V. fluvialis. Вибрионы Мечникова, в отличие от других микроорганизмов этой группы, не имеют индофенолоксидазы и нитратредуктазы. Отличительными признаками V. fluvialis является наличие аргининдигидролазы при отсутствии лизиндекарбоксилазы; V. cholerae не O1 и V. mimicus дифференцируют по отношению к сахарозе.
Во второй части ключа дана схема дифференциации галофильных вибрионов, не образующих газ из глюкозы: V. vulnificus, V. alginolyticus, V. parahaemolyticus, V. hollisae и некоторых штаммов V. fluvialis, V. metschnikovii.
Тестами, позволяющими дифференцировать вибрионы этой группы, являются: ферментация сахарозы, образование ацетилметилкарбинола, наличие лизиндекарбоксилазы, аргининдигидролазы, 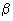 -галактозидазы. Наибольшую сложность представляет дифференциация V. vulnificus и V. parahaemolyticus. V. vulnificus, в отличие от V. parahaemolyticus, ферментирует целлобиозу, салицин и обладают
-галактозидазы. Наибольшую сложность представляет дифференциация V. vulnificus и V. parahaemolyticus. V. vulnificus, в отличие от V. parahaemolyticus, ферментирует целлобиозу, салицин и обладают 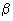 -галактозидазой.
-галактозидазой.
Третья часть ключа полезна для дифференциации галофильных вибрионов, ферментирующих глюкозу с образованием газа, которая возможна по результатам изучения ферментации арабинозы, сахарозы, маннита и способности образовывать ацетилметилкарбинол.
4. Методы определения некоторых дифференциальных признаков патогенных вибрионов
При выделении из исследуемого материала вибрионов, агглютинирующихся холерными сыворотками O1, O139 серогрупп, их идентифицируют в соответствии с МУ 4.2.1097-02 "Лабораторная диагностика холеры". В случае выделения культур вибрионов, не агглютинирующихся сыворотками против возбудителей холеры O1 и O139, их изучают по расширенному набору признаков, определяющих родовую и видовую принадлежность. Методики описаны в МУ 4.2.1097-02 "Лабораторная диагностика холеры", в связи с чем в настоящем документе приведены лишь некоторые не описанные ранее методы, имеющие значение для дифференциации патогенных галофильных и негалофильных вибрионов.
4.1. Вибриостатический тест
Для постановки теста используют диски фирмы Oxoid, содержащие 10 и 150 мкг вибриостатика O-129 (2,4-diamino 6,7-diisopropylpteridine phosphate) и другие. Суспензией суточной агаровой культуры исследуемого штамма равномерно засевают пластинку щелочного агара, на газон накладывают диски, инкубируют в течение 18-20 ч и учитывают результаты. Любая зона ингибиции роста вокруг дисков рассматривается как положительный результат. В отличие от Aeromonas и Pseudomonas негалофильные вибрионы чувствительны к вибриостатику. Галофильные вибрионы ведут себя по-разному.
4.2. Выявление способности к роению
Феномен роения для дифференциации алгинолитических и парагемолитических вибрионов на 1,5%-ном агаре с 3% натрия хлорида. Алгинолитические вибрионы, в отличие от парагемолитических, растут в виде сплошного налета, напоминающего рост вульгарного протея. Для выявления феномена роения суточную агаровую культуру наносят в центр подсушенной пластины щелочного агара и сутки инкубируют при (37±0,5) °С. Роящиеся культуры распространяются по поверхности всей среды, а нероящиеся - вырастают только на месте посева.
4.3. Серотипирование холерных вибрионов не O1 группы
Серотипирование холерных вибрионов не O1 проводят в реакции агглютинации с набором диагностических моноспецифических сывороток к типовым штаммам этих микроорганизмов. В настоящее время в международных зарубежных коллекциях насчитывается около 200 типовых штаммов, а в Российской - 83, из них штаммы только 38 серогрупп (O2-O39) соответствуют международной классификации. Остальные, выделенные в 70-80-х годах преимущественно от больных ОКЗ в различных регионах бывшего СССР, не изучены в сравнении с типовыми штаммами международной коллекции. Специалистами Российского НИПЧИ "Микроб" и Ростовского противочумного института разработана технология получения набора диагностических вибрионных агглютинирующих сывороток моноспецифических, поливалентной и групповых по отношению к типовым штаммам Российской национальной коллекции. Сыворотки используют в диагностическом разведении в реакции ориентировочной или объемной агглютинации в соответствии с инструкцией по применению препаратов. Выделенные от больных штаммы типируются в 60-70% случаев. Преимущественно энтеропатогенными являются вибрионы O5, O6, O8, O10, O13, O17, O18, O23, O28, O34, O37, O40, O41, O42, O47, O50, O62, O82 и некоторых других серогрупп по отечественной классификации. При наличии в распоряжении исследователя набора моноспецифических сывороток для серологической идентификации выделенных от больных культур в первую очередь используют сыворотки этих серогрупп. Получение положительного результата с одной из них достаточно для определения принадлежности к соответствующей серогруппе. В случае получения отрицательных результатов с сыворотками против вибрионов преимущественно энтеропатогенных серогрупп, идентификацию продолжают с другими сыворотками.
4.4. Серологическое цитирование парагемолитических вибрионов
Для эпиданализа заболеваний, обусловленных парагемолитическими вибрионами, важное значение имеет серологическая идентификация выделенных культур. Серологическое типирование проводят по схеме (табл.3). Для определения К-антигена исследуют живую культуру, O-антигена - убитую 2-часовым кипячением.
Таблица 3
Схема серотипирования V. parahaemolyticus (Sakazaki R., 1979)
|
O-группа |
К-антигены |
|
01 |
1, 25, 26, 32, 38, 41, 56, 58* |
|
02 |
3, 28 |
|
03 |
4*, 5, 6, 7, 29, 30*, 31, 33, 37, 43, 45, 48, 54, 57, 58*, 59 |
|
04 |
4*, 8, 9, 10, 11, 12, 13, 34, 42, 49, 53, 55 |
|
05 |
15, 17, 30*, 47, 60 |
|
06 |
18, 46 |
|
07 |
19* |
|
08 |
20, 21, 22, 39 |
|
09 |
23, 44 |
|
010 |
19*, 24, 52 |
|
011 |
36, 40, 50, 51 |
|
012 |
61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71 |
|
________________ | |
Набор агглютинирующих О- и К-сывороток для серологического типирования на стекле выпускает японская фирма Toschiba Kazaki Co.Ltd, Tokyo и другие.
4.5. Фаготипирование холерных вибрионов не O1 серогруппы
Фаготипирование энтеропатогенных вибрионов не O1 серогруппы используют в эпидемиологической практике, а также для идентификации вибрионов, выделенных от людей и из объектов внешней среды.
Методика фаготипирования
Набор типирующих фагов (ТЭПВ) производства Российского НИПЧИ "Микроб" состоит из семи фагов: ТЭПВ-1-ТЭПВ-7 (табл.4). Для фаготипирования используют 1,5-2,0% щелочной питательный агар рН 7,6±0,2. Питательную среду разливают в чашки Петри по 20-25 мл и после застывания подсушивают 30 мин при (37±0,5) °С. Фаги ТЭПВ используют цельные и в разведениях 10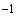 , 10
, 10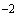 и 10
и 10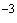 . Рабочие разведения готовят путем последовательных десятикратных разведений в питательном бульоне рН 7,2-7,6.
. Рабочие разведения готовят путем последовательных десятикратных разведений в питательном бульоне рН 7,2-7,6.
Таблица 4
Схема фаготипирования холерных вибрионов не O1 серогруппы
|
Фаготип |
Типирующие фаги | ||||||
|
ТЭПВ-1 |
ТЭПВ-2 |
ТЭПВ-3 |
ТЭПВ-4 |
ТЭПВ-5 |
ТЭПВ-6 |
ТЭПВ-7 | |
|
1 |
+ |
|
|
|
|
|
|
|
2 |
|
+ |
|
|
|
|
|
|
3 |
|
|
+ |
|
|
|
|
|
4 |
|
|
|
+ |
|
|
|
|
5 |
|
|
|
|
+ |
|
|
|
6 |
|
|
|
|
|
+ |
|
|
7 |
|
|
|
|
|
|
+ |
В пробирку с 3 мл 0,7%-ного агара, расплавленного на водяной бане и остуженного до 45 °С, добавляют 0,2-0,3 мл 3-4-часовой бульонной культуры испытуемого штамма вибриона, тщательно смешивают и быстро выливают на агаровую пластинку в чашках Петри. После застывания и подсыхания нанесенного слоя агара с культурой платиновой петлей (диаметр 2 мм) наносят каждый фаг цельный и из разведений 10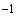 , 10
, 10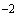 , 10
, 10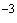 . После подсыхания капель чашки переворачивают вверх дном и инкубируют при (37±0,5) °С 16-18 ч.
. После подсыхания капель чашки переворачивают вверх дном и инкубируют при (37±0,5) °С 16-18 ч.
Результаты оценивают по 4-балльной системе.
++++ - сливной полный лизис на месте нанесения фага; +++ -множественные негативные колонии или лизис с мягким вторичным ростом; ++ - изолированные негативные колонии или лизис со значительным вторичным ростом; + - едва заметный след на месте нанесения фага.
За положительный результат принимают лизис культур не менее чем на 2+. Определение фаготипа проводят по схеме. Всего установлено 7 фаготипов. В том случае когда штамм лизируется двумя или несколькими фагами в разных разведениях, его относят к тому фаготипу, с фагом которого получен лизис с наивысшей степенью разведения. В тех случаях когда степень разведения и полнота лизиса равны для нескольких фагов, опыт повторяют с добавлением одного или двух разведений (10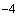 , 10
, 10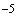 ) и оценивают также. Не типирующиеся фагами ТЭПВ холерные не O1 вибрионы представляют собой отдельную группу штаммов.
) и оценивают также. Не типирующиеся фагами ТЭПВ холерные не O1 вибрионы представляют собой отдельную группу штаммов.
4.6. Определение патогенных свойств парагемолитических вибрионов
Феномен Канагава
Патогенные для человека парагемолитические вибрионы дифференцируют от непатогенных по способности продуцировать прямой термостабильный гемолизин (ТПГ). Гемолитическая активность выявляется на специальной среде Вагатцума, которая содержит эритроциты человека. По результатам теста штаммы делят на Канагава-положительные (вирулентные) и Канагава-отрицательные (авирулентные). Штаммы, выделенные от больных, Канагава-позитивны более чем в 95% случаев, а из внешней среды - до 1%.
Постановка теста.
Культуру засевают в мясопептонный бульон с 1,5% натрия хлорида. Свежеприготовленную и разлитую в чашки Петри среду Вагатцума слегка подсушивают. Суточную бульонную культуру каплей наносят в центр пластины агара. Посевы инкубируют при (37±0,5) °С. Результат оценивают через 24-48 ч по величине и полноте зоны гемолиза. При необходимости посева нескольких культур на одну пластину среды Вагатцума ее делят на секторы, вырезая между ними полоски агара.
Входящие в среду Вагатцума компоненты (пептон - 1,0 г; дрожжевой экстракт сухой - 0,3 г; натрия хлорид - 7,0 г; двузамещенный фосфорно-кислый калий - 0,5 г; агар-агар - 1,5 г; дистиллированная вода - 100 мл) растворяют при нагревании, но не стерилизуют, затем добавляют 1 г маннита, 0,1 мл 0,1%-ного спиртового раствора кристаллвиолета и 5 мл дефибринированной крови человека. Среду разливают по чашкам и слегка подсушивают.
4.7. Определение патогенных свойств холерных вибрионов не O1, не O139 серогрупп
Для выявления генов патогенности возбудителя холеры (ctx, tcpA, toxR и др.) у холерных вибрионов не O1, не O139 серогрупп используют молекулярные методы исследования - полимеразная цепная реакция (ПЦР) и блотгибридизация по Саузерну в соответствии с методиками, изложенными в МУ 4.2.1097-02 "Лабораторная диагностика холеры". Там же приведена методика внутрикишечного заражения кроликов-сосунков для оценки токсигенных свойств холерных вибрионов на экспериментальных животных.
5. Библиографические данные
1. Безопасность работы с микроорганизмами I-IV групп патогенности (опасности): СП 1.3.1285-03.
2. Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I-IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения: СП 1.3.1318-03.
3. Порядок учета, хранения, передачи и транспортирования микроорганизмов I-IV групп патогенности: СП 1.2.036-95.
4. Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами: СП 1.2.731-99.
5. Лабораторная диагностика холеры: МУ 4.2.1097-02.
6. Методические указания по контролю в рыбных продуктах парагемолитических вибрионов-возбудителей пищевых токсикоинфекций: МУ 5780-91 от 03.04.91.
Текст документа сверен по:
официальное издание
М.: Федеральный центр госсанэпиднадзора
Минздрава России, 2004
 S
S