МУК 4.2.992-00
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы выделения и идентификации
энтерогеморрагической кишечной палочки E. coli O157:Н7
Дата введения 2001-02-04
1. РАЗРАБОТАНЫ Федеральным центром госсанэпиднадзора Минздрава России (Л.Г.Подунова, Н.С.Кривопалова, Р.С.Сорокина), Центром госсанэпиднадзора в Тульской области (Л.И.Шишкина, Т.А.Попова, А.Я.Сыпченко, Н.М.Корнеева), Государственным научным центром прикладной микробиологии (М.В.Храмов).
2. УТВЕРЖДЕНЫ Главным государственным санитарным врачом Российской Федерации - Первым заместителем министра здравоохранения Российской Федерации Г.Г.Онищенко 4 ноября 2000 г.
3. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
1. Настоящие методические указания предназначены для бактериологических лабораторий центров государственного санитарно-эпидемиологического надзора, других учреждений системы здравоохранения Российской Федерации, осуществляющих бактериологическую диагностику острых кишечных инфекций с гемоколитом и развитием гемолитико-уремического синдрома, а также обследование контактных в очагах заболевания и контроль за качеством продовольственного сырья и пищевых продуктов.
2. Методические указания определяют методы обнаружения, выделения и идентификации энтерогеморрагической кишечной палочки Е. coli О157:Н7 и разработаны в связи с отсутствием в настоящее время нормативных документов по данному разделу бактериологических исследований.
3. Методические указания являются обязательными при контроле продуктов детского питания, молочных и мясных продуктов в ходе проведения противоэпидемических мероприятий при возникновении вспышек, а также осуществления санитарно-эпидемиологического надзора.
4. Настоящие методические указания созданы с целью унификации и дальнейшего совершенствования бактериологических методов выделения и идентификации энтерогеморрагической кишечной палочки Е. coli О157:Н7 в связи с регистрацией данной патологии на территории Российской Федерации, а также роста заболеваемости вспышечного характера и спорадической за рубежом.
2. Сущность метода
Методические указания содержат описание микробиологического исследования с целью выделения и идентификации энтерогеморрагической кишечной палочки Е. coli О157:Н7 из биоматериала от больных неосложненными диареями, острыми кишечными инфекциями с гемоколитом и развитием гемолитико-уремического синдрома, от контактных в очаге, а также пищевых продуктов, сырья.
Предлагаемый дифференциально-диагностический метод основан на использовании некоторых особенностей биохимических свойств данного микроорганизма: отсутствии фермента 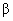 -D-глюкуронидазы и способности ферментировать сорбитол, а также на наличии у Е. coli О157:Н7 такого "маркера", как продукция веротоксинов (VT1, VT2).
-D-глюкуронидазы и способности ферментировать сорбитол, а также на наличии у Е. coli О157:Н7 такого "маркера", как продукция веротоксинов (VT1, VT2).
Для осуществления возможности практического использования данной методики в течение короткого периода времени разработана отечественная питательная среда "Сорбитол Е. coli О157:Н7 агар" (ФС 42-0027-00) для выделения Е. coli О157:Н7 из клинического материала, объектов окружающей среды (разработчик - Государственный научный центр прикладной микробиологии, отделение "Питательные среды", г.Оболенск Серпуховского района Московской области), а также созданы диагностические сыворотки для реакции агглютинации и методика определения веротоксинов в клиническом материале.
Огромный интерес, проявляемый к острым кишечным инфекциям с гемолитико-уремическим синдромом (ГУС) со стороны научных центров и практического здравоохранения за рубежом и в нашей стране, закономерен.
Количество регистрируемых заболеваний острыми кишечными инфекциями с гемолитико-уремическим синдромом, как вспышечного характера, так и спорадических, ежегодно возрастает (США, Канада, Финляндия, Япония, Европа).
Этиологическим фактором этих заболеваний являются энтерогеморрагические кишечные палочки, продуцирующие веротоксины (шигаподобные токсины). Они представлены довольно большим разнообразием серологических вариантов, из которых Е. coil О157:Н7 имеет наибольшее эпидемиологическое значение в качестве причин неосложненных диарей и кровавого поноса с последующим развитием ГУС.
К настоящему времени биология эшерихии Е. соli О157:Н7, эпидемиология, патогенез и диагностика связанных с ней заболеваний достаточно изучены.
Первые сведения о выделении Е. coli О157:Н7 и регистрация данной патологии в нашей стране имели место в Тульской области, где диагностика острых кишечных инфекций с гемолитико-уремическим синдромом начата с конца 1996 года.
Результаты выделения Е. coli О157:Н7 из клинического материала от детей, больных ОКИ, сырья, пищевых продуктов (сырого мяса, молока) получены в 1997-99 гг.: установление этиологического фактора (Е. coli О157:Н7) случаев острых кишечных инфекций, осложненных гемолитико-уремическим синдромом, составило в Тульской области 43%, высеваемость Е. coli О157:Н7 из пищевых продуктов и сырья 1,96%; высеваемость культур от животноводов и доярок ферм - 9%.
Наибольшему риску подвержены дети до 5 лет и пожилые люди.
Естественным резервуаром бактерий Е. coli О157:Н7, патогенных для человека, служит крупный рогатый скот, овцы. Наиболее частый путь распространения этой инфекции - пищевой. Основным фактором передачи является сырая говядина, особенно мясной фарш, мясные полуфабрикаты, прошедшие недостаточную термическую обработку, сырое молоко. Отмечены случаи передачи возбудителя через воду.
3. Нормативные ссылки
3.1. "Основы законодательства Российской Федерации об охране здоровья граждан" от 22.07.93 г.N 5487-1.
3.2. Федеральный закон "О санитарно-эпидемиологическом благополучии населения" от 30 марта 1999 г. N 52-ФЗ.
3.3. СанПиН 2.3.2.560-96 "Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов"*.
___________________
* Действуют СанПиН 2.3.2.1078-01. - Примечание .
3.4. ГОСТ 26668-85 "Продукты пищевые и вкусовые. Методы отбора проб для микробиологических исследований".
3.5. ГОСТ 26669-85 "Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов".
3.6. ГОСТ 26670-91 "Продукты пищевые. Методы культивирования микроорганизмов".
3.7. ГОСТ 10444.1-84 "Консервы. Приготовление растворов, красок, индикаторов, питательных сред, применяемых в микробиологическом анализе".
3.8. ГОСТ Р 50474-93 "Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)".
3.9. ГОСТ Р 50480-93 "Продукты пищевые. Методы выявления бактерий рода Salmonella".
3.10. ГОСТ 9225-84 "Молоко и молочные продукты. Методы микробиологического анализа".
3.11. ГОСТ 9792-73 "Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб".
3.12. ГОСТ 9958-81 "Изделия колбасные и продукты из мяса. Методы бактериологического анализа".
3.13. ГОСТ 21237-75 "Мясо. Методы микробиологического анализа".
3.14. ГОСТ 4288-76 "Изделия кулинарные и полуфабрикаты из рубленого мяса. Правила приемки и методы испытания".
3.15. ГОСТ Р 50396.0-92 "Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим исследованиям".
3.16. ГОСТ 7702.2.2-93 "Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы выявления и определения количества бактерий группы кишечных палочек".
3.17. ГОСТ 7702.2.3-93 "Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы выявления сальмонелл".
3.18. МУ 04-723/3 от 17.12.84 г. Методические указания по микробиологической диагностике заболеваний, вызываемых энтеробактериями.
3.19. Инструкция к применению "Набора реагентов для выявления веротоксина у эшерихий" (фирма "Seiken", Япония).
4. Методы забора, доставки проб клинического материала от больных и контактных
Важным условием выделения эшерихий Е. coli О157:Н7 из клинического материала является отбор и доставка его в лабораторию в возможно ранние сроки: оптимальными сроками являются 1-3 день от момента заболевания.
У больных интенсивность выделения возбудителя снижается, достигая 50% и более низкого уровня через 5-8 дней от начала заболевания. Гемолитико-уремический синдром обычно развивается спустя, как минимум, одну неделю после первых признаков диареи, и вероятность обнаружения возбудителя к этому времени существенно уменьшается.
Материалом для бактериологического исследования служат в первую очередь испражнения, моча.
Испражнения собирают в консервант, в качестве которого можно использовать фосфатно-буферную или глицериновую смеси. В случае доставки материала в течение 2 часов с момента забора нативные испражнения отбирают в стерильные флаконы.
При обследовании контактных лиц с целью выявления бактерионосителей возможно взятие материала ректальными тампонами, проволочными петлями.
Мочу после туалета наружных половых органов собирают в стерильную посуду. Перед посевом мочу центрифугируют и засевают осадок. В случае небольшого количества осадка засевают нативную мочу в среду обогащения двойной концентрации в равных объемах (приложение 1).
5. Методы подготовки пищевых продуктов
для бактериологического исследования
и схемы посева на питательные среды
Методы отбора проб, хранение и подготовка их к анализу регламентированы в действующих нормативных документах на конкретный вид продукта (раздел 3 "Нормативные ссылки").
Проведение испытаний различных пищевых продуктов устанавливает единый метод выявления в определенной навеске пищевого продукта колиформных бактерий в соответствии с ГОСТ Р 50474-93 "Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)". По классификации кишечных палочек Е. coli 0157:Н7 относится к энтерогеморрагическим, энтеропатогенным кишечным палочкам, поэтому выявление ее как патогена необходимо проводить в 25 г продукта. Возможно выявление Е. coli О157:Н7 в других объемах, регламентированных нормативной документацией на конкретный вид продукта, а также СанПиН 2.3.2.560-96 "Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов" (приложения 2, 3).
6. Проведение анализа
Принципы бактериологического исследования с целью выделения Е. coli О157:Н7 не отличаются от общепринятых для возбудителей острых кишечных инфекций и включают методы классического бактериологического исследования, основанные на выделении чистой культуры микроорганизма и последующей его идентификации по культурально-морфологическим, биохимическим, антигенным свойствам. Основным критерием отнесения штамма к группе энтерогеморрагических эшерихий являются данные, подтверждающие продукцию веротоксинов. Штаммы, не продуцирующие токсинов, не могут считаться возбудителями эшерихиозов у людей.
6.1. Посев клинического материала с целью выделения Е. coli О157:Н7 проводится на питательную среду Сорбитол Е. coli О157:Н7 агар (прямой посев) и в соотношении 1:5 в среды накопления, которыми могут служить бульон лактозный с бриллиантовым зеленым и желчью (ГОСТ Р 50474-93), GN Enrichment Broth асс. to HAJNA (Cat. N 10756, фирма "MERCK", Германия). При отсутствии нативного материала испражнения, забранные в консервант, засевают в среду обогащения двойной концентрации (приложение 1).
6.2. Посев пищевых продуктов для выявления БГКП (колиформных бактерий) в определенной навеске продукта проводится в соответствии с ГОСТ Р 50474-93. Дополнительной питательной средой для выявления Е. coli О157:Н7 является Сорбитол E. coli О157:Н7 агар (приложение 2), потому что плотная питательная среда, используемая для выделения колиформных бактерий (Эндо), не может быть использована для целенаправленного поиска E. coli О151:Н7, т.к. данный микроорганизм разлагает лактозу подобно другим эшерихиям.
6.3. Подготовку пищевых продуктов для выявления E. coli О157:Н7 с применением сред обогащения осуществляют в соответствии с ГОСТ Р 50480-93 "Продукты пищевые. Методы выявления бактерий рода Salmonella", но в качестве сред обогащения могут быть использованы среда Кесслера, трипказо-соевый бульон, бульон лактозный с бриллиантовым зеленым и желчью, Грам-негативный бульон (GN-бульон). После термостатирования посевов при 37 °С в течение 18-24 ч проводят высев на плотную среду Сорбитол Е. coli О157:Н7 агар, обладающую дифференциальными и селективными свойствами (приложение 3).
Отличительным биохимическим свойством Е. coli О157:Н7 является отсутствие способности ферментировать сорбитол. Для выделения штаммов Е. coli О157:Н7 необходимо использовать Сорбитол Е. coli О157:Н7 агар или среды зарубежного производства: Fluorocult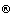 Е. coli О157:Н7 Agar (Cat. N 1.04036); Sorbitol MacConkey Agar (SMAC-agar) Cat. N 1.09207; Fluorocult
Е. coli О157:Н7 Agar (Cat. N 1.04036); Sorbitol MacConkey Agar (SMAC-agar) Cat. N 1.09207; Fluorocult HC Agar acс. to SZABO Cat. N 1.09206 (фирма "MERCK", Германия).
HC Agar acс. to SZABO Cat. N 1.09206 (фирма "MERCK", Германия).
Характеристика роста Е. coli О157:Н7 на плотных питательных средах представлена в табл.1.
Таблица 1
Характеристика роста Е. coli О157:Н7 на плотных питательных средах
|
Питательная среда |
Характер колоний |
|
Среда ЭНДО |
Колонии средней величины, выпуклые, круглые, влажные, темно-красные, Lac |
|
Сорбитол Е. coli О157:Н7 агар |
Колония средней величины, выпуклые, круглые, влажные, бесцветные, прозрачные. Могут быть бледно-розовые со светлым ореолом, мутноватые |
|
Fluorocult Е. coli О157:Н7 Agar |
Прозрачные или полупрозрачные колонии, бесцветные, размером 1,5-2 мм |
|
Простой питательный агар |
Колонии средней величины, выпуклые, круглые, влажные, блестящие, прозрачные в проходящем свете |
|
Агар Плоскирева, Висмут-сульфит агар, ЖСА, среда Сабуро |
Роста нет. Иногда на среде Плоскирева - мелкие выпуклые колонии красноватого цвета, Lac |
|
Кровяной агар |
Колонии средней величины, выпуклые, круглые, влажные, бледноватые, иногда сероватые. Гемолиз отсутствует |
Если на чашке с Сорбитол Е. coli О157:Н7 агаром выросли 1-2 сорбитол-отрицательных колонии, то серологические исследования проводят после посева на одну из сред для первичной дифференциации: агар Клиглера, Олькеницкого, Ресселя. В случае роста на чашке Петри однотипной культуры с 3-5 колониями проводят серологическую идентификацию на стекле с "О"- и "Н"-сыворотками к антигенам Е. coli О157:Н7, либо с латексным антительным диагностикумом.
Не менее 5 сорбитол-отрицательных колоний пересевают на среду для первичной идентификации. Посевы инкубируют в термостате при 37 °С 18-24 часа. При получении на следующий день результатов, подтверждающих принадлежность культуры к роду эшерихий (ферментация глюкозы и лактозы с образованием кислоты и газа, отсутствие H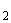 S), проводят дальнейшую биохимическую и серологическую идентификацию (приложения 2, 3).
S), проводят дальнейшую биохимическую и серологическую идентификацию (приложения 2, 3).
7. Биохимические свойства и серологическая идентификация Е. соli O157:Н7
Серологическая идентификация предусматривает выявление "О"- и "Н"-антигенов у эшерихий Е. coli О157:Н7.
Определение "О"- и "Н"-антигенов проводится в обычной реакции агглютинации на стекле с эшерихиозными сыворотками к Е. соli O157:Н7, выпускаемыми АООТ "Биомед" имени И.И.Мечникова (Московская область, Красногорский район, с.Петрово-Дальнее) или латексным антительным диагностикумом производства ГНЦ ПМ (Московская область, Серпуховской район, г.Оболенск). Реакция агглютинации осуществляется в соответствии с наставлениями по применению данных сывороток.
Необходимо отметить, что Е. coli О157:Н7 имеет антигенные связи с другими эшерихиями (табл.2).
Таблица 2
Антигенные связи Е. соli О157:Н7 и других эшерихий
|
Е. coli |
Наименование сывороток | |
|
О157 |
Н7 | |
|
О2-О17 |
- |
- |
|
О19-О49 |
|
|
|
О51-О54 |
||
|
О56-О115 |
|
|
|
О117-О164 |
|
|
|
О50 |
+ |
- |
|
О1; О18; О55 |
- |
+ |
|
О157:Н7 |
+ |
+ |
Все штаммы, дающие положительную реакцию агглютинации, подлежат обязательной биохимической идентификации для подтверждения видовой принадлежности. Биохимические свойства Е. coli О157:Н7 отражены в табл.3.
Таблица 3
Основные биохимические свойства Е. coli О157:Н7
|
N |
Тест или субстрат |
Наименование штаммов | |
|
Е. соli O157:Н7 |
Е. coli | ||
|
1 |
Сорбитол |
- |
+ |
|
2 |
|
- |
+ |
|
3 |
Цитрат Симмонса |
- |
- |
|
4 |
Мочевина |
- |
- |
|
5 |
Малонат натрия |
- |
- |
|
6 |
Сероводород |
- |
- |
|
7 |
Фенилаланиндезаминаза |
- |
- |
|
8 |
Ацетат натрия |
+ |
+ |
|
9 |
Рамноза |
± |
± |
|
10 |
Глюкоза (газ) |
+ |
+ |
|
11 |
Лактоза |
+ |
± |
|
12 |
Сахароза |
± |
± |
|
13 |
Маннит |
+ |
+ |
|
14 |
Арабиноза |
+ |
+ |
|
15 |
Адонит |
- |
- |
|
16 |
Инозит |
- |
- |
|
17 |
Салицин |
(±) |
± |
|
18 |
Дульцит |
(±) |
± |
|
19 |
Раффиноза |
± |
± |
|
20 |
Ксилоза |
+ |
± |
|
21 |
Орнитиндекарбоксилаза |
+ |
± |
|
22 |
Лизиндекарбоксилаза |
+ |
+ |
|
23 |
Аргининдегидролаза |
- |
± |
|
24 |
Индол |
+ |
+ |
|
25 |
|
+ |
+ |
|
26 |
Реакция с метиловым красным |
+ |
+ |
|
27 |
Реакция Фогеса-Проскауэра |
- |
- |
Характерной биохимической особенностью энтерогеморрагических кишечных палочек Е. coli O157:Н7, в отличие от других Е. coli, является отсутствие способности продуцировать фермент 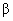 -D-глюкуронидазу (95% штаммов) и расщеплять сорбитол.
-D-глюкуронидазу (95% штаммов) и расщеплять сорбитол.
В остальном биохимические свойства штаммов Е. coli O157:Н7 практически не отличаются от таковых у Е. coli: ферментируют с кислотообразованием углеводы - глюкозу, маннит, лактозу; не ферментируют адонит и инозит; сбраживают вариабельно рамнозу, сахарозу, салицин, дульцит, раффинозу; не образуют сероводород; не утилизируют, цитрат, малонат; не имеют фенилаланиндезаминазы, уреазы; утилизируют ацетат; дают положительную реакцию с метиловым красным и отрицательную Фогеса-Проскауэра; обладают ферментом 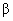 -D-галактозидазой; большинство штаммов (89%) расщепляют аминокислоты лизин и орнитин, не расщепляют аргинин.
-D-галактозидазой; большинство штаммов (89%) расщепляют аминокислоты лизин и орнитин, не расщепляют аргинин.
Определение фермента 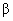 -D-глюкуронидазы возможно при использовании питательных сред фирмы MERCK: Fluorocult
-D-глюкуронидазы возможно при использовании питательных сред фирмы MERCK: Fluorocult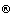 Е. coli O157:Н7 Agar или Fluorocult
Е. coli O157:Н7 Agar или Fluorocult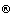 НС Agar асс. to SZABO. Указанные среды в своей рецептуре содержат 4-methylumbelliferyl-
НС Agar асс. to SZABO. Указанные среды в своей рецептуре содержат 4-methylumbelliferyl-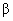 -D-glucuronide (MUG), который при наличии у исследуемого штамма
-D-glucuronide (MUG), который при наличии у исследуемого штамма 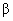 -D-глюкуронидазы расщепляется ею до глюкуроновой кислоты и компонента 4-methylumbelliferone, который обнаруживается по флюоресценции колоний при освещении длинноволновой ультрафиолетовой лампой (UV-366 nm). He продуцируя данного фермента, Е. coli O157:Н7 образуют на вышеуказанных средах флюоресценс-негативные колонии.
-D-глюкуронидазы расщепляется ею до глюкуроновой кислоты и компонента 4-methylumbelliferone, который обнаруживается по флюоресценции колоний при освещении длинноволновой ультрафиолетовой лампой (UV-366 nm). He продуцируя данного фермента, Е. coli O157:Н7 образуют на вышеуказанных средах флюоресценс-негативные колонии.
Для определения 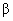 -D-галактозидазы и сорбитола используются биохимические пластины для дифференциации энтеробактерий (ПБДЭ) производства НПО "Диагностические системы" (г.Нижний Новгород) и планшеты ММТЕ 1, ММТЕ 2 (НПО "Аллерген", г.Ставрополь).
-D-галактозидазы и сорбитола используются биохимические пластины для дифференциации энтеробактерий (ПБДЭ) производства НПО "Диагностические системы" (г.Нижний Новгород) и планшеты ММТЕ 1, ММТЕ 2 (НПО "Аллерген", г.Ставрополь).
В практике бактериологических лабораторий учреждений системы здравоохранения широко используются для идентификации энтеробактерий: API-тесты и биохимический экспресс-анализатор "АТВ identification" фирмы BioMerieux (Франция), тест-система BBL "Crystall" фирмы "Becton Dickinson" (Германия), а также идентификатор микроорганизмов MicroTax фирмы "SY-LAB" (Австрия).
С помощью поименованных тест-систем возможно определение всех биохимических свойств и Е. coli O157:Н7, включая фермент 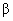 -D-глюкуронидазу.
-D-глюкуронидазу.
8. Определение факторов патогенности Е. coli O157:Н7
При подтверждении принадлежности выделенной культуры к роду Escherichia, серогруппе O157 или Е. coli O157:Н7 необходимо определение способности данной культуры продуцировать веротоксины (VТ1, VТ2).
Настоящие методические указания предлагают апробированную и модифицированную методику выявления веротоксинов выделенных культур микроорганизмов с помощью "Набора реагентов для выявления веротоксина у эшерихий" (фирма "Seiken", Япония) для постановки реакции обращенной пассивной латексной агглютинации (далее РОПЛА), методом иммуноферментного анализа (ИФА) с помощью набора Ridasckeen "Веротоксин" (фирма "Biopharm", Германия) и методом биологических проб.
8.1. Определение веротоксинов методом реакции
обращенной пассивной латексной агглютинации
Принцип метода заключается в том, что латексные частицы данного набора, сенсибилизованные специфическими антителами против VT1 и VT2, реагируют с веротоксином образца, что приводит к агглютинации. Комплекс AG+AT диффузно осаждается на дно лунки микропланшета, образуя "зонтик". Об отсутствии веротоксина свидетельствует отрицательная реакция агглютинации - образование плотной латексной бляшки - "пуговки". Методика постановки реакции обращенной пассивной латексной агглютинации аналогична РПГА, проста в постановке и учете результатов. Важным моментом является приготовление образцов из культур эшерихий, позволяющее в полной мере разрушать бактериальные клетки и экстрагировать токсин. В наставлении по применению предложены два варианта приготовления образцов, но оба варианта требуют сложных питательных сред, культивирования в течение 18-20 ч. на качалке, разрушения клеток с помощью полимиксина В, что является трудоемким для практических лабораторий. Разрушение бактериальных клеток можно проводить с помощью ультразвука на установке УЗТ-101 Ф, для чего делается посев изучаемого штамма на триптозный ГРМ-агар (аналогичной импортной средой является агаризированная среда Brain-heart infusion broth (BHI), Cat. N 51009, фирма "BioMerieux", Франция) с добавлением 90 мкг/мл линкомицина.
После 18-20-часового инкубирования при 37 °С выросшую на чашке культуру смывают 3 мл физиологического раствора. Микробную взвесь пипеткой переносят в пробирку диаметром 20-23 мм высотой 95 мм. Полученный таким образом образец подвергают ультразвуковой обработке интенсивностью 1 Вт/см , при импульсном режиме работы 10 миллисекунд в течение 5 мин, погружая электрод в микробную взвесь (после каждого образца электрод обрабатывают 70° этиловым спиртом).
, при импульсном режиме работы 10 миллисекунд в течение 5 мин, погружая электрод в микробную взвесь (после каждого образца электрод обрабатывают 70° этиловым спиртом).
Обработанную ультразвуком микробную взвесь переносят в центрифужные пробирки, центрифугируют при 3000 об/мин 30 мин. Для обнаружения веротоксина берется супернатант.
Постановка реакции с полученным супернатантом и учет результатов обращенной пассивной латексной агглютинации подробно описаны в наставлении по применению набора реагентов "VEROTOX-F", с помощью которого возможно выявление как VT1, так и VT2.
Данная реакция для выявления веротоксинов у эшерихий разных серологических групп, в т.ч. Е. coli О157:Н7, имеет преимущества перед другими методами: высокая точность, простота постановки, учет результатов реакции через 18-20 часов.
8.2. Определение веротоксинов методом иммуноферментного анализа
Для определения веротоксинов выделенных культур Е. coli О157:Н7 может быть использован метод иммуноферментного анализа с применением для этих целей наборов Ridascreen "Веротоксин" (Cat. N R-5701 и С-2201, фирма "Biopharm", Германия). В основе процедуры лежит взаимодействие антигенов с антителами. Поставляемый в комплекте набора планшет сенсибилизирован моноклональными антителами к веротоксинам 1 и 2 (VT1 и VT2). Для достижения достаточной чувствительности при определении веротоксинов в выделенных культурах перед иммуноферментным анализом необходимо провести культивацию патогенов в средах обогащения (см. п.10.3 "Реактивы, питательные среды") в течение 18-24 часов при 37 °С. В состав набора входят материалы и реагенты в количестве, достаточном для выполнения 96 определений. Постановка иммуноферментного анализа для выявления веротоксинов проводится в соответствии с методикой, прилагаемой в наставлении к набору.
8.3. Определение веротоксинов методом биологических проб
8.3.1. Определение веротоксинов культур E. coli О157: Н7
При отсутствии набора реагентов для выявления веротоксинов выделенных штаммов Е. coli О157:Н7 (РОПЛА, ИФА) определить веротоксины в супернатанте выделенного штамма можно путем биопробы с использованием белых мышей. Для биопробы следует взять 4 мышей весом 16-18 граммов и двум мышам ввести внутрибрюшинно по 1 мл супернатанта. Две другие мыши остаются контрольными, им вводится по 1 мл прокипяченного в течение 45 минут супернатанта. При положительном результате мыши погибают через 10-12 часов. В этом случае определяется комплекс токсинов (VT1+VT2) или один из них, присущий изучаемому штамму. Вскрытие мышей позволяет наблюдать патологические изменения в толстом кишечнике, характеризующиеся явлениями гемоколита (отек слизистой, эритемы, геморрагии). Мыши контрольной группы остаются живы.
8.3.2. Определение веротоксинов в клиническом материале
В случае получения отрицательного результата при исследовании нативного материала путем посева на Сорбитол Е. coli О157: Н7 агар (прямого и через среду обогащения) или позднего обследования больного ОКИ, когда вероятность выделения культуры резко снижается, возможно определение веротоксинов непосредственно в испражнениях. Испражнения в лабораторию доставляются во флаконе в нативном виде. Не менее 1 г переносят в центрифужную пробирку, заливают 4-5 мл физиологического раствора, размешивают стеклянной палочкой и оставляют при комнатной температуре в течение 30 мин, центрифугируют при 3000 об/мин 30 мин, надосадочную жидкость используют для выявления веротоксинов методом биологических проб. Надосадочная жидкость после центрифугирования фекалий делится на 2 пробы: одна проба кипятится в пробирке 40-45 минут с целью разрушения веротоксина и используется как контрольная. На каждую пробу используется по 2 мыши, которым внутрибрюшинно вводится по 1 мл надосадочной жидкости испражнений. В результате мыши, которым был введен нативный экстракт фекалий, гибнут через 10-12 часов при наличии веротоксина, а мыши контрольной группы остаются живы.
8.4. Определение веротоксинов в клиническом материале
При наличии незначительного количества возбудителя в пробах и невозможности его выделения классическим методом (на поздних сроках заболевания), а также для получения быстрого результата возможно определение веротоксинов непосредственно из фекалий.
Обнаружение веротоксинов в испражнениях больных является таким же достоверным методом, как и выделение микроорганизма. Основные преимущества этого метода - быстрота определения веротоксинов (т.к. не требуется выделения чистых культур) и возможность определения их концентрации на разных этапах заболевания.
Подготовку испражнений проводят аналогично определению веротоксинов для метода биопроб (п.8.3.2). Надосадочную жидкость после центрифугирования испражнений в физрастворе используют для определения веротоксинов в реакциях (РОПЛА, ИФА) аналогично обнаружению токсинов выделенных культур Е. coli О157:Н7. Методика позволяет определить токсин в фекалиях не только качественно, но и показать его концентрацию.
При определении факторов патогенности особый интерес представляют методы, позволяющие обнаруживать токсин бактериального специфического липополисахарида (ЛПС) Е. coli О157:Н7, а также гены вирулентности посредством изучения цитопатогенной активности в отношении культуры клеток HeLa или почечных клеток Vero. Эффективно также использование методов генетических зондов и ПЦР. Эти исследования недоступны для практических лабораторий и проводятся, как правило, в референс-лабораториях.
Исследование крови с целью обнаружения веротоксинов проводить не рекомендуется, поскольку веротоксины, обладая исключительно высоким аорфинитетом к рецептору УВ 3, очень быстро связываются с ним и практически никогда не определяются в сыворотке крови.
9. Серологическая диагностика
Выявление в сыворотке крови больных эшерихиозом, обусловленным Е. coli О157:Н7, антител к О-антигену и антитоксических антител является перспективным при диагностике на поздних сроках заболевания, а также для определения причины развития у больных гемолитико-уремического синдрома.
Однако отсутствие отечественных диагностикумов и анатоксинов не позволяет в настоящее время использовать серологические реакции в сети практических лабораторий.
10. Аппаратура, материалы, лабораторная посуда, реактивы и питательные среды
10.1. Аппаратура и инструментарий
|
Термостат, позволяющий поддерживать рабочую температуру 37 °С с отклонением от заданной ±1 °С |
ТУ 64-1-1382-72 | |
|
Шкаф сушильный стерилизационный ШСС-80П или других марок, позволяющий поддерживать температуру (160±5) °С |
ТУ 64-1-28-70-76 | |
|
Анализатор потенциометрический, погрешность измерений рН±0,01 |
||
|
Баня водяная с подогревом |
||
|
Весы лабораторные общего назначения, 2 и 4 класса точности, с наибольшим пределом взвешивания 200 г |
||
|
__________________ | ||
|
Микроскоп биологический МБИ-1, МБИ-2, МБИ-3, МБР-1, МБР-3 |
ГОСТ 8284-78 | |
|
Стерилизаторы паровые медицинские или аналогичные |
ГОСТ 19569-89 Е* | |
|
__________________ | ||
|
Дистиллятор, обеспечивающий качество дистиллированной воды в соответствии с ГОСТ 6709-72 |
||
|
Центрифуга медицинская с числом оборотов не менее 3000 об/мин |
| |
|
Аппарат для ультразвуковой терапии УЗТ-101-Ф |
Завод электромедицинской аппаратуры (ЭМА), г.Москва | |
|
Анализатор иммуноферментный |
| |
|
Пинцет медицинский |
||
|
Скальпель хирургический, 15 см |
||
|
Часы механические сигнальные |
ГОСТ 3145-84 | |
|
Штативы для пробирок |
||
|
Электроплитка |
||
|
| ||
|
Бумага фильтровальная лабораторная |
||
|
Бутылки стеклянные для химических реактивов |
||
|
Вата медицинская гигроскопическая |
||
|
Воронки стеклянные |
||
|
Кастрюли эмалированные |
ГОСТ 24778-81 | |
|
Марля медицинская |
ОСТ 9412-93 | |
|
Колбы плоскодонные конические или круглые разной вместимости |
ОСТ 25336-82 | |
|
Пипетки вместимостью 1, 2, 5 и 10 см |
||
|
Полистироловые планшеты U-образные |
||
|
Пробирки Уленгута (поплавки) |
||
|
Пробирки типов П1, П2 |
||
|
Стекла предметные для микропрепаратов |
ГОСТ 6672-75 | |
|
Ступка фарфоровая с пестиком |
||
|
Термометр ртутный с диапазоном измерения от 0 до 100 °С, с ценой деления шкалы 1 °С |
||
|
Чашки биологические (Петри) |
||
|
Шпатели стеклянные |
||
|
| ||
|
Агар микробиологический |
ГОСТ 17206-96 | |
|
Агар сухой питательный |
ФС 42-188 ВС-90 | |
|
Бромтимоловый синий |
ТУ 6-09-20-86-77 | |
|
Бриллиантовый зеленый |
ТУ 6-09-4279-76 | |
|
Вода дистиллированная |
||
|
Глицерин |
||
|
D-глюкоза, ч. |
||
|
D-лактоза, 1-водная |
ТУ 6-09-22-98-79 | |
|
Желчь сухая или желчь нативная сельскохозяйственных животных, стерильная |
ОСТ 49 278-75 | |
|
Калий фосфорно-кислый однозамещенный, ч. |
||
|
Калий фосфорно-кислый двузамещенный, ч. |
||
|
Кристаллический фиолетовый |
ТУ 6-09-4119-75 | |
|
L-аргинин гидрохлорид |
ТУ 6-09-124-63 | |
|
L-лизин гидрохлорид |
| |
|
L-орнитин моногидрохлорид |
| |
|
Малонат натрия |
| |
|
Масло иммерсионное для микроскопии |
ГОСТ 13739-78 | |
|
Натрий фосфорно-кислый двузамещенный, безводный |
||
|
Натрий хлористый (ч., х.ч. или ч.д.а.) |
||
|
Набор для окраски по Граму |
| |
|
Пептон сухой ферментативный для бактериологических целей |
||
|
ГРМ-агар |
ФС 42-3377-97 (ГНЦ ПМ*) | |
|
________________ | ||
|
Триптозный ГРМ-агар и ГРМ-бульон |
по заказу экспериментальными сериями (ГНЦ ПМ) | |
|
Сахароза |
||
|
Спирт этиловый ректификованный |
ГОСТ 5962-67* | |
|
_________________ | ||
|
Соль Мора |
||
|
Панкреатический гидролизат казеина |
ТУ 9385-002-00479327-94 (ГНЦ ПМ); ФС 42-3440-97 | |
|
Сорбитол |
(АООТ "Биомед*) | |
|
_________________ | ||
|
Сухой питательный бульон (ГРМ-бульон) |
ФС 42-3378-97 | |
|
Среда Клиглера |
ФС 42-3387-97 | |
|
|
(АООТ "Биомед"); ФС 42-0023-00 (ГНЦ ПМ) | |
|
Среда Кесслера сухая |
ФС 42-0024-00 (ГНЦ ПМ) | |
|
Среда Сорбитол Е. coli О157:Н7 агар |
ФС 42-0027-00 (ГНЦ ПМ) | |
|
Среда Ресселя |
ФС 42-3587-98 | |
|
Среда Эндо |
ФС 42-186 ВС-88 | |
|
Феноловый красный, индикатор |
ГОСТ 4599-73 | |
|
Фуксин основной |
ТУ 6-09-4119-75 | |
|
Цитратный агар Симмонса |
ВФС 42-3344-99 (ГНЦ ПМ) | |
|
Среды Гисса |
ФС 42-3644-98 | |
|
Среда Олькеницкого |
экспериментально-производственные серии (ГНЦ ПМ) | |
Возможно использование коммерческих питательных сред, диагностических препаратов и систем идентификации зарубежных фирм, предназначенных для приведенных методов. При использовании их следует руководствоваться рекомендациями фирмы-производителя.
Питательные среды и биологические препараты должны иметь международный сертификат качества ИСО 9.000 или EN 29.000.
|
Селективные питательные среды для обнаружения и выделения Е. соli О157:Н7 | |
|
Fluorocult |
Cat. N 1.04036 (фирма "MERCK", Германия) |
|
Fluorocult |
Cat. N 1.09206 (фирма "MERCK", Германия) |
|
Sorbitol MacConkey Agar (SMAC Agar) |
Cat. N 1.09207 (фирма "MERCK", Германия) |
|
Среды обогащения | |
|
Бульон лактозный с бриллиантовым зеленым и желчью - лабораторного приготовления по ГОСТ Р 50474-93 |
|
|
Brain-heat infusion broth (BHI) (сердечно-мозговой бульон) |
Cat. N 51009 (фирма "BioMerieux", Франция) |
|
GN Enrichment Broth acс. to HAJNA (грам-негативный бульон по Хайну) |
Cat. N 1.10756 (фирма "MERCK", Германия); Cat. N М 242 (фирма "Ni Media", Индия) |
|
Среда Кесслера сухая |
ФС 42-0024-00 |
|
Трипказо-соевый бульон |
Cat. N 51019 (фирма "BioMerieux", Франция) |
|
Диагностикумы, сыворотки | |
|
Набор Ridascheen "Веротоксин" |
Cat. N R-5701 (фирма "Biopharm", Германия) |
|
Набор Ridascheen "Веротоксин" |
Cat. N С-2201 (фирма "Biopharm", Германия) |
|
Набор реагентов "Verotox-F" для определения веротоксинов методом обращенной пассивной латексной агглютинации (РОПЛА) |
Cat. N 342101 (фирма "Seiken", Япония) |
|
Сыворотки диагностические эшерихиозные O157 групповые адсорбированные, сухие для РА |
АООТ "Биомед" имени И.И.Мечникова |
|
Н-сыворотка сухая эшерихиозная для определения Н7-антигена |
АООТ "Биомед" имени И.И.Мечникова |
|
Латексный антительный диагностикум |
экспериментальные серии (ГНЦ ПМ) |
10.4. Приготовление растворов реактивов, консервантов и питательных сред
10.4.1. Приготовление растворов реактивов и консервантов
10.4.1.1. Физиологический раствор
0,85 г хлористого натрия растворяют в 100 см дистиллированной воды и стерилизуют при температуре (121±1) °С в течение 30 минут. Хранят при комнатной температуре.
дистиллированной воды и стерилизуют при температуре (121±1) °С в течение 30 минут. Хранят при комнатной температуре.
10.4.1.2. Фосфатно-буферная смесь
5,34 г натрия фосфорнокислого двузамещенного безводного (Na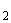 HPО
HPО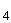 ) и 0,45 г калия фосфорнокислого однозамещенного (КН
) и 0,45 г калия фосфорнокислого однозамещенного (КН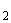 РО
РО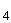 ) растворяют в 1 дм
) растворяют в 1 дм (1000 см
(1000 см ) дистиллированной воды и стерилизуют при температуре (121±1) °С в течение 30 минут.
) дистиллированной воды и стерилизуют при температуре (121±1) °С в течение 30 минут.
10.4.1.3. Глицериновая смесь
|
Натрий хлорид |
8,5 г |
|
Глицерин нейтральный |
500 см |
|
Дистиллированная вода |
1000 см |
|
Натрий фосфорнокислый двузамещенный безводный 20%-ный раствор |
150 см |
Натрий хлорид растворяют в дистиллированной воде, смешивают с глицерином и добавляют раствор натрия гидрофосфата в таком количестве, чтобы довести pH до 7,8-8,0. Стерилизуют при (112±1) °С в течение 30 минут. После стерилизации pH=7,6-7,8.
10.4.1.4. Раствор бриллиантового зеленого концентрацией 5 г/дм (по ГОСТ Р 50474-93)
(по ГОСТ Р 50474-93)
0,5 г бриллиантового зеленого переносят в фарфоровую ступку и постепенно растирают с добавлением горячей дистиллированной воды, затем раствор переливают в мерную колбу вместимостью 100 см и доводят дистиллированной водой до метки. Колбу плотно закупоривают и помещают на 2-3 дня в термостат при 37 °С. После этого раствор фильтруют через бумажный фильтр и хранят в темном флаконе с притертой пробкой.
и доводят дистиллированной водой до метки. Колбу плотно закупоривают и помещают на 2-3 дня в термостат при 37 °С. После этого раствор фильтруют через бумажный фильтр и хранят в темном флаконе с притертой пробкой.
10.4.1.5. Растворы и реактивы для окраски по Граму
Готовят в соответствии с ГОСТ 10444.1-84.
10.4.2. Приготовление питательных сред
10.4.2.1. Бульон лактозный с бриллиантовым зеленым и желчью (по ГОСТ Р 50474-93)
|
Пептон |
10,0 г |
|
Лактоза |
5,0 г |
|
Натрий двузамещенный фосфорнокислый безводный |
6,45 г |
|
Калий однозамещенный фосфорнокислый безводный |
2,0 г |
|
Желчь говяжья сухая |
20,0 г (или 200 см |
|
Бриллиантовый зеленый 0,5%-ный водный раствор |
3,0 см |
|
Вода дистиллированная |
1000 см |
Ингредиенты тщательно перемешивают в воде, нагревают на слабом огне до кипения, кипятят 1-2 минуты, фильтруют через ватно-марлевый фильтр, охлаждают до 45-55 °С и устанавливают pH=7,2±0,1, после чего среду вновь доводят до кипения. Среда не подлежит стерилизации в автоклаве, ее разливают с соблюдением правил асептики по 10 см в стерильные пробирки с поплавками или по 100 см
в стерильные пробирки с поплавками или по 100 см в стерильные колбы.
в стерильные колбы.
10.4.2.2. Среда Кесслера (по ГОСТ Р 50474-93)
|
Пептон |
10,0 г |
|
Лактоза |
2,5 г |
|
Желчь говяжья сухая |
5,0 г (или 50 см |
|
1%-ный водный раствор генцианвиолета (или кристаллического фиолетового, или метилового фиолетового) |
2 см |
|
Вода дистиллированная |
1000 см |
Ингредиенты тщательно перемешивают, нагревают на слабом огне до кипения, кипятят 1-2 минуты, фильтруют через ватно-марлевый фильтр, охлаждают до 45-55 °С, устанавливают pH=7,3±0,2.
Среду разливают по 10 см в пробирки с поплавками или в колбы по 100 см
в пробирки с поплавками или в колбы по 100 см и стерилизуют при температуре (115±1) °С в течение 20 минут.
и стерилизуют при температуре (115±1) °С в течение 20 минут.
10.4.2.3. Сердечно-мозговой бульон (BHI), Cat. N 51009, фирма "BioMerieux", Франция
Готовится по прописи, указанной на этикетке, или по инструкции фирмы по приготовлению.
10.4.2.4. Гром-негативный бульон по Хайну (GN Enrichment Broth асе. to HAJNA), Cat. N 10756,
фирма "MERCK", Германия (или Cat. N М 242, фирма "Ni Media", Индия)
Готовится по прописи, указанной на этикетке.
10.4.2.5. Трипказо-соевый бульон (Cat. N 51009, фирма "BioMerieux", Франция)
Готовится по прописи, указанной на этикетке.
Среды, поименованные в п.п.10.4.2.6-10.4.2.15, готовятся по прописи на этикетке:
10.4.2.6. Сорбитол E. coli О157:Н7 агар
10.4.2.7. Агар Клиглера
10.4.2.8. Среда Кесслера
10.4.2.9. Цитратный агар Симмонса
10.4.2.10. ГРМ-агар
10.4.2.11. Среда Ресселя
10.4.2.12. Среды Гисса
10.4.2.13 Тритпозный ГРМ-агар
10.4.2.14. Тритпозный ГРМ-бульон
10.4.2.15. Среда Олькеницкого
Приложение 1
(обязательное)
Схема выделения Е. соli O157:Н7 из клинического материала
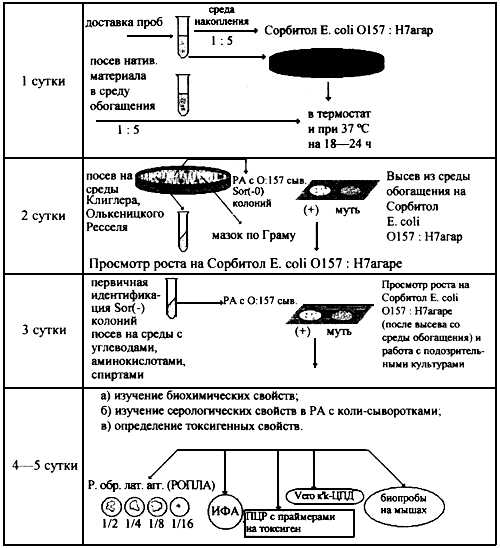
Приложение 2
(рекомендуемое)
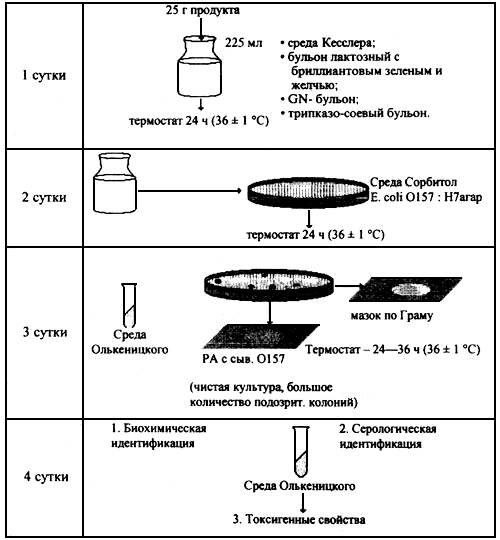
Схема выделения Е. coli О157:Н7 из пищевых продуктов при проведении санитарно-эпидемиологической экспертизы

Приложение 3
(обязательное)
Схема выделения Е. coli О157:Н7 из пищевых продуктов
Текст документа сверен по:
официальное издание
М.: Федеральный центр госсанэпиднадзора
Минздрава России, 2001