МУ 3.1.1098-02
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
3.1. ЭПИДЕМИОЛОГИЯ, ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Организация и проведение эпидемиологического надзора
в природных очагах чумы на территории Российской Федерации
Дата введения 2002-04-01
1. РАЗРАБОТАНЫ: Департаментом госсанэпиднадзора Минздрава России (Г.Г.Онищенко, Ю.М.Федоров); Противочумным центром Минздрава России (Л.А.Калошина, Ю.С.Королев, А.А.Кюрегян, М.А.Самуров); Российским научно-исследовательским противочумным институтом "Микроб" (Е.В.Куклев, Н.В.Попов, В.В.Кутырев, В.П.Топорков, А.С.Васенин, А.И.Кологоров, Г.А.Корнеев, А.А.Кузнецов, А.Н.Матросов, Т.В.Князева, Т.Н.Донская, Л.В.Самойлова, О.В.Кедрова); Ставропольским научно-исследовательским противочумным институтом (А.И.Дятлов, Г.М.Грижебовский, В.М.Мезенцев, Ю.М.Евченко, М.П.Григорьев, С.Д.Брюханова, И.В.Чумакова, А.П.Бейер); Иркутским научно-исследовательским противочумным институтом Сибири и Дальнего Востока (Т.И.Иннокентьева, Г.А.Воронова, Ю.Д.Очиров, Д.Б.Вержуцкий, A.Ф.Попков, С.В.Балахонов, С.Г.Саппо, Е.В.Чипанин); Астраханской противочумной станцией (А.А.Илюхин, Т.А.Козлова, B.В.Кабин, А.К.Рогаткин); Дагестанской противочумной станцией (Б.М.Асваров, В.П.Казаков, С.Г.Газиев); Кабардино-Балкарской противочумной станцией (А.М.Казаков, Е.И.Белогрудова, Г.А.Мазлоев); Элистинской противочумной станцией (А.В.Подсвиров, В.В.Дмитриенко, В.Б.-X.Санджиев, А.А.Французов).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Комиссией по государственному санитарно-эпидемиологическому нормированию при Минздраве России (протокол N 10 от 13 декабря 2001 г.).
3. УТВЕРЖДЕНЫ Главным государственным санитарным врачом Российской Федерации - Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 15 января 2002 г. Введены в действие 1 апреля 2002 г.
4. ВВЕДЕНЫ ВЗАМЕН "Инструкции по эпидемиологическому надзору в природных очагах чумы Советского Союза" от 03.07.79.
1. Область применения
Методические указания составлены с учетом опыта работы противочумных станций и регламентируют их деятельность по эпидемиологическому надзору в природных очагах чумы Российской Федерации.
Настоящие методические указания обязательны для выполнения на всей территории Российской Федерации органами и учреждениями санитарно-эпидемиологической службы и здравоохранения.
2. Нормативные ссылки
2.1. Основы законодательства Российской Федерации об охране здоровья граждан. - М., 1993.
2.2. Закон Российской Федерации "О санитарно-эпидемиологическом благополучии населения" N 52 от 30.03.99.
2.3. Закон Российской Федерации "О государственной границе Российской Федерации". - М., 1993, с дополнениями и изменениями 1994 г.
2.4. Закон Российской Федерации "О ветеринарии" N 4989-1 от 14.05.93.
2.5. Закон Российской Федерации "Об охране окружающей среды" N 133 от 14.07.93.
2.6. Порядок разработки, экспертизы, утверждения, издания и распространения нормативных и методических документов системы санитарно-эпидемиологического нормирования: Сборник Р 1.1.001-1.1.005-96. - М., 1998.
2.7. Профилактика и борьба с заразными болезнями, общими для человека и животных: Сборник санитарных и ветеринарных правил: Санитарные правила СП 3.1.090-96. Ветеринарные правила ВП 13.4.1370-96. - М., 1996. - С.120-132.
2.8. Инструкция по проведению первичных мероприятий при выявлении больного (трупа), подозрительного на заболевание чумой, холерой, контагиозными вирусными геморрагическими лихорадками. - М., 1985.
2.9. Инструкция по учету численности грызунов для противочумных учреждений Советского Союза. - Саратов, 1978.
2.10. Общая инструкция по паразитологической работе в противочумных учреждениях СССР. - Саратов, 1978.
2.11. Методические указания по определению площадей эпизоотий в природных очагах чумы. - М., 1983.
2.12. Методические указания о порядке заготовок, о сроках сдачи на промышленные предприятия шкурок сурков и сусликов, добытых на энзоотичных по чуме территориях. ГУКИ МЗ СССР, 20.08.80.
2.13. Инструкция по борьбе с сусликами в природных очагах чумы. - Саратов, 1978.
2.14. Инструкция по борьбе с песчанками полуденной, гребенщиковой, краснохвостой и Виноградова в природных очагах чумы. - Саратов, 1982.
2.15. Инструкция по борьбе с мышевидными грызунами. - Саратов, 1973.
2.16. Временные методические указания по организации и проведению эпидемиологического надзора в природных очагах чумы России в условиях ограниченных финансовых и материально-технических ресурсов. - М., 1998.
2.17. Приказ Госкомсанэпиднадзора России N 44 от 29.03.96 "Об организации специальных противоэпидемических бригад".
2.18. Правила ветеринарного осмотра убойных животных и ветеринарно-санитарной экспертизы мяса и мясных продуктов. - М., 1988.
2.19. Безопасность работы с микроорганизмами I-II групп патогенности: СП 1.2.011-94*. - М., 1994.
_______________
* Действуют Приказ Минздрава России "О проведении мероприятий по профилактике чумы" N 350 от 02.12.97.
2.23. Инструкция по ингаляционной иммунизации людей против чумы. - Саратов, 1987.
2.24. Приказ Минздрава России "О повышении готовности органов и учреждений госсанэпидслужбы России к работе в чрезвычайных ситуациях" N 230 от 29.07.98.
2.25. Приказ Минздрава России "О введении в действие Перечня инфекционных заболеваний, требующих проведения мероприятий по санитарной охране территории Российской Федерации" N 263 от 2.07.99.
3. Обоснование
На территории Российской Федерации функционируют 11 природных очагов чумы 4 типов: сусликового - 7, песчаночьего - 2, полевочьего - 1, пищухового - 1. С момента выхода документа, регламентирующего деятельность противочумных учреждений по эпидемиологическому надзору, прошло более 20 лет. Существенным образом изменившаяся с тех пор политическая, экономическая, социальная и экологическая обстановка диктует необходимость создания нового методического документа, соответствующего современным требованиям. Тем не менее перечень основных направлений деятельности противочумных учреждений в природных очагах чумы, из которых складывается система эпидемиологического надзора, остался прежним:
- эпизоотологическое обследование, выполняемое с целью получения информации о наличии эпизоотий чумы в природных очагах;
- эпидемиологическое наблюдение за населением, проживающим на энзоотичной по чуме территории;
- профилактические мероприятия (дератизация, дезинсекция, вакцинация, информационно-разъяснительная работа);
- специальная подготовка медицинских, ветеринарных и других работников по профилактике, диагностике и лечению чумы;
- изучение закономерностей природной очаговости чумы.
Методы исследования подробно излагаются в специальных методических пособиях и в настоящих методических указаниях не рассматриваются.
4. Общие требования
4.1. Эпидемиологический надзор за чумой - это комплекс мероприятий, включающий слежение за эпизоотическими проявлениями чумы в природных очагах и проведение профилактических и противоэпидемических мероприятий, предупреждающих заражение чумой людей и антропонозное распространение инфекции.
4.2. Мероприятия по предотвращению распространения чумы из природных очагов на территории Российской Федерации и завоза ее из-за рубежа проводятся в соответствии с действующими санитарными правилами по санитарно-эпидемиологической охране территории Российской Федерации и другими нормативно-методическими документами.
4.3. Организация и проведение мероприятий по эпидемиологическому и эпизоотологическому надзору за чумой в природных очагах чумы Российской Федерации осуществляются Противочумным центром Министерства здравоохранения Российской Федерации с подведомственными противочумными станциями и их отделениями, железнодорожными противочумными станциями Министерства путей сообщения во взаимодействии с другими территориальными учреждениями санитарно-эпидемиологического, лечебно-профилактического и ветеринарного профиля Минздрава России, Министерства сельского хозяйства и продовольствия РФ, Министерства путей сообщения РФ.
4.4. Координация всех мероприятий по эпиднадзору за чумой на территории Российской Федерации, а также контроль за выполнением требований к его организации и обеспечению осуществляются Департаментом госсанэпиднадзора Министерства здравоохранения Российской Федерации.
4.5. Научно-методическая, практическая и консультативная помощь по вопросам профилактических и противоэпидемических мероприятий на территории природных очагов чумы осуществляется курирующими научно-исследовательскими противочумными институтами. Российский научно-исследовательский противочумный институт "Микроб" является головным по проблеме "Чума".
4.6. Организация мероприятий по эпиднадзору за чумой и контроль за их выполнением в войсках и на территориях их дислокации, а также на объектах федеральных органов исполнительной власти, на которые в соответствии с действующим законодательством Российской Федерации возложено осуществление ведомственного санитарно-эпидемиологического надзора, обеспечиваются противочумными учреждениями соответствующих министерств и ведомств.
4.7. Объем, характер и направленность профилактических мероприятий определяются результатами эпизоотологического обследования и прогнозом эпизоотической и эпидемической ситуации по чуме в конкретных природных очагах, на основании чего осуществляется планирование мероприятий на последующий год. План после согласования с курирующим противочумным институтом направляется на утверждение главному врачу Противочумного центра Министерства здравоохранения Российской Федерации. Основные объемы санитарно-профилактических мероприятий утверждены приказом Минздрава России.
4.8. Территориальные центры госсанэпиднадзора в регионах с природными очагами чумы планируют проведение профилактических мероприятий, направленных на предотвращение эпидемических проявлений чумы, выноса инфекции за пределы природного очага. Комплексный план противочумных мероприятий составляют ЦГСЭН и управления (министерства, департаменты, комитеты) здравоохранения с участием специалистов противочумного учреждения сроком на 5 лет с ежегодным корректированием (схема комплексного плана дана в прилож.1).
4.9. При выраженном обострении эпизоотической и эпидемической обстановки решение о перераспределении сил и средств противочумных станций на федеральном уровне принимает Противочумный центр Министерства здравоохранения Российской Федерации.
4.10. Для осуществления научно-методической, консультативной и практической помощи в работе противочумных станций региональные институты назначают кураторов станций из числа наиболее квалифицированных специалистов института, кандидатуры которых рассматриваются ученым советом института и утверждаются приказом директора института. В состав кураторской группы входят эпидемиолог, зоолог, бактериолог (вирусолог), паразитолог. При необходимости на станцию направляются сотрудники института других специальностей. Посещение кураторами противочумных станций должно быть приурочено к обследовательскому сезону, к расширенным заседаниям научно-производственного совета и осуществляется не менее двух раз в год. Кроме того, выезд кураторов желателен при обострении эпизоотической ситуации, возникших эпидемических проявлениях чумы или иных нестандартных ситуациях.
Кураторы осуществляют работу во взаимодействии с начальником или полномочным представителем станции и руководителями территориальных органов и учреждений госсанэпиднадзора и здравоохранения.
Начальник станции обязан обеспечить условия работы кураторов и доводить до сведения всех специалистов их рекомендации.
По результатам посещения противочумной станции кураторы представляют начальнику противочумной станции и директору курирующего института справку о проведенной работе с замечаниями и предложениями по улучшению работы, копия направляется в адрес Противочумного центра Министерства здравоохранения Российской Федерации. Куратор при посещении временных сезонных формирований обязан заносить в специальный журнал свои замечания и рекомендации.
Функциональное закрепление противочумных станций за курирующими их противочумными институтами приведено в прилож.2.
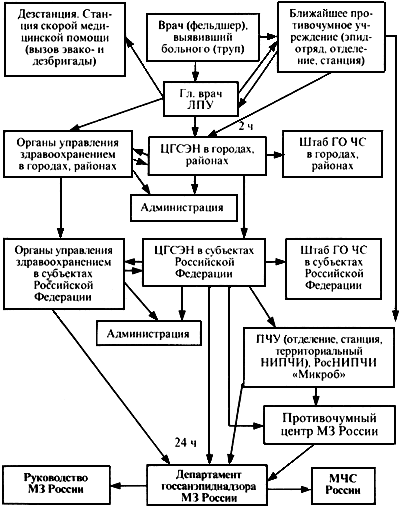
5. Порядок информации при эпидемических и эпизоотических проявлениях чумы
5.1. В каждом случае выявления больного (подозрительного) чумой представляются внеочередные донесения в следующем порядке:
- врач, выявивший больного, срочно извещает об этом главного врача лечебного учреждения;
- главный врач лечебного учреждения немедленно сообщает о выявлении больного в ЦГСЭН и противочумное учреждение (не позже 2 ч с момента выявления);
- центры госсанэпиднадзора района (города) посылают внеочередные донесения в ЦГСЭН в субъектах Российской Федерации, противочумные учреждения, органы управления здравоохранением и штабы ГО и ЧС немедленно по получении информации;
- центры госсанэпиднадзора в субъектах Российской Федерации направляют внеочередные донесения в течение 24 ч в Департамент госсанэпиднадзора Минздрава России, органы управления здравоохранением субъектов Российской Федерации, штабы ГО и ЧС, противочумные учреждения, Противочумный центр Минздрава России и Российский научно-исследовательский противочумный институт "Микроб";
- при выявлении случая заболевания или смерти указываются фамилия и возраст; место работы или учебы; название населенного пункта, района, области; дата заболевания, обращения, госпитализации, смерти; первоначальный и окончательный диагнозы; сведения о прививках; предполагаемый источник инфекции и факторы передачи; принимаемые меры.
Порядок информации см. в прилож.3.
5.2. В каждом случае выделения культуры чумного микроба от носителей и переносчиков в населенном пункте представляются внеочередные донесения в следующем порядке:
- врач, выделивший культуру, немедленно сообщает об этом начальнику противочумной станции;
- начальник противочумной станции направляет специалиста-бактериолога для подтверждения культуры по месту ее выделения (противоэпидемический отряд, противочумное отделение, противочумная станция);
- о выделении культуры начальник противочумной станции сообщает в центр госсанэпиднадзора и органы управления здравоохранением субъекта РФ и в Противочумный центр Минздрава России;
- повторно дается сообщение о подтверждении культуры. Дальнейшее прохождение информации аналогично порядку, описанному в п.5.1 и прилож.3.
5.3. Сообщения о выделении впервые в сезоне культур возбудителя чумы от носителей или переносчиков в природных очагах чумы посылают сразу после подтверждения культуры в Противочумный центр Минздрава России, курирующий противочумный институт. О выделении культур чумы ставят в известность центры госсанэпиднадзора и органы управления здравоохранением территорий, на которых выявлены эпизоотии, и сопредельных с ними территорий. Сведения об обнаружении переносчиков чумы в жилье человека начальник станции сообщает в ЦГСЭН, Противочумный центр и курирующий НИПЧИ.
5.4. Объем профилактических мероприятий отражается в ежемесячных оперативных сводках, сведения о выделении культур чумного микроба - в извещениях о выделении культур за месяц, которые посылаются в Противочумный центр, курирующий противочумный институт и Российский научно-исследовательский противочумный институт "Микроб".
5.5. Выделенные культуры возбудителя чумы после идентификации вместе с паспортами следует направлять в курирующий противочумный институт. Курирующие противочумные институты проводят окончательную идентификацию и изучение культур возбудителя чумы, оформляют паспорта, которые направляют в Государственную коллекцию патогенных бактерий "Микроб", являющуюся консультативно-методическим центром для коллекционных центров и музеев живых культур противочумных институтов и Противочумный центр Минздрава России. Институты передают штаммы чумного микроба в Государственную коллекцию патогенных бактерий "Микроб" по ее запросу. Уничтожение штаммов проводят по разрешению Противочумного центра Минздрава России и по согласованию с курирующим противочумным институтом и государственной коллекцией патогенных бактерий "Микроб".
6.1. Общие положения
Ключевыми мероприятиями в системе эпидемиологического надзора являются эпизоотологическое обследование и эпидемиологическое наблюдение за населением, осуществляемое противочумными учреждениями на подведомственных территориях по типу мониторинга. Экстренные специфические и неспецифические профилактические мероприятия проводят при возникновении реальной опасности заражения человека чумой (обнаружение эпизоотии в поселениях носителей, повышенная численность синантропных грызунов и блох) на территориях, определяемых результатами эпизоотологического обследования.
Основными параметрами эпиднадзора, подлежащими оптимизации, являются кратность и продолжительность эпизоотологического обследования территорий природных очагов чумы, а также число пунктов взятия проб полевого материала и степень их рассредоточения, что обязывает существенно повышать значение эпизоотологического прогноза по чуме и эпидемиологической дифференциации очаговых территорий, необходимых для обоснования кратности и приоритетности обследования отдельных участков.
При организации эпизоотологического обследования прежде всего обеспечивают решение главной задачи - как можно более раннее обнаружение эпизоотии чумы. После этого все действия осуществляют в строго установленном порядке. Определяют площадь и границы эпизоотической территории, меняя соответствующим образом территориально-календарный план работы зоогруппы. При необходимости подключают к работе дополнительные обследовательские группы. Уточняют численность и дислокацию населения, проживающего на данной территории, планируют и проводят комплекс необходимых профилактических мероприятий.
Результаты эпизоотологической дифференциации и эпидемиологического районирования используют для обоснованного ограничения мест поиска эпизоотий за счет исключения неэпизоотических участков с низкой численностью населения и для увеличения кратности и плотности обследования потенциально опасных в отношении чумы территорий очага. При этом учитывают, что эпидемиологическая и эколого-эпизоотологическая ситуации в очаге и различных его частях постоянно и порой резко меняются. Поэтому однажды проведенное районирование по мере необходимости уточняют и обновляют, исходя из реально складывающейся обстановки.
Решающее значение для оценки и прогноза эпизоотического состояния природного очага чумы имеет информация об уровне и динамике численности основных и второстепенных носителей и переносчиков возбудителя. Учеты численности носителей проводят в оптимальные фенологические сроки или в другие, определяемые регламентом, периоды обследования. При этом численность эктопаразитов учитывают постоянно в процессе сбора и лабораторного исследования полевого материала.
В целях оптимизации эпиднадзора за чумой используют четкую регламентацию стационарных и разовых наблюдений, наиболее экономичные и эффективные тактические и методические приемы проведения полевых и лабораторных исследований. Одновременно повышают качество исполнения таких профилактических мероприятий, как медицинское наблюдение за населением силами противочумных, лечебно-профилактических и санитарно-эпидемиологических учреждений, подготовка и переподготовка персонала местных медицинских учреждений по выявлению и локализации возможных заболеваний людей чумой, информационно-разъяснительная работа среди населения.
6.2. Паспортизация природных очагов чумы
На каждый природный очаг чумы на территории Российской Федерации должен быть составлен паспорт - документ, содержащий важнейшие сведения о конкретном очаге. Эти сведения включают в себя его название, географические границы в настоящее время и в прошлом; физико-географическую и ландшафтную характеристики; вирулентность возбудителя; описание пространственной и биоценотической структуры, исторические данные об эпизоотической активности и эпидемических осложнениях, социальных и других, важных в эпидемиологическом отношении факторах; данные о медицинских и ветеринарных учреждениях и о проводившихся в очаге мероприятиях по специфической и неспецифической профилактике.
Кроме текстовой части в паспорт очага включают специальные картографические материалы, которые по мере необходимости могут дополняться или заменяться новыми, измененными или уточненными.
6.2.1. Картографическое обеспечение эпизоотологического обследования
Картографическим источником в противочумной практике служат топографические карты масштаба 1:100000 ("километровки"). Могут быть использованы карты и более крупных масштабов - 1:50000 и 1:25000. Для обобщения эпизоотологической или эпидемиологической информации изготавливают карты более мелких масштабов.
Для учета любой информации использован формально-территориальный принцип деления земной поверхности и ее картографической модели на стандартные листы, применяемый при создании топографических карт. В России установлена номенклатура листов карт разных масштабов, ограниченных меридианами и параллелями, изготавливаемых в равноугольной поперечно-цилиндрической проекции Гаусса-Крюгера. Форма листов близка к трапеции, основания которой имеют незначительный прогиб в сторону экватора. В основу номенклатуры трапеций всех масштабов положена международная разграфка листов карт масштаба 1:1000000. В противочумной практике минимальной учетной единицей территории принят один лист карты масштаба 1:25000 в системе координат 1942 г., получивший название "сектор первичного района". Территория, изображенная на каждом таком листе (секторе), ограничена на местности и на карте конкретными параллелями и меридианами и занимает 7'30" по долготе и 5'00" по широте. Четыре трапеции масштаба 1:25000, объединяемые в трапецию масштаба 1:50000, образуют "первичный район". Шифры секторов образованы из номенклатуры соответствующих листов карт (Методические рекомендации по паспортизации природных очагов чумы. М., 1976), отклонения границ которых от картографического регламента (градусной сетки) не допускаются.
Противочумные формирования осуществляют эпизоотологическое обследование природных очагов чумы и их фрагментов в естественных границах. Формализованные учетные единицы (секторы и первичные районы) необходимы для унифицированной регистрации и обработки информации и облегчают географическую привязку данных. В оперативном порядке рассмотрение как крупных, так и более мелких однородных территориальных образований (очагов чумы, эпизоотических участков, ландшафтно-экологических районов и т.д.) допускается осуществлять в формализованных (геодезических) границах, совпадающих с границами (рамками) секторов. Углубленный анализ и прогнозирование эпизоотологической и эпидемиологической обстановки на конкретных территориях, а также детальное планирование профилактических мероприятий осуществляют в границах, проведенных с соблюдением указанных ниже правил.
Внешние границы природных очагов чумы проводят по геодезическим границам секторов. При этом очаговая территория должна быть полностью перекрыта, независимо от того известно или неизвестно точное местоположение ее естественной границы на суше. Если очаговая территория ограничена морем (озером) или рекой, то границу проводят по береговой линии. Такие ландшафтные (естественные) границы, а также границы между соприкасающимися очагами чумы или их частями, проходящие вдоль линейных географических преград (берегов морей, рек, водораздельных хребтов и т.д.), контуров ландшафтных выделов (кромка песков, лесные массивы и т.д.) или государственной границы Российской Федерации, должны рассматриваться так, как они изображены на карте. В этом случае измеряют конкретную площадь частей секторов, примыкающих к такой границе, и составляют их список с указанием площадей, принадлежащих тому или иному очагу.
6.2.2. Номенклатура, географические границы и краткое описание природных очагов чумы
на территории Российской Федерации
Площадь природных очагов чумы на территории Российской Федерации составляет 253590 км (табл.1).
(табл.1).
Таблица 1
Сведения о природных очагах чумы на территории Российской Федерации
|
|
|
|
Площадь очага с эпизоотиями |
|
||||||
|
Тип очага |
Шифр очага |
Название очага |
Пло- |
за весь период наблюдений |
с 1978 |
Площадь очага с эпидемичес- |
Вирулен- | |||
|
км |
% |
км |
% |
км |
% |
| ||||
|
Сусли- |
01 |
Центрально- |
4600 |
3950 |
85,9 |
3100 |
67,4 |
- |
0,0 |
50-100 |
|
02 |
Терско- |
2480 |
360 |
14,5 |
90 |
3,6 |
- |
0,0 |
100 | |
|
03 |
Дагестанский равнинно-предгорный |
11150 |
2100 |
18,8 |
490 |
4,4 |
- |
0,0 |
100 | |
|
14 |
Прикаспийский Северо- |
65500 |
15540 |
23,7 |
2690 |
4,1 |
4620 |
7,0 |
100 | |
|
15 |
Волго-Уральский степной |
30000 |
610 |
2,0 |
- |
0,0 |
530 |
1,8 |
100 | |
|
37 |
Тувинский горный |
6410 |
1910 |
29,8 |
1120 |
17,5 |
- |
0,0 |
100 | |
|
38 |
Забайкальский степной |
18150 |
5020 |
27,7 |
- |
0,0 |
1600 |
8,8 |
100 | |
|
Песча- |
16 |
Волго- |
8700 |
3430 |
39,4 |
510 |
5,9 |
510 |
5,9 |
100 |
|
43 |
Прикаспийский песчаный |
71950 |
19620 |
27,3 |
15140 |
21,0 |
880 |
1,2 |
100 | |
|
Поле- |
39 |
Восточно- |
23420 |
690 |
3,0 |
690 |
3,0 |
- |
0,0 |
100* |
|
Пищу- |
36 |
Горно- |
11230 |
1800 |
16,0 |
1010 |
9,0 |
- |
0,0 |
100* |
|
Итого: |
253590 |
55030 |
21,7 |
24840 |
9,8 |
8140 |
3,2 |
|||
|
* Штаммы чумного микроба с избирательной вирулентностью (вирулентны для белых мышей, ивирулентны для морских свинок) | ||||||||||
Природные очаги сусликового типа представлены Центрально-Кавказским высокогорным, Терско-Сунженским низкогорным, Дагестанским равнинно-предгорным, Прикаспийским Северо-Западным степным, Волго-Уральским степным, Тувинским горным и Забайкальским степным, общая площадь которых составляет 138-290 км .
.
Центрально-Кавказский высокогорный очаг (01).
Занимает участки высокогорий и среднегорий Приэльбрусья, расположенных между Передовым и Скалистым хребтами от верховий р.Кубань на западе до Черек-Безенгийского хребта на востоке. Общая площадь очага составляет 4600 км (прилож.4.1). Основным носителем чумной инфекции является горный суслик Citellus musicus; переносчиком - блохи Citellophilus tesquorum. Поселения сусликов распределены неравномерно и занимают только 20% территории в поясе горных степей на субальпийских и альпийских лугах. Циркулируют два варианта возбудителя чумы основного подвида Y. pestis subsp. pestis. В восточной и центральной части очага на правобережье р.Баксан выделяются высоковирулентные штаммы, типичные для равнинных очагов, слабовирулентные или авирулентные, относящиеся к высокогорному варианту - на территории всего очага. В центральной части встречаются обе эти разновидности.
(прилож.4.1). Основным носителем чумной инфекции является горный суслик Citellus musicus; переносчиком - блохи Citellophilus tesquorum. Поселения сусликов распределены неравномерно и занимают только 20% территории в поясе горных степей на субальпийских и альпийских лугах. Циркулируют два варианта возбудителя чумы основного подвида Y. pestis subsp. pestis. В восточной и центральной части очага на правобережье р.Баксан выделяются высоковирулентные штаммы, типичные для равнинных очагов, слабовирулентные или авирулентные, относящиеся к высокогорному варианту - на территории всего очага. В центральной части встречаются обе эти разновидности.
Возбудитель чумы впервые выделен в 1971 г. Эпизоотии на сусликах регистрируются ежегодно с марта по октябрь, активизируясь в июле-августе. Устойчивое проявление чумы на большинстве эпизоотических участков - основная особенность очага. Эпизоотическая площадь достаточно велика (86%). Эпидемических проявлений не отмечалось.
Терско-Сунженский низкогорный очаг (02).
Находится в Алханчуртовской долине в Терско-Сунженском междуречье, представляющей собой окультуренные степные ландшафты. Площадь очага 2480 км (прилож.4.1). Носителями чумы являются малые суслики подвида Citellus pygmaeus bohemii, переносчиками - блохи Neopsylla setosa и Citellophilus tesquorum ciscaucasicus. Поселения сусликов распределены неравномерно и занимают изолированные участки целинной степи между распашками, лесопосадками и населенными пунктами. Численность сусликов низкая. Повсеместно распространены мышевидные грызуны, численность которых в отдельные годы достигает высоких значений. Циркулируют преимущественно высоковирулентные штаммы Y. pestis subsp. pestis.
(прилож.4.1). Носителями чумы являются малые суслики подвида Citellus pygmaeus bohemii, переносчиками - блохи Neopsylla setosa и Citellophilus tesquorum ciscaucasicus. Поселения сусликов распределены неравномерно и занимают изолированные участки целинной степи между распашками, лесопосадками и населенными пунктами. Численность сусликов низкая. Повсеместно распространены мышевидные грызуны, численность которых в отдельные годы достигает высоких значений. Циркулируют преимущественно высоковирулентные штаммы Y. pestis subsp. pestis.
Площадь с эпизоотиями за весь период наблюдения составляет 14%. Эпизоотическая активность низкая. Возбудитель чумы впервые выявлен в 1970 г. Эпизоотии отмечались в 1970-1971, 2000 гг. и развивались на фоне повышенной численности и активности сусликов и их блох в мае-июле. Отмечено продолжение эпизоотии на мышевидных грызунах в октябре-ноябре. В 1978 г. от суслика был выделен единичный штамм чумного микроба кавказского подвида. Заболеваний чумой среди людей не отмечалось.
Дагестанский равнинно-предгорный очаг (03).
Располагается вдоль берега Каспийского моря и занимает южную часть Северо-Дагестанской низменности в Терско-Сулакском междуречье и северо-восточные предгорья Главного Кавказского хребта. Площадь очага 11150 км (прилож.4.1). Основной носитель чумы - малый суслик С. pygmaeus satunini. Поселения его распределены неравномерно, занимают лишь 10% очаговой территории. Переносчиками являются блохи Cit. Tesquorum ciscaucasicus и N. setosa. Циркулируют высоковирулентные штаммы основного подвида чумного микроба Y. pestis subsp. pestis.
(прилож.4.1). Основной носитель чумы - малый суслик С. pygmaeus satunini. Поселения его распределены неравномерно, занимают лишь 10% очаговой территории. Переносчиками являются блохи Cit. Tesquorum ciscaucasicus и N. setosa. Циркулируют высоковирулентные штаммы основного подвида чумного микроба Y. pestis subsp. pestis.
Возбудитель чумы был выделен в 1951 г. В 1951-1952 гг. регистрировалась разлитая интенсивная эпизоотия чумы в Кумыкской и Присулакской низменности. Впоследствии отмечались лишь локальные эпизоотии в 1956, 1975, 1984, 1994, 1998-1999 гг. Все проявления чумы, кроме разлитых эпизоотий в 1951-1952 гг., регистрировались на фоне крайне низкой численности сусликов и других грызунов и развивались в мае-июне. Доля эпизоотической территории составляет около 19%. Единственный случай заболевания человека чумой зарегистрирован в 1951 г. (п.Бабаюрт).
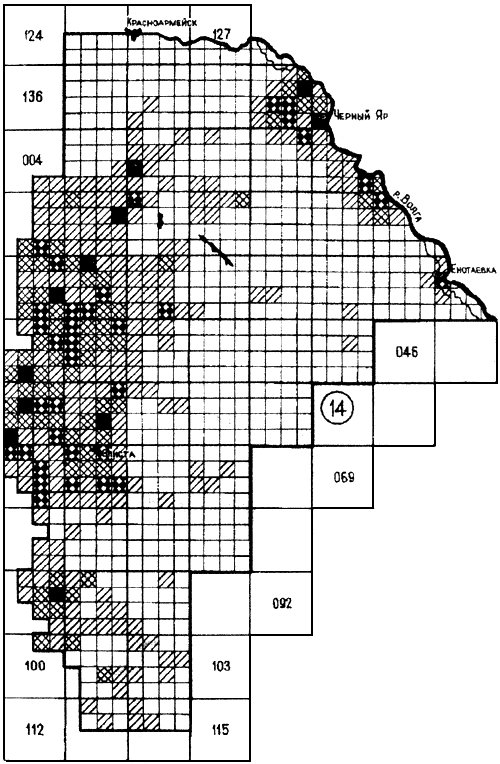
Прикаспийский Северо-Западный степной очаг (14).
Располагается на правом берегу Волги и занимает Сарпинскую низменность с лощиной Даван и возвышенность Ергени. Площадь очага в современных границах составляет 65500 км (прилож.4.2). Основной носитель - малый суслик С. pygmaeus pygmaeus, переносчики - блохи N. setosa и Cit. tesquorum ciscaucasicus. Поселения сусликов распределены равномерно, численность зверьков средняя. Циркулируют высоковирулентные штаммы чумного микроба Y. pestis subsp. pestis.
(прилож.4.2). Основной носитель - малый суслик С. pygmaeus pygmaeus, переносчики - блохи N. setosa и Cit. tesquorum ciscaucasicus. Поселения сусликов распределены равномерно, численность зверьков средняя. Циркулируют высоковирулентные штаммы чумного микроба Y. pestis subsp. pestis.
Относится к очагам с высокой эпидемической активностью. Эпизоотии регистрируются с 1913 г. Участки стойкой очаговости приурочены к Ергеням. С 1913 по 1938 гг. возбудитель чумы выделяли почти ежегодно. Затем после 35-летнего перерыва эпизоотии вновь начали выявлять в 1972-1973, 1986-1990 гг. Чаще эпизоотическая активность регистрируется в мае-июне. Площадь с эпизоотиями составляет около 24%. Эпидемические проявления отмечались с 1878 по 1935 гг. За этот период выявлен 1441 больной в 193 пунктах, заболевания которых были связаны с заражением в степи (охота, сельхозработы). Заболевания 174 человек в 19 пунктах были обусловлены заносом с других территорий.
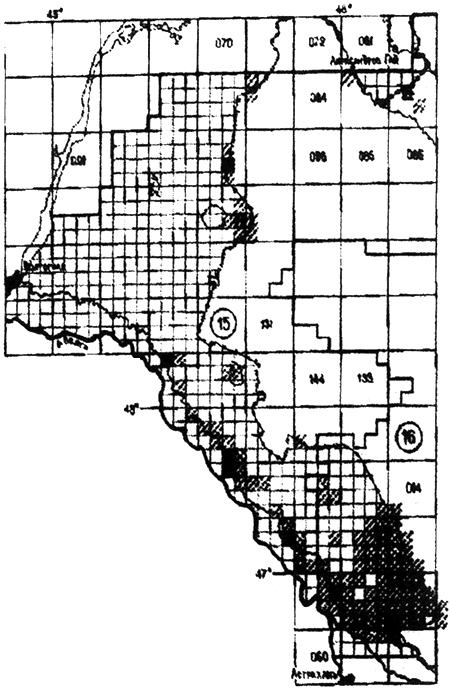
Волго-Уральский степной очаг (15).
Располагается в северной части Волго-Уральского междуречья, занимая Прикаспийскую низменность до отрогов Общего Сырта. Площадь очага составляет 80000 км , из которых в Российской Федерации - 30000 км
, из которых в Российской Федерации - 30000 км (прилож.4.3). Основной носитель - малый суслик С. pygmaeus pygmaeus, переносчики - блохи N. setosa и Cit. tesquorum transvolgensis. Поселения сусликов распределены равномерно, численность зверьков средняя и высокая. Циркулируют высоковирулентные штаммы чумного микроба Y. pestis subsp. pestis.
(прилож.4.3). Основной носитель - малый суслик С. pygmaeus pygmaeus, переносчики - блохи N. setosa и Cit. tesquorum transvolgensis. Поселения сусликов распределены равномерно, численность зверьков средняя и высокая. Циркулируют высоковирулентные штаммы чумного микроба Y. pestis subsp. pestis.
В начале XX столетия очаг являлся одним из наиболее активных. Разлитые эпизоотии чумы известны здесь с 1913 г. и отмечались с небольшими интервалами до 1950 г. После длительного перерыва с 1978 г. эпизоотии возобновились в Урало-Кушумском междуречье, а затем и в других частях очага (Токайский участок, 1979-1981 гг.) и отмечались до 90-х годов. Сезонная приуроченность эпизоотии - апрель-июнь. Эпидемические вспышки известны с 1878 г. и периодически отмечались с 1878 по 1933 гг. В этот период было зарегистрировано 774 заболевания чумой, связанных с первичными заражениями в очаге, в 54 пунктах и 308 случаев в 17 пунктах, которые были обусловлены заносом из других очагов. Значительная доля заражений была обусловлена непосредственным контактом людей с сусликами и зараженными блохами в жилье человека. Известны случаи заражения от верблюдов.
Тувинский горный очаг (37).
Является северной частью природного очага, расположенного в Монголии. На территории Российской Федерации занимает южные склоны хребтов Цаган-Шибету и Западного Танну-Ола. Площадь его 6410 км (прилож.4.5).
(прилож.4.5).
Основным носителем является длиннохвостый суслик Citellus undulatus; основной переносчик - блоха Cit. tesquorum altaicus. Поселения сусликов ленточные или островные. Максимальная плотность поселений зверьков отмечается в низкотравных биотопах на границах субальпийского и горно-степного высотных поясов. Численность зверьков средняя, но стабильная. В очаге циркулируют высоковирулентные штаммы чумного микроба Y. pestis subsp. pestis.
Эпизоотии чумы регистрируют в очаге практически ежегодно с 1964 г. Разлитые эпизоотии регистрируются редко. Их особенностями являются выраженная микроочаговость, локальность проявлений и вялое течение процесса. Эпизоотии начинаются в мае, достигают высшего подъема в июле и снижают активность к сентябрю. Эпизоотическая площадь составляет около 30%. Заболеваний людей чумой не отмечалось. В 1984 г. зарегистрирован один случай внутрилабораторного заражения человека чумой.
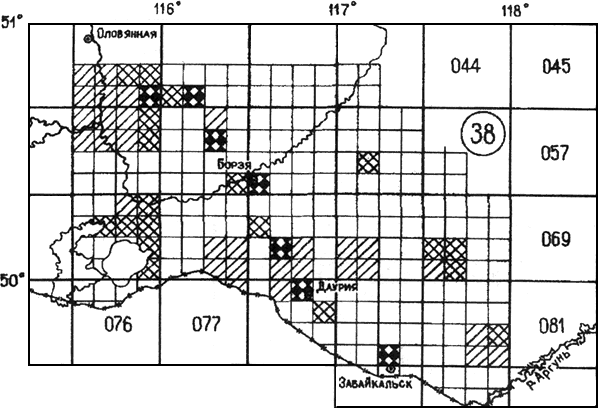
Забайкальский степной очаг (38).
Является северной частью природного очага, расположенного в Монголии и Китае. Занимает степи Даурии в междуречье Онон и Аргунь. Площадь в границах России составляет 18-150 км (прилож.4.6). Основным носителем в недалеком прошлом считался сурок тарбаган - Marmota sibirica, а переносчиками - блохи Oropsylla silantiewi. В связи с уничтожением и вымиранием сурков эпизоотии чумы стали регистрировать в популяциях даурского суслика Citellus dauricus. Переносчиком являются блохи Cit. tesquorum sungaris. Численность сусликов в настоящее время невысокая, но устойчивая. Поселения их распределены неравномерно и приурочены к населенным пунктам, обочинам дорог и местам интенсивного выпаса скота. Штаммы чумного микроба высоковирулентны, относятся к основному подвиду Y. pestis subsp. pestis.
(прилож.4.6). Основным носителем в недалеком прошлом считался сурок тарбаган - Marmota sibirica, а переносчиками - блохи Oropsylla silantiewi. В связи с уничтожением и вымиранием сурков эпизоотии чумы стали регистрировать в популяциях даурского суслика Citellus dauricus. Переносчиком являются блохи Cit. tesquorum sungaris. Численность сусликов в настоящее время невысокая, но устойчивая. Поселения их распределены неравномерно и приурочены к населенным пунктам, обочинам дорог и местам интенсивного выпаса скота. Штаммы чумного микроба высоковирулентны, относятся к основному подвиду Y. pestis subsp. pestis.
Эпизоотии среди сурков известны с 1911 г. и отмечались в их популяциях до 1946 г. Эпизоотии чумы на сусликах регистрировали в 1966-1968 и 1970 гг. В последние 30 лет они не обнаруживаются. Площадь с эпизоотиями составляет 28%. Эпидемические вспышки отмечались с 1876 г. и периодически регистрировались до 1930 г. В 1938 г. имели место единичные заболевания людей чумой. За период наблюдения всего было выявлено 1052 больных чумой в 39 пунктах, большинство заболеваний - 837 из 13 пунктов - были заносными. Подавляющее число заболеваний приурочено к населенным пунктам, расположенным вдоль железной дороги. Основная особенность очага - значительное снижение уровня эпидемической опасности в современный период.
Природные очаги чумы песчаночьего типа расположены в регионах Северного и Северо-Западного Прикаспия и представлены Волго-Уральским песчаным и Прикаспийским песчаным очагами чумы.
Волго-Уральский песчаный очаг (16).
Занимает южную часть Прикаспийской низменности в междуречье Урала и Волги. Границы его совпадают с контурами зонального ландшафта песков, включая интразональную Волго-Ахтубинскую пойму. Общая площадь очага составляет 61160 км , в пределах Российской Федерации - 8700 км
, в пределах Российской Федерации - 8700 км (прилож.4.3).
(прилож.4.3).
Основными носителями являются полуденная и гребенщиковая песчанки - Meriones meridianus и М. tamariscinus, переносчиками - их блохи Xenopsylla conformis и Nosopsyllus laeviceps. Штаммы чумного микроба высоковирулентны, относятся к основному подвиду Y. pestis subsp. pestis.
С 1923 по 1952 г. эпизоотии чумы здесь регистрировали почти ежегодно. В последние десятилетия наиболее крупные эпизоотические волны отмечались в 1962-1963 и 1978-1982 гг. С 1989 г. эпизоотии чумы среди песчанок ежегодно регистрируют в центральных и северных частях очага на территории Казахстана. В Российской Федерации культуры возбудителя выделялись в 1998-1999 гг. Эпизоотии развиваются в апреле-мае и в октябре-ноябре. Эпидемические вспышки известны с 1877 г. и отмечались вплоть до 1938 г. Общее число заболевших составило 2421 человек в 219 населенных пунктах. На территории Российской Федерации большую известность получила эпидемическая вспышка в Волго-Ахтубинской пойме, развившаяся на фоне интенсивных эпизоотий среди мышевидных грызунов в конце 30-х годов. В 1995 г. зарегистрирован случай заболевания человека в южной части очага на территории Казахстана. Население заражалось при непосредственном контакте с природой, при забое и разделке больных верблюдов.
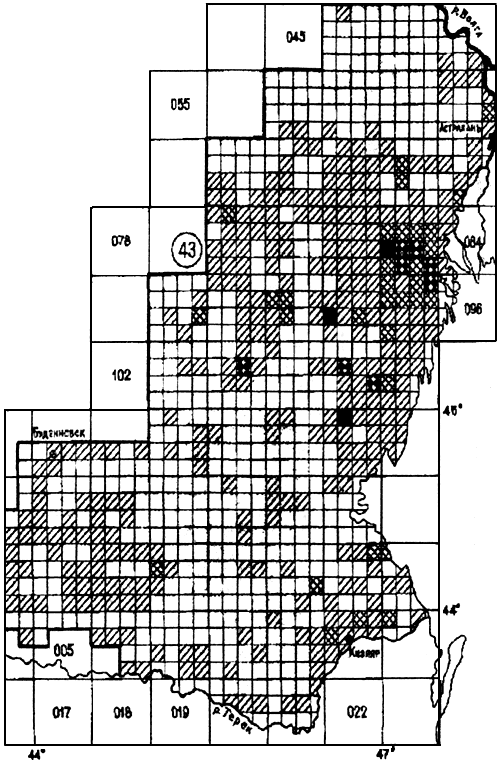
Прикаспийский песчаный очаг (43).
Занимает западную часть Прикаспийской низменности и располагается вдоль берега Каспийского моря от Волги до Терека на площади 71950 км (прилож.4.4). Основными носителями являются полуденная песчанка М. meridianus, гребенщиковая песчанка М. tamariscinus и малый суслик С. pygmaeus pallidus, а переносчиками - блохи N. laeviceps, N. setosa и Cit. tesquorum transvolgensis. Штаммы чумного микроба высоковирулентны и относятся к основному подвиду Y. pestis subsp. pestis.
(прилож.4.4). Основными носителями являются полуденная песчанка М. meridianus, гребенщиковая песчанка М. tamariscinus и малый суслик С. pygmaeus pallidus, а переносчиками - блохи N. laeviceps, N. setosa и Cit. tesquorum transvolgensis. Штаммы чумного микроба высоковирулентны и относятся к основному подвиду Y. pestis subsp. pestis.
Ранее эта территория входила в состав Прикаспийского Северо-Западного степного очага. К 80-м годам в связи с естественными и антропогенными изменениями структуры природных комплексов был выделен песчаный очаг чумы. Эпизоотии регистрировали с 1913 по 1954 г. с небольшими интервалами. Затем после длительного перерыва эпизоотии возобновились в 1979 г. и отмечаются ежегодно. Сезонные проявления чумы в популяциях зверьков приурочены к апрелю-июню и октябрю-ноябрю. Крупные эпидемические вспышки известны с 1923 по 1936 г. Единичные заболевания чумой среди людей отмечены в 1947, 1948, 1979 гг. Всего было зарегистрировано 128 больных чумой в 16 пунктах. Люди заражались при работах в степи, разделке верблюдов, в населенных пунктах от больных мышей.
Восточно-Кавказский высокогорный очаг (39).
Природный очаг чумы полевочьего типа расположен в горах Восточного Кавказа и занимает площадь 23420 км (прилож.4.1). Основным носителем чумы является обыкновенная полевка Microtus arvalis, основным переносчиком - блоха Callopsylla caspia. Поселения зверьков мозаичны, численность средняя или низкая. В очаге циркулирует чумной микроб кавказского подвида Y. pestis subsp. caucasica с избирательной вирулентностью.
(прилож.4.1). Основным носителем чумы является обыкновенная полевка Microtus arvalis, основным переносчиком - блоха Callopsylla caspia. Поселения зверьков мозаичны, численность средняя или низкая. В очаге циркулирует чумной микроб кавказского подвида Y. pestis subsp. caucasica с избирательной вирулентностью.
Возбудитель чумы был выделен в 1977 г. С 1977 по 1994 гг. эпизоотии чумы регистрировали практически ежегодно. Площадь эпизоотической территории невелика и составляет 3%. Проявления чумы в поселениях полевок локальны, кратковременны, с низкой интенсивностью и приурочены к июлю-сентябрю. Заболевания чумой среди населения не отмечены.
Горно-Алтайский высокогорный очаг (36).
Природный очаг чумы пищухового типа. Расположен в отрогах Сайлюгемского, Южно-Чуйского и Курайского хребтов. Является северной частью очага, уходящего в Монголию. В границах Российской Федерации его площадь составляет 11230 км (прилож.4.7). Очаг полигостальный, основную роль в котором играет монгольская пищуха Ochotona pricei, и поливекторный - переносчиками являются блохи Paradoxopsyllus scorodumovi, Rhadinopsylla dahurica, Amphalius runatus, Ctenophyllus hirticrus, Frontopsylla hetera. Поселения монгольской пищухи мозаичные, численность подвержена колебаниям по сезонам и годам. Циркулирует чумной микроб алтайского подвида Y. pestis subsp. altaica с избирательной вирулентностью.
(прилож.4.7). Очаг полигостальный, основную роль в котором играет монгольская пищуха Ochotona pricei, и поливекторный - переносчиками являются блохи Paradoxopsyllus scorodumovi, Rhadinopsylla dahurica, Amphalius runatus, Ctenophyllus hirticrus, Frontopsylla hetera. Поселения монгольской пищухи мозаичные, численность подвержена колебаниям по сезонам и годам. Циркулирует чумной микроб алтайского подвида Y. pestis subsp. altaica с избирательной вирулентностью.
Эпизоотии в популяциях монгольской и даурской пищух, длиннохвостого суслика, плоскочерепной полевки выявляются с 1961 г. ежегодно. Активизация эпизоотического процесса наблюдается в августе-октябре. Эпизоотии носят локальный, вялый характер, в отдельные годы отмечаются интенсивные и разлитые. Заболевания людей чумой не отмечались.
6.3. Эпизоотологическая дифференциация природных очагов чумы
Изучение природных очагов чумы показало неравнозначность их частей по эпизоотической активности. Анализ параметров эпизоотических проявлений в прошлом позволяет осуществить ретроспективную дифференциацию природного очага. Эта дифференциация необходима для прогнозирования ожидаемой эпизоотической ситуации и уточнения тактики эпизоотологического обследования, а также для эпидемиологического районирования.
Главным предметом анализа являются точки обследования, где при бактериологическом и серологическом исследовании добытых здесь носителей и переносчиков был получен достоверный положительный результат на чуму с возможно более точным географическим адресом, включая шифр сектора первичного района. Такие точки наносят на карту с обозначением даты забора полевого материала и (или) номера по прилагаемому к карте кадастру со всеми исходными данными. Та или иная территория, объединяющая положительные точки, называется эпизоотическим участком.
Для оперативной оценки эпизоотической ситуации в период обследования и составления отчетной документации конфигурацию и площадь эпизоотических участков определяют формально-территориальным способом (по секторам первичных районов), регламентируемым "Методическими указаниями по определению площадей эпизоотии в природных очагах чумы СССР" (М., 1983). Для углубленного анализа применяют способ круговой экстраполяции по каждой точке с положительным результатом на чуму. При этом допускают, что возбудитель циркулирует в популяциях носителей и переносчиков не далее чем в 5 км от места его обнаружения для равнинных очагов и в 2 км - для горных. Оконтуривание эпизоотического участка заключается в вычерчивании окружностей радиусом в 5 или 2 км (в масштабе карты) вокруг каждой положительной точки обследования. Один эпизоотический участок образуется при соприкосновении или частичном перекрытии нескольких окружностей. Если какие-либо фрагменты окружностей выступают за пределы поселений носителей (при наличии подобной информации), их отсекают по имеющимся на карте линейным ориентирам. После этого измеряют площади эпизоотических участков с помощью сеточной палетки, результат округляют до 1 тыс.га. При наличии карты границ отдельных поселений основных носителей эпизоотическим считают все поселение, если в его пределах обнаружена хотя бы одна точка с положительным результатом на чуму. Если размеры такого поселения в 2 и более раз превышают указанные выше окружности, то эпизоотическую площадь определяют способом круговой экстраполяции.
Ретроспективный анализ эпизоотической активности природного очага чумы осуществляется картографически с помощью вычерчивания эпизоотических участков описанным выше или формально-территориальным способом за те сезоны или годы наблюдений, для которых имеется необходимая информация. Последующее наложение карт друг на друга и выявление территорий с различной кратностью проявлений чумы служит основой эпизоотологической дифференциации очага.
Дополнительным критерием дифференциации очагов чумы служит информация об интенсивности эпизоотического процесса. В этих целях используют плотность положительных проб на единицу площади эпизоотического участка. При ретроспективном анализе вычисляют суммарную плотность положительных проб за все годы как для всей эпизоотической площади в очаге, так и для отдельных фрагментов, характеризующихся различной кратностью проявлений чумы. Этот показатель автоматически зависит как от кратности проявлений чумы на каждой территории, так и от интенсивности процесса во всех эпизоотических циклах.
6.4. Эпидемиологическое районирование энзоотичных территорий
Эпидемиологическое районирование природных очагов чумы служит основой планирования и проведения профилактических мероприятий. Целью районирования является дифференциация природных очагов чумы на отдельные участки по степени опасности заражения человека на основании изучения закономерностей эпидемических и эпизоотических проявлений с учетом природно-географических, социально-экономических и исторических особенностей каждого из них. Районирование российских очагов чумы осуществлено формально-территориальным способом по секторам первичных районов.
Ретроспективная характеристика эпизоотических и эпидемических проявлений в пределах каждого сектора представлена в четырех градациях: эпизоотий и эпидемий чумы не отмечено ни разу за весь период наблюдений; эпизоотии чумы были отмечены один раз; эпизоотии отмечались 2 и более раз; кроме эпизоотии на территории сектора были отмечены эпидемические проявления чумы.
Социологическая характеристика каждого сектора оценена по плотности проживающего там населения и представлена в двух градациях: до 1 чел. на 1 км ; более 1 чел. на 1 км
; более 1 чел. на 1 км . Обе характеристики сведены в таблицу, в которой то или иное сочетание градаций определяет уровень потенциальной эпидемической опасности (табл.2). Понятие "эпидопасность" приложимо к возможному в будущем развитию эпидемических событий, в отличие от понятия "эпидактивность", характеризующего имевшие место в прошлом эпидемические осложнения.
. Обе характеристики сведены в таблицу, в которой то или иное сочетание градаций определяет уровень потенциальной эпидемической опасности (табл.2). Понятие "эпидопасность" приложимо к возможному в будущем развитию эпидемических событий, в отличие от понятия "эпидактивность", характеризующего имевшие место в прошлом эпидемические осложнения.
Таблица 2
Уровень эпидемической опасности (в баллах) на территории сектора в зависимости
от характера проявлений чумы и плотности населения
|
Характер проявлений чумы |
Плотность населения (чел. на 1 км | |
|
до 1 |
более 1 | |
|
Проявлений не было |
1 |
2 |
|
Эпизоотии отмечались 1 раз |
2 |
3 |
|
Эпизоотии отмечались 2 и более раз |
3 |
4 |
|
Отмечались эпизоотии и эпидемии |
4 |
5 |
Условному числовому баллу уровня эпидемической опасности соответствует следующее описание:
1 - очень низкий: эпизоотических и эпидемических проявлений чумы не регистрировалось, плотность населения до 1 чел. на 1 км ;
;
2 - низкий: эпизоотии чумы отмечались однократно, плотность населения до 1 чел. на 1 км ; эпизоотических и эпидемических проявлений чумы не отмечалось, плотность населения более 1 чел. на 1 км
; эпизоотических и эпидемических проявлений чумы не отмечалось, плотность населения более 1 чел. на 1 км ;
;
3 - средний: эпизоотии чумы регистрировались 2 и более раз, плотность населения до 1 чел. на 1 км ; эпизоотии отмечались однократно, плотность населения более 1 чел. на 1 км
; эпизоотии отмечались однократно, плотность населения более 1 чел. на 1 км ;
;
4 - высокий: отмечались эпизоотические и эпидемические проявления чумы, плотность населения до 1 чел. на 1 км ; регистрировались только эпизоотические проявления чумы 2 и более раз, плотность населения более 1 чел. на 1 км
; регистрировались только эпизоотические проявления чумы 2 и более раз, плотность населения более 1 чел. на 1 км ;
;
5 - очень высокий: отмечались эпизоотические и эпидемические проявления чумы, плотность населения более 1 чел. на 1 км .
.
По итоговой информации об уровне эпидемической опасности, характеризующей каждый сектор в составе природных очагов Российской Федерации, изготовлены картограммы (прилож.4). Границы между очагами на картограммах изображены условно по рамкам секторов, хотя в некоторых случаях известна истинная (ландшафтная) граница (Волго-Уральские степной и песчаный очаги), которой следует пользоваться при работе. Результаты подсчета количества различных секторов представлены в табл.3.
Таблица 3
Дифференциация природных очагов чумы Российской Федерации
по уровню эпидемической опасности
|
Шифр и название очага |
Общее число секторов |
Число секторов с различным уровнем эпидемической опасности | ||||||||||
|
|
|
очень низкий |
низкий |
средний |
высокий |
очень высокий | ||||||
|
|
|
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% | |
|
01 |
Центрально-Кавказский высокогорный |
49 |
6 |
12,2 |
10 |
20,4 |
19 |
38,8 |
14 |
28,6 |
- |
0,0 |
|
02 |
Терско-Сунженский низкогорный |
28 |
5 |
17,9 |
19 |
67,9 |
3 |
10,7 |
1 |
3,6 |
- |
0,0 |
|
03 |
Дагестанский равнинно-предгорный |
138 |
64 |
46,4 |
56 |
40,6 |
14 |
10,1 |
4 |
2,9 |
- |
0,0 |
|
14 |
Прикаспийский Сев.-Зап. степной |
775 |
474 |
61,2 |
190 |
24,5 |
63 |
8,1 |
36 |
4,6 |
12 |
1,5 |
|
15 |
Волго-Уральский степной |
400 |
363 |
90,7 |
24 |
6,0 |
5 |
1,3 |
3 |
0,7 |
5 |
1,3 |
|
37 |
Тувинский горный |
93 |
27 |
32,3 |
50 |
52,3 |
12 |
15,4 |
- |
0,0 |
- |
0,0 |
|
38 |
Забайкальский степной |
239 |
183 |
76,4 |
30 |
12,5 |
19 |
7,9 |
7 |
3,2 |
- |
0,0 |
|
16 |
Волго-Уральский песчаный |
120 |
54 |
45,0 |
29 |
24,2 |
29 |
24,2 |
6 |
5,0 |
2 |
1,7 |
|
43 |
Прикаспийский песчаный |
825 |
480 |
58,2 |
302 |
36,6 |
32 |
3,9 |
8 |
1,0 |
3 |
0,4 |
|
39 |
Восточно-Кавказский высокогорный |
265 |
169 |
63,8 |
93 |
35,1 |
3 |
1,1 |
- |
0,0 |
- |
0,0 |
|
36 |
Горно-Алтайский высокогорный |
153 |
121 |
78,3 |
21 |
13,5 |
11 |
8,2 |
- |
0,0 |
- |
0,0 |
|
Итого: |
3085 |
1950 |
62,7 |
824 |
27,1 |
210 |
6,8 |
79 |
2,7 |
22 |
0,7 | |
При составлении картограмм был понижен уровень эпидопасности на 1-2 ступени для некоторых секторов, на территории которых в настоящее время отсутствуют поселения основных носителей чумы, либо случаи заболевания человека чумой в прошлом являлись заносными. В отдельных случаях, при резком перепаде уровня эпидопасности между соседними секторами (через 2-3 ступени), была осуществлена интерполяция путем повышения статуса менее опасной территории на 1-2 ступени, что обеспечило плавный переход между группами секторов. Эта операция существенно снизила вероятность необоснованной выбраковки секторов из плана обследования по случайным причинам.
6.4.1. Эпидемиологическое картографирование
Эпидемиологическое картографирование природных очагов чумы осуществляют специалисты противочумных учреждений в пределах обслуживаемой ими территории. В качестве исходных материалов для его проведения используют: описание случаев заражения чумой и отдельных вспышек заболевания, паспорта природных очагов чумы, сведения о динамике и интенсивности эпизоотической активности на различных участках природного очага, степени и характере соприкосновения отдельных групп населения с природным очагом в различные отрезки времени. В пределах природного очага чумы определяют территориальную приуроченность мест инфицирования, конкретные причины, способствовавшие заражению человека (проведение сельскохозяйственных работ, выпас скота, участие в вынужденном забое верблюдов, занятие охотопромыслом и т.д.), время (сезон) инфицирования, пораженность отдельных профессиональных групп населения, условия, способствовавшие антропонозному распространению заболевания (характер жилья и размещения населения, условия проживания, санитарная грамотность, наличие блох в жилье человека, миграционные процессы, особенности быта и погребения умерших).
Источниками для эпидемиологического картографирования служат различные карты природного очага чумы или его части, составленные на топографической основе в масштабе 1:100000-1:500000. Независимо от масштаба карты на ней обязательно должны быть нанесены границы секторов (градусная сетка). Такую же сетку наносят на все рабочие и отчетные карты по строго формализованному принципу. На эпидемиологическую карту наносят данные о территориальной приуроченности эпидемических проявлений чумы в прошлом. На ней указывают дислокацию отдельных населенных пунктов, животноводческих ферм, мест отдыха населения (санатории, лагеря, туристические стоянки и др.), обозначают участки территории, относящиеся к различным сельскохозяйственным учреждениям, скотопрогонные трассы, места расположения геологоразведочных партий, строительных бригад, учреждений здравоохранения, ветеринарной службы, расположение бригад, занимающихся охотопромыслом, территории, отведенные под дачные участки, места заготовки сена, дороги.
В легенде к эпидемиологической карте приводят сведения о характере эпидемических проявлений в прошлом (эпидемии, вспышки, спорадические случаи), данные об источниках, обстоятельствах и способах заражения, времени инфицирования и характере последующего антропонозного распространения инфекции по территории. Характеризуют современный род занятий и хозяйственной деятельности населения, мощность лечебно-профилактических и санитарно-эпидемиологических учреждений, их укомплектованность специалистами.
На этой же карте должны быть нанесены обобщенные сведения об эпизоотологической характеристике зоны обслуживания - границы эпизоотических участков за ряд лет наблюдений, места выделения культур чумы. В легенде к карте приводят данные о периодичности возникновения эпизоотий, их интенсивности, степени вовлечения в эпизоотический процесс синантропных грызунов, верблюдов, сезонности обнаружения возбудителя чумы у отдельных видов грызунов и их эктопаразитов.
Такие карты, имеющие справочно-информационный и демонстрационный характер, должны быть на противочумной станции, в каждом отделении и эпидотряде на обслуживаемую данным формированием территорию. При этом, чем меньше обслуживаемая территория, тем крупнее должен быть масштаб изготавливаемой карты, выше подробность и объем наносимой информации.
6.4.2. Оценка эпидемического потенциала природного очага чумы
Эпидемический потенциал - это показатель опасности заражения людей чумой в природном очаге (первичные и первично-опосредованные очаги чумы) в определенный момент времени.
Количественная оценка величины эпидемического потенциала осуществляется в соответствии с официально зарегистрированной "Программой расчета величины эпидемического потенциала природного очага чумы" с использованием следующего алгоритма подсчета:
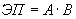 ,
,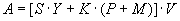 ,
,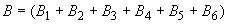 ,
,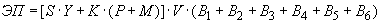 ,
,
где  - эпидемический потенциал;
- эпидемический потенциал;
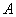 - распространенность и интенсивность эпизоотических проявлений чумы;
- распространенность и интенсивность эпизоотических проявлений чумы;
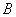 - степень контакта населения с природным очагом;
- степень контакта населения с природным очагом;
 - площадь эпизоотии;
- площадь эпизоотии;
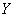 - интенсивность эпизоотии;
- интенсивность эпизоотии;
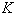 - доля участка очага, занятая поселениями основного носителя чумы;
- доля участка очага, занятая поселениями основного носителя чумы;
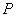 - плотность поселений грызунов или их численность на 1 га;
- плотность поселений грызунов или их численность на 1 га;
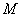 - запас блох на 1 га или индекс обилия их в гнездах;
- запас блох на 1 га или индекс обилия их в гнездах;
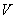 - вирулентность штаммов возбудителя чумы;
- вирулентность штаммов возбудителя чумы;
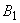 - контакт человека с блохами диких грызунов в поле;
- контакт человека с блохами диких грызунов в поле;
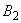 - наличие грызунов и блох в жилье;
- наличие грызунов и блох в жилье;
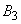 - наличие верблюдов и их численность;
- наличие верблюдов и их численность;
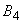 - охота на основных и случайных носителей чумы;
- охота на основных и случайных носителей чумы;
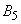 - близость поселений основных носителей чумы к жилью человека и контакт детей с грызунами;
- близость поселений основных носителей чумы к жилью человека и контакт детей с грызунами;
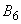 - наличие в жилье человека кошек и собак.
- наличие в жилье человека кошек и собак.
Все многообразие условий и факторов, определяющих величину эпидемического потенциала, выражают через оценку двух его элементов; распространенности и интенсивности эпизоотических проявлений чумы (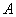 ) и степени контакта населения с носителями и переносчиками инфекции (
) и степени контакта населения с носителями и переносчиками инфекции (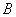 ) в данный момент времени. В количественную характеристику эпидпотенциала значения двух его элементов входят как сомножители равной величины (по 10 баллов каждый) при максимально возможной балльной оценке - 100.
) в данный момент времени. В количественную характеристику эпидпотенциала значения двух его элементов входят как сомножители равной величины (по 10 баллов каждый) при максимально возможной балльной оценке - 100.
В зависимости от целей и сложившейся эпидемиологической обстановки подсчет величины эпидемического потенциала осуществляется для стандартных участков природного очага (сектор или первичный район сетки паспортизации) или отдельных территорий различной площади (урочище или ландшафтно-экологический район).
Качественная характеристика эпидпотенциала должна соответствовать ее количественной оценке. С учетом максимально возможной величины в 100 баллов оптимальными являются следующие качественные оценки эпидемического потенциала природного очага чумы: высокий - более 50 баллов; средний - 25,1-50; низкий - 5-25; очень низкий - менее 5 баллов.
6.5. Требования к планированию профилактических мероприятий
в природных очагах чумы
Работа противочумных станций регламентируется, помимо инструктивно-методических документов и приказов, планом профилактических мероприятий на очередной календарный год, составленным специалистами станции, согласованным с курирующим противочумным институтом и утвержденным главным врачом Противочумного центра Министерства здравоохранения Российской Федерации.
При составлении плана руководствуются регламентом эпизоотологического обследования природных очагов чумы, представленным в настоящих методических указаниях, прогнозом, составленным по результатам обследования в предшествующий период, и, по возможности, информацией о текущем развитии событий эпизоотологического и эпидемиологического характера. Как правило, показатели плана характеризуют работу противочумного учреждения в наиболее типичном режиме. Однако необходимо постоянно сохранять готовность к значительному увеличению затрат на проведение экстренных профилактических мероприятий, что, в первую очередь, характерно для высокоэпидемичных очагов с непостоянной эпизоотической активностью.
Планы работы стационарных лабораторий, эпидотрядов и подвижных групп предусматривают обоснование объемов и сроков исполнения обследовательских работ, регламентацию применяемых методик и утверждаются начальниками противочумных отделений и станций. При смене эпизоотической обстановки эти планы могут меняться и корректироваться с учетом рационального маневрирования силами и средствами.
Непосредственное выполнение полевых работ осуществляют в соответствии с календарно-территориальным планом, который утверждается руководителем соответствующего структурного подразделения на весь срок сезонной работы, с учетом плановых задач подразделения и сложившейся эпизоотологической и эпидемиологической обстановкой. Кроме того, в планах должна быть отражена готовность противочумного учреждения к проведению экстренных мероприятий в очаге чумы, холеры, других опасных инфекций.
В планах сезонных формирований должен определяться порядок работы в условиях необходимости экстренных исследований в эпидемическом очаге чумы и других особо опасных инфекций.
7. Эпизоотологическое обследование территории природных очагов чумы
Целью эпизоотологического обследования является выявление эпизоотии чумы в популяциях носителей и переносчиков возбудителя, определение количественных характеристик процесса и (или) составление прогноза эпизоотического состояния очага.
Основным приемом эпизоотологического обследования является сбор и доставка полевого материала (зоолого-паразитологическая работа) и последующая диагностика чумы у носителей и переносчиков возбудителя (лабораторная работа).
В качестве основных задач эпизоотологического обследования выступают:
1) обнаружение эпизоотии чумы;
2) оценка параметров зарегистрированных эпизоотий (размеры и границы пораженных территорий, интенсивность процесса и ее динамика, спектр вовлеченных в эпизоотию видов животных и т.д.);
3) определение объемов профилактических и противоэпидемических мероприятий по результатам оценки параметров эпизоотии;
4) оценка состояния основных факторов энзоотии на территории природного очага чумы (уровень, динамика и мозаика численности носителей и переносчиков, их физиологическое и генеративное состояние и др.);
5) составление прогноза развития эпизоотической ситуации в настоящее время и на следующий сезон (год) по результатам анализа комплекса данных о факторах энзоотии, погодно-климатических условиях, биоценотических и других факторах.
Если на обследуемой территории не выявлена эпизоотия чумы, обеспечивают получение максимально возможного объема информации, необходимой для решения задач 4 и 5.
Эпизоотологическое обследование природных очагов чумы осуществляется силами подразделений в составе противочумных станций:
- стационарные лаборатории;
- сезонные противоэпидемические отряды;
- подвижные противоэпидемические группы.
Стационарные лаборатории противочумных станций и отделений ведут круглогодичное наблюдение в границах всей очаговой территории или на отдельных ее участках и в непосредственной близости от нее. Они обеспечивают получение информации, необходимой для планирования и проведения всего комплекса обследовательских и профилактических мероприятий на подведомственной территории.
Сезонные противоэпидемические отряды создаются на энзоотичной по чуме территории и выставляются временно в периоды ожидаемых сезонных обострений эпизоотической обстановки. Они обеспечивают комплекс мероприятий по эпизоотологическому обследованию и эпидемиологическому наблюдению на закрепленной за ними территории. При наличии необходимости и возможности проводят научно-исследовательские работы и специальные санитарно-профилактические мероприятия.
Подвижные противоэпидемические группы в составе врача, зоолога-паразитолога и дезинфектора выставляются на энзоотичной территории с целью эпидемиологического наблюдения за населением и информационно-разъяснительной работы, а также визуально-рекогносцировочного эпизоотологического обследования.
Сбор полевого материала осуществляют зоологические группы в пределах территорий, закрепленных за стационарными или сезонными противочумными формированиями, в состав которых входят эти группы. Доставку материала осуществляют в бактериологическую лабораторию данного формирования. В некоторые периоды, когда сезонное формирование (эпидотряд) не работает, материал с его подведомственной территории доставляют в стационарную лабораторию силами ее штатной или дополнительной зоогруппы в соответствии с планом.
Осмотр территории очага при движении на автомашине без сбора полевого материала и (или) маршрутно-визуальный учет численности грызунов называют визуально-рекогносцировочным обследованием (ВРО), при котором обязательно собирают найденные трупы носителей. Отмечают секторы, по которым проходил маршрут визуального обследования. В случае нахождения и сбора трупов животных (полевой материал) сектор исключают из числа визуально и включают в число фактически обследованных.
При планировании, организации и проведении эпизоотологического обследования используют следующие принципы учета и оценки обследованной площади природного очага чумы. Применяют формально-территориальный способ с подсчетом числа секторов. Сектор считается фактически обследованным, если на его территории хотя бы раз в течение года был взят материал для лабораторного исследования. Последующие этапы забора материала или визуально-рекогносцировочного обследования на территории сектора в другие декады текущего года расцениваются как повторные обследования. Их учитывают отдельно и каждый раз суммируют площадь этого сектора. Таким образом, повторно обследованная площадь в очаге может значительно превышать как фактически обследованную, так и площадь всего очага. Учет визуально обследованных секторов ведут лишь в том случае, если материал в них не брался в течение всего года, а их площади в итоге суммируют с площадями фактически обследованных секторов. В случае сбора материала в текущем году данный сектор из числа визуально обследованных исключают.
7.1. Зоолого-паразитологическая работа
Основу эпизоотологического обследования составляет зоолого-паразитологическая работа на территории природного очага чумы. Одним из основных разделов этой работы является сбор полевого материала путем отлова мелких млекопитающих, их последующего очеса в лаборатории, добычи эктопаразитов из нор и гнезд грызунов, поиска погадок хищных птиц, трупов грызунов, их экскрементов. Помимо сбора полевого материала зоолого-паразитологическая работа проводится по следующим направлениям:
- наблюдение за численностью основных носителей и переносчиков возбудителя чумы;
- наблюдение за генеративным состоянием носителей и переносчиков;
- учет заселенности грызунами и блохами населенных пунктов.
Проведение этих, а при необходимости и других видов работ осуществляется силами зоологических групп, входящих в состав эпидотрядов или стационарных лабораторий. Подробное описание приемов зоологической и паразитологической работы изложено в действующих методических документах.
Эпизоотологические аспекты зоолого-паразитологической работы заключаются в следующем. Для сбора полевого материала выбирают места, где наиболее вероятна встреча зараженных чумой носителей и переносчиков. Критериями выбора таких участков служат: более резкое снижение численности носителей, чем на окружающей территории; повышенная миграция блох к устьям нор; более высокая численность носителей и переносчиков; неоднократное обнаружение возбудителя чумы в прошлом. Важным эпидемиологическим аргументом для обследования служит близкое расположение населенных пунктов к поселениям носителей, особенно если в этих поселениях когда-либо ранее обнаруживался возбудитель инфекции.
Единицей обследования является отдельная проба полевого материала, доставленного из одного пункта, именуемого "точкой эпизоотологического обследования". Площадь одной точки, на которой работает, как правило, один ловец, не превышает 25-100 га, а часто значительно меньше. Расстояние между точками и их количество в одном секторе не регламентируются. Расстояние между точками, обследуемыми в течение одной декады как в одном секторе, так и в разных, не должно быть меньше 1 км. При работе на точке следует отлавливать не более 30 зверьков и собирать не более 50 норовых блох. Отлов и осмотр нор проводят не подряд, а по принципу "рассредоточения проб", что повышает вероятность встречи зараженных животных. На территориях с повышенным обилием блох в норах допустимо ограничиться сбором эктопаразитов без вылова носителей. Конкретное поселение грызунов, в котором будет осуществляться сбор полевого материала, выбирают по комплексу внешних признаков, характеризующих возможное протекание эпизоотического процесса в нем. При этом, следует помнить, что наличие больных чумой животных далеко не всегда сопровождается какими-либо внешними признаками, отсутствие которых не должно являться причиной отказа от сбора материала в намеченном поселении.
Учеты численности зимоспящих животных ведут не менее одного раза в год, незимоспящих - двух раз. При учете основных носителей чумы применяют визуально-маршрутные методы с количественными нормативами регистрации объектов учета, регламентируемые в соответствующих методических документах. Для учета мелких мышевидных грызунов используют метод ловушко-ночей.
Учет численности блох осуществляют непрерывно при эпизоотологическом обследовании путем очеса доставленных в лабораторию зверьков, при осмотре входов нор, а также при раскопках и добыче гнезд грызунов. Для расчета запаса блох в микробиотопе или на 1 га территории используют индексы их приуроченности к хозяину.
Учет грызунов и блох в жилищах человека проводят в те фенологические периоды, когда эти животные могут представлять наибольшую эпидемиологическую опасность. Эту работу проводят преимущественно осенью или в начале зимы - в сезон усиления миграции синантропных грызунов в жилища человека или во время ожидаемого массового выплода блох.
Наблюдения за генеративной активностью носителей и переносчиков ведут непрерывно в процессе вскрытия или просмотра поступающих в лабораторию животных. Зоологи консультируют лабораторный персонал, проверяют правильность определения генеративного состояния грызунов и составляют сводки по журналам вскрытия.
7.2. Лабораторная диагностика чумы у носителей и переносчиков
7.2.1. Общие положения
Диагностические исследования материала на чуму проводят в бактериологических лабораториях противочумных учреждений (противочумные институты, станции, отделения), в специальных или приспособленных помещениях сезонных эпидотрядов, в подвижных автолабораториях, в вагонах-лабораториях, в палатках, юртах и т.д. Во всех случаях планировка должна обеспечить необходимый набор помещений и поточность прохождения материала. Каждая лаборатория должна иметь разрешение на диагностические исследования на чуму в соответствии с действующими правилами по безопасности работы.
Лабораторное исследование носителей и переносчиков на зараженность их чумой проводят специалисты противочумных учреждений с высшим и средним медицинским и биологическим образованием, подготовленные на соответствующих курсах специализации и имеющие свидетельства об их окончании. Все исследования осуществляют в соответствии с действующими санитарными правилами по безопасности работы с микроорганизмами I-II группы патогенности.
Исследованию в природных очагах чумы подлежат: грызуны, зайцеобразные, насекомоядные и наземные хищники, их эктопаразиты; трупы мелких млекопитающих, остатки пищи из гнезд хищных птиц, материал от больных и павших верблюдов, эктопаразиты, снятые с верблюдов и других домашних животных. В отдельных случаях исследуют материал от сайгаков, погадки хищных птиц, экскременты грызунов и хищников, пробы почвы.
Полевой материал необходимо доставлять в лабораторию в предельно короткие сроки, предпочтительнее в первой половине дня, с целью исследования его в течение первых суток.
Полевой материал в лабораториях ПЧС должен исследоваться дифференцированно. Тактические и методические приемы лабораторных исследований полевого материала должны определяться их информативностью в различные фенологические периоды жизнедеятельности носителей и переносчиков чумы в зависимости от характера и качества доставленного материала.
Животных, добытых живыми, если не предполагаются специальные исследования, умерщвляют прямо у капкана с помощью корнцанга. Трупы помещают в бязевые мешочки, которые плотно завязывают, снабжают этикетками, складывают в металлические отсадники, ящики или клеенчатые мешки и, по возможности, быстро доставляют в лабораторию. Если необходимо кратковременное хранение материала, то это осуществляют в относительно прохладном месте (в специально вырытой яме, расщелине и т.д.). Живых грызунов помещают в отсадники, металлические ящики или ящики, обитые изнутри жестью, и дустируют. Ящики должны быть снабжены решетчатой крышкой.
Лабораторное исследование полевого материала начинают сразу же после его поступления. При невозможности этого допускается кратковременное его хранение (не более 20 ч) в помещении с низкой температурой (рефрижератор, ледник и др.).
Эктопаразитов собирают в стерильные пробирки, закрывают ватно-марлевой пробкой, затем упаковывают в отсадники или металлические пеналы. Эктопаразиты должны быть доставлены в лабораторию живыми или в консервирующей жидкости: 2%-ный раствор хлористого натрия с генцианвиолетом 1:200000.
Трупы животных после очеса погружают в 3%-ный мыльный раствор или другое моющее средство, затем помещают на сетку, после того как раствор стечет, укладывают на вскрывочные доски, группируя по точкам добычи и видам.
Вскрытие, посев органов, приготовление суспензий из органов, забор крови, осуществляет лаборант (очес и вскрытие грызунов может проводить дезинфектор). Определение вида, пола, возраста грызуна, его генеративного состояния, оценку патологоанатомических изменений в органах исследуемого зверька, заражение биопробных животных, осуществляют врач-бактериолог и лаборант. Правильность определения вида, пола, возраста и генеративного состояния грызуна контролирует зоолог не реже 2 раз в месяц. Все указанные выше сведения заносят в протокол вскрытия, где отмечают порядковый номер по журналу вскрытия грызунов и номер биопробного животного. Вскрытие проводят без отсепарирования кожи, откидывая кожно-мышечный лоскут на мордочку животного.
Исследование материала проводят бактериологическим, серологическим, биологическим и молекулярно-генетическими методами.
7.2.2. Бактериологический метод исследования носителей чумы
До обнаружения эпизоотии на данной территории у всех зверьков подлежат исследованию печень и селезенка. Суспензии готовят из органов зверьков одного вида, добытых в одной точке обследования. Для одной суспензии объединяют органы не более чем от 10 мелких зверьков, от 5 сравнительно крупных (сурки, хори и т.д.). Кусочки органов тщательно растирают в ступке со стерильным песком, затем добавляют небольшое количество 0,9%-ного раствора хлористого натрия (не более 2 мл). Полученную суспензию используют для посева на плотные питательные среды, нанося каплю суспензии у края чашки и рассевая ее затем по всей поверхности петлей частыми штрихами. Этой же суспензией заражают биопробное животное. После обеззараживания суспензия может быть использована для поиска антигена.
При выделении первой культуры, в зависимости от задач эпизоотологического обследования, посев органов может производиться отпечатками их срезов на агаровые пластинки. На одну чашку агара может быть посеян материал от 3 животных, если исследуют только печень и селезенку, или от 2 животных, если исследованию подлежит и кровь из сердца (при определении границ эпизоотии). Оптимальным является дублирование посевов: отпечатками органов и посев их суспензий после растирания.
Объекты с посевами инкубируют при 28 °С. Просмотр осуществляют через 24-48 ч и далее ежедневно до 5 суток от момента посева.
При обнаружении характерных для чумы патологоанатомических изменений у животных кроме печени, селезенки обязательно исследуют кровь, легкие и лимфоузлы (паховые, аксилярные, глоточные, паратрахеальные, забрюшинные), участки измененных органов и тканей. Из всех органов делают мазки-отпечатки, красят их анилиновыми красками и исследуют. Органы от каждого животного сеют отпечатками на пластинки агара, затем собирают в ступку со стерильным песком и готовят суспензию, которую засевают на агар. Этой же суспензией заражают индивидуальную биопробу. Остальной материал после обеззараживания используют для серологического исследования, направленного на поиск специфических для чумы антигенов (РНГА-РНАт), а также для выявления ДНК возбудителя чумы в полимеразной цепной реакции (ПЦР). Суспензии сгустков крови сердца и крупных сосудов после инактивации исследуют серологически на наличие специфических антител (РНГА-РНАг).
Трупы животных, найденных в поле, исследуют так же, как зверьков с патологоанатомическими изменениями. Помимо этого, у них обязательно исследуют костный или головной мозг посевом на отдельную чашку, суспензией головного или костного мозга заражают вторую индивидуальную биопробу. Для посевов используют селективные питательные среды с ингибиторами роста посторонней флоры.
Труп павшего верблюда, как правило, вскрывает ветеринарный работник под наблюдением специалиста противочумного учреждения или специалиста по особо опасным инфекциям ЦГСЭН с соблюдением правил биологической безопасности. Для исследования забирают лимфоузлы глоточного кольца, шейные, брыжеечные и забрюшинные, паховые, аксилярные, кусочки паренхиматозных органов, легких, надпочечников, сгустки крови из сердца и крупных сосудов, участки патологически измененных тканей и органов, костный мозг из трубчатой кости. Материал подлежит бактериологическому, биологическому и серологическому исследованию. Каждый орган сеют на отдельную чашку Петри с селективной средой (в качестве ингибитора предпочтительнее фосфомицин - 100 мкг/мл, губительно действующий на вульгарный протей). Суспензией органов заражают не менее 2 биопробных животных (подкожно и накожно) и 1 биопробное животное заражают суспензией костного мозга. После обеззараживания суспензия органов исследуется серологически (поиск антигена), а также для выявления ДНК возбудителя чумы в полимеразной цепной реакции (ПЦР). Сыворотку, полученную после сокращения сгустков крови, подвергают инактивации и адсорбции, после чего исследуют серологически для поиска специфических антител.
7.2.3. Бактериологический метод исследования переносчиков чумы
Сборы блох с каждого грызуна или одной норы исследуют отдельно групповым способом, взяв на один посев, как правило, не более 20-30 насекомых. При обилии блох разрешается доводить количество их в одном посеве до 50. Допускается объединять в одну пробу блох с грызунов из одного участка или из близлежащих гнезд. Индивидуальному исследованию в обязательном порядке подлежат все эктопаразиты, собранные с трупов животных или животных с патологоанатомическими изменениями, похожими на чуму, а также с целью определения процента зараженности блох.
Блох перед исследованием усыпляют эфиром, без предварительной промывки ссыпают в стерильную ступку, куда вносят 0,5 мл 0,9%-ного раствора хлористого натрия или чумной антифаговой сыворотки. После растирания делают посев на агаровые пластинки. При исследовании на чуму иксодовых клещей в один посев берут не более трех пивших самок, голодных - до 30, пивших нимф - до 15, голодных - до 50, пивших личинок - до 30 экземпляров. Перед исследованием рекомендуется промывать клещей в 50-70°-ном спирте, а затем в 2-3 порциях 0,9%-ного раствора хлористого натрия. При растирании напившихся клещей ступку прикрывают крышкой от чашки Петри, пивших самок перед растиранием разрезают ножницами. Полученную суспензию высевают на питательный агар. В отдельных случаях эту суспензию используют для заражения биопробных животных.
7.2.4. Питательные среды для выделения чумного микроба
Для выделения чумного микроба используют слабощелочной (рН 7,0-7,2) питательный агар с аминным азотом 60-120 мг %. Для диагностических целей могут быть использованы среды лабораторного изготовления, а также коммерческие сухие среды, имеющие номер госрегистрации и лицензию на изготовление. Каждая серия агара должна быть проверена на чувствительность к росту чумного микроба согласно действующим нормативно-методическим документам. Срок хранения агара не более 2 месяцев, после чего он должен проходить переконтроль для продления срока годности еще на 1 месяц. Питательные среды должны храниться в темном месте при постоянной температуре (от 4 до 20 °С). Перепады температуры снижают качество питательных сред.
При диагностике чумы используют селективные среды, которые содержат стимуляторы роста чумного микроба и ингибиторы посторонней флоры.
В качестве стимуляторов роста чумного микроба используют сульфит натрия в концентрации 1:4000 (1 мл 2,5%-ного раствора на 100 мл агара), гемолизированную кровь в концентрации 0,01-1%, стимулятор роста чумного микроба из сарцин (стимулятор Карпузиди) согласно инструкции по применению препарата. В очагах, где циркулируют тиаминзависимые штаммы, в качестве стимулятора роста используют витамин B в концентрации 0,0001 мг на 100 мл среды или синтетическую среду 199 (3 мл на 100 мл среды).
в концентрации 0,0001 мг на 100 мл среды или синтетическую среду 199 (3 мл на 100 мл среды).
Для подавления роста посторонней микрофлоры используют генцианвиолет в концентрации 1:100000-1:800000. Рабочую дозу определяют для каждой серии препарата перед обследовательским сезоном и указывают в паспорте на рабочий раствор генцианвиолета.
Помимо этого, для ингибирования посторонней флоры могут быть использованы теллурит калия в концентрации 1:300000, дезоксихолат натрия - 1 мг %, фосфомицин 50-100 мкг/мл.
7.2.5. Биологический метод исследования грызунов
В качестве биопробных животных могут быть использованы белые мыши и морские свинки.
Способ приготовления суспензий для биопроб описан выше. Заражают биопробных животных подкожно в паховую область; белым мышам вводят по 0,2 мл суспензии, морским свинкам - по 0,5-1,0 мл. При исследовании сильно загрязненного материала (загнившие трупы, субстраты нор, помет) заражают биопробных животных накожно.
Павших биопробных животных исследуют, проводя вскрытие по полной схеме (отсепаровка кожи, осмотр и посев лимфоузлов, посев всех органов, крови, серологическое исследование на наличие антигена). От павшей биопробы обязательно ставят пассажи до выяснения причины гибели. После обеззараживания суспензия органов павшей биопробы может быть исследована в ПЦР.
Биопробных животных, выживших после заражения, забивают через 6 суток также с полным бактериологическим исследованием без пассажа. При исследовании материала из сочетанных природных очагов чумы и туляремии биопробных животных забивают на 8-9-е сутки.
7.2.6. Идентификация выделенных культур чумного микроба
Первичная (предварительная) идентификация выделенной культуры проводится сразу после ее выделения по следующим признакам:
- морфология роста на питательном агаре и бульоне;
- морфология клетки, характер окраски по Граму;
- лизис диагностическими бактериофагами Л-413, Покровской;
- ферментация мочевины, рамнозы, глицерина (при отсутствии ЦДС);
- характерный рост на среде ЦДС (отсутствие способности к ферментации мочевины и лактозы);
- чувствительность к антибиотикам методом дисков (при выделении первой культуры).
Окончательная идентификация и изучение культуры чумы проводится в стационарной лаборатории противочумной станции или института, имеющих разрешение на проведение экспериментальной работы с микробами I группы патогенности по следующим признакам:
- наличие F1;
- биохимическая активность (пестрый ряд), подвижность;
- вирулентность для лабораторных животных;
- плазмидный состав (pCad, pPst, pFra);
- способность к нитрификации и денитрификации;
- пестицин-фибринолизин-плазмокоагулазная активность;
- чувствительность к пестицину 1;
- питательная потребность при необходимости.
7.2.7. Серологический метод исследования полевого материала
Серологические реакции направлены на поиск антител к специфическому антигену F1 в сыворотке крови у носителей чумы, наземных хищников, домашних животных и антигена в тканях и органах зверьков с патологоанатомическими изменениями, их трупов, в субстратах нор теплокровных, остатках пищи и погадках хищных птиц, субстратах гнезд, в помете носителей, почве.
При выполнении серологических исследований должны быть соблюдены следующие правила:
- серологические реакции должны ставиться только с обеззараженным материалом;
- все иммунобиологические и диагностические препараты должны иметь номера госрегистрации и лицензии на изготовление;
- планшеты, пипетки, капельницы, шприцы должны быть вымыты моющим средством, хорошо отмыты обильным количеством воды, последнее ополаскивание проводят дистиллированной водой; луночки планшетов должны быть гладкими и прозрачными;
- сыворотки человека и животных (верблюда, кошек, собак), а также мутные сыворотки и с признаками гемолиза необходимо перед исследованием адсорбировать 50%-ной взвесью формалинизированных, но не сенсибилизированных эритроцитов;
- все ингредиенты для серологических реакций должны быть оттитрованы (не реже 1 раза в 2 недели), формалин перед обследовательским сезоном адсорбирован мелом (1:1) для инактивации кислых продуктов в коммерческом препарате и проверен на антибактериальную активность;
- все исследования проводят согласно действующим инструктивно-методическим материалам по применению серологических методов диагностики при эпизоотологическом обследовании природных очагов чумы.
Для поиска антител исследуют сыворотки, смывы из сердца и крупных сосудов или высушенные на фильтровальных бумажках образцы крови и сыворотки животных. Поиск антител осуществляют у зверьков, относительно резистентных к чумному микробу (малый, длиннохвостый, горный, даурский суслики, полуденная песчанка с левого берега Волги, даурская пищуха, мелкие куньи и др.). Для обнаружения антител используют реакцию непрямой гемагглютинации (РНГА) с антигенным диагностикумом, а также реакцию нейтрализации антигена с иммуноглобулиновым диагностикумом. При массовых исследованиях реакции ставят в два этапа: вначале каждая из реакций в двух луночках и только при положительных результатах ставят развернутые реакции для определения их титра. Система однонаправленных реакций весьма информативна, т.к. по соотношению титров двух реакций (превышение титра РНАг) можно судить о давности контакта зверька с микробом, а при достаточно большом количестве исследований - о фазе эпизоотии в данном участке территории. С этой же целью ставят пробу с восстановителем 2-меркаптэтанолом (СН ОНСН
ОНСН 3Н), которая дифференцирует макро- и микроглобулины.
3Н), которая дифференцирует макро- и микроглобулины.
При сомнительных результатах реакции повторяют после адсорбции исследуемого материала 50%-ной взвесью формалинизированных и несенсибилизированных эритроцитов, параллельно ставят идентичные реакции с гетерологичными диагностикумами (туляремийный, бруцеллезный, холерный и др.).
Для поиска антигена готовят суспензии из исследуемого материала, добавляя к нему 0,9%-ный раствор хлористого натрия с 2%-ным раствором формалина. На 1 часть субстрата добавляют 10 частей раствора. После отстаивания в течение не менее 3 ч (лучше 20-24 ч) отбирают надосадочную жидкость и ставят серологические реакции: РНГА и РТНГА с иммуноглобулиновым диагностикумом и реакцию нейтрализации антител (РНАт) с антигенным диагностикумом.
С целью подтверждения специфичности результатов следует тот же материал использовать в системе серологических реакций (РНГА-РНАт) с гетерологичными диагностикумами (туляремийный, бруцеллезный, холерный и др.).
Тактика применения иммуноферментного анализа для поиска антигена F1 и антител к нему такая же, как при использовании иммуносуспензионных методов.
Полимеразная цепная реакция используется при углубленном эпизоотологическом обследовании территории (преимущественно в пунктах долговременного наблюдения). Исследованию подлежат суспензии органов носителей чумы с характерными патологоанатомическими изменениями, трупов павших зверьков, трупов верблюдов, а также при необходимости суспензии эктопаразитов, субстраты гнезд грызунов, погадки и остатки пищи хищных птиц, пробы почвы и др. Предварительно исследуемые суспензии обеззараживают добавлением мертиолята натрия до конечной концентрации 1:10000 с последующим прогреванием при 56 °С в течение 30 мин. Для проведения генодиагностического анализа применяют "Тест-систему для выявления Y. pestis методом полимеразной цепной реакции (ПЦР)", производство РосНИПЧИ "Микроб" (рекомендована комитетом МИБП МЗ РФ для практического использования). Для постановки пультиплексной ПЦР использованы праймеры, обеспечивающие специфичную амплификацию фрагментов ДНК двух генов - cafl и pla, локализованных на собственных плазмидах чумного микроба pFra и pPst, соответственно.
Метод ДНК-зондов может быть использован как для характеристики плазмидного профиля штаммов при идентификации выделенных культур, так и при исследовании биологического материала (содержимое бубонов, мокроты, органов животных и т.д.).
Для повышения чувствительности метода возможно подращивание образцов путем помещения нейлонового фильтра с нанесенным материалом на поверхность агара Хоттингера на 16-24 ч при 28 °С. После нанесения исследуемого материала на фильтр его инактивируют парами хлороформа. Для этого на крышку чашки Петри, в которую помещен фильтр с исследуемым материалом, наносят 0,5 мл хлороформа, выдерживают в таком виде (крышка снизу) в эксикаторе в течение 30 мин, после чего фильтр считается обеззараженным и может пересылаться для дальнейшего исследования в стационарную лабораторию противочумной станции или института.
7.3. Оценка и прогнозирование эпизоотической активности очагов чумы,
составление эпизоотологического обзора и оперативных сводок
Оценку эпизоотической активности очагов чумы осуществляют на основании материалов эпизоотологического обследования. По площади и количеству выявленных эпизоотических участков оценивают характер эпизоотии (локальная, разлитая). Кроме количественных показателей, важна информация о вовлечении в эпизоотический процесс разных видов носителей и переносчиков. Для оценки эпидемической значимости выявленной эпизоотии имеет значение участие в эпизоотическом процессе синантропных видов грызунов и блох жилищ человека.
Для каждого очага чумы должны быть разработаны конкретные прогностические признаки, которые позволяют предвидеть текущие изменения эпизоотической активности очага.
Ход выполнения противочумной станцией плановых показателей в течение года отражают в ежемесячных оперативных сводках о проведенных санитарно-профилактических противочумных мероприятиях, правила заполнения которых разрабатываются Противочумным центром Минздрава России.
Одним из основных итоговых документов, составляемых каждой противочумной станцией по результатам эпизоотологического обследования обслуживаемой территории за прошедший календарный год, является обзор и прогноз эпизоотического состояния природных очагов чумы. Обзор и прогноз служат источником информации при планировании профилактических мероприятий на очередной год и представляются в Противочумный центр Минздрава России и курирующий противочумный институт.
Все материалы должны быть приведены по отдельным очагам или мезоочагам.
Обзор и прогноз эпизоотического состояния природного очага чумы должен содержать введение, в котором кратко описывается территория, обслуживаемая противочумной станцией, ее отделениями и эпидотрядами, краткую характеристику эпизоотической ситуации в предшествующем году и описание материалов, послуживших основой для настоящего эпизоотологического обзора.
Материалы по отдельным очагам или их частям излагают в следующем порядке:
- краткая характеристика погодных условий анализируемого периода, их сравнение с нормой;
- описание и оценка кормовой базы носителей чумы;
- характеристика численности и ее динамики в анализируемый период как основных, так и второстепенных носителей, имеющих значение в эпизоотологии и эпидемиологии чумы, выявление существенных различий в численности на отдельных участках обслуживаемой территории (прилагают карты численности основных носителей);
- характеристика генеративной активности основных и наиболее важных второстепенных носителей чумы как в целом по очагу, так и по отдельным его участкам, если имелись различия, анализ основных показателей и оценка их влияния на динамику численности грызунов;
- характеристика видового состава и численности основных переносчиков возбудителя чумы; описание и анализ изменений обилия блох на основных носителях; сравнение данных анализируемого периода со среднемноголетними значениями; краткое описание хода размножения переносчиков и выявление его отличия от обычного (прилагают карты численности основных переносчиков);
- описание видового состава и динамики численности носителей и переносчиков возбудителя чумы в населенных пунктах и жилищах человека; объема и эффективности поселковой дератизации и дезинсекции;
- характеристика эпизоотического состояния очагов чумы и их отдельных участков в отчетном году, которая включает подробную информацию о количестве точек с положительными результатами на чуму при бактериологическом и серологическом исследовании, числе выделенных культур возбудителя чумы с указанием объектов выделения и сроков их сбора, площадях эпизоотических участков, зараженности зверьков (по видам) и блох (в процентах), проценте зараженных проб в пределах эпизоотических участков и плотности таких проб на 1 тыс. га (прилагают карты размещения положительных на чуму проб);
- анализ интенсивности эпизоотического процесса на основании вычисленных показателей, оценка эпидемической опасности сложившейся ситуации на основании изучения дислокации эпизоотических участков, поселений носителей и населенных пунктов, а также сведений о численности синантропных грызунов и блох;
- прогнозирование эпизоотической активности природных очагов чумы и их частей на основании анализа всех материалов эпизоотологического обследования и прогноза численности основных видов носителей и переносчиков на следующий год (сезон);
- оценка реальной возможности эпидемических осложнений и общие рекомендации по организации санитарно-профилактических мероприятий, их возможному объему и срокам.
Обзор подписывают начальник противочумной станции и заведующие лабораториями, принимавшие участие в его составлении.
7.4. Тактические приемы наблюдений за эпизоотическим состоянием
природных очагов чумы Российской Федерации
При выборе тактики эпизоотологического обследования ориентируются на результаты эпидемиологического районирования (прилож.4), эпизоотологическую дифференциацию природного очага чумы и фазу эпизоотического цикла, в которой находится очаг в период обследования.
В очагах чумы с непостоянной эпизоотической активностью различают эпизоотические и межэпизоотические периоды, которые продолжаются от одного до нескольких лет. Наступление межэпизоотического периода констатируют тогда, когда на всей обследуемой территории природного очага отсутствуют регистрации зараженных животных в течение одного года после последней положительной находки. Эпизоотический период наступает с момента первого обнаружения возбудителя в очаге и заканчивается через 1 год с момента последнего обнаружения.
В очагах с постоянной эпизоотической активностью нет оснований выделять межэпизоотический период. Однако периоды сезонных затуханий и обострений процесса должны быть четко определены.
В тех и других очагах проводят эпизоотологическое обследование в обычные для данного очага периоды сезонного обострения эпизоотического процесса с целью обнаружения эпизоотии, определения ее количественных характеристик и получения информации для обоснованного планирования профилактических мероприятий.
Приемы эпизоотологического обследования природных очагов чумы, закрепленных за противочумными станциями, имеют различия в эпизоотический и межэпизоотический периоды. В межэпизоотический период поиск эпизоотии осуществляют в наиболее перспективных для ее обнаружения местах, используя результаты эпизоотологической дифференциации и оперативных зоологических наблюдений. Особое внимание уделяется обнаружению признаков эпизоотии в поселениях носителей чумы (снижение численности и активности грызунов, повышенная миграция эктопаразитов, смена поведенческих реакций, находки больных и павших зверьков, скопление хищников и т.д.). Точки эпизоотологического обследования закладывают в поселениях носителей по усмотрению зоолога, при этом не требуется соблюдать равномерность их рассредоточения по территории с обязательным посещением каждого сектора. Регламентируемая плотность обследования является лишь средней характеристикой, на которую ориентируются при определении общего числа проб, приходящихся на ту или иную категорию секторов.
При обнаружении возбудителя (эпизоотический период) немедленно приступают к определению размеров и границ эпизоотической территории. Обследование остальной территории продолжают по запланированной схеме. Дополнительно берут пробы полевого материала вокруг точки с положительным на чуму результатом не дальше чем в 5 км и не менее чем в 4 направлениях от нее. Новые точки могут располагаться в любых секторах, в т.ч. с очень низким уровнем эпидемической опасности, на которых в другое время сбор полевого материала не предусматривается. Очередные точки по определению эпизоотической территории располагают на удалении до 10 км от первой. Затем обследование корректируют по мере появления новых положительных результатов. В горных очагах интервалы между точками обследования могут быть уменьшены соответственно размерам ареалов популяций или поселений носителей.
При составлении территориально-календарного плана на сезон из обследования исключают труднодоступные территории с низкой численностью населения, ландшафтные районы, резко отличающиеся от очаговых территорий, окультуренные земли или другие участки, где отсутствуют поселения носителей. Крупные массивы или отдельные секторы, где перспективен поиск эпизоотии чумы, могут обследоваться при этом с большей интенсивностью.
Обследование проводят в фенологические сроки, оптимальные для сезонного обострения эпизоотического процесса. Для каждого подразделения возможны значительные корректировки регламентируемых календарных сроков, включая перегруппировку сил и увеличение продолжительности обследования во время эпизоотии.
Объем пробы зависит прежде всего от численности и активности животных, однако следует стремиться, по возможности, к добыче максимально допустимого количества зверьков на одной точке (20-30 экз.) и норовых блох (40-50 экз.), если таковые имеются. Превышать указанный объем проб допускается только при учетных выловах и сборах.
Рекомендуемые сроки и плотность эпизоотологического обследования различных по уровню эпидемической опасности участков природных очагов чумы приведены в прилож.5. В зависимости от типа активизации в течение года эпизоотического процесса в конкретном очаге чумы (одновершинный или двухвершинный) в регламенте определено количество обследовательских сезонов (весенний, летний, осенний и т.д.), для каждого из которых выделена отдельная строка с ориентировочным указанием срока и продолжительности обследования. При необходимости сезон может быть разбит на два-три периода, разделенных интервалами произвольной длительности.
Последовательность охвата территории, включая повторное взятие материала в том или ином секторе в течение сезона, определяется территориально-календарным планом или складывающейся эпизоотической обстановкой.
Плотность и объем обследования участков являются усредненными показателями для всех секторов той или иной категории. Дробные значения плотности указывают на то, что одна проба приходится в среднем на два и более секторов. При распределении общего числа планируемых точек эпизоотологического обследования по территории не следует стремиться ни к их равномерности, ни к обязательному посещению каждого сектора. Участки, где наиболее вероятно обнаружение зараженных носителей и переносчиков, могут обследоваться со значительно большей плотностью и кратностью. При необходимости и наличии возможностей объем обследования может быть значительно увеличен.
На территориях (секторах), для которых достаточным является только визуально-рекогносцировочное обследование, может осуществляться сбор полевого материала при определении границ эпизоотических участков или при возникновении на них ситуации, характерной для возможного начала эпизоотического периода.
При проведении эпизоотологического обследования весь полевой материал, поступающий в лабораторию ПЧС, должен исследоваться дифференцированно. Выбор наиболее экономичных и эффективных тактических и методических лабораторных исследований проводят на основе результатов многолетних данных по их информативности и целесообразности, тесно связанной с характерами сезонной и многолетней эпизоотической активности очагов, сезонными изменениями восприимчивости и инфекционной чувствительности носителей возбудителя чумы.
8.1. Полевая и поселковая дератизация и дезинсекция
Истребление носителей и переносчиков возбудителя чумы осуществляют на энзоотичной территории для предотвращения заражений человека. Мероприятия, проводимые в период регистрации эпизоотии чумы, расценивают как экстренную профилактику, в межэпизоотический сезон - как заблаговременную. Экстренная профилактика призвана снижать риск заражения людей чумой, заблаговременная - ограничивать интенсивность и экстенсивность эпизоотического процесса, прогнозируемого на ближайшее будущее.
Полевую дератизацию и дезинсекцию используют как меру экстренной профилактики. При этом истребляют грызунов и (или) блох в каждой точке обнаружения зараженных животных на площади до 100 га. Обработке подлежат также окрестности всех населенных пунктов, расположенных в зоне эпизоотии и до 10 км за ее пределами. Ширина барьерной обработки вокруг населенных пунктов составляет 0,3-0,5 км. Одновременно проводят поселковую дератизацию и дезинсекцию. Кроме экстренной поселковой дератизации и дезинсекции проводят заблаговременную профилактику при повышенных показателях численности синантропных грызунов (более 15% попадания в ловушки) и наличии блох в жилье человека.
В зоне эпизоотии на участках интенсивной хозяйственной, изыскательской, промысловой и другой деятельности, удаленных от населенных пунктов, проводят полевую дератизацию и дезинсекцию на всей площади, где возможен контакт с источниками инфекции. При полевой и поселковой дератизации и дезинсекции применяют методы и нормативы, регламентируемые действующими методическими документами.
8.2. Специфическая профилактика чумы
Показанием к проведению вакцинопрофилактики на территории природных очагов чумы являются эпизоотические или эпидемические проявления. В зависимости от конкретной эпизоотической или эпидемической обстановки вакцинацию проводят на строго определенной территории.
При выявлении на территории природных очагов эпизоотических проявлений чумы различной интенсивности и распространенности или эпидемических проявлений (спорадических или групповых) руководители противочумных учреждений определяют необходимость вакцинопрофилактики всего населения или отдельных контингентов, относящихся к группам повышенного риска заражения (животноводов, заготовителей фуража и сена, фермеров, охотников, сезонных рабочих, организованных строительных и изыскательских групп, вахтовых смен добывающей и перерабатывающей промышленности и др.), а также определяют сроки вакцинации с учетом сезонов активизации эпизоотической активности очага, сроков охотопромысла на носителей и других моментов. Решение о проведении вакцинопрофилактики принимает санитарная противоэпидемическая комиссия.
Вакцинацию населения проводят территориальные учреждения здравоохранения, которые формируют прививочные бригады. Каждую бригаду возглавляет врач, который обучает технике и методике вакцинации средний медицинский персонал бригады и несет ответственность за правильный подбор лиц, подлежащих вакцинации. Противочумные учреждения осуществляют контроль за полнотой охвата вакцинацией населения, качеством и документированием работы.
Ревакцинацию проводят через 12 мес. после первой прививки, в особо тяжелых эпидемических условиях - через 6 мес. Ревакцинация населения отменяется по прекращении эпизоотии, угрожаемых контингентов - спустя один год после прекращения эпизоотии.
Основными методами вакцинации является накожный. Вакцинация проводится согласно действующей "Инструкции по применению вакцины чумной живой сухой", которая вкладывается в каждую коробку препарата.
В случае необходимости проведения массовой специфической профилактики населения целесообразно использовать безыгольный инъектор БИ-ЗМ (с противоинфекционным протектором).
В случае необходимости проведения массовой специфической профилактики населения для защиты от легочной чумы с воздушно-капельным механизмом передачи возбудителя целесообразно использовать ингаляционный метод согласно "Инструкции по ингаляционной иммунизации людей против чумы" (Москва, Саратов, 1987).
8.3. Специальная подготовка медицинских, ветеринарных
и немедицинских работников
8.3.1. Противочумные учреждения в пределах обслуживаемой ими территории должны ежегодно, а при выявлении эпизоотических проявлений чумы дополнительно осуществлять специальную подготовку медицинских работников учреждений здравоохранения и госсанэпиднадзора, а также работников ветеринарных учреждений, независимо от их ведомственной принадлежности.
8.3.2 Подготовку медицинских работников осуществляют через лекции, семинары, инструктажи и тренировочные занятия. На семинарских занятиях и во время инструктажей должны быть подробно изложены вопросы эпидемиологии (источники инфекции, способы заражения, пути распространения, сбор эпидемиологического анамнеза), клинической диагностики и дифференциальной диагностики кожных, бубонных и легочных форм чумы от аналогичных форм сибирской язвы, туляремии и других инфекционных и неинфекционных заболеваний, меры личной профилактики и проведение первичных противоэпидемических мероприятий при выявлении больных с подозрением на чуму. Семинарами и инструктажами должны быть охвачены все врачи и средние медицинские работники лечебно-профилактических и санитарно-эпидемиологических учреждений, независимо от их ведомственной принадлежности и специальности.
8.3.3. Тренировочные занятия с вводом условно больного чумой должны проводиться в поликлиниках, больницах, фельдшерско-акушерских пунктах, фельдшерских пунктах и других медицинских учреждениях, куда непосредственно обращаются больные люди. Тренировочные занятия должны быть направлены на практическую реализацию теоретической подготовки в проведении первичных противоэпидемических мероприятий от изоляции условно больного по месту его выявления до госпитализации в предусмотренный для этих целей специализированный госпиталь (бокс). Такие занятия предусматривают практическое освоение своих функциональных обязанностей всеми медицинскими работниками, закрепленными за отдельными формированиями (госпиталь, провизорный госпиталь, изолятор, бактериологическая лаборатория), которые предусмотрены планами противоэпидемических мероприятий на случай возможного возникновения заболеваний чумой и другими карантинными инфекциями.
Контроль практической готовности персонала лечебно-профилактического учреждения к проведению первичных мероприятий в случае выявления больного (трупа) чумой осуществляется путем проведения внепланового тренировочного учения с вводом условного больного.
8.3.4. Противочумные учреждения, осуществляющие эпиднадзор в природных очагах чумы, на территории которых содержатся верблюды, должны проводить подготовку всех ветеринарных работников, независимо от должности, по вопросам эпизоотологии, клиники, диагностики и профилактики чумы у верблюдов. Подготовку ветеринарных работников осуществляют через семинары и инструктажи, на которых необходимо подробно изложить материал о границах энзоотичной территории по чуме в пределах административных территорий (район, область), о носителях и переносчиках чумного микроба, о механизме заражения верблюдов, клинической картине заболевания и патологоанатомическим изменениям в органах и тканях заболевших чумой животных. Особое внимание слушателей обращают на необходимость вызова сотрудников противочумных учреждений в случае обнаружения больных верблюдов с подозрением на чуму или больных животных с неясным диагнозом. При этом, следует заострить внимание на безусловную обязательность вскрытия ветеринарными работниками трупов павших или забитых верблюдов, объяснить слушателям причину присутствия при вскрытии специалистов противочумной службы или ЦГСЭН, цели взятия материала на лабораторное исследование, а также возможные последствия нарушения описанных правил.
8.3.5. Противочумные и санитарно-эпидемиологические учреждения проводят информационно-разъяснительную работу в форме лекций, бесед и инструктажей по эпидемиологии, клинике и основам личной и общественной профилактики чумы среди сотрудников таможен, пограничников, летного состава гражданской авиации, сотрудников ГИБДД и т.д.
8.4. Информационно-разъяснительная работа среди населения
Информационно-разъяснительная работа должна быть направлена на личную и общественную безопасность населения. С этой целью среди населения энзоотичной территории необходимо формировать сознательное отношение к предупреждению возникновения и распространения заболеваний чумой, которое может быть обеспечено обязательным и своевременным обращением всех граждан в медицинские учреждения с признаками заболевания, подозрительными на чуму.
Эту работу проводят специалисты всех противочумных учреждений и их временных формирований (эпидотряды, подвижные противоэпидемические группы и др.), санитарно-эпидемиологических и лечебно-профилактических территориальных учреждений. Информационно-разъяснительную работу проводят в форме лекций, выступлений по радио и телевидению, бесед, распространения популярных брошюр, листовок, плакатов, памяток, а также через публикацию актуальных материалов в местных газетах и специальных выпусках санитарных бюллетеней.
Информационно-разъяснительная работа должна быть направлена на знание постоянным и временным населением эпизоотического состояния территории природного очага в целом и отдельных его участков, прилегающих к населенным пунктам, местам работы промысловых и изыскательских партий, вахтовых смен в строительной, добывающей и перерабатывающей промышленности и т.д., где имеет место большая вероятность заражения людей чумой. При этом, на территориях, где в личном и общественном хозяйствах имеются верблюды, обращают особое внимание населения на их роль в эпидемиологии чумы.
В процессе информационно-разъяснительной работы необходимо информировать население о значении вакцинации в формировании защиты организма от заражения чумой, а также о вреде самолечения заболевшего человека, поскольку оно сглаживает клиническую картину и затрудняет своевременную постановку правильного диагноза.
К проведению информационно-разъяснительной работы противочумные учреждения должны привлекать группы санитарных уполномоченных, которых подбирают из лиц, постоянно проживающих в населенных пунктах, систематически общающихся с большинством населения и пользующихся у них авторитетом (зооветеринарные работники, заведующие фермами, учителя, почтальоны и т.д.). Санитарные уполномоченные после инструктажа специалистами противочумных учреждений участвуют в проведении бесед с населением о мерах личной профилактики чумы при работе в природных очагах, в распространении листовок, брошюр и плакатов, а также информируют противочумные и лечебно-профилактические учреждения о случаях появления больных с лимфаденитами, заболеваниях с высокой температурой, скоропостижно скончавшихся по неизвестным причинам односельчан, наличии павших верблюдов или прирезке больных верблюдов, увеличении численности грызунов и блох в жилищах, браконьерской охоте на территории природного очага.
8.5. Наблюдение за верблюдами
На всей энзоотичной по чуме территории ветеринарные работники осуществляют постоянное ветеринарное наблюдение за верблюдами.
В случае выявления на энзоотичной по чуме территории больных верблюдов с неясной клинической картиной, а также павших от неизвестных причин животных (независимо от того, регистрируются или нет эпизоотии в природном очаге) ветеринарные работники должны немедленно вызвать специалиста противочумного учреждения для бактериологического, биологического и серологического исследования материала на чуму.
При регистрации эпизоотии чумы среди грызунов, за верблюдами ужесточают ветеринарный надзор, устанавливают карантин и запрещают вывоз и ввоз животных за пределы пораженной территории. Забой здоровых животных допускают только с разрешения главного ветеринарного врача территории. Шерсть от здоровых животных подвергают обработке инсектицидными препаратами. Карантин снимают после прекращения эпизоотии, а в случае регистрации больных чумой верблюдов через 60 дней после выявления последнего больного животного.
При выявлении локальной эпизоотии выпас верблюдов на этом участке запрещают, усиливают ветеринарный надзор за ними, осуществляют обработку инсектицидами всех животных с периодичностью 7-10 дней.
При выявлении разлитой эпизоотии чумы, верблюдов собирают на специальные площадки для стойлового содержания, которые предварительно обрабатывают инсектицидами, в последующем животных обрабатывают инсектицидами с периодичностью 7-10 дней.
9.1. Медицинское и эпидемиологическое наблюдение за населением
9.1.1. Медицинское наблюдение за населением проводится с целью раннего выявления спорадических случаев заболеваний чумой и предотвращения антропонозного распространения инфекции и осуществляется лечебно-профилактическими учреждениями при участии и под контролем территориальных противочумных учреждений.
9.1.2. Максимальное внимание медицинских работников, независимо от их ведомственной принадлежности, должно быть направлено на раннее выявление больных с явлениями острой лихорадки, пневмонии и лимфаденита неясной этиологии, а также в случае обнаружения больных людей, участвовавших в забое верблюда или занимавшихся охотопромыслом. При регистрации случаев скоропостижной смерти от неизвестных причин трупы подлежат обязательному вскрытию и исследованию на чуму специалистами противочумных учреждений.
9.1.3. К работе по выявлению подозрительных на чуму больных медицинские работники должны широко привлекать население, используя для этого санитарных уполномоченных, чтобы обо всех случаях появления больных с указанными выше признаками, а также в случаях скоропостижных смертей, падежа верблюдов или их вынужденного забоя немедленно становилось известно противочумной, санитарно-эпидемиологической и лечебно-профилактической службам территории.
9.1.4. При выявлении эпизоотии чумы медицинское наблюдение за населением, проживающим в зоне эпизоотии, осуществляется не реже 1 раза в 3 дня силами медицинских работников учреждений здравоохранения, противочумных учреждений и центров госсанэпиднадзора.
9.1.5. Общая оценка качества медицинского наблюдения за населением осуществляется на основе данных ретроспективного анализа сезонной инфекционной заболеваемости лимфаденитами, пневмониями и остролихорадочными состояниями по историям болезни и картам амбулаторного обследования, а также анализа числа и обстоятельств случаев скоропостижных смертей от неизвестных причин. С этой целью могут быть использованы формы АСУ 1 и 2.
9.1.6. Для эпидемиологического наблюдения за населением необходимо иметь основные сведения о его численности, плотности распределения по территории, социально-профессиональному составу, полу и возрасту, особенностях местных обычаев.
Специалисты противочумных учреждений обязаны знать характер и особенности эпизоотических и эпидемических проявлений чумы в прошлом и настоящем на контролируемых территориях, как на отдельных участках, так и на территории природного очага в целом.
9.1.7. Противочумные учреждения должны на постоянной основе представлять информацию об эпизоотологической обстановке по чуме на контролируемой ими территории администрации, центрам госсанэпиднадзора и управлениям здравоохранения, службам ветеринарного надзора.
9.1.8. Особое внимание следует уделять контингентам постоянного и временного населения, относящимся к группам повышенного риска заражения чумой - скотоводам, заготовителям, охотникам, строителям, геологам, археологам, путевым обходчикам, туристам, сезонным рабочим и другим группам населения с учетом конкретной эпизоотологической обстановки. С этой целью противочумная, санитарно-эпидемиологическая и лечебно-профилактическая службы должны иметь сведения о количестве, сроках прибытия и убытия, дислокации, характере деятельности и особенностях быта организованных и неорганизованных групп населения - постоянных и временных рабочих, занятых в сельском хозяйстве, промысловых и изыскательских партиях, вахтовых смен в строительной, добывающей и перерабатывающей промышленности.
9.1.9. Противочумные учреждения должны иметь паспорта населенных пунктов и временного жилья населения, в которых с ежегодной корректировкой необходимо иметь сведения: о численности постоянного и временного населения, его распределение по возрасту, полу, социально-профессиональной и бытовой деятельности; характере контактов с природным очагом различных групп населения; количестве верблюдов в общественных и личных хозяйствах и ветеринарном надзоре за ними; количестве построек и их санитарном состоянии (наличие в них синантропных грызунов и блох жилья человека), энергообеспечении, связи, транспортных связях, источниках водоснабжения, утилизации бытовых и хозяйственных отходов; о характере санитарно-эпидемиологического и лечебно-профилактического обслуживания населения, укомплектованности этих служб кадрами и профессиональной готовности медицинских работников к выявлению первых случаев заболевания чумой и проведению первичных противоэпидемических мероприятий по предотвращению антропонозного распространения инфекции; наличие и реальность комплексных планов или программ по охране территории и борьбе с чумой и другими особо опасными заболеваниями.
9.1.10. В противочумных учреждениях необходимо иметь укладки с комплектами защитной одежды, дезинфицирующих средств и всего необходимого для забора материала от больных людей, трупов, больных и павших верблюдов (прилож.6).
9.2. Мероприятия по локализации и ликвидации эпидемического очага чумы
9.2.1. В случае выявления больного, подозрительного на чуму, в каждом амбулаторно-поликлиническом и больничном учреждении должны быть проведены первичные противоэпидемические мероприятия в соответствии с оперативным планом учреждения, заключающиеся в изоляции больного по месту его выявления, проведении патогенетической (без введения антибиотиков) терапии, выявлении и изоляции контактировавших с больным лиц, срочном извещении о выявленном больном главного врача (лица, замещающего его) и руководителя территориального противочумного учреждения. Дальнейший ход информации - в прилож.2.
9.2.2. При выявлении больного с подозрением на чуму в медицинском учреждении медицинский работник, не выходя из помещения, где находится больной, по телефону или через нарочного извещает главного врача, который направляет в кабинет или палату, где выявлен больной, инфекциониста или терапевта. Последние, надев костюм I типа, заходят к больному и, оказав ему необходимую помощь, подтверждают или снимают диагноз. Врач, выявивший больного, выходит за пределы помещения, где последний обнаружен, и снимает с себя рабочую и личную одежду, обрабатывает руки, лицо, волосы, все открытые части тела дезинфицирующим раствором, рот и горло прополаскивает 70°-ным спиртом, надевает чистую одежду, в нос и глаза ему закапывают растворы антибиотиков (табл.4). Вопрос об его изоляции и назначении профилактического лечения решается в зависимости от диагноза, поставленного больному. По распоряжению главного врача закрывают двери помещения или отделения (этажа) и составляют списки лиц, контактировавших с больным. Больного специальным транспортом направляют в стационар. В медицинском учреждении проводится заключительная дезинфекция. В лечебно-профилактическом учреждении до проведения заключительной дезинфекции временно прекращают прием (выписка больных, выдача трупов, посещение больных родственниками), запрещают выносить из кабинета (палаты) вещи, передавать амбулаторные карты (истории болезни) в регистратуру.
При выявлении больного (подозрительного) чумой на фельдшерско-акушерском пункте (ФАП) медицинский работник может оказаться один. В этом случае для проведения первичных противоэпидемических мероприятий он может временно покинуть свой кабинет для переодевания в защитную одежду и срочного сообщения (по телефону, нарочным, водителем санитарного транспорта) главному врачу о случившемся.
В случае выявления больного на дому или на работе, медицинский работник изолирует его в отдельной комнате {юрте, вагончике, палатке и т.д.), сообщает о случившемся главному врачу (по телефону, с водителем санитарного транспорта или нарочным) и, защитив органы дыхания любой повязкой (полотенце, косынка, бинт и т.д.), остается с ним до его эвакуации для оказания помощи, одновременно он проводит опрос больного с целью выявления источника заражения и лиц, контактных с источником инфекции или выявленным больным.
В случае если возникло подозрение на чуму при патологоанатомическом вскрытии трупа, врач, проводящий его, немедленно прекращает работу и выходит из помещения. Затем снимает с себя одежду и погружает ее в дезраствор или бикс для обеззараживания автоклавированием, а открытые части кожного и волосяного покрова обрабатывает 70°-ным этиловым спиртом. Сообщает о случившемся главному врачу, который вызывает специалиста противочумного учреждения или специалиста по ООН центра госсанэпиднадзора. Дальнейшее вскрытие проводят в присутствии консультантов в защитном противочумном костюме первого типа, дополненного нарукавниками и фартуком. Для подтверждения возникшего подозрения и лабораторной диагностики чумы берут кусочки паренхиматозных органов и лимфатических узлов, кровь, костный мозг, которые исследуют в территориальных противочумных учреждениях. За всеми лицами, принимавшими участие во вскрытии, устанавливается медицинское наблюдение в течение 6 суток. Вопрос о необходимости их изоляции и профилактического лечения решает специалист противочумного учреждения или центра госсанэпиднадзора.
9.2.3. Обо всех случаях выявления больных с подозрением на чуму (или трупа) медицинские работники обязаны немедленно сообщить в центр госсанэпиднадзора и органы управления здравоохранением, а также в ближайшее противочумное учреждение. Далее информация в кратчайший срок должна быть передана в территориальное управление здравоохранения, центр госсанэпиднадзора, противочумный институт, Российский НИПЧИ "Микроб", Противочумный центр, Департамент госсанэпиднадзора Министерства здравоохранения Российской Федерации (прилож.2).
9.2.4. Общее руководство мероприятиями по локализации и ликвидации эпидемического очага (очагов) спорадических, групповых и массовых случаев заболевания людей чумой осуществляет санитарно-противоэпидемическая комиссия (СПК), создаваемая решением администрации района, города, области, края, республики. Возглавляет СПК глава (заместитель) администрации. В ее состав входят руководители госсанэпиднадзора, здравоохранения, силовых структур (МВД, МО, ФСБ), транспорта и других ведомств.
Всей работой по локализации и ликвидации очага чумы руководит начальник очага (квалифицированный специалист противочумного учреждения или центра госсанэпиднадзора, подготовленный по особо опасным инфекциям), который утверждается решением СПК.
При начальнике очага организуется противоэпидемический штаб, начальником которого является руководитель местного управления здравоохранения (его заместитель). В состав штаба входят все начальники служб, ежедневные заседания протоколирует секретарь, приказом оформляют всех местных и прикомандированных медицинских и других работников, принимающих участие в локализации и ликвидации очага.
В зависимости от масштаба эпидемических проявлений чумы (спорадические, групповые или массовые заболевания) и клинической формы заболевания определяется количественный состав противоэпидемического штаба, его служб и входящих в них групп. Расчет штатов, коечного фонда, материально-технического и другого обеспечения противоэпидемических мероприятий при единичных и массовых эпидемических проявлениях должны быть предусмотрены комплексным планом (программой) по санитарной охране территории (района, города, области, края, республики).
9.2.5. Для локализации очага (очагов) заболевания чумой должны быть проведены противоэпидемические мероприятия, направленные на предупреждение распространения чумы от человека к человеку и заражения людей от грызунов и эктопаразитов в природном очаге. Такими мероприятиями являются:
- выявление и госпитализация больных чумой;
- выявление и изоляция лиц, контактировавших с больными, трупами, зараженными вещами, мясом больных верблюдов;
- выявление и захоронение трупов погибших от чумы людей;
- медицинское наблюдение за населением, активное выявление и провизорная госпитализация всех остро лихорадящих больных, больных с лимфаденитами и пневмониями;
- введение ограничительных мероприятий при бубонной форме чумы и карантинных - при легочной форме чумы; ограничительные мероприятия (карантин) вводятся (снимаются) постановлениями правительств (администраций) субъектов Российской Федерации - на сельские населенные пункты, районы города, органов местного самоуправления - на отдельные домовладения, части населенных пунктов по представлению главных государственных санитарных врачей, по решению СПК соответствующих территорий и муниципальных образований;
- лабораторное исследование на чуму материала от больных, лиц, контактировавших с ними, больных, госпитализированных в провизорные стационары, а также грызунов, эктопаразитов, больных и павших верблюдов;
- зоолого-паразитологическое обследование в населенном пункте и вне его;
- ветеринарное наблюдение за верблюдами частного и общественного сектора;
- дератизация и дезинсекция в населенном пункте и вне его;
- проведение текущей и заключительной дезинфекции.
Эпидемический очаг чумы считается локализованным по прошествии одного инкубационного периода (6 суток) с момента госпитализации последнего больного.
9.2.6. Для ликвидации эпидемического очага (очагов) чумы осуществляют:
- лечение больных;
- профилактическое лечение лиц, находящихся в изоляции в связи с их общением с больными чумой, трупами или зараженными вещами, а также больных в провизорном госпитале;
- заключительную дезинфекцию в госпитале (отделении) после выписки последнего больного;
- дератизацию и дезинсекцию;
- информационно-разъяснительную работу среди населения.
Эпидемический очаг чумы следует считать ликвидированным после выписки последнего больного и проведения заключительной дезинфекции госпиталя (бокса), где находился больной.
9.2.7. Целесообразность и сроки проведения экстренной и специфической профилактики определяет противоэпидемический штаб. Необходимость проведения экстренной антибиотикопрофилактики возникает при регистрации эпидемических проявлений легочной чумы и должна быть проведена в первые дни локализации очага. Вакцинопрофилактика может быть проведена как в период локализации, так и ликвидации очага.
После ликвидации эпидемического очага территориальные противочумные учреждения с целью снижения риска заражения людей в зоне регистрации эпизоотических проявлений продолжают работу по снижению численности носителей и переносчиков, а также эпизоотологическое обследование территории для установления границ эпизоотии.
Лечебно-профилактические и санитарно-эпидемиологические учреждения продолжают медицинское наблюдение за населением и информационно-разъяснительную работу среди населения, а ветеринарная служба - наблюдение за верблюдами до окончания эпизоотических проявлений в природном очаге чумы.
9.3. Клиника и лечение чумы
9.3.1. Инкубационный период при чуме от 1 до 6 суток, в исключительных случаях, у привитых - до 8-10 суток.
При любой клинической форме чумы начало заболевания внезапное, острое, без продромальных явлений. Сильный озноб, быстрое повышение температуры до 38-40 °С, резкая головная боль, головокружение, раннее нарушение сознания, бессонница, бред, иногда рвота. Состояние беспокойства, возбуждения. У других больных заторможенность, оглушенность. Лицо покрасневшее, одутловатое, затем становится осунувшимся, черты его заостряются. Гиперемия конъюнктив, глаза окружены темными кругами. Страдальческое выражение лица, нередко полное страха, ужаса. Язык обложен ("натерт мелом"), припухший, нередко тремор. Сухость слизистых полости рта. Зев гиперемирован, миндалины могут быть увеличены. Быстро нарастают явления сердечно-сосудистой недостаточности. Через сутки развиваются характерные для каждой формы признаки болезни. При всех формах характерно несоответствие тяжелого общего состояния больного и минимальных местных проявлений.
Бубонная форма (наиболее частая) - основным признаком является бубон (воспаление ближайшего к месту внедрения возбудителя чумы лимфатического узла). Бубон резко болезненный, плотный, спаянный с окружающей подкожной клетчаткой (неподвижный, плохо контурируемый), лимфангоит отсутствует.
Кожная, кожно-бубонная формы встречаются сравнительно редко. При кожной форме, переходящей обычно в кожно-бубонную, выявляются изменения в виде некротических язв, фурункула, геморрагического карбункула. Различают быстро сменяющиеся стадии: пятно, папула, везикула, пустула. Язвы при чуме на коже отличаются длительностью течения, заживают медленно, образуя рубцы.
Легочная форма - на фоне общетоксических признаков появляются боли в грудной клетке, одышка, рано наступает угнетение психики, бред; кашель появляется с самого начала заболевания. Мокрота часто пенистая с прожилками алой крови. Характерно несоответствие между данными объективного обследования легких и общим тяжелым состоянием больного.
Септическая форма - ранняя тяжелая интоксикация, чрезвычайно тяжелые общие симптомы заболевания и быстрая смерть (резкое падение кровяного давления, кровоизлияния на слизистых, коже, кровотечение во внутренних органах).
Кишечная форма - встречается крайне редко. На фоне высокой температуры и выраженной интоксикации больные жалуются на боли в животе, рвоту с примесью крови и жидкий стул с примесью крови. Без своевременно начатого лечения заболевание заканчивается летально.
Не исключена возможность развития чумного менингита с тяжелым течением, заканчивающегося также неблагоприятным исходом.
Широкое применение антибиотиков, изменяющих клиническую картину чумы, может привести к появлению стертых и атипичных форм болезни, включая ангинозные формы.
9.3.2. Лечение больных чумой должно быть комплексным и включать применение этиотропных, патогенетических и симптоматических средств.
Патогенетическая терапия прежде всего заключается в борьбе с интоксикацией. Используются сбалансированные полиионные растворы (квартасоль, ацесоль, хлосоль, трисоль, дисоль) и коллоиды (10%-ный или 20%-ный растворы альбумина, гемодез и др.). Суточный объем жидкости 40-80 мл на 1 кг массы больного.
Для борьбы с инфекционно-токсическим шоком назначают немедленно: кислород - ингаляция; преднизолон - 60 мг в 0,9%-ном растворе натрия хлорида, лактосол - 400 мл внутривенно капельно, трентал - внутривенно, капельно (разовая доза - 2,0-4,0 мг/кг, суточная доза - 9,0-17,0 мг/кг).
При отсутствии этих препаратов назначают: внутривенное капельное введение гемодеза - 400 мл, полиглюкина, реополиглюкина, раствор глюкозы и физиологический раствор.
Дальнейшие мероприятия по интенсивной терапии проводят в стационаре.
Этиотропными средствами для экстренной профилактики и лечения чумы являются антибактериальные препараты: амикацин, нетилмицин, гентамицин, стрептомицин, канамицин, тобрамицин, рифампицин, доксициклин, тетрациклин, цефтриаксон, цефтизоксим, цефотаксим, цефтазидим, офлоксацин, ципрофлоксацин, пефлоксацин, сульфамонометоксин/триметоприм, ампициллин/сульбактам, азтреонам.
Суточные дозы антибиотиков вводят дробно с интервалом в 6, 8 или 12 ч.
Экстренную профилактику чумы у людей проводят одним из препаратов, представленных в табл.4.
Таблица 4
Схемы применения антибактериальных препаратов при экстренной профилактике чумы
|
Наименование препарата |
Способ приме- |
Разовая доза, г |
Кратность приме- |
Суточная доза, |
Курсовая доза, |
Продолжи- |
|
Ципрофлоксацин |
Внутрь |
0,5 |
2 |
1,0 |
5,0 |
5 |
|
Офлоксацин |
" |
0,2 |
2 |
0,4 |
2,0 |
5 |
|
Пефлоксацин |
" |
0,4 |
2 |
0,8 |
4,0 |
5 |
|
Доксициклин |
" |
0,2 |
2 |
0,4 |
2,8 |
7 |
|
Рифампицин |
" |
0,3 |
2 |
0,6 |
4,2 |
7 |
|
Рифампицин/триметоприм |
" |
0,3/0,08 |
2 |
0,6/0,16 |
4,2/1,12 |
7 |
|
Рифампицин+ампициллин |
" |
0,3+1,0 |
1+2 |
0,3+2,0 |
2,1+14,0 |
7 |
|
Рифампицин+ципрофлоксацин |
" |
0,3+0,25 |
1 |
0,3+0,25 |
1,5+1,25 |
5 |
|
Рифампицин+офлоксацин |
" |
0,3+0,2 |
1 |
0,3+0,2 |
1,5+1,0 |
5 |
|
Рифампицин-пефлоксацин |
" |
0,3+0,4 |
1 |
0,3+0,4 |
1,5+2,0 |
5 |
|
Сульфамонометоксин/триметоприм |
" |
1,0/0,4 |
2 |
2,0/0,8 |
14,0/5,6 |
7 |
|
Гентамицин |
В/м |
0,08 |
3 |
0,24 |
0,8 |
5 |
|
Амикацин |
" |
0,5 |
2 |
1,0 |
5,0 |
5 |
|
Стрептомицин |
" |
0,5 |
2 |
1,0 |
5,0 |
5 |
|
Цефтриаксон |
" |
1,0 |
1 |
1,0 |
5,0 |
5 |
|
Цефотаксим |
" |
1,0 |
2 |
2,0 |
14,0 |
7 |
|
Цефтазидим |
" |
1,0 |
2 |
2,0 |
14,0 |
7 |
Примечание. Здесь и далее в таблицах: в/м - внутримышечная инъекция.
Для экстренной профилактики конъюнктивального заражения чумой, т.е. при попадании возбудителя чумы на слизистые оболочки глаз, носа и рта, в глаза вводят несколько капель одного из указанных в табл.5 растворов антибиотиков или других апробированных по отношению к чуме и растворимых в дистиллированной воде или прилагаемом к антибиотикам растворителю. Несколько капель закапывают в нос. При отсутствии антибиотиков в глаза закапывают 1%-ный раствор азотнокислого серебра, в нос - 1%-ный раствор протаргола. Рот и горло промывают 70°-ным этиловым спиртом.
Таблица 5
Схема местной экстренной профилактики при конъюнктивальном заражении
(промывание глаз)
|
Наименование препаратов |
Способ приготовления глазных капель |
Концентрация, мг/мл |
Способ и кратность применения |
|
Стрептомицин сульфат |
Содержимое флакона (0,5 г) растворить в 20 мл дистиллированной воды |
25 |
Закапывать в глаза сразу после предполагаемого заражения, затем 3 раза в день 3 сут. |
|
Гентамицина сульфат |
Содержимое флакона (0,08 г) растворить в 20 мл дист. воды или содержимое ампулы (1 мл=0,04 г) растворить в 10,0 мл дист. воды |
4 или 0,3%-ный раствор |
" |
|
Амикацина сульфат |
Содержимое флакона (2 мл=0,5 г) растворить в 125 мл дист. воды |
4 |
" |
|
Ампициллина натриевая соль |
Содержимое флакона (500 мг) растворить в 33,2 мл дист. воды |
15 |
" |
|
Тетрациклин |
0,5%-ный раствор |
" | |
|
Левомицетина сукцинат натрия |
0,5%-ный раствор |
" | |
|
Сульфацил натрия (альбуцид)* |
20,0%-ный раствор |
" | |
|
Азотнокислое серебро |
1%-ный раствор |
" | |
|
Борная кислота* |
1%-ный раствор |
. |
" |
|
* Растворы применяются при отсутствии антибиотиков как глазные капли. Рот и горло промывают 70°-ным этиловым спиртом. | |||
Лечение больных чумой должно осуществляться с обязательным применением антибактериальных препаратов по схемам в соответствии с формой заболевания: бубонной (табл.6), легочной и септической формами (табл.7 и 8).
Таблица 6
Схемы применения антибактериальных препаратов для лечения бубонной чумы
|
Наименование препаратов |
Способ приме- |
Разовая доза, |
Кратность приме- |
Суточная доза, |
Курсовая доза, |
Продолжи- |
|
Рифампицин/триметоприм |
Внутрь |
0,45/0,12 |
2 |
0,9/0,24 |
6,3/1,68 |
7 |
|
Доксициклин* |
" |
0,2 |
2 |
0,4 |
4,0 |
10 |
|
Ципрофлоксацин* |
" |
0,5 |
2 |
1,0 |
7,0-10,0 |
7-10 |
|
Пефлоксацин* |
" |
0,4 |
2 |
0,8 |
5,6-8,0 |
7-10 |
|
Офлоксацин* |
" |
0,4 |
2 |
0,8 |
5,6-8,0 |
7-10 |
|
Сульфамонометоксин/ |
" |
1,0/0,4 |
2 |
2,0/0,8 |
20,0-28,0/8,0-11,2 |
10-14 |
|
Гентамицин |
В/м |
0,16 |
3 |
0,48 |
3,26 |
7 |
|
Амикацин |
" |
0,5 |
2 |
1,0 |
7,0 |
7 |
|
Стрептомицин |
" |
0,5 |
2 |
1,0 |
7,0 |
7 |
|
Тобрамицин |
" |
0,1 |
2 |
0,2 |
1,4 |
7 |
|
Цефтриаксон |
" |
2,0 |
1 |
2,0 |
14,0 |
7 |
|
Цефотаксим |
" |
2,0 |
3-4 |
6,0-8,0 |
42,0-80,0 |
7-10 |
|
Цефтазидим |
" |
2,0 |
2 |
4,0 |
28,0-40,0 |
7-10 |
|
Ампицилин/сульбактам |
" |
2,0/1,0 |
3 |
6,0/3,0 |
42,0-60,0/21,0-30,0 |
7-10 |
|
Азтреонам |
" |
2,0 |
3 |
6,0 |
42,0-60,0 |
7-10 |
|
* Выпускаются растворимые формы препаратов для парентерального введения. | ||||||
Таблица 7
Схемы применения антибактериальных препаратов для лечения легочной
и септической форм чумы
|
Наименование препаратов |
Способ приме- |
Разовая доза, г |
Крат- |
Суточная доза, г |
Курсовая |
Продолжи- |
|
Рифампицин/триметоприм |
Внутрь |
0,6/0,16 |
2 |
1,2/0,32 |
8,4-12,0/2,24-3,2 |
7-10 |
|
Ципрофлоксацин* |
" |
0,75 |
2 |
1,5 |
15,0-21,0 |
10-14 |
|
Пефлоксацин* |
" |
0,8 |
2 |
1,6 |
16,0-22,4 |
10-14 |
|
Офлоксацин* |
" |
0,4 |
2 |
0,8 |
8,0-11,2 |
10-14 |
|
Доксициклин* |
" |
0,2 |
2 |
0,3 |
2,1-2,9 |
10-14 |
|
Гентамицин |
В/м |
0,16 |
3 |
0,48 |
4,8 |
10 |
|
Амикацин |
" |
0,5 |
3 |
1,5 |
15,0 |
10 |
|
Стрептомицин |
" |
0,5 |
3 |
1,5 |
15,0 |
10 |
|
Ципрофлоксацин |
В/в |
0,2 |
2 |
0,4 |
2,8 |
7 |
|
Цефтриаксон |
В/м, в/в |
2,0 |
2 |
4,0 |
28,0-40,0 |
7-10 |
|
Цефотаксим |
" |
3,0 |
3 |
9,0 |
90,0 |
10 |
|
Цефтазидим |
" |
2,0 |
3 |
6,0 |
60,0 |
10 |
|
Левомицитина сукцинат натрия |
" |
0,07-0,1 г/кг |
1 |
0,07-0,1 г/кг |
0,49-0,7 г/кг |
7 |
|
* Существуют инъекционные формы препаратов, предназначенные для внутривенного введения, с которых можно начинать лечение (2-3 дня с уменьшением дозы) с последующим переходом на прием внутрь (ступенчатая терапия). | ||||||
Таблица 8
Схемы применения комбинаций антибактериальных препаратов при лечении больных
легочной и септической формами чумы
|
Наименование препаратов |
Способ применения |
Разовая доза, г |
Кратность приме- |
Суточная доза, г |
Курсовая доза, г |
Продолжи- |
|
Цефтриаксон |
В/м |
1,0 |
2 |
2,0 |
20,0 |
10 |
|
+ |
+ |
+ |
+ |
|||
|
стрептомицин (или амикацин) |
В/в
|
0,5
|
1,0
|
10,0
|
||
|
Цефтриаксон |
В/м |
1,0 |
2 |
2,0 |
20,0 |
10 |
|
+ |
+ |
+ |
+ |
|||
|
гентамицин |
В/в |
0,08 |
0,16 |
1,6 |
||
|
Цефтриаксон |
В/в |
1,0 |
2 |
2,0 |
20,0 |
10 |
|
+ |
+ |
+ |
+ |
|||
|
рифампицин |
Внутрь |
0,3 |
0,6 |
6,0 |
||
|
Ципрофлоксацин* |
Внутрь |
0,5 |
2 |
1,0 |
10,0 |
10 |
|
+ |
+ |
+ |
+ |
|||
|
рифампицин |
Внутрь |
0,3 |
0,6 |
6,0 |
||
|
Ципрофлоксацин* |
Внутрь |
0,5 |
2 |
1,0 |
10,0 |
10 |
|
+ |
+ |
+ |
+ |
|||
|
стрептомицин (или амикацин) |
В/в, в/м
|
0,5
|
1,0
|
10,0
|
||
|
Ципрофлоксацин* |
Внутрь |
0,5 |
2 |
1,0 |
10,0 |
10 |
|
+ |
+ |
+ |
+ |
|||
|
гентамицин |
В/в, в/м |
0,08 |
0,16 |
1,6 |
||
|
Ципрофлоксацин* |
В/в, |
0,1-0,2 |
2 |
0,2-0,4 |
2,0-4,0 |
10 |
|
+ |
||||||
|
цефтриаксон |
В/в, в/м |
1,0 |
2,0 |
20,0 |
||
|
Рифампицин |
Внутрь |
0,3 |
2 |
0,6 |
6,0 |
10 |
|
+ |
+ |
+ |
+ |
|||
|
гентамицин |
В/в, в/м |
0,08 |
0,16 |
1,6 |
||
|
Рифампицин |
Внутрь |
0,3 |
2 |
0,6 |
6,0 |
10 |
|
+ |
+ |
+ |
+ |
|||
|
стрептомицин (или амикацин) |
В/в, в/м
|
0,5
|
1,0 |
10,0
|
||
|
* Ципрофлоксацин можно заменить на офлоксацин (разовая доза - 0,2 г), пефлоксацин (разовая доза - 0,4 г). Лечение больных можно начинать с внутривенного введения препаратов с последующим переходом на внутримышечные инъекции и прием внутрь (ступенчатая терапия). Нельзя назначать детям до 15 лет. | ||||||
9.4. Патологическая анатомия чумы у человека
9.4.1. Вскрытие трупа с подозрением на чуму производят в специально выделенном и оборудованном для вскрытия инфекционных больных морге или патологоанатомическом отделении больницы. Морг должен быть оборудован душевой или санитарным пропускником. Полы и стены в морге должны быть непроницаемы для грызунов, не допускаются щели в полах. Предпочтительны покрытия стен и полов керамической плиткой. Окна должны быть защищены сеткой от насекомых.
Секционный стол должен иметь водонепроницаемое покрытие, подвод горячей и холодной воды и отключаемый сток в канализацию. При вскрытии трупов инфекционных больных сток в канализацию отключают. При этом жидкость стекает в подставленную емкость с двойной концентрацией дезраствора. В случае отсутствия такого приспособления, отверстие стока в столе плотно закупоривают резиновой или деревянной пробкой, стол покрывают медицинской клеенкой.
При отсутствии специального морга используют ближайший морг любого типа или подсобное помещение, выбранное совместно со специалистом противочумного учреждения или ЦГСЭН и врачом, производящим вскрытие. Возможно вскрытие (включая эксгумацию) и у места захоронения. При вскрытии трупа у края могилы в качестве секционного стола можно использовать медицинскую каталку, при отсутствии - насыпь земли достаточной высоты, покрытую досками или деревянным настилом. Персонал при вскрытии в этом случае располагается с наветренной стороны от трупа. В этих и других выездных случаях используют оснащение и дезсредства, разрешенные к применению для этих целей Департаментом госсанэпиднадзора Минздрава РФ, заложенные в типовые укладки для производства вскрытия трупа.
9.4.2. Как правило, смерть при чуме наступает в период генерализации инфекции, поэтому наряду с признаками, характерными для каждой формы, обнаруживают изменения, характерные для сепсиса (геморрагической септицемии).
При бубонной форме видимые изменения на месте внедрения возбудителя отсутствуют. Постоянный и характерный признак этой формы - наличие первичного бубона, острого воспаления группы регионарных к месту заражения лимфатических узлов. При осмотре бубон имеет вид опухолевидного образования со сглаженными контурами. На разрезе - узлы увеличены, спаяны между собой и с окружающей клетчаткой, обильно пропитаны кровью или серозно-геморрагической жидкостью, часто имеют своеобразный "пестрый" вид из-за наличия участков некроза и гнойного расплавления на фоне геморрагического пропитывания. При гибели в поздние сроки может наблюдаться образование свища с гнойным отделяемым, рубцевание. Чаще всего первичные бубоны локализуются в бедренной, паховой, шейной, подмышечной областях. Вторичные бубоны могут локализоваться в любой группе лимфатических узлов. В сердце возможны кровоизлияния в перикарде и под эндокардом. Печень может быть увеличена, с признаками мутного набухания, жировой дистрофии и очаговыми некрозами. Селезенка увеличена, капсула напряжена, с очаговыми кровоизлияниями, пульпа дает обильный соскоб. В почках - кровоизлияния, явления мутного набухания. В серозных и слизистых оболочках желудочно-кишечного тракта - мелкоочаговые кровоизлияния. Вторичные кожные проявления при бубонной форме чумы - кровоизлияния, розеолы, пустулы, карбункулы, язвы. Вторичная чумная пневмония - мелкоочаговая (размером от просяного зерна до сливы), реже - сливная, локализуется в разных долях, в центральных или периферических их участках, часто - под плевральным покровом. Характерны красный, серо-красный, серо-желтый или серый цвет пневмонических фокусов, гладкая поверхность их и плевры. Фокусы могут быть окружены множественными кровоизлияниями.
При кожной (кожно-бубонной) форме в месте проникновения возбудителя возникает первичный эффект в виде фликтены, пустулы, язвы, некроза, чумного карбункула. Карбункул - плотный, неподвижный, инфильтрированный, отечный конусообразный участок кожи с серозно-геморрагическим или гнойным пропитыванием тканей на разрезе. В центре карбункула могут быть некроз или язва, которая имеет плотные валикообразные края, инфильтрированное дно желтоватого цвета. Пустулы также могут быть изъязвлены. В регионарных к первичному аффекту лимфатических узлах - первичные бубоны. Изменения в других органах - как при бубонной чуме.
Первичная чумная пневмония протекает по типу очаговой или сливной, реже псевдолобарной, единичные или множественные пневмонические очаги локализуются в разных долях, в основном в прикорневых отделах, на разрезе гладкие, красного цвета, реже - серо-красные или серые, несколько выступают над поверхностью разреза, плотновато-эластической консистенции, при сдавлении с поверхности разреза стекает кровянистая пенистая жидкость. Вокруг и вне очагов, под плеврой - множественные кровоизлияния. В плевральной полости может быть небольшое количество серозной или серозно-геморрагической жидкости, после антибиотикотерапии - фибринозные наложения на плевре. В лимфатических узлах в области корней легких и средостения - изменения, характерные для первичных бубонов. В вышележащих отделах дыхательных путей - явления острого катара.
При первично-септической форме патологоанатомические изменения не успевают развиться вследствие ее быстротечности. На вскрытии обнаруживают признаки, характерные для сепсиса: единичные или множественные мелкоочаговые кровоизлияния в коже, слизистых и серозных оболочках, во внутренних органах, иногда - некоторое увеличение селезенки.
При кишечной форме на вскрытии в брюшной полости отмечают большое количество серозной жидкости, кровоизлияния в серозном покрове тонкого и толстого кишечника, в брыжейке, отек слизистой оболочки и кровоизлияния в ней, увеличение мезентериальных узлов (по типу первичного бубона), в содержимом кишечника - примесь крови.
9.5. Лабораторная диагностика чумы у человека
Для лабораторной диагностики чумы используют бактериоскопический, бактериологический, биологический, серологические и молекулярно-генетические методы.
Диагноз чумы у человека ставится на основании выявления у него возбудителя - выделение и идентификация культуры, обнаружения специфического для чумного микроба антигена FI и специфических антител к антигену FI в сыворотках больных и переболевших.
В качестве экспресс-методов используют иммуно-флюоресцентный анализ (обнаружение микроба с помощью флюоресцирующих иммуноглобулинов), ПЦР (обнаружение микроба по наличию искомого участка ДНК в результате его многократного копирования), имунно-суспензионные методы - система 2-3-компонентных реакций с эритроцитарными диагностикумами или иммуноферментный анализ для обнаружения специфических антигенов чумного микроба. С этой же целью применяют и другие варианты иммуно-суспензионных методов: дот-иммуноферментный анализ, радиоиммунный анализ. Все экспресс-методы выполняют после обеззараживания материала.
Обязательному лабораторному исследованию подлежит материал:
- от больных людей с симптомами болезни, сходными с клиническими проявлениями всех форм чумы;
- лиц, контактировавших с больными легочной чумой;
- лиц, участвовавших (без защитной одежды) во вскрытии трупов людей и верблюдов, погибших от чумы;
- лиц, участвовавших в прирезке и разделке туши больного чумой верблюда и других животных, обработке мяса в процессе приготовления пищи, употреблявших в пищу мясо больных чумой животных;
- лиц, совершивших аварию с разбрызгиванием заразного материала при работе с возбудителем чумы.
Материал от больных, как правило, целесообразно брать сразу при поступлении в лечебное учреждение и спустя 3 дня после окончания специфического лечения антибиотиками с интервалами между очередными исследованиями 24 ч до получения 3 отрицательных результатов. Материал от лиц, контактировавших с больными или контаминированными объектами - при поступлении в изолятор и по окончании профилактического лечения, перед выпиской.
Исследованию подлежит: при легочной форме чумы - мокрота, при ее отсутствии - мазок из зева, кровь из вены, моча; при септической форме - кровь, моча; при бубонной форме - пунктат бубона, кровь, моча; при кожной форме - отделяемое язвы, кровь, моча; при кишечной форме - кал, кровь, моча; при менингиальных явлениях - спинномозговая жидкость.
У лиц, контактировавших с больным легочной формой чумы, а также в других случаях, если есть подозрение, что заражение произошло аэрогенным путем, исследуют мазок из зева. В остальных случаях у контактных исследования не проводят.
Забор материала на исследование у больных с подозрением на чуму следует, как правило, проводить в условиях стационара до начала специфического лечения обученным квалифицированным медицинским персоналом под наблюдением специалиста противочумного учреждения или специалиста по особо опасным инфекциям ЦГСЭН. В случае невозможности забрать материал в первые 2 ч после возникновения подозрения, лечение начинают по клиническим показаниям до забора материала.
Забор материала у лиц, контактировавших с больными чумой и совершивших аварию, производят в изоляторе до начала профилактического лечения.
Исследование материала проводят специалисты территориальных противочумных учреждений на своей базе, а также на базе лабораторий отделов особо опасных инфекций центров госсанэпиднадзора областей, краев, республик, если они соответствуют требованиям действующих "Санитарных правил безопасности работы с микроорганизмами I-II групп патогенности". Специалисты отделов особо опасных инфекций проводят исследование обеззараженного материала экспресс-методами. Ведущим методом является люминесцентно-серологический. Определение антигена у больного возможно только при осложненной клинике в спинномозговой жидкости, в пунктате бубона - при тяжелом течении болезни, в моче - при всех формах болезни, начиная с 3-4 дня заболевания в низких титрах.
Методы забора материала - в прилож.8.
Запрещается давать окончательный (отрицательный или положительный) ответ на основании результатов экспресс-методов.
Исследование материала от больного чумой.
I этап:
- приготовление мазков, окраска фиксированных мазков анилиновыми красителями, чумными флюоресцирующими иммуноглобулинами;
- полимеразная цепная реакция;
- посев на жидкие и плотные питательные среды со стимуляторами роста чумного микроба (кровь, моча, спинномозговая жидкость, пунктат бубона);
- посев на плотные питательные среды со стимулятором роста чумного микроба и ингибиторами посторонней флоры (мокрота, мазок из зева, субстрат из вскрывшегося бубона, отделяемое язвы, моча, испражнения);
- проба с диагностическими бактериофагами нативного материала на соответствующей плотной среде;
- проба на чувствительность к антибиотикам с нативным материалом на плотной среде методом дисков;
- поиск антигена FI иммуносуспензионными методами: реакция непрямой гемагглютинации, реакция нейтрализации антител, иммуноферментный анализ, дот-иммуноферментный анализ, радиоиммунный анализ (моча, спинномозговая жидкость, пунктат бубона); параллельно в качестве контроля ставят те же реакции с диагностикумами на другие инфекции (туляремия, бруцеллез, холера и др.);
- заражение лабораторных животных (морские свинки, белые мыши) внутрибрюшинно и подкожно (кровь, пунктат бубона, спинномозговая жидкость), подкожно и накожно (мокрота, мазок из зева, вскрывшийся бубон, отделяемое язвы, моча, испражнения).
II этап (2-5 ч от начала исследования):
- выдача предварительного положительного ответа на основании наличия в мазках биополярно окрашенных грамотрицательных овоидных палочек, их специфического свечения при окраске мазка флюоресцирующими чумными иммуноглобулинами, положительной ПЦР, положительных иммуносуспензионных реакций при отрицательных контролях.
III этап (24-48 ч):
- выдача подтверждения предварительного положительного ответа на основании наличия характерного роста на жидких и плотных питательных средах, наличия в мазках из этих сред грамотрицательных овоидных палочек с биполярным окрашиванием, положительной пробой с бактериофагами (лизис культуры чумными бактериофагами Покровской и Л-413С).
Высев культуры для дальнейшей идентификации на питательный агар и агар с содержанием дефибринированной крови (5%) для определения продукции FI после инкубации при 37 °С. Одновременно выдача предварительного ответа о чувствительности выделенной культуры к антибиотикам. Посев культуры на среды Гисса с рамнозой, глицерином, сахарозой, на среду Тимофеевой, среду Ленской для определения уреазной активности (после накопления чистой культуры).
IV этап (3-7-е сутки):
- выдача окончательного положительного ответа на основании выделения чистой культуры чумного микроба из посевов нативного материала, его идентификации по морфологическим, культуральным, биохимическим признакам, чувствительности к диагностическим бактериофагам, наличию специфических плазмид, а также на основании подтверждения диагноза выделением идентичных культур от павших или забитых лабораторных животных.
V этап (5-8-е сутки):
- выдача отрицательного ответа на основании отсутствия специфического роста на питательных средах при посеве нативного материала и органов забитых биопробных животных, отрицательной ПЦР, отрицательных иммуносуспензионных реакций с нативным материалом и органами забитых или павших биологических проб, отсутствия патологоанатомических изменений у последних, отсутствия в парных сыворотках больного специфических антител к чумному микробу.
Исследование материала от лиц, контактировавших с больными легочной формой чумы, а также лиц, присутствовавших при аварии с разбрызгиванием заразного материала.
Исследуемый материал - мазок из зева.
I этап:
- приготовление мазков, окраска анилиновыми красителями, флюоресцирующими чумными иммуноглобулинами;
- полимеразная цепная реакция;
- посев на плотные селективные среды;
- заражение лабораторных животных подкожно и накожно.
II этап (2-5 ч):
- выдача предварительного положительного ответа на основании обнаружения специфически светящихся клеток в люминесцентном микроскопе, положительной ПЦР.
III этап (48 ч):
- выдача подтверждения предварительного положительного ответа на основании наличия характерных по морфологии колоний в посевах на плотной среде;
- пересев колоний на питательный слабощелочной агар, на селективный агар и на агар с кровью для дальнейшей идентификации (последний посев ставят в термостат с 37 °С для последующего определения FI);
- при достаточном количестве колоний постановка пробы на чувствительность с диагностическими бактериофагами на плотной среде и пробы на чувствительность к антибиотикам методом дисков.
IV этап (3-4-е сутки):
- выдача положительного ответа на основании выделения типичной по морфологии культуры, лизирующейся диагностическими бактериофагами;
- выдача ответа о результатах положительных иммуносуспензионных реакций на наличие антигена FI;
- дальнейшая идентификация выделенной культуры.
V этап (5-8-е сутки):
- вскрытие забитых биопроб, их исследование бактериологически и серологически;
- выдача окончательного положительного ответа на основании выделения и идентификации культуры чумного микроба, типичной по морфологическим, культуральным, биохимическим свойствам, фаголизабельности, наличию специфических плазмид, подтверждения диагноза выделением идентичной культуры от павших или забитых биопробных животных (схема идентификации выделенных культур - в прилож.9);
- выдача отрицательного ответа на основании отсутствия специфически светящихся клеток в мазках, окрашенных люминесцирующими чумными иммуноглобулинами, отрицательной ПЦР, отсутствия роста характерных по морфологии колоний на плотной среде, отсутствия характерных для чумы изменений в органах у биопробных животных и отсутствия специфического роста на плотной среде из посевов отпечатков их органов.
Исследование материала от трупа человека, погибшего от чумы.
Исследованию подлежат: кусочки паренхиматозных органов, легких из мест, где есть характерные для чумы изменения, лимфатические узлы как регионарные к первичному аффекту, так и другие, увеличенные и имеющие изменения, сгустки крови из сердца и крупных сосудов, сыворотка крови, полученная из сгустков при их сокращении, участки любой ткани, имеющие изменения септического характера, спинномозговая жидкость, моча, содержимое кишечника, в случае наличия признаков загнивания трупа исследуют спинной и головной мозг.
Исследования ведут по этапам, как исследование материала от больного чумой человека.
Положительный предварительный диагноз может быть поставлен на любом этапе, т.к. при гибели от чумы все органы и ткани содержат большое количество возбудителя и его антигенов, в т.ч. FI. Поэтому весьма вероятен первый положительный ответ уже через 2 ч после исследования на основании наличия грамотрицательных биполярно окрашенных палочек, специфически светящихся в люминесцентном микроскопе при обработке мазков-отпечатков флюоресцирующим чумным иммуноглобулином, положительной ПЦР, высокого титра антигена FI в тканях и органах, наличия противочумных антител в сыворотке.
Высокая вероятность подтверждения диагноза через 24-48 ч после начала исследования на основании обнаружения типичных по морфологии колоний чумного микроба, положительной пробы с бактериофагом, которую следует ставить на селективном агаре во избежание зарастания пятна лизиса культуры посторонней флорой и ошибочного отрицательного ответа.
Окончательный положительный ответ может быть поставлен через 48 ч - 6 сут. по результатам идентификации культуры чумного микроба и подтверждения ее выделением идентичной культуры от биопробного животного.
Окончательный отрицательный диагноз дают на 5-8-е сутки, как и при исследовании материала от больного.
Запрещается выдавать отрицательный ответ по результатам ускоренного исследования и на основании результатов экспресс-методов.
10. Организация контроля
Контроль за выполнением требований настоящих указаний должны осуществлять:
- Противочумный центр Министерства здравоохранения Российской Федерации - на всех противочумных станциях;
- противочумные научно-исследовательские институты - на курируемых противочумных станциях;
- комиссии Министерства здравоохранения Российской Федерации, создаваемые из высококвалифицированных специалистов противочумных и других учреждений санитарно-эпидемиологического профиля - во всех противочумных учреждениях страны, центрах госсанэпиднадзора и лечебно-профилактических учреждениях.
Результаты контроля должны быть отражены в аналитической справке с указанием выявленных нарушений при выполнении настоящих методических указаний и предложений по их устранению.
Библиографический список
1. Руководство по профилактике чумы. - Саратов, 1992.
2. Методические рекомендации по паспортизации природных очагов чумы. - М., 1976.
3. Оценка информативности методов диагностики при эпизоотологическом обследовании природных очагов чумы: Методические рекомендации. - М., 1995.
4. Методические рекомендации по полевой дератизации и дезинсекции в очагах чумы сусликового типа Российской Федерации. - Саратов, 1995.
5. Методические рекомендации по истреблению мелких млекопитающих на сенопунктах, расположенных на энзоотичной по чуме территории. - Саратов, 1985.
6. Диагностика возбудителей опасных инфекционных болезней. - Саратов, 1998.
7. Инструктивно-методические материалы по применению серологических методов диагностики при эпизоотологическом обследовании природных очагов чумы. - М., 1983.
8. Программа расчета величины эпидемического потенциала природного очага чумы (N гос. регистрации 2000610423).
9. Методическое руководство по борьбе с чумой у верблюдов. - Саратов, 1963.
10. Чума (Руководство для практических медработников). - Алма-Ата, 1992.
11. Организация и проведение первичных мероприятий в случаях выявления больного (трупа), подозрительного на заболевание карантинными инфекциями, контагиозными вирусными геморрагическими лихорадками, малярией и инфекционными болезнями неясной этиологии, имеющими важное международное значение: МУ 3.4.1028-01.
12. Временные методические рекомендации по лабораторной диагностике чумы у людей. - М., 1999.
Приложение 1
(рекомендуемое)
Схема комплексного плана противочумных мероприятий для территорий,
расположенных в природных очагах чумы
|
N |
Наименование мероприятий |
Срок исполнения |
Ответственные лица | |
|
1 |
2 |
3 |
4 | |
|
1. Организационные мероприятия | ||||
|
1.1 |
Определить и утвердить персональный состав санитарно-противоэпидемической комиссии |
Январь календарного года |
Глава администрации территории | |
|
1.2 |
Определить и утвердить персональный состав медицинского (противоэпидемического) штаба |
Январь календарного года |
Глава Департамента здравоохранения | |
|
1.3 |
Обеспечить поступление оперативной информации. Составить и утвердить схему экстренного оповещения |
Немедленно при выявлении больного, регистрация эпизоотических проявлений |
Главы Департамента здравоохранения | |
|
1.4 |
Разработать (откорректировать) оперативные планы первичных противоэпидемических мероприятий на случай выявления больного на СКО, СКП, ПСКП, лечебно-профилактических учреждениях |
Ежегодно |
Руководители учреждений здравоохранения и госсанэпиднадзора | |
|
1.5 |
Определить медицинские учреждения для перепрофилирования на случай выявления больного чумой под специализированные провизорные госпитали, изоляторы, обсерваторы, лаборатории, провести их паспортизацию |
Ежегодно |
Главы Департаментов здравоохранения | |
|
1.6 |
Определить санитарные стоянки в аэропортах и автодорожных магистралях, санитарные тупики на железных дорогах, санитарные причалы в морских и речных портах и обеспечить их всем необходимым для своевременного проведения противоэпидемических мероприятий при выявлении больного чумой на транспортных средствах |
Постоянно |
Администрация аэропортов, пассажирского автотранспорта, железнодорожного транспорта, морских и речных портов | |
|
1.7 |
Определить персональный состав консультативных групп, порядок их оповещения и сбора |
Постоянно |
Руководители opганов управления здравоохранением, госсанэпиднадзора | |
|
1.8 |
Экстренно направлять информацию о выявлении эпизоотии чумы в природных очагах в территориальные ЦГСЭН, органы управления здравоохранением и ЦГСЭН соседних областей |
Немедленно по мере выявления |
Начальники ПЧС | |
|
1.9 |
Определить республиканский (краевой, областной, городской) резерв медицинского персонала для работы в госпиталях, изоляторах, лабораториях |
Ежегодно |
Руководители органов управления здравоохранением | |
|
1.10 |
Проверить готовность к работе в очаге чумы органов и учреждений здравоохранения, ЦГСЭН |
В соответствии с планом проверки готовности |
Руководители органов управления здравоохранением | |
|
1.11 |
Создать резерв необходимого количества медикаментов, оборудования, аппаратуры, имущества, питательных сред, химреактивов, диагностических и профилактических препаратов, дезинфицирующих средств в соответствии с мощностью планируемых к развертыванию госпитальной и лабораторной базы |
Постоянно |
Руководители органов управления здравоохранением | |
|
2. Подготовка медицинских и немедицинских кадров | ||||
|
2.1 |
Проводить специальную подготовку эпидемиологов и медицинского персонала (поликлинической и госпитальной базы, лабораторий, СКП, СКО, ЦГСЭН, "станций скорой помощи") на семинарских занятиях, тренировочных учениях с вводом условного больного чумой |
В соответс- твии с планом подготовки кадров, повторно при выявлении эпизоотии чумы |
Главные врачи ЛПУ | |
|
2.2 |
Проводить теоретическую и практическую подготовку по симптоматике чумы, действиям в случае выявления заболеваний и проведению первичных противоэпидемических мероприятий, санитарных уполномоченных, сотрудников ГИБДД, сотрудников КПП, таможенной службы, лиц, занимающихся охотопромыслом, пограничников |
Ежегодно, повторно при выявлении эпизоотии |
Руководители ПЧУ | |
|
2.3 |
Проводить специальную теоретическую подготовку ветеринарных работников по вопросам клиники, диагностики и профилактики чумы у верблюдов |
Ежегодно, повторно при выявлении эпизоотии |
Врачи ПЧУ | |
|
2.4 |
Проводить информационно-разъяснительную работу с населением по вопросам клиники и профилактики чумы |
Постоянно |
Руководители ПЧУ | |
|
3. Профилактические мероприятия | ||||
|
3.1 |
Проводить медицинское наблюдение за населением, проживающим на энзоотичной территории |
Постоянно |
Главные врачи ЛПУ | |
|
3.2 |
Своевременно выявлять больных с сигнальными признаками чумы на всех этапах оказания медицинской помощи населению |
Постоянно |
Главные врачи ЛПУ | |
|
3.3 |
Осуществлять оценку качества медицинского наблюдения за населением на основе ретроспективного анализа сезонной заболеваемости лимфаденитами, пневмониями, острыми лихорадочными заболеваниями |
Весной и осенью |
Руководители ПЧУ | |
|
3.4 |
Проводить эпизоотологическое обследование энзоотичных по чуме территорий с целью своевременного выявления эпизоотии чумы |
В течение всего года |
Начальники противочумных станций | |
|
3.5 |
Проводить определение видового состава, численности носителей, переносчиков чумы в природных очагах |
Постоянно |
Руководители ПЧУ | |
|
3.6 |
При выявлении эпизоотии чумы определить ее границы |
По мере выявления |
Руководители ПЧУ | |
|
3.7 |
Проводить дератизацию и дезинсекцию в населенных пунктах, находящихся в зоне эпизоотии |
Сразу же после выявления эпизоотии |
Руководители ПЧУ | |
|
3.8 |
Провести вакцинацию против чумы населения, проживающего в зоне эпизоотии |
После выявления эпизоотии |
Главные врачи ЛПУ | |
|
3.9 |
Осуществлять медицинское наблюдение за населением, проживающим в зоне эпизоотии, не реже 1 раза в 3 дня |
После выявления эпизоотии |
Главные врачи ЛПУ | |
|
3.10 |
Запретить проведение охотопромысла в зоне эпизоотии |
После выявления эпизоотии |
Главы администрации территории | |
|
3.11 |
Установить постоянное ветеринарное наблюдение за верблюдами |
Постоянно |
Главные ветеринарные врачи | |
|
3.12 |
Запретить вывоз животных за пределы пораженной территории |
При выявлении эпизоотии |
Главы администрации территории | |
|
3.13 |
Осуществлять периодическую обработку шерсти домашних животных инсектицидными препаратами 1 раз в 7-10 дней |
При выявлении эпизоотии |
Главы администрации территории | |
|
3.14 |
Проводить информационно-разъяснительную работу среди населения по мерам личной и общественной безопасности в отношении чумы |
Постоянно в соответствии с планом |
Главные врачи ЦГСЭН | |
|
4. Противоэпидемические мероприятия | ||||
|
4.1 |
Обеспечить оперативную информацию о выявлении заболевания с подозрением на чуму и принятых первоочередных противоэпидемических мерах |
Немедленно при выявлении больного |
Главные врачи ЛПУ | |
|
4.2 |
Обеспечить вызов консультантов для уточнения диагноза и взятия материала для лабораторного исследования |
Немедленно при выявлении больного |
Главные врачи ЛПУ | |
|
4.3 |
Начать работу территориальных СПК и медицинского штаба по локализации и ликвидации возникшего очага |
Немедленно при выявлении больного |
Главы администрации | |
|
4.4 |
Обеспечить биологическую безопасность работы в специализированных учреждениях (госпитали, изоляторы, лаборатории, морги, эвакотранспорт, дезбригады) |
Немедленно |
Руководители органов управления здравоохранением | |
|
4.5 |
Провести эпидемиологическое обследование в очагах чумы |
Немедленно |
Руководители ПЧУ | |
|
4.6 |
Составить списки лиц, соприкасавшихся с больными, обеспечить их изоляцию и подвергнуть их экстренной профилактике |
Немедленно |
Руководители органов управления здравоохранением | |
|
4.7 |
Обеспечить активное выявление и госпитализацию больных, подозрительных на заболевания чумой, в провизорный госпиталь. Проводить подворные (поквартирные) обходы |
Немедленно, после выявления больного (трупа) |
Руководители органов здравоохранения | |
|
4.8 |
Обеспечить выявление умерших от неизвестных причин, патологоанатомическое вскрытие трупов, взятие материала на лабораторное исследование, обеззараживание, правильное транспортирование, захоронение |
По показаниям |
Руководители органов здравоохранения | |
|
4.9 |
Проводить заключительную дезинфекцию (дезинсекцию) в эпидемических очагах |
При выявлении больного |
Главные врачи ЦГСЭН | |
|
4.10 |
Провести вакцинацию населения очага |
После локализации очага (вспышки) |
Главные врачи ЛПУ | |
|
4.11 |
Обеспечить своевременное финансирование проводимых мероприятий, создание резерва специалистов, транспорта, лечебных препаратов, дезинфектантов, инсектицидов |
По показаниям |
Главы администрации территории | |
|
4.12 |
Провести экстренную профилактику антибиотиками отдельных контингентов населения |
По показаниям |
Руководители органов управления здравоохранением | |
|
4.13 |
Обеспечить бесплатную выдачу дезинфицирующих (инсектицидных) средств населению |
Во время локализации |
Руководители органов управления здравоохранением | |
|
4.14 |
Провести зоолого-паразитологическое обследование в населенном пункте и вне его |
Немедленно |
Руководители ПЧУ | |
|
4.15 |
Провести дератизацию и дезинсекцию в населенном пункте |
Немедленно |
Руководители ПЧУ | |
|
4.16 |
Установить ветеринарное наблюдение за верблюдами |
Немедленно при их наличии |
Органы ветеринарного надзора | |
|
4.17 |
Ввести ограничительные мероприятия (при необходимости карантин). Обеспечить вооруженную охрану госпиталей, изоляторов, обсерваторов, лабораторий, моргов |
Во время локализации и ликвидации очага |
Главы администрации | |
|
4.18 |
Усилить санитарный надзор за предприятиями общественного питания, торговли, рынками, вокзалами |
Во время локализации и ликвидации очага |
Главные врачи ЦГСЭН | |
|
4.19 |
Усилить информационно-разъяснительную работу с населением |
По показаниям |
Руководители органов управления здравоохранением | |
К комплексному плану прилагаются следующие документы.
1. План развертывания госпитальной и лабораторной баз.
2. План обеспечения учреждений госпитальной базы консультантами.
3. Расчет антибактериальных препаратов для лечения больного чумой.
4. План организации противоэпидемической службы.
5. План обеспечения города, населенного пункта медицинскими бригадами для проведения подворных обходов.
6. План обеспечения города, населенного пункта бригадами для иммунизации против чумы.
7. План обеспечения бригад эвакуации, дезинфекции и дезинсекции кадрами, оборудованием, санитарно-хозяйственным имуществом, дезсредствами и защитной одеждой.
8. Расчет обеспечения учреждений лабораторной базы питательными средами, диагностическими препаратами, дезсредствами и лабораторными животными на 1 месяц работы.
9. План обеспечения зоологических и дератизационных бригад области кадрами, санитарным имуществом, оборудованием, средствами защиты и ядохимикатами.
10. План обеспечения мероприятий автомобильным транспортом.
Приложение 2
(обязательное)
Перечень противочумных станций, курируемых научно-исследовательскими
противочумными институтами для оказания научно-методической и практической
помощи по вопросам профилактики чумы и других особо опасных инфекций
|
Противочумные институты |
Курируемые ПЧС |
Обслуживаемые природные |
|
Российский научно-исследовательский противочумный институт "Микроб" |
Астраханская противочумная станция |
Волго-Уральский степной |
|
|
Элистинская противочумная станция |
Прикаспийский Северо-Западный степной |
|
Ставропольский научно-исследовательский противочумный институт |
Дагестанская противочумная станция |
Дагестанский равнинно-предгорный |
|
|
Кабардино-Балкарская противочумная станция |
Центрально-Кавказский высокогорный |
|
|
Причерноморская противочумная станция |
- |
|
Иркутский научно-исследовательский противочумный институт Сибири и Дальнего Востока |
Читинская противочумная станция |
Забайкальский степной |
|
|
Алтайская противочумная станция |
Горно-Алтайский высокогорный |
|
|
Тувинская противочумная станция |
Тувинский горный |
Приложение 4
(рекомендуемое)
Дифференциация территории природных очагов чумы Российской Федерации
по уровню эпидемической опасности (картограммы 4.1-4.7)
Условные обозначения к картограммам 4.1-4.7
Секторы с различным уровнем эпидемической опасности по чуме:
 - 1;
- 1;  - 2;
- 2;  - 3;
- 3;  - 4;
- 4;  - 5
- 5
|
1 - очень низкий |
эпизоотических и эпидемических проявлений не отмечалось, плотность населения до 1 чел. на 1 км |
|
2 - низкий |
эпизоотии чумы отмечались в течение 1 эпизоотического цикла, плотность населения до 1 чел. на 1 км |
|
3 - средний |
эпизоотии чумы отмечались 2 и более раз в разные эпизоотические циклы, плотность населения до 1 чел. на 1 км |
|
эпизоотии чумы отмечались в течение 1 эпизоотического цикла, плотность населения более 1 чел. на 1 км | |
|
4 - высокий |
эпидемии и эпизоотии чумы отмечались, плотность населения до 1 чел. на 1 км |
|
эпизоотии чумы отмечались 2 и более раз в разные эпизоотические циклы, плотность населения более 1 чел. на 1 км | |
|
5 - очень высокий |
эпидемии и эпизоотиии чумы отмечались, плотность населения более 1 чел. на 1 км |

Картограмма 4.1.
Центрально-Кавказский высокогорный, Терско-Сунженский низкогорный,
Дагестанский равнинно-предгорный, Восточно-Кавказский высокогорный очаги чумы.
Приложение 5
(обязательное)
Регламент эпизоотологического обследования участков природных очагов чумы
с различным уровнем эпидемической опасности
|
Природный очаг чумы и его шифр |
Сезон и продолжи- |
Уровень эпидеми- |
Минимальные плотность и объем обследования |
Подразделе- |
Объекты, исследуемые различными лабораторными методами | |||
|
месяцы |
число дней |
проб на 1 сектор |
сумма проб |
бактерио- |
сероло- | |||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Центрально- |
Апрель- |
25-30 |
Высокий (14) |
2,0 |
28 |
Стационарные лаборатории и эпидотряды |
Носители и переносчики |
- |
|
Средний и низкий (29) |
0,5 |
15 |
" |
" |
- | |||
|
Июль- |
40-60 |
Высокий (14) |
2,0 |
28 |
" |
" |
Носи- | |
|
Средний и низкий (29) |
1,0 |
29 |
" |
" |
" | |||
|
1 раз в 2-3 года |
Очень низкий (6) |
Визуально-рекогносцировочное обследование | ||||||
|
Терско- |
Апрель- |
25-30 |
Высокий и средний (4) |
2,0 |
8 |
Эпидотряд |
Носители и переносчики |
Носите- |
|
Низкий (19) |
1,0 |
19 |
" |
" |
" | |||
|
1 раз в 2-3 года |
Очень низкий (5) |
Визуально-рекогносцировочное обследование | ||||||
|
Дагестанский равнинно- |
Апрель- |
35-45 |
Высокий и средний (18) |
2,0 |
36 |
Стационарные лаборатории |
Носители и переносчики |
Носите- |
|
Низкий (56) |
0,5 |
28 |
" |
" |
" | |||
|
Сентябрь- |
15-20 |
Высокий и средний (18) |
1,0 |
18 |
" |
" |
" | |
|
1 раз в 2 -3 года |
Очень низкий (64) |
Визуально-рекогносцировочное обследование | ||||||
|
Прикаспийский Северо- |
Апрель- |
35-45 |
Очень высокий и высокий (48) |
2,0 |
96 |
Стационарные лаборатории и эпидотряды |
Носители и переносчики |
Носи- |
|
Средний и низкий (253) |
1,0 |
253 |
" |
" |
" | |||
|
Октябрь- |
15-20 |
Очень высокий и высокий (48) |
0,5 |
24 |
Стационарные лаборатории |
" |
" | |
|
Средний и низкий (253) |
0,25 |
64 |
" |
" |
" | |||
|
1 раз в 2-3 года |
Очень низкий (474) |
Визуально-рекогносцировочное обследование | ||||||
|
Волго- |
Апрель- |
35-45 |
Очень высокий и высокий (8) |
2,0 |
16 |
Стационарные лаборатории и эпидотряды |
Носители и переносчики |
Носи- |
|
Средний и низкий (29) |
1,0 |
29 |
" |
" |
" | |||
|
Октябрь- |
15-20 |
Очень высокий и высокий (8) |
0,5 |
4 |
Стационарные лаборатории |
" |
" | |
|
Средний и низкий (29) |
0,25 |
8 |
" |
" |
" | |||
|
1 раз в 2-3 года |
Очень низкий (363) |
Визуально-рекогносцировочное обследование | ||||||
|
Тувинский горный (37) |
Май- |
15-20 |
Средний (12) |
1,0 |
12 |
Стационарные лаборатории и эпидотряды |
Носители и переносчики |
Носи- |
|
Низкий (50) |
0,25 |
13 |
" |
" |
" | |||
|
Июль- |
25-30 |
Средний (12) |
2,0 |
24 |
" |
" |
" | |
|
Низкий (50) |
0,5 |
25 |
" |
" |
" | |||
|
1 раз в 2-3 года |
Очень низкий (31) |
Визуально-рекогносцировочное обследование | ||||||
|
Забайкальский степной (38) |
Май |
15-20 |
Высокий и средний (26) |
0,5 |
13 |
Стационарные лаборатории |
- |
Носи- |
|
Низкий (30) |
0,25 |
8 |
" |
- |
" | |||
|
Июль- |
35-45 |
Высокий и средний (26) |
1,0 |
26 |
" |
Носители и переносчики |
" | |
|
Низкий (30) |
0,5 |
15 |
" |
" |
" | |||
|
1 раз в 2-3 года |
Очень низкий (183) |
Визуально-рекогносцировочное обследование | ||||||
|
Волго- |
Апрель- |
30-40 |
Очень высокий и высокий (8) |
2,0 |
16 |
Стационарные лаборатории и эпидотряды |
Носители и переносчики |
Носи- |
|
Средний и низкий (58) |
1,0 |
58 |
" |
" |
" | |||
|
Октябрь- |
20-30 |
Очень высокий и высокий (8) |
2,0 |
16 |
" |
" |
" | |
|
Средний и низкий (58) |
0,5 |
29 |
" |
" |
" | |||
|
1 раз в 2-3 года |
Очень низкий (54) |
Визуально-рекогносцировочное обследование | ||||||
|
Прикаспийский песчаный (43) |
Апрель- |
30-40 |
Очень высокий и высокий (11) |
2,0 |
22 |
Стационарные лаборатории и эпидотряды |
Носители и переносчики |
Носите- |
|
|
Средний и низкий (334) |
0,5 |
167 |
" |
" |
" | ||
|
Октябрь- |
30-40 |
Очень высокий и высокий (11) |
2,0 |
22 |
" |
" |
" | |
|
|
Средний и низкий (334) |
0,5 |
167 |
" |
" |
" | ||
|
1 раз в 2-3 года |
Очень низкий (480) |
Визуально-рекогносцировочное обследование | ||||||
|
Восточно- |
Май- |
25-30 |
Средний (3) |
2,0 |
6 |
Стационарные лаборатории |
Носители и переносчики |
Носите- |
|
Низкий (93) |
0,25 |
24 |
" |
" |
" | |||
|
Август |
25-30 |
Средний (3) |
3,0 |
9 |
Эпидотряды |
" |
" | |
|
|
Низкий (93) |
0,33 |
31 |
" |
" |
" | ||
|
1 раз в 2-3 года |
Очень низкий (169) |
Визуально-рекогносцировочное обследование | ||||||
|
Горно- |
Май-июнь |
15-20 |
Средний (11) |
1,0 |
11 |
Стационарные лаборатории и эпидотряды |
Носители и переносчики |
Носите- |
|
Низкий (21) |
0,5 |
11 |
" |
" |
" | |||
|
Сентябрь- |
25-30 |
Средний (11) |
2,0 |
22 |
" |
" |
" | |
|
|
Низкий (21) |
1,0 |
21 |
" |
" |
" | ||
|
1 раз в 2-3 года |
Очень низкий (121) |
Визуально-рекогносцировочное обследование | ||||||
Приложение 6
(рекомендуемое)
Укладка для забора материала от больного (трупа), подозрительного
на заболевание чумой, холерой, малярией, вирусной геморрагической
лихорадкой, сибирской язвой
|
1. |
Банка широкогорлая с крышкой или притертой пробкой емкостью не менее 200 мл (стерильная) |
4 шт. |
Дополни- |
|
2. |
Стакан стеклянный |
2 шт. |
|
|
3. |
Пробирка бактериологическая (стерильная) |
5 шт. |
|
|
4. |
Пробирка с ватным тампоном для взятия мазков из зева (стерильная) |
2 шт. |
|
|
5. |
Пробки резиновые N 12, 14 (для пробирок, флаконов) |
10 шт. |
|
|
6. |
Пипетка пастеровская с длинным концом (стерильная) |
10 шт. |
|
|
7. |
Груша резиновая с шлангом |
1 шт. |
|
|
8. |
Пинцет анатомический |
1 шт. |
|
|
9. |
Ножницы |
1 шт. |
|
|
10. |
Скальпель |
1 шт. |
|
|
11. |
Шпатель деревянный (металлический) (стерильный) |
2 шт. |
|
|
12. |
Стекло предметное обезжиренное |
50 шт. |
|
|
13. |
Чашка Петри разовая |
10 шт. |
|
|
14. |
Штатив складной из 6 гнезд |
1 шт. |
|
|
15. |
Шприц 5 мл разовый |
2 шт. |
|
|
16. |
Шприц 10 мл разовый |
1 шт. |
|
|
17. |
Иглы к шприцам с широким просветом |
10 шт. |
|
|
18. |
Жгут резиновый |
1 шт. |
|
|
19. |
Емкость для фиксатора |
1 шт. |
|
|
20. |
Пенал металлический для пробирок |
1 шт. |
|
|
21. |
Полиэтиленовый пакет |
5 шт. |
|
|
22. |
Спирт ректификат 96° |
250 мл |
|
|
23. |
Раствор йода 5%-ный по 1,0 мл в ампулах |
2 шт. |
|
|
24. |
Спиртовка |
1 шт. |
|
|
25. |
Спички |
1 кор. |
|
|
26. |
Коробка стерилизационная (среднего размера) |
1 шт. |
|
|
27. |
Вата (500,0) |
1 пачка |
|
|
28. |
Марля |
1 м |
|
|
29. |
Тампоны ватные, марлевые (стерильные) |
30 шт. |
|
|
30. |
Клеенка медицинская подкладная |
1 м |
|
|
31. |
Нитки суровые или лигатура |
0,5 м |
|
|
32. |
Пластилин |
15 г |
|
|
33. |
Лейкопластырь |
1 уп. |
|
|
34. |
Карандаш по стеклу (стеклограф) |
1 шт. |
|
|
35. |
Вода дистиллированная в ампулах по 5 мл |
2 шт. |
|
|
36. |
Раствор NaCl 0,9%-ный в ампулах по 5 мл |
3 шт. |
|
|
37. |
Бланк направления |
10 шт. |
|
|
38. |
Блокнот, простой карандаш |
1+1 |
|
|
39. |
Бумага писчая |
10 листов |
|
|
40. |
Бумага копировальная |
2 листа |
|
|
41. |
Инструкции по забору материала на все указанные в заголовке инфекции |
1 экз. |
|
|
42. |
Бикс или металлический ящик для доставки проб в лабораторию |
1 шт. |
|
|
43. |
Хлорамин в пакете по 300 г, рассчитанный на получение 10 л 3%-ного раствора, или другое дезинфицирующее средство, разрешенное к применению Департаментом ГСЭН Минздрава России |
1 пакет |
|
|
44. |
Сухая хлорная известь в пакете из расчета по 200 г на 1 кг выделений |
1 кг |
|
|
45. |
Пергидроль (на 10 л дезраствора) |
1 л |
|
|
46. |
Емкость из темного стекла 1 л |
3 шт. |
|
|
47. |
Навеска детергента (5 г на 1 л дезраствора) |
10 шт. |
|
|
48. |
Емкость эмалированная 10 л |
1 шт. |
|
|
49. |
Контейнер для транспортировки материала в обычном или сухом льду |
1 шт. |
|
|
50. |
Перчатки резиновые |
2 пары |
|
|
51. |
Противочумный костюм I типа |
2 комп. |
|
|
52. |
Мешок из клеенки (для упаковки использованной защитной одежды) |
2 шт. |
|
|
53. |
Емкость для обработки рук (кристаллизатор) |
2 шт. |
|
|
54. |
Стекла предметные с шлифованными краями |
3 шт. |
малярии |
|
55. |
Перья-скарификаторы для взятия крови (стерильные) |
3 шт. |
малярии |
|
56. |
Флакон инсулиновый с пробкой (стерильный) |
4 шт. |
геморрагической лихорадки |
|
57. |
Флакон пенициллиновый с пробкой (стерильный) |
4 шт. |
геморрагической лихорадки |
|
58. |
Контейнер металлический с завинчивающейся крышкой, большой |
1 шт. |
геморрагической лихорадки |
|
59. |
Контейнер металлический с завинчивающейся крышкой, малый |
3 шт. |
геморрагической лихорадки |
|
60. |
Стеклянная трубка (стерильная) с резиновой грушей малого размера |
3 шт. |
холеры |
|
61. |
Петля алюминиевая (стерильная) |
10 шт. |
холеры |
|
62. |
Катетер резиновый (N 26 и 28) |
2 шт. |
холеры |
|
63. |
Пептонная вода 1%-ная во флаконах по 50 мл, закрытых резиновыми пробками, завальцованными металлическими колпачками |
4 шт. |
|
|
64. |
Бульон питательный (рН 7,2) по 5 мл в пробирках (стерильный) |
3 шт. |
чумы |
|
65. |
Бульон питательный (рН 7,2) во флаконе (стерильный) |
50 мл |
" |
|
66. |
Фартук клеенчатый |
2 шт. |
для вскрытия трупа |
|
67. |
Секционный набор |
1 комп. |
" |
|
68. |
Нарукавники |
2 пары |
" |
Примечания.
1. Срок годности стерильной посуды, инструментов и других материалов должен соответствовать Приказу МЗ СССР N 408 от 12.07.89 и ОСТ 42-21-2-86.
2. Питательные среды и дезинфицирующие средства должны заменяться по истечению срока годности.
3. Допускается замена дезинфицирующих средств на любые другие, разрешенные к применению для указанных целей Департаментом госсанэпиднадзора Минздрава России.
4. Перечисленные предметы и материалы могут быть упакованы в несколько укладок по усмотрению специалистов учреждения.
Приложение 7
(рекомендуемое)
Укладка для забора проб из объектов окружающей среды
1. Ящик тарный на 20 гнезд - 1 шт.
2. Ящик металлический для оборудования - 1 шт.
3. Бутылка 0,5 л с ватно-марлевой пробкой и бумажным колпачком - 20 шт.
4. Банки широкогорлые с крышками емкостью не менее 200 мл (стерильные) - 5 шт.
5. Ложки металлические или пластмассовые - 5 шт.
6. Мешочки бязевые для грызунов - 20 шт.
7. Пробирки с пробками (стерильные) - 10 шт.
8. Спирт 96° - 100 мл
9. Вата - 100 г
10. Карандаш по стеклу - 2 шт.
11. Карандаш простой - 1 шт.
12. Бумага писчая - 10 листов
13. Направления - 10 листов
14. Копировальная бумага - 5 листов
15. Перчатки резиновые - 2 пары
16. Халат медицинский с шапочкой - 2 шт.
17. Пинцет (мягкий паразитологический) - 1 шт.
18. Банка 0,5 л с матерчатыми салфетками (15 шт.) для обработки проб со сточными водами
19. Термометр до 50° - 1 шт.
20. Бумага индикаторная для определения рН (1-12) - 1 упаковка
21. Банка с притертой крышкой с ватными тампонами - 1 шт.
22. Батометр - 1 шт.
23. Шпагат-мотки по 5, 10 и 30 м.
24. Хлорамин в пакетах по 30 г, рассчитанных на получение 1 л 3%-ного раствора - 2 шт.
25. Перекись водорода (на 10 л дезинфицирующего раствора) - 1 л
26. Навеска моющего средства (5 г на 1 л раствора) - 10 шт.
27. Емкость из темного стекла 1 л - 3 шт.
28. Перчатки резиновые - 2 пары
29. Пакеты полиэтиленовые - 5 шт.
30. Отсадник металлический - 1 шт.
31. Корнцанг - 1 шт.
Примечания те же, что и к прилож.6.
Приложение 8
(рекомендуемое)
Правила забора материала от больного с подозрением на чуму
Пунктат из бубона (везикул, пустул, карбункулов) берут шприцем емкостью не менее 5 мл. Кожу на участке, намеченном для прокола, обрабатывают 70°-ным спиртом, а затем смазывают 5%-ным раствором йода и вновь протирают 70°-ным спиртом. Иглу вводят с таким расчетом, чтобы ее острие достигло центральной части бубона, после чего, оттянув до отказа поршень, медленно вытягивают иглу. Так как экссудат в чумном бубоне расположен между плотными тканями, количество его, попадающее в шприц, как правило, незначительно и часто заполняет только просвет иглы. После извлечения иглы из бубона через нее набирают в шприц 0,5 мл стерильного питательного бульона (рН 7,2), содержимое выливают в стерильную пробирку и закрывают стерильной резиновой пробкой. Бульон можно набрать в шприц и до начала пункции. В качестве метода, повышающего возможность выделения культуры чумного микроба, и в случае невозможности получить материал, в бубон вводят 0,3-0,5 мл стерильного изотонического раствора натрия хлорида или питательного бульона. При вскрывшемся бубоне забирают материал отдельно из периферической плотной части и отделяемое свища. Обе порции исследуют раздельно.
При кожных поражениях иглу шприца вводят у края везикулы (пустулы) и затем продвигают к середине. У карбункулов и язв пунктируют плотный край.
Мокроту собирают в широкогорлые банки с притертой пробкой. Слизь из зева берут стерильным ватным тампоном по общепринятой методике.
Кровь забирают из локтевой вены в количестве 10 мл разовым шприцем и в нем доставляют кровь в лабораторию.
У больных чумой с локализацией первичных бубонов в области головы и шеи дополнительно забирают на исследование слизистое отделяемое ротовой полости и глотки стерильным ватным тампоном.
Посуду со взятым материалом обрабатывают снаружи марлей, смоченной в дезрастворе, обертывают вощеной бумагой, помещают в металлический бикс, перекладывают ватой. Тару с упакованным материалом опечатывают, на крышке указывают "верх" и отправляют в лабораторию с нарочным на специально выделенном транспорте.
К каждой пробе прикладывают направление с указанием сведений о материале (Ф., И., О. больного, наименование пробы, дата и час забора материала), а также сопроводительный документ, в котором содержатся сведения о больном (Ф., И., О., предполагаемый диагноз, получал ли больной до взятия материала антибиотики, какие и в каком количестве, какой материал направляется на исследование).
Время от момента взятия материала до начала исследования не должно превышать 5-6 ч, если нет условий для его хранения на холоде.
Текст документа сверен по:
официальное издание
М.: Федеральный центр госсанэпиднадзора
Минздрава России, 2002