ГОСТ Р ИСО 10993.11-99*
_________________________________________
* В указателе "Национальные стандарты" 2007 г.
настоящий стандарт приводится
с номером ГОСТ Р ИСО 10993-11-99. -
Примечание изготовителя базы данных.
Группа Р20
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 11
Исследование общетоксического действия
Medical devices. Biological evaluation of medical devices.
Part 11. Tests for systemic to xicity
ОКС 01.140.20*
ОКСТУ 9403
____________________
* В указателе "Национальные стандарты" 2007 г.
ОКС 11.020. - Примечание изготовителя базы данных.
Дата введения 2002-01-01
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники (ВНИИИМТ)
ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. N 862-ст
3 Разделы настоящего стандарта, за исключением раздела 3 и приложения Б, представляют собой аутентичный текст международного стандарта ИСО 10993.11-93 "Оценка биологического действия медицинских изделий. Часть 11. Исследование общетоксического действия"
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Соблюдение положений стандартов серии ГОСТ Р ИСО 10993 "Оценка биологического действия медицинских изделий" позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление конкретных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие специальную подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты этой серии являются руководящими документами для прогнозирования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых образцов.
В стандарты серии ГОСТ Р ИСО 10993, имеющие групповой заголовок "Изделия медицинские. Оценка биологического действия медицинских изделий", входят следующие части:
- часть 1 - оценка и исследования;
- часть 3 - исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
- часть 4 - исследование изделий, взаимодействующих с кровью;
- часть 5 - исследование на цитотоксичность: методы in vitro;
- часть 6 - исследование местного действия после имплантации;
- часть 7 - остаточное содержание этиленоксида после стерилизации;
- часть 9 - основные принципы идентификации и количественного определения потенциальных продуктов деструкции;
- часть 10 - исследование раздражающего и сенсибилизирующего действия;
- часть 11 - исследование общетоксического действия;
- часть 12 - приготовление проб и стандартные образцы;
- часть 13 - идентификация и количественное определение продуктов деструкции полимерных медицинских изделий;
- часть 16 - моделирование и исследование токсикокинетики продуктов деструкции и вымывания.
Настоящий стандарт устанавливает методы оценки потенциального общетоксического действия медицинских изделий.
Методы исследования, указанные в стандарте, взяты из международных, региональных и национальных стандартов, директив и нормативов. Методики определения острой токсичности на белых мышах и исследований пирогенности, применяемые в России, приведены в приложении Б.
Допускается применение других методов, обеспечивающих оценку биологического действия медицинских изделий в соответствии с требованиями международных стандартов на продукцию конкретных видов.
1 Область применения
Настоящий стандарт устанавливает методы оценки потенциального общетоксического действия химических компонентов, мигрирующих в организм из медицинских изделий.
Настоящий стандарт распространяется на оценку конечного продукта и компонентов его вымывания. Исследования вытяжек из изделия или продуктов вымывания следует проводить с использованием модельной среды, которая обеспечивает максимальную экстракцию продуктов вымывания для дальнейшего биологического исследования.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р ИСО 10993.1-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Оценка и исследования
ГОСТ Р ИСО 10993.3-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Методы исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию
ИСО 10993-2-92* Оценка биологического действия медицинских изделий. Часть 2: Требования к защите животных
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Американский национальный институт стандартов/Американская ассоциация зубных врачей N 41 Оценка биологического действия стоматологических материалов*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Американское общество по испытаниям и материалам F 619:1986, Практическое руководство по экстракции из медицинских пластиков*, том 13.01
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Американское общество по испытаниям и материалам F 750: 1987, Практическое руководство по исследованию вытяжек из материалов на общую токсичность в инъекционном эксперименте на мышах*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Британский стандарт 5736: Часть 5: 1982* Оценка биологического риска, связанного с медицинскими изделиями. Часть 5: Метод исследования на общетоксическое действие; оценка вытяжек из медицинских изделий на пирогенность на кроликах
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Швейцарский стандарт 119800 Оценка биологического действия стоматологических материалов*, Швейцарская ассоциация по стандартизации
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Европейская фармакопея XXII, 1990*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
ОЭСР - Руководство по тестированию химических веществ*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Официальный журнал Европейского сообщества, 79/831*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Официальный журнал Европейского сообщества, 84/449*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Официальный журнал Европейского сообщества, 87/302*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Свод Федеральных нормативных документов США 1500.40: Метод тестирования токсических веществ*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
ЭПА США ПБ 86/108958*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
ЭПА США ПБ 89/124077*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
ФДА США Токсикологические принципы оценки безопасности пищевых добавок, 1982*
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
Фармакопея США XXII: Тесты на биологическую реактивность in vivo. The National Formulari XVII, Rockville, MD, Pharmacopeial Convention, 1990*, pp.1497-1500
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
3 Определения
В настоящем стандарте используют термины, приведенные в ГОСТ Р ИСО 10993.1, а также следующие определения:
3.1 модельная среда: Жидкость, которую используют для экстракции продуктов вымывания из изделия.
3.2 вытяжка: Жидкость, подвергающаяся изучению с целью выявления ее биологической реакции после того, как изделие подверглось в ней экстракции.
3.3 образец: Изделие или его часть, подвергаемые исследованию.
3.4 холостой контроль: Модельная среда, не содержащая образец, используемая в исследовании для сравнения с вытяжкой.
3.5 общетоксическое действие: Токсическое действие на весь организм.
3.6 острая токсичность: Неблагоприятный эффект, возникающий после введения однократной или многократных доз исследуемой пробы в течение 24 ч.
3.7 подострая токсичность: Неблагоприятный эффект, возникающий после ежедневного введения однократной или многократных доз исследуемой пробы в течение 14-28 дней.
3.8 субхроническая токсичность: Неблагоприятный эффект, возникающий после ежедневного введения однократной или многократных доз исследуемой пробы в течение части общей продолжительности жизни (обычно 90 дней, но не более 10% продолжительности жизни).
3.9 исследуемая проба: Изделие или вытяжка из него, используемые для изучения общетоксического действия.
4 Подготовка пробы
4.1 Общие требования
Пациент может подвергаться воздействию различных условий и состояний, связанных с применением изделия. Исследуемые образцы отбирают с учетом условий, в которых обычно используют изделие. Изменения условий заносят в отчет об исследовании вместе с обоснованием.
Исследование проводят на готовых к употреблению изделиях и материалах или репрезентативных образцах компонентов готового к употреблению изделия. В отдельных случаях можно также рекомендовать исследование каких-либо компонентов отдельно или сразу же после сборки конечного изделия.
4.2 Применение форм
Если для приготовления исследуемых проб используют форму, она не должна взаимодействовать или отрицательно влиять на материал образца. В случае необходимости используют подходящую изолирующую среду.
4.3 Полированные материалы
Если готовые к употреблению изделия полируют, то поверхность образца обрабатывают так же. Полирующую среду затем полностью удаляют. Острые края закругляют так, как того требует применение изделия.
4.4 Условия производства
Компонент или изделие, используемое в качестве образца, подвергают воздействию тех же условий и веществ, которым они подвергаются в процессе производства (отмывка, упаковка, стерилизация и т.п.).
4.5 Стерилизация
Изделия, применяемые стерильными, используют после стерилизации с указанием способа стерилизации.
4.6 Физическое состояние образца
4.6.1 Материалы, предназначенные для прямого контакта (например жидкость, паста или гель), исследуют, не подвергая модификации, в экспериментах с кожной аппликацией или оральным введением.
4.6.2 Порошки (например продукты, относящиеся к классу абсорбентов) исследуют прямым нанесением или готовят из них пасты с использованием подходящего растворителя или жидкого дисперсанта, а потом наносят.
4.6.3 Жидкости исследуют прямым нанесением либо после их разведения.
Жидкие материалы, такие как спрей или чернила, предназначенные к применению в высушенной форме, наносят в виде тонкого слоя на стекло, высушивают, а затем подвергают экстракции.
4.6.4 Твердые материалы исследуют при прямом контакте с кожей.
Если необходимо, твердый материал распыляют или смачивают либо водой, либо другим растворителем (5.4), не вызывающим раздражение, обеспечивая хороший контакт с тканями.
5 Методы получения вытяжек из медицинских изделий
5.1 Пояснение
5.1.1 Приведенные методы получения вытяжек из изделий для дальнейшего исследования являются общими для всех видов изделий, однако при необходимости могут быть изменены для конкретного изделия.
5.1.2 Условия проведения экстракции могут быть выбраны более жесткими, чем те, в которых изделие применяется в медицинской практике для определения потенциального риска токсического действия без значительных изменений материала, которые обычно не происходят в реальной практике, например затвердение или плавление. Если воздействие в условиях клинического применения и условия производства изделия четко определены, выбирают условия проведения экстракции, имитирующие время и температуру воздействия при применении изделия.
5.2 Подготовка образца
Образец готовят, разделив его на части; допускается исследование целого образца.
Если материалы невозможно разделить, не нарушая их природы, идентичности или целостности, и вычисленный объем модельной среды не покрывает образец (например сложные изделия, металлические предметы, внутренние поверхности мешков и т.д.), используют минимальное количество модельной среды, которое покроет исследуемые поверхности. Для образцов небольшого размера проводят экстракцию нескольких образцов одновременно, чтобы вытяжки было достаточно для исследования. В зависимости от вида образца выбирают либо определенную массу (с точностью до 0,1 г), либо площадь поверхности образца (с точностью до 1 см ), подвергающегося экстракции. Регистрируют объем вытяжки.
), подвергающегося экстракции. Регистрируют объем вытяжки.
5.3 Требования к образцу
5.3.1 Соотношение площади поверхности образца к объему вытяжки приведено в таблице 1.
Таблица 1
|
Форма изделия |
Толщина, мм |
Соотношение площади поверхности |
|
Пленка или пластина (изолированная или в виде покрытия на стекле) |
До 0,5 |
6 см |
|
от 0,5 до 1 |
3 см | |
|
Трубки |
До 0,5 (стенка) |
6 см |
|
от 0,5 до 1 (стенка) |
3 см | |
|
Плитки, трубки и формованные изделия |
От 1 |
3 см |
|
Изделия неправильной формы (порошки, пилюли, и т.д.) |
- |
0,2 г образца на 1 мл |
|
| ||
Примечание - Дополнительные пояснения даны в ГОСТ Р ИСО 10993.12.
5.3.2 Образцы должны быть таких размеров, чтобы было удобно поместить их в сосуды для экстракции; все поверхности образцов должны быть полностью покрыты модельной средой.
5.3.3 Изделия поставляют стерильными и/или упакованными в готовом к применению в медицинской практике виде. Следует учитывать, что дополнительные манипуляции и воздействия высушивающих температур могут отрицательно повлиять на результаты исследований.
5.3.4 Предназначенный для экстракции образец промывают и высушивают, если его поверхность кажется загрязненной или этого требует процедура экстракции. Материал промывают очищенной водой или водой для инъекций. При необходимости образец промывают повторно и высушивают перед экстракцией, если это требуется для обеспечения совместимости с вытяжкой. Если образец чистый, его можно не промывать, так как в таком случае результат исследования будет отражать характер процесса производства и самого материала.
5.3.5 Следует убедиться в том, что сосуды для экстракции не вступают во взаимодействие с вытяжкой из исследуемых материалов.
5.4 Модельная среда
В качестве модельных сред используют репрезентативные экстрагенты, способные экстрагировать широкий спектр веществ в соответствии с 5.4.1-5.4.3.
Примечание - Особое внимание следует обратить на биосовместимость модельной среды.
5.4.1 К полярной модельной среде относят физиологический раствор.
5.4.2 К неполярной модельной среде относят нейтральные масла (например РАС фракционированное кокосовое масло; Британская фармакопея 73) или растительное масло (например кунжутное или хлопковое масло; Европейская фармакопея или Фармакопея США). При этом растительные масла должны быть свежерафинированными.
5.4.3 К дополнительным модельным средам относят спирт-воду, спирт-физиологический раствор, полиэтиленгликоль 400, диметилсульфоксид, минимальные среды с содержанием сыворотки теленка 5-10%, разведенный поверхностно-активный агент, очищенную воду, воду для инъекций и диспергирующие агенты.
5.5 Приготовление вытяжек
Образец, предназначенный для экстракции и подготовленный соответствующим образом, помещают в специальный сосуд и добавляют выбранную модельную среду. Эту процедуру повторяют с каждой модельной средой в соответствии с программой исследования. Одновременно готовят по одному контролю на каждую модельную среду для параллельного введения и сравнения.
5.6 Условия экстракции
5.6.1 Используют калиброванные соответствующим образом автоклав, термостат, водяную баню или инкубатор. Для большинства изделий подходит экстракция при (37±2) °С не более 72 ч. Допускается использовать более короткий период времени при более высокой температуре. Предлагаемые условия экстракции:
- (37±2) °С в течение (72±2) ч;
- (50±2) °С в течение (72±2) ч;
- (70±2) °С в течение (24±2) ч;
- (121±2) °С в течение (1±0,2) ч.
Процедуру взбалтывания необходимо отметить в отчете.
5.6.2 Идеальная экстракция для оценки материала возможна при использовании условий, имитирующих предполагаемые условия применения изделия. Выбранные температура и продолжительность экстракции не должны влиять на свойства изделия, например вызывать значительные изменения физических свойств.
После изъятия сосудов из термостатирующих установок их охлаждают до комнатной температуры. Во время охлаждения сосуд энергично встряхивают в течение 30 с и выливают вытяжку в сухой стерильный контейнер.
ПРЕДОСТЕРЕЖЕНИЕ - В целях безопасности температура и давление внутри герметичных сосудов без входных отверстий, используемых при температуре 121 °С, должны достичь показателей, соответствующих внешним условиям.
6 Методы исследования общетоксического действия
6.1 Общие требования
Методы и программа исследования изделия должны соответствовать требованиям ГОСТ Р ИСО 10993.1 с учетом вида и продолжительности контакта с пациентом.
6.2 Подготовка
Готовят образцы для исследования, как указано в разделе 2.
6.3 Рекомендованные методики
Методики изложены в документах, указанных в 6.5-6.8. Рекомендованные методики являются общепринятыми международными и национальными руководствами, стандартами и нормативами.
6.4 Программа и интерпретация результатов исследования
В описании методов исследований в большинстве случаев не указаны подробности, которые можно найти в стандартных процедурах выполнения или подобных документах, так как токсикология является развивающейся наукой, и слишком узкие рамки или детальные характеристики могли бы препятствовать ее дальнейшему развитию. Необходимым условием проведения токсикологического исследования является хорошее владение методиками и умение трезво рассуждать.
Любое изменение методики исследования вносят в отчет об исследованиях и научно обосновывают.
6.5 Острая общая токсичность
В соответствии с требованиями безопасности животных и новыми методами изучения общетоксического действия нет необходимости определять LD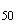 . Методы фиксированной дозы обеспечивают адекватные данные по острой токсичности для классификации, маркировки и определения риска потенциально опасных веществ и препаратов.
. Методы фиксированной дозы обеспечивают адекватные данные по острой токсичности для классификации, маркировки и определения риска потенциально опасных веществ и препаратов.
6.5.1 Оральное введение в остром опыте
Методики исследования изложены в следующих документах:
6.5.1.1 ОЭСР, Руководство N 401: Острая токсичность (оральное введение).
6.5.1.2 ФДА США, Управление по пищевым продуктам: Токсикологические принципы оценки безопасности пищевых добавок, 1982, Приложение II, стр.1 ff.
6.5.1.3 Официальный журнал Европейского сообщества, 19 сентября 1984, 84/449/В1. Острая токсичность (оральное введение).
6.5.1.4 Официальный журнал Европейского сообщества, Острая токсичность (оральное введение). Метод фиксированной дозы, ЕС: 79/831/ЕЭС, Приложение V, февраль 1990.
6.5.2 Острый опыт с аппликацией на кожу
Методики исследования изложены в следующих документах:
6.5.2.1 ОЭСР, Руководство N 402: Острый опыт с аппликацией на кожу.
6.5.2.2 Свод Федеральных норм США 1500.40: Метод тестирования токсических веществ. Острый опыт с аппликацией на кожу (однократное воздействие).
6.5.2.3 ЭПА США: Острый опыт с аппликацией на кожу, ЭПА, Вашингтон ДК, ноябрь 1984 ПБ 86-108958, стр.39 ff.
6.5.2.4 Официальный журнал Европейского сообщества, 19 сентября 1984. Острая токсичность (кожа).
6.5.3 Острый ингаляционный опыт
Методики исследования изложены в следующих документах:
6.5.3.1 ОЭСР, Руководство N 403: Острый ингаляционный опыт.
6.5.3.2 ЭПА США: Острый и субхронический ингаляционный опыт, ЭПА, Вашингтон ДК, октябрь 1988, ПБ 89-124077.
6.5.3.3 Официальный журнал Европейского сообщества, 19 сентября 1984, 84/449/ЕЭС/Б2. Острая токсичность (ингаляции).
6.5.4 Острый опыт с внутривенным введением
Методики исследования изложены в следующих документах:
6.5.4.1 Американское общество по испытаниям и материалам F 750: 1987, Практическое руководство по оценке вытяжек из материалов в остром опыте с инъекцией мыши; (метод А), Внутривенный.
6.5.4.2 Фармакопея США XXII NF XVII (88), Тесты на биологическую реактивность, in-vivo.
6.5.5 Острые опыты с внутрибрюшинным введением
Методики исследования изложены в следующих документах:
6.5.5.1 Американское общество по испытаниям и материалам F 750: 1987, Практическое руководство по оценке вытяжек из материалов при помощи инъекционного опыта на мышах; (метод Б), Внутрибрюшинный.
6.5.5.2 Фармакопея США XXII NF XVII (88), Тесты на биологическую реактивность, in-vivo.
6.5.5.3 Американский национальный институт стандартов/Американская ассоциация зубных врачей N 41: Оценка биологического действия стоматологических материалов: Острый опыт на общетоксическое действие.
6.6 Подострая общая токсичность
6.6.1 Оральное введение подострых доз
Методики исследования изложены в следующих документах:
6.6.1.1 ОЭСР, Руководство N 407: Многократное введение токсичных доз орально. Грызуны. Продолжительность теста 28 или 14 дней.
6.6.1.2 ФДА США: Управление пищевых продуктов: Токсикологические принципы оценки безопасности пищевых добавок, 1982, Приложение II, стр.8 ff.
6.6.1.3 Официальный журнал Европейского сообщества, 19 сентября 1984, ЕС: 84/449/ЕЕС/В7 N L251/118. Подострая токсичность (оральная).
6.6.2 Подострый опыт с кожной аппликацией
Методики исследования изложены в следующих документах:
6.6.2.1 ОЭСР, Руководство N 410: Кожная токсичность, повторная доза: 21/28-дневное исследование.
6.6.2.2 Официальный журнал Европейского сообщества, 19 сентября 1984, ЕС: 84/449/ЕЕС/Б9, N L251/127. Подострая токсичность (кожная).
6.6.2.3 ЭПА США: Кожная токсичность, повторная доза, 21-дневное исследование, ЭПА, Вашингтон ДК, ноябрь 84, ПБ 86-108958.
6.6.3 Подострый ингаляционный опыт
Методики исследования изложены в следующих документах:
6.6.3.1 ОЭСР, Руководство N 412: Ингаляционный опыт, многократная доза: 28 или 14-дневное исследование.
6.6.3.2 Официальный журнал Европейского сообщества, 19 сентября 1984, ЕС: 84/449/ЕЭС/Б8. Подострая токсичность (ингаляционная).
6.6.3.3 ЭПА США: Острая и субхроническая токсичность, ингаляционный опыт, ЭПА, Вашингтон ДК, октябрь 1988, ПБ 89-124077.
6.6.4 Подострый опыт, внутривенная инъекция
Адаптируют Руководство ОЭСР N 409: Подострая токсичность, заменив кожный опыт на внутривенную инъекцию в соответствии с методиками, изложенными в 6.5.4.
6.6.5 Подострый опыт с внутрибрюшинным введением
Адаптируют Руководство ОЭСР N 409: Подострая токсичность, заменив кожный опыт на внутрибрюшинную инъекцию в соответствии с одной из методик, изложенных в 6.5.5.
6.7 Субхроническая общая токсичность
6.7.1 Субхронический опыт с оральным введением
Методики исследования изложены в следующих документах:
6.7.1.1 Руководство ОЭСР N 408: Субхронический токсикологический опыт с оральным введением. Грызуны: 90-дневное исследование.
6.7.1.2 Руководство ОЭСР N 409: Субхронический токсикологический опыт с оральным введением. Негрызуны: 90-дневное исследование.
6.7.1.3 ФДА США, Управление по пищевым продуктам: Токсикологические принципы оценки безопасности пищевых добавок, 1982, Приложение II, стр.19 ff.
6.7.1.4 Официальный журнал Европейского сообщества, 19 сентября 1984 ЕС: 87/302/ЕЭС, N L133/8: 90-дневный эксперимент с многократным оральным введением грызунам.
6.7.2 Субхронический кожный опыт
Методики исследования изложены в документе:
Руководство ОЭСР N 411: Субхронический кожный опыт: 90-дневный эксперимент.
6.7.3 Субхронический ингаляционный опыт
Методики исследования изложены в документе:
Руководство ОЭСР N 413: Субхронический ингаляционный опыт: 90-дневный эксперимент.
6.7.4 Субхронический опыт с внутривенным введением
Приспосабливают Руководство ОЭСР N 408: Субхронический опыт с оральным введением, заменив оральное введение на внутривенное в соответствии с одной из методик исследования, изложенной в 6.5.4.
6.8 Хроническая токсичность и канцерогенность
При необходимости проводят исследования медицинских изделий на хроническую токсичность или канцерогенность. В тех случаях, когда необходимо исследовать указанные виды воздействия, методику исследования выбирают в соответствии с ГОСТ Р ИСО 10993.3.
При исследовании стоматологических материалов методом орального введения риск для здоровья оценивают на основе теста однократного разведения в соответствии со Швейцарским стандартом 119800.
7 Методы изучения пирогенности
Пирогены могут вызывать воспалительные реакции у пациентов. Пирогенность традиционно объясняли воздействием бактериальных эндотоксинов, загрязняющих изделия. В настоящее время доказано, что некоторые материалы сами содержат пирогены. При оценке изделий и/или материалов проводят исследование на пирогенность. Методики определения пирогенов изложены в документах, указанных в 7.1-7.2.
7.1 Определение эндотоксинов и других пирогенов, имеющих небактериальную природу
Фармакопея США XXII, NF XVII (151). Тест на пирогенность, стр.1515.
7.2 Определение эндотоксинов
7.2.1 Фармакопея США XXII, NF XVII (85). Определение бактериального эндотоксина, стр.1493 ff.
7.2.2 Европейская Фармакопея; часть V.2.1.0. Пирогены, 1990.
8 Оценка результатов
Результаты исследования любого изделия на токсичность следует оценивать с учетом:
- научного обоснования;
- ограниченных возможностей методик;
- предполагаемого клинического применения медицинского изделия;
- количества подопытных животных;
- продолжительности воздействия;
- огромного количества веществ, контактирующих с изделием;
- возможности неправильного применения изделия.
Оценка результатов в соответствии с критерием "прошел тест - не прошел" не соответствует цели биологического исследования по двум основным причинам:
- исследование на токсичность не дает гарантии отсутствия вредного эффекта изделия на человека;
- вредное воздействие, обнаруженное при исследовании на токсичность, может быть компенсировано преимуществом применения изделия.
Следовательно, хотя результаты исследования на токсичность в большинстве случаев достаточно эффективно определяют потенциальную опасность, необходимо тщательно наблюдать за состоянием здоровья человека и тщательно оценивать результаты тестирования на токсичность.
9 Отчет о проведенном исследовании
9.1 Отчет должен соответствовать конкретной использованной методике исследования.
9.2 Кроме требования 9.1, в отчете должны быть указаны:
- тип изделия;
- полная информация об изучаемом изделии;
- размеры, масса образца или части образца;
- код изготовителя, номер по каталогу, номер изделия или дата изготовления, торговое наименование и т.д.
9.3 При исследовании вытяжки в отчет включают следующие данные:
- соотношение объема модельной среды и площади поверхности образца или объема модельной среды и массы образца;
- условия экстракции в соответствии с 5.6.1;
- идентификацию модельной среды, включая подробное описание, по которому можно воспроизвести ее состав;
- любые данные о значительных физических изменениях образца или вытяжки: изменение цвета образцов, изменение цвета вытяжки, потенциальное многофазное разделение и др.
ПРИЛОЖЕНИЕ А
(справочное)
Перечень адресов
Список адресов, по которым можно приобрести документы, указанные в настоящем стандарте.
Европейская Фармакопея (ЕР)
Издает:
Европейский фармакопейный комитет
Совет Европы
F-67006 Strasbourd Cedex
France
Напечатано и опубликовано:
Maisonneuve S.A. 57 Sainte-Ruffine
France
Фармакопея США
Фармакопейная конвенция США, инк.
12601 Iwinbrook Parkway
Rockville, MD 20856
USA
Руководство ОЭСР по тестированию химических соединений
Издательский отдел ОЭСР
2, rue Andre-Pascal
F-75775 Paris Ctdex 16
France
ФДА США Токсикологические принципы оценки безопасности пищевых добавок
Управление по пищевым продуктам и лекарственным средствам США
Управление по пищевым продуктам
200 С Street, SW
Washington, DC 20204
США
US/EPA Тестирование на токсичность
Национальная информационная служба (NTIS)
Департамент торговли
Springfield, VA 22161
USA
Американское общество по тестированию и материалам (ASTM)
1916 Race Street
Philadelphia, PA 19103-1187
USA
Копии национальных стандартов (например ANSI/ADA Американский стандарт, BS Британский стандарт) можно приобрести в национальной организации по стандартизации в любом государстве - члене ИСО.
ПРИЛОЖЕНИЕ Б
(справочное)
Методики исследования общетоксического действия
Б.1 Определение острой токсичности на белых мышах
Б.1.1 Средства исследований
Весы лабораторные типа ВЛКТ-500 по ГОСТ 24104.
Шприцы объемом 2 мл.
Лупа.
Б.1.2 Ход исследования
Вытяжки из изделий исследуют на беспородных белых мышах (самцах) массой 18-25 ч*, прошедших 7-суточный карантин. В опытной и контрольной группах должно быть не менее восьми животных. Вытяжки в количестве 50 мл на 1 кг массы тела животных вводят однократно внутрибрюшинно. Животным контрольной группы в том же объеме вводят модельную среду. Состояние животных оценивают по следующим тестам:
_______________
* Соответствует оригиналу. - Примечание изготовителя базы данных.
- масса тела в граммах - определяют до введения вытяжек и через сутки после введения, натощак;
- общее состояние животных: поведение, подвижность, состояние шерстного покрова - сразу после введения, через 4 и 24 ч после введения;
- макроскопическая оценка состояния внутренних органов и тканей на вскрытии. Животных умерщвляют декапитацией через 24 ч после введения вытяжки. Сначала вскрывают контрольную группу, затем подопытную, обращая внимание на область введения вытяжки, состояние подкожной клетчатки, брюшины, мышц брюшной стенки, регионарных лимфоузлов и их протоков, внутренних органов;
- взвешивание внутренних органов (печени, почек, селезенки): определение коэффициентов массы внутренних органов делением массы органа в миллиграммах на массу тела в граммах. Полученные данные подлежат статистической обработке с использованием критерия Стьюдента t. При получении достоверной разности двух исследуемых показателей опытной и контрольной групп вытяжку из изделия признают токсичной. При обнаружении достоверного отличия по одному из показателей состояния животных испытания следует повторить на удвоенном количестве животных. При повторном обнаружении достоверных различий изделие считают токсичным. В случае гибели одного-двух животных исследование повторяют на удвоенном количестве животных (по 16 мышей в каждой группе). При гибели хотя бы одного подопытного животного при повторном исследовании изделие считают токсичным.
Б.2 Исследование на пирогенность на кроликах
Б.2.1 Средства исследований
Шприцы объемом 2 мл.
Термометр медицинский.
Б.2.2 Ход исследования
Отбор, содержание, подготовку животных к исследованиям, повторность их использования проводят по Государственной Фармакопее XI издания.
Тест-доза - 10 мл на килограмм массы кролика. Вытяжку вводят в ушную вену.
Исследуемую партию изделий считают апирогенной, если после введения вытяжки ни у одного из трех подопытных кроликов ни при одном из трех измерений не наблюдалось повышение температуры больше чем на 0,6 °С по сравнению с исходной температурой и в сумме повышение температуры при каждом измерении у трех кроликов не превышало 1,4 °С.
Примечание - За партию изделий принимают количество изделий, простерилизованных за сутки радиационным способом или за один цикл стерилизации в одном стерилизаторе при газовом способе стерилизации.
Если у одного или двух кроликов температура повысилась более чем на 0,6 °С и в сумме при каждом измерении у трех кроликов повышение температуры составило более 1,4 °С, исследование повторяют дополнительно на пяти кроликах.
Партию изделий считают апирогенной, если не более чем у трех из восьми кроликов наблюдалось индивидуальное повышение температуры не более чем на 0,6 °С и общая сумма повышений температуры у всех восьми кроликов не превышала 3,7 °С.
Допускается максимальное снижение температуры на 0,6 °С. При снижении температуры у одного кролика более чем на 0,6 °С исследование повторяют на пяти кроликах.
Партию изделий считают апирогенной, если после повторного исследования ни у одного из пяти кроликов максимальное понижение температуры не превысило 0,6 °С и не более чем у двух кроликов из пяти температура понизилась на 0,6 °С по сравнению с исходной. В противном случае партию изделий бракуют.
Б.3 Исследования на пирогенность методом реакции связывания комплемента
Б.3.1 Приготовление вытяжек
Б.З.1.1 Приготавливают вытяжки (смывы) из конкретных изделий согласно нормативной документации (НД) на приготовление вытяжек (смывов) из этих изделий.
Б.3.2 Применяемое оборудование
Стенд для испытаний по ГОСТ Р ИСО 10993.5.
Пробирки с притертой пробкой, 10 шт., объемом по 3 мл.
Дозатор пипеточный объемом 0,5; 0,2; 0,1; 0,05; 0,02 мл.
Весы аналитические с погрешностью взвешивания не более 0,001 г.
Пинцет анатомический длиной 250 мм.
Сосуд Дьюара, 2 шт.
Стерилизатор воздушный медицинский, температура (180+2) °С.
Холодильник бытовой.
Термостат с максимальной температурой 50 °С.
рН-метр, тип рН-121.
Применяемые реактивы.
Хлорид натрия, стерильный апирогенный изотонический раствор 0,9%-ный.
Сперма быка (замороженная в жидком азоте).
Антитела (замороженные в жидком азоте).
Комплемент (замороженный в жидком азоте).
Липополисахарид (в ампуле).
Б.3.3 Готовят раствор антител. Замороженную гранулу антител из сосуда Дьюара берут длинным анатомическим пинцетом и помещают в сухую пробирку.
Б.3.4 Готовят раствор антигена. Вскрывают ампулу с липополисахаридом, содержащую 500 минимальных пирогенных доз в 1 мл. 0,1 мл этого препарата приливают в пробирку с 0,9 мл апирогенного раствора хлорида натрия. Приготовленный раствор тщательно перемешивают, при этом концентрация антигена в нем составляет 50 минимальных пирогенных доз в 1 мл.
Б.3.5 Готовят раствор комплемента. Гранулу замороженного комплемента длинным анатомическим пинцетом помещают в сухую пробирку при комнатной температуре и выдерживают в течение 10 мин до полного оттаивания.
Б.3.6 Готовят опытный образец. В пробирку с притертой пробкой наливают 1 мл вытяжки (смыва), а также антитела и комплемент согласно паспорту. Содержимое пробирки перемешивают встряхиванием.
Примечание - За образец принимают часть вытяжки, подвергаемую необходимому исследованию.
Б.3.7 Готовят отрицательный контрольный образец. В пробирку с притертой пробкой наливают 1 мл апирогенного раствора хлорида натрия, а также антитела и комплемент согласно паспорту. Содержимое пробирки перемешивают встряхиванием.
Б.3.8 Готовят положительный контрольный образец. В пробирку с притертой пробкой наливают 1 мл апирогенного раствора хлорида натрия, добавляют 0,02 мл раствора антигена, полученного в соответствии с Б.3.3, и добавляют антитела и комплемент согласно паспорту. Содержимое пробирки перемешивают встряхиванием.
Б.3.9 Опытный и контрольные образцы помещают в термостат. Проводят инкубацию в течение 18-24 ч при температуре (27±2) °С в термостате.
Б.3.10 Готовят биосенсорную систему. Отмеряют пипеткой в пробирки объем разбавителя, указанный в паспорте, и ставят их в водяную баню при температуре (40±1,5) °С. В каждую пробирку добавляют объем антител, указанный в паспорте, и тщательно перемешивают встряхиванием. Охлажденным до температуры жидкого азота длинным анатомическим пинцетом извлекают из сосуда Дьюара гранулу спермы и опускают в нагретый раствор. После оттаивания гранулы содержимое пробирки перемешивают и выдерживают 10 мин. НЕ ДОПУСКАЕТСЯ ОТТАИВАТЬ НЕСКОЛЬКО ГРАНУЛ В ОДНОЙ ПРОБИРКЕ! Содержимое пробирок сливают в одну и перемешивают встряхиванием. Получается маточный раствор спермы.
Б.3.11 Готовят рабочие образцы. В каждую пробирку контрольной и опытной серий добавляют по 0,2 мл маточного раствора спермы.
Б.3.12 Готовят пробы к исследованию на стенде. Каждый рабочий образец переносят в кювету. Затем кювету (капилляр) устанавливают в кюветодержатель (каретку) стенда для исследования.
Б.3.13 Накапливают экспериментальные данные. При достижении нулевых значений показателя подвижности во всех кюветах прекращают процесс накопления данных.
Б.3.14 Обрабатывают экспериментальные данные с помощью компьютера. Суммарную двигательную активность  , в условных единицах, каждого образца вычисляют по формуле
, в условных единицах, каждого образца вычисляют по формуле
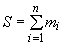 ,
,
где 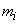 -
- 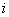 -е значение показателя подвижности;
-е значение показателя подвижности;
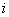 - текущий номер оценки показателя подвижности;
- текущий номер оценки показателя подвижности;
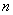 - количество оценок показателя подвижности.
- количество оценок показателя подвижности.
Б.3.15 Оценка результатов контроля
Б.3.15.1 Если для контрольных образцов выполняется соотношение
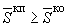 ,
,
где  и
и  - среднее арифметическое значение суммарной двигательной активности выборок образцов положительного и отрицательного контроля,
- среднее арифметическое значение суммарной двигательной активности выборок образцов положительного и отрицательного контроля,
результаты считают статистически значимыми, если  и
и  отличаются друг от друга по
отличаются друг от друга по 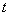 -критерию при уровне значимости 0,05. Результаты исследований образцов оценивают в соответствии с Б.3.15.2. В любом другом случае испытания повторяют, начиная с Б.3.4. Если при повторных исследованиях результат не изменится, исследования повторяют с новым набором реактивов и посуды.
-критерию при уровне значимости 0,05. Результаты исследований образцов оценивают в соответствии с Б.3.15.2. В любом другом случае испытания повторяют, начиная с Б.3.4. Если при повторных исследованиях результат не изменится, исследования повторяют с новым набором реактивов и посуды.
Б.3.15.2 Оценивают результаты исследований образца вытяжки (смыва)
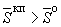 - образец считают апирогенным;
- образец считают апирогенным;
 - образец признают пирогенным,
- образец признают пирогенным,
где  - среднее арифметическое значение суммарной двигательной активности выборки образцов опыта.
- среднее арифметическое значение суммарной двигательной активности выборки образцов опыта.
При обнаружении пирогенности испытания по Б.3.4 повторяют. При этом вытяжку (смыв) готовят из вновь отобранных изделий. При получении такого же результата вытяжку (смыв) признают пирогенной.
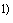 ;
; ;
;