ГОСТ Р 51577-2000
Группа Р14
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СРЕДСТВА ГИГИЕНЫ ПОЛОСТИ РТА ЖИДКИЕ
Общие технические условия
Liquid oral hygiene products.
General specifications
ОКС 71.100.70
ОКП 91 5823
Дата введения 2001-07-01
Предисловие
1 РАЗРАБОТАН И ВНЕСЕН Техническим комитетом по стандартизации ТК 405 “Средства гигиены полости рта”
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 28 марта 2000 г. N 64-ст
3 ВВЕДЕН ВПЕРВЫЕ
Внесена поправка, опубликованная в ИУС N 9, 2001 год
Поправка внесена юридическим бюро по тексту ИУС N 9, 2001 год
1 Область применения
Настоящий стандарт распространяется на жидкие средства гигиены полости рта (эликсиры, полоскания, ополаскиватели, освежители, бальзамы и т.п.), предназначенные для ухода за зубами и слизистой оболочкой полости рта (далее - жидкие СГПР).
Стандарт устанавливает общие технические требования к жидким СГПР и методы испытаний.
Требования по безопасности изложены в 3.1.3 (таблица 1, пункты 6-9), 3.1.4, 3.2, 3.3.1, 3.4.2, 3.4.4, разделах 4 и 6.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 61-75 Кислота уксусная. Технические условия
ГОСТ 245-76 Натрий фосфорнокислый однозамещенный 2-водный. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Технические условия
ГОСТ 2053-77 Натрий сернистый 9-водный. Технические условия
ГОСТ 2493-75 Калий фосфорнокислый двузамещенный 3-водный. Технические условия
ГОСТ 3118-77 Кислота соляная. Технические условия
ГОСТ 3164-78 Масло вазелиновое медицинское. Технические условия
ГОСТ 3639-79 Растворы водно-спиртовые. Методы определения концентрации этилового спирта
ГОСТ 3760-79 Аммиак водный. Технические условия
ГОСТ 4145-74 Калий сернокислый. Технические условия
ГОСТ 4165-78 Медь (II) сернокислая 5-водная. Технические условия
ГОСТ 4166-76 Натрий сернокислый. Технические условия
ГОСТ 4172-76 Натрий фосфорнокислый двузамещенный 12-водный. Технические условия
ГОСТ 4198-75 Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4204-77 Кислота серная. Технические условия
ГОСТ 4217-77 Калий азотнокислый. Технические условия
ГОСТ 4233-77 Натрий хлористый. Технические условия
ГОСТ 4236-77 Свинец (II) азотнокислый. Технические условия
ГОСТ 4328-77 Натрия гидроокись. Технические условия
ГОСТ 4461-77 Кислота азотная. Технические условия
ГОСТ 4463-76 Натрий фтористый. Технические условия
ГОСТ 5556-81 Вата медицинская гигроскопическая. Технические условия
ГОСТ 5821-78 Кислота сульфаниловая. Технические условия
ГОСТ 51652-2000 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ 6038-79 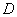 -Глюкоза. Технические условия
-Глюкоза. Технические условия
ГОСТ 6259-75 Глицерин. Технические условия
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 6824-96 Глицерин дистиллированный. Технические условия
ГОСТ 8864-71 Натрий N, N-диэтилдитиокарбамат 3-водный. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9412-93 Марля медицинская. Общие технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10652-73 Соль динатриевая этилендиамин-N, N, N', N'-тетрауксусной кислоты 2-водная (трилон Б)
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13739-78 Масло иммерсионное для микроскопии. Технические требования. Методы испытания
ГОСТ 13805-76 Пептон сухой ферментативный для бактериологических целей. Технические условия
ГОСТ 14618.10-78 Масла эфирные, вещества душистые и полупродукты их синтеза. Методы определения плотности и показателя преломления
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 17206-96 Агар микробиологический. Технические условия
ГОСТ 19569-89 Стерилизаторы паровые медицинские. Общие технические требования и методы испытаний
ГОСТ 20015-88 Хлороформ. Технические условия
ГОСТ 20729-75 Питательные среды. Вода мясная (для ветеринарных целей). Технические условия
ГОСТ 22280-76 Натрий лимоннокислый 5,5-водный. Технические условия
ГОСТ 24104-88 Весы лабораторные общего назначения и образцовые. Общие технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25706-83 Лупы. Типы, основные параметры. Общие технические требования
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 26678-85 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
ГОСТ 27429-87 Изделия парфюмерно-косметические жидкие. Упаковка, маркировка, транспортирование и хранение
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29188.0-91 Изделия парфюмерно-косметические. Правила приемки, отбор проб, методы органолептических испытаний
ГОСТ 29188.2-91 Изделия косметические. Метод определения водородного показателя рН
ГОСТ 29188.6-91 Изделия парфюмерно-косметические. Газохроматографический метод определения этилового спирта
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 30178-96 Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов
ГОСТ Р 51391-99 Изделия парфюмерно-косметические. Информация для потребителя. Общие требования
3 Технические требования
3.1 Характеристика
3.1.1 Жидкие СГПР представляют собой водные, спиртоводные или водно-спиртовые растворы, содержащие лечебно-профилактические вещества. Жидкие СГПР также могут содержать влагоудерживающие, связующие, поверхностно-активные, вкусовые, ароматические и консервирующие добавки в различных комбинациях, а также красители.
Жидкие СГПР не должны содержать сахарозу и другие легкоферментируемые углеводы.
3.1.2 Жидкие СГПР вырабатывают в соответствии с требованиями настоящего стандарта, по техническим требованиям на конкретное наименование продукции, рецептурам и технологическим регламентам, с соблюдением санитарных норм и правил, утвержденных в установленном порядке.
3.1.3 По органолептическим, физико-химическим, микробиологическим показателям жидкие СГПР должны соответствовать требованиям, указанным в таблице 1.
Таблица 1
|
Наименование показателя |
Характеристика и норма |
Метод испытаний |
|
|
|
|
|
________________________ | ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_______________________ | ||
|
8 Масса фторидов в единице упаковки, мг, не более |
120 |
6.9 |
|
|
|
|
|
_______________________ | ||
3.1.4 По микробиологическим показателям жидкие СГПР должны соответствовать нормам безопасности, установленным гигиеническими требованиями к жидким СГПР [1].
3.2 Требования к сырью и материалам
Сырье и материалы для приготовления жидких СГПР должны соответствовать требованиям нормативных документов, утвержденных в установленном порядке.
Для производства спиртосодержащих жидких СГПР должен применяться спирт этиловый ректификованный по ГОСТ 51652 (кроме 1-го сорта) или спирт этиловый ректификованный по ГОСТ 51652 (кроме 1-го сорта), денатурированный добавками, разрешенными для использования в пищевых продуктах в Российской Федерации.
3.3 Маркировка
3.3.1 Маркировка жидких СГПР - по ГОСТ Р 51391 со следующими дополнениями:
- противопоказания (при наличии);
- предостережение “Не глотать”;
- массовая доля фторида (для фторидсодержащих жидких СГПР);
- сведения о денатурирующих добавках.
Маркировка жидких СГПР должна быть однозначно понимаемой, полной и достоверной, чтобы потребитель не мог быть обманут или введен в заблуждение относительно происхождения, свойств, состава, способа применения, а также других сведений, характеризующих прямо или косвенно качество и безопасность жидких СГПР, и не мог ошибочно принять данные изделия за другие, близкие к ним по внешнему виду или органолептическим показателям.
Не допускается использовать в наименовании и названии жидких СГПР слова “спирт”.
3.3.2 Маркировка транспортной тары - в соответствии с требованиями ГОСТ 27429.
3.4 Упаковка
3.4.1 Упаковка жидких СГПР - по ГОСТ 27429.
3.4.2 Жидкие СГПР фасуют в потребительскую тару, обеспечивающую их сохранность и безопасность потребителя при их использовании.
3.4.3 Жидкие СГПР упаковывают в соответствии с установленной массой или объемом. Допускаемое отклонение не должно превышать ±5%.
3.4.4 Тара и упаковочные средства должны быть изготовлены из материалов, разрешенных учреждениями госсанэпидслужбы России для контакта с пищевыми продуктами, обеспечивающих сохранность жидкого СГПР в течение срока годности и не взаимодействующих с жидкими СГПР.
Не допускается фасование жидких СГПР в потребительскую тару, предназначенную для пищевых продуктов и алкогольных напитков.
Спиртосодержащие жидкие СГПР с массовой долей этилового спирта более 15% должны реализовываться в емкостях не более 255 см .
.
3.4.5 Транспертная упаковка - в соответствии с требованиями ГОСТ 27429.
4 Требования безопасности
4.1 По степени воздействия на организм жидкие СГПР относят к 4-му классу опасности по ГОСТ 12.1.007 - вещества малоопасные.
Жидкие СГПР должны быть токсикологически и клинически безопасны. Они не должны оказывать неблагоприятного воздействия на ткани полости рта и не должны вызывать изменений в количественном и видовом составе нормальной микрофлоры полости рта при правильном применении и при соблюдении условий хранения на протяжении срока годности.
4.2 Гигиенические требования к производству, безопасности жидких СГПР должны соответствовать санитарным правилам и нормам [1].
4.3 Общие требования по обеспечению пожарной безопасности должны соответствовать ГОСТ 12.1.004.
4.4 При загорании следует применять тонкораспыленную воду, химическую пену, песок, все виды огнетушителей.
6 Методы испытаний
Отбор проб проводят по ГОСТ 29188.0, раздел 2.
Для проведения испытаний масса объединенной пробы должна быть не менее 300 г. Объединенную пробу тщательно перемешивают.
Для проведения физико-химических испытаний из пробы отбирают навески.
Отбор проб для определения микробиологической чистоты проводят по 6.5.4.
6.1 Определение внешнего вида и консистенции - по ГОСТ 29188.0, раздел 3.
6.2 Определение цвета - по ГОСТ 29188.0, раздел 3.
6.3 Определение запаха - по ГОСТ 29188.0, раздел 3.
6.4 Определение вкуса - органолептически. В случаях, если способ применения предполагает разбавление жидкого СГПР перед использованием, для проведения испытания пробу жидкого СГПР разбавляют в соответствии с указанием, данным в аннотации.
6.5 Определение микробиологической чистоты
Метод основан на посеве разведения навески жидкого СГПР в питательные среды с последующим культивированием посевов в условиях, благоприятных для роста микроорганизмов. Приемосдаточные испытания на микробиологическую чистоту включают:
- определение общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов;
- определение присутствия (отсутствия) плесневых грибов и дрожжей.
При контрольных испытаниях дополнительно определяют:
- присутствие (отсутствие) бактерий семейства Enterobacteriaceae, Pseudomonas aeruginosa (P. aeruginosa), Sttphylococcus aureus (S. aureus).
Для жидких СГПР, содержащих антимикробные препараты и консерванты, предварительно определяют наличие антимикробной активности самого жидкого СГПР. При подтверждении наличия антимикробной активности устраняют ее перед проведением испытаний на микробиологическую чистоту.
6.5.1 Аппаратура
Для работы применяют обычное оборудование микробиологических лабораторий.
Стерилизатор паровой медицинский по ГОСТ 19569.
Дистиллятор электрический ДЭ-4 или другой марки.
Стерилизатор воздушный.
Аппарат для встряхивания жидкости.
Термостаты, позволяющие поддерживать температуру (30±1) °С и (37±1) °С.
Микроскоп биологический.
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
Баня водяная или другое подобное устройство, позволяющее поддерживать температуру (45±0,5) °С.
Лупа с 5-кратным увеличением по ГОСТ 25706.
рН-метр любой марки с набором электродов с погрешностью измерения ±0,1 рН.
Холодильник бытовой электрический по ГОСТ 26678.
Таймер.
Электроплитка по ГОСТ 14919.
Чашки Петри стеклянные (или пластмассовые одноразовые) диаметром от 90 до 100 мм по ГОСТ 25336.
Пипетки дозирующие вместимостью 1, 5 и 10 см по ГОСТ 29227.
по ГОСТ 29227.
Пробирки бактериологические по ГОСТ 25336.
Колбы стеклянные вместимостью 100, 200, 250, 500 и 1000 см по ГОСТ 1770.
по ГОСТ 1770.
Бутылки и флаконы стеклянные для хранения реактивов.
Ступки фарфоровые с пестиками по ГОСТ 9147.
Стекла предметные для микропрепаратов по ГОСТ 9284.
Стекла покровные по ГОСТ 6672.
Облучатель бактерицидный потолочный ОБИ-300 или другой марки.
Марля медицинская по ГОСТ 9412.
Прибор вакуумного фильтрования ПВФ-47.
Фильтры бумажные “белая лента”.
Мембраны Владипор типа МФАС-Б-5 или МФА-МА-N 5.
6.5.2 Питательные среды и реактивы
Агар микробиологический по ГОСТ 17206.
Агар сухой питательный для культивирования микроорганизмов по фармакопейной статье [2].
Агар мясо-пептонный с глюкозой, приготовленный по ГОСТ 10444.1.
Агар яично-желточно-солевой, приготовленный по ГОСТ 10444.1.
Вода мясная по ГОСТ 20729.
Вода дистиллированная по ГОСТ 6709.
Глицерин дистиллированный по ГОСТ 6824.
Глюкоза по ГОСТ 6038.
Калий сернокислый по ГОСТ 4145.
Калий фосфорнокислый однозамещенный по ГОСТ 4198.
Магний хлорнокислый безводный [3].
Натрия гидроокись по ГОСТ 4328, раствор концентрации  (NaOH)=1,0 моль/дм
(NaOH)=1,0 моль/дм (1 н.).
(1 н.).
Натрий хлористый по ГОСТ 4233.
Натрий фосфорнокислый однозамещенный 2-водный по ГОСТ 245.
Пептон сухой ферментативный по ГОСТ 13805.
Спирт этиловый ректификованный по ГОСТ 5962.
Феноловый красный, индикатор по Государственной Фармакопее СССР [3].
Малахитовый зеленый, индикатор по Государственной Фармакопее СССР [3].
Левомицетин по Государственной Фармакопее СССР [3].
Калий фосфорнокислый двузамещенный 3-водный по ГОСТ 2493.
Натрий фосфорнокислый двузамещенный 12-водный по ГОСТ 4172.
Калий азотнокислый по ГОСТ 4217.
Кислота соляная по ГОСТ 3118, раствор концентрации  (HCI)=1,0 моль/дм
(HCI)=1,0 моль/дм (1 н.).
(1 н.).
Кислота сульфаниловая по ГОСТ 5821.
Кислота уксусная ледяная по ГОСТ 61.
N, N-диметил-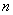 -фенилендиамин дигидрохлорид, раствор массовой долей 1%.
-фенилендиамин дигидрохлорид, раствор массовой долей 1%.
Масло иммерсионное для микроскопирования по ГОСТ 13739.
Масло вазелиновое медицинское по ГОСТ 3164.
Плазма кролика сухая цитратная для реакции плазмокоагуляции.
Питательная среда N 1 (для культивирования аэробных и факультативно-анаэробных микроорганизмов), сухая по временной фармакопейной статье [4].
Питательная среда N 2 (для выращивания плесневых грибов), сухая (Сабуро-агар) по временной фармакопейной статье [5].
Питательная среда N 3 (обогащения для бактерий семейства Enterobacteriaceae), сухая по временной фармакопейной статье [6].
Питательная среда N 4 (для выделения Enterobacteriaceae), сухая (агар Эндо) по временной фармакопейной статье [7].
Питательная среда N 6 (для определения ферментации глюкозы), сухая по временной фармакопейной статье [8].
Питательная среда N 7 (для определения редукции нитратов в нитриты), сухая по временной фармакопейной статье [9].
Питательная среда N 8 (для выращивания Р. aeruginosa и S.aureus), сухая по фармакопейной статье [10].
Питательная среда N 9 (для выделения пигмента пиоцианита Р. aeruginosa), сухая по временной фармакопейной статье [11].
Питательная среда N 10 (для идентификации S. aureus), сухая по временной фармакопейной статье [12].
Д-Маннит [13].
I-Нафтол, спиртовой раствор массовой долей 1% [14].
I-Нафтиламин [15].
Вода дистиллированная по ГОСТ 6709.
Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов и питательных сред по качеству не ниже вышеуказанных.
6.5.3 Приготовление растворов и питательных сред
6.5.3.1 Общие требования при подготовке растворов и питательных сред
Для приготовления растворов и питательных сред следует использовать обеззараженные основные компоненты, сухие питательные среды или готовые среды в стерильной упаковке, изготовленные на специализированных предприятиях, дистиллированную или деионизированную воду.
Измерения рН следует проводить при 20 °С.
Доведение рН среды до нужного значения осуществляют с помощью растворов гидроокиси натрия и соляной кислоты.
Жидкости для разведения и питательные среды стерилизуют в автоклаве или кипячением (дробно).
Готовые среды хранят в сухом темном месте при температуре от 0 °С до 4 °С (жидкие - не более 14 дней, плотные - не более 2 мес).
При приготовлении и использовании питательных сред необходимо соблюдать следующие правила:
- твердые компоненты среды растворяют в воде, подогревая в случае необходимости (в первую очередь - питательные основы и соли, в последнюю - сахара);
- жидкие питательные среды должны быть прозрачными;
- продолжительность выдерживания питательного агара в кипящей водяной бане при его расплавлении не должна превышать 45 - 60 мин;
- необходимо проверять стерильность каждой партии питательной среды.
6.5.3.2 Физиологический раствор
0,85 г хлористого натрия растворяют в 100 см дистиллированной воды и стерилизуют 20 мин при температуре (121±1) °С.
дистиллированной воды и стерилизуют 20 мин при температуре (121±1) °С.
Хранят при комнатной температуре не более 14 дней.
6.5.3.3 Буферный раствор, рН 7,0
1,0 г сухого пептона, 4,30 г хлористого натрия, 7,23 г фосфорнокислого двузамещенного натрия и 3,56 г фосфорнокислого однозамещенного калия растворяют при нагревании в 1000 см дистиллированной воды, фильтруют через бумажный фильтр, устанавливают рН 7,0, разливают в колбы по 250 см
дистиллированной воды, фильтруют через бумажный фильтр, устанавливают рН 7,0, разливают в колбы по 250 см , стерилизуют 15 мин при температуре (121±1) °С.
, стерилизуют 15 мин при температуре (121±1) °С.
Хранят при температуре от 4 °С до 6 °С не более 14 дней.
6.5.3.4 Феноловый красный, индикатор, раствор массовой долей 1%
1,0 г фенолового красного растирают в ступке, добавляя небольшими порциями 28,2 см раствора гидроокиси натрия концентрации 0,1 моль/дм
раствора гидроокиси натрия концентрации 0,1 моль/дм . Полученный раствор переносят в мерную колбу вместимостью 100 см
. Полученный раствор переносят в мерную колбу вместимостью 100 см , доливают водой до метки.
, доливают водой до метки.
Хранят во флаконе из темного стекла при температуре от 4 °С до 10 °С.
6.5.3.5 Малахитовый зеленый, индикатор, раствор массовой долей 0,5%
0,5 г красителя переносят в стерильный флакон, заливают 100 см стерильной горячей дистиллированной воды, помещают на сутки в термостат при 37 °С, периодически взбалтывая. Готовый раствор хранят во флаконе из темного стекла при температуре от 4 °С до 10 °С.
стерильной горячей дистиллированной воды, помещают на сутки в термостат при 37 °С, периодически взбалтывая. Готовый раствор хранят во флаконе из темного стекла при температуре от 4 °С до 10 °С.
6.5.3.6 Среда для культивирования аэробных и факультативно-анаэробных микроорганизмов
Используют сухой питательный агар, мясо-пептонный агар с глюкозой, приготовленные по ГОСТ 10444.1, сухую среду N 1 [4] или среду, приготовленную по следующей методике: 10 г пептона и 5 г хлористого натрия растворяют при нагревании в 1000 см мясной воды, добавляют 1 г глюкозы, устанавливают рН 7,3, кипятят 1 мин, вносят 13 - 15 г заранее замоченного микробиологического агара, нагревают до полного его растворения, фильтруют через ватно-марлевый фильтр, разливают во флаконы вместимостью не более 500 см
мясной воды, добавляют 1 г глюкозы, устанавливают рН 7,3, кипятят 1 мин, вносят 13 - 15 г заранее замоченного микробиологического агара, нагревают до полного его растворения, фильтруют через ватно-марлевый фильтр, разливают во флаконы вместимостью не более 500 см , заполняя их примерно на
, заполняя их примерно на 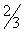 .
.
Стерилизуют 15 мин при температуре (121±1) °С.
рН после стерилизации - 7,2±0,2.
6.5.3.7 Среда для выращивания плесневых грибов и дрожжей (среда Сабуро)
Используют сухую среду N 2 [5] или среду, приготовленную по ГОСТ 10444.1.
6.5.3.8 Среда обогащения для бактерий семейства Enterobacteriaceae
Используют сухую среду N 3 [6] или среду, приготовленную по следующей методике: 10 г пептона, 7,5 г фосфорнокислого двузамещенного натрия, 2,5 г фосфорнокислого однозамещенного калия растворяют в 1000 см мясной воды при нагревании, добавляют 10 г глюкозы, прибавляют 8 см
мясной воды при нагревании, добавляют 10 г глюкозы, прибавляют 8 см раствора фенолового красного (6.5.3.4) и 3 см
раствора фенолового красного (6.5.3.4) и 3 см раствора малахитового зеленого (6.5.3.5), устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают в колбы вместимостью 100 см
раствора малахитового зеленого (6.5.3.5), устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают в колбы вместимостью 100 см и стерилизуют 15 мин при температуре (112±1) °С.
и стерилизуют 15 мин при температуре (112±1) °С.
рН после стерилизации - 7,2±0,2.
6.5.3.9 Сухой агар Эндо для обнаружения бактерий семейства Enterobacteriaceae
Используют сухую среду N 4 [7]. Готовую среду хранят при температуре от 0 °С до 4 °С не более 5 дней.
6.5.3.10 Среда для определения ферментации глюкозы
Используют сухую среду N 6 [8] или среду, приготовленную по следующей методике: 10 г пептона и 5 г хлористого натрия растворяют в 1000 см мясной воды при нагревании, вносят 40 г глюкозы, добавляют 8 см
мясной воды при нагревании, вносят 40 г глюкозы, добавляют 8 см раствора фенолового красного (6.5.3.4), устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают в пробирки с поплавками по 4 - 5 см
раствора фенолового красного (6.5.3.4), устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают в пробирки с поплавками по 4 - 5 см и стерилизуют 15 мин при температуре (112±1) °С. По окончании стерилизации среду быстро охлаждают.
и стерилизуют 15 мин при температуре (112±1) °С. По окончании стерилизации среду быстро охлаждают.
рН после стерилизации - 7,2±0,2.
6.5.3.11 Среда для определения редукции нитратов в нитриты
Используют сухую среду N 7 [9] или среду, приготовленную по следующей методике: 5 г пептона, 5 г хлористого натрия, 1,5 г азотнокислого калия растворяют в 1000 см дистиллированной воды при нагревании, устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают в пробирки по 4-5 см
дистиллированной воды при нагревании, устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают в пробирки по 4-5 см и стерилизуют 15 мин при температуре (121±1) °С.
и стерилизуют 15 мин при температуре (121±1) °С.
рН после стерилизации - 7,2±0,2.
6.5.3.12 Реактив Грисса
Раствор 1: 0,5 г сульфаниловой кислоты растворяют в 30 см ледяной уксусной кислоты, фильтруют через бумажный фильтр. Раствор годен в течение 30 дней.
ледяной уксусной кислоты, фильтруют через бумажный фильтр. Раствор годен в течение 30 дней.
Раствор 2: 0,1 г 1-нафтиламина растворяют в 100 см кипящей воды, охлаждают, добавляют 30 см
кипящей воды, охлаждают, добавляют 30 см ледяной уксусной кислоты, фильтруют через бумажный фильтр. Раствор годен в течение 7 дней.
ледяной уксусной кислоты, фильтруют через бумажный фильтр. Раствор годен в течение 7 дней.
Перед употреблением смешивают равные объемы растворов 1 и 2.
6.5.3.13 Реактив на цитохромоксидазу
Раствор 1: Спиртовой раствор нафтола-1 массовой долей 1%. 1,0 г нафтола-1 растворяют в 100 см этилового спирта.
этилового спирта.
Раствор 2: Раствор N, N-диметил-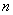 -фенилендиамина дигидрохлорида в воде массовой долей 1%. 1,0 г N, N-диметил-
-фенилендиамина дигидрохлорида в воде массовой долей 1%. 1,0 г N, N-диметил-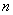 -фенилендиамина дигидрохлорида растворяют в 100 см
-фенилендиамина дигидрохлорида растворяют в 100 см дистиллированной воды.
дистиллированной воды.
Перед употреблением смешивают растворы 1 и 2 в соотношении 2:3.
Хранят при температуре от 4 °С до 10 °С во флаконах из нейтрального светозащитного стекла в течение 14 дней.
6.5.3.14 Среда для выращивания Р. aeruginosa и S. aureus
Используют любой питательный бульон (рН 7,2) или сухую среду N 8 [10], или среду, приготовленную по следующей методике: 10 г пептона, 5 г хлористого натрия, 2,5 г фосфорнокислого двузамещенного калия растворяют в 1000 см дистиллированной воды при нагревании, вносят 2,5 г глюкозы, устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают по 100 см
дистиллированной воды при нагревании, вносят 2,5 г глюкозы, устанавливают рН 7,3, кипятят 1 мин, фильтруют через бумажный фильтр, разливают по 100 см в колбы и стерилизуют 15 мин при температуре (112±1) °С.
в колбы и стерилизуют 15 мин при температуре (112±1) °С.
рН после стерилизации - 7,2±0,2.
6.5.3.15 Среда для выявления пигмента пиоцианина Р. aeruginosa
Используют сухую среду N 9 [11] или среду, приготовленную по следующей методике: 20 г пептона, 1,4 г безводного хлорнокислого магния, 10 г сернокислого калия вносят в 1000 см дистиллированной воды и оставляют на 15 мин, перемешивают, растворяют при нагревании. Добавляют 10 см
дистиллированной воды и оставляют на 15 мин, перемешивают, растворяют при нагревании. Добавляют 10 см глицерина, устанавливают рН 7,3, кипятят 1 мин, прибавляют 15 г микробиологического агара, замоченного заранее, нагревают до полного его растворения, фильтруют через ватно-марлевый фильтр, разливают по 100 см
глицерина, устанавливают рН 7,3, кипятят 1 мин, прибавляют 15 г микробиологического агара, замоченного заранее, нагревают до полного его растворения, фильтруют через ватно-марлевый фильтр, разливают по 100 см во флаконы и стерилизуют 15 мин при температуре (121±1) °С.
во флаконы и стерилизуют 15 мин при температуре (121±1) °С.
рН после стерилизации - 7,2±0,2.
6.5.3.16 Среда для идентификации S. aureus (маннитно-солевой агар)
Используют сухую среду N 10 [12], яично-желточно-солевой агар, приготовленный по ГОСТ 10444.1, или среду, приготовленную по следующей методике: 10 г пептона, 75 г хлористого натрия, 10 г Д-маннита растворяют при нагревании в 1000 см дистиллированной воды, добавляют 2,5 см
дистиллированной воды, добавляют 2,5 см раствора фенолового красного (6.5.3.4), устанавливают рН 7,5, кипятят 1 мин, добавляют замоченный заранее микробиологический агар, нагревают до полного его растворения, фильтруют через ватно-марлевый фильтр, разливают во флаконы вместимостью 500 см
раствора фенолового красного (6.5.3.4), устанавливают рН 7,5, кипятят 1 мин, добавляют замоченный заранее микробиологический агар, нагревают до полного его растворения, фильтруют через ватно-марлевый фильтр, разливают во флаконы вместимостью 500 см и стерилизуют 15 мин при температуре (121±1) °С.
и стерилизуют 15 мин при температуре (121±1) °С.
рН после стерилизации - 7,4±0,2.
6.5.3.17 Проверка стерильности питательных сред
Пробирки, флаконы, колбы со средами после стерилизации инкубируют в термостате при температуре (35±1) °С 72 ч. Использованию подлежат среды без признаков микробного роста.
Допускается совмещать проверку на стерильность среды с проведением анализа, устанавливая контрольные пробы (чашки или пробирки со средой данной партии) рядом с анализируемыми.
6.5.4 Отбор проб и подготовка пробы к испытанию
Пробы для анализа отбирают до отбора проб для органолептических, физико-химических и других видов испытаний с соблюдением правил асептики, для того, чтобы исключить вторичное микробное загрязнение продукта.
Из каждой партии жидких СГПР готовят образец для анализа (среднюю пробу) из 5 разных упаковок, не менее. При повторном анализе пробу готовят из 5 других упаковок.
Перед вскрытием упаковки верхнюю часть флакона вместе с бушоном протирают тампоном, смоченным этиловым спиртом, и вскрывают перед пламенем горелки.
Небольшую порцию жидкого СГПР (10-15 г), непосредственно прилегающую к отверстию, выливают в отдельную посуду и выбрасывают.
6.5.4.1 Подготовка проб для определения антимикробной активности жидких СГПР
Определение антимикробной активности проводят для жидких СГПР, содержащих антимикробные препараты и консерванты.
По 2,0 см испытуемого жидкого СГПР из 5 разных упаковок (всего 10 г) вносят в стерильную посуду, тщательно перемешивают и используют для анализа.
испытуемого жидкого СГПР из 5 разных упаковок (всего 10 г) вносят в стерильную посуду, тщательно перемешивают и используют для анализа.
6.5.4.2 Подготовка проб для определения микробиологической чистоты жидких СГПР
По 10,0 см испытуемого жидкого СГПР из 5 разных упаковок (всего 50 г) вносят в стерильную градуированную колбу вместимостью 250 см
испытуемого жидкого СГПР из 5 разных упаковок (всего 50 г) вносят в стерильную градуированную колбу вместимостью 250 см и постепенно добавляют буферный раствор, приготовленный по 6.5.3.3, до 100 см
и постепенно добавляют буферный раствор, приготовленный по 6.5.3.3, до 100 см . Раствор соответствует разведению 1:1 (1-е разведение).
. Раствор соответствует разведению 1:1 (1-е разведение).
После тщательного перемешивания пробы из полученного раствора готовят последовательные разведения образца 1:10 (2-е разведение: 20 см 1-го разведения плюс 80 см
1-го разведения плюс 80 см буферного раствора) и 1:100 (3-е разведение: 10 см
буферного раствора) и 1:100 (3-е разведение: 10 см 2-го разведения плюс 90 см
2-го разведения плюс 90 см буферного раствора). Посев осуществляют не позднее чем через 30 - 45 мин после окончательного разведения образца.
буферного раствора). Посев осуществляют не позднее чем через 30 - 45 мин после окончательного разведения образца.
6.5.5 Проведение испытаний
6.5.5.1 Определение антимикробной активности жидких СГПР
Метод основан на подавлении роста тест-микроорганизмов под действием испытуемого жидкого СГПР. В качестве тест-штаммов используют Bacillus subtilis ATCC 6633 (Bacillus cereus ATCC 10702), Escherichia coli ATCC 25922, Pseudomonos aeruginosa ATCC 453, Staphylococcus aureus ATCC 6538-P, Candida albicans ATCC 885-653 [16].
Культуры Bacillus subtilis (Bacillus cereus), Escherichia coli, Pseudomonos aeruginosa, Staphylococcus aureus выращивают на жидкой среде по 6.5.3.6 при температуре от 30 °С до 35 °С в течение 18 - 20 ч. Культуру Candida albicans - на жидкой среде по 6.5.3.7 при температуре от 20 °С до 25 °С в течение 48 ч.
Из каждой выросшей культуры готовят взвесь микроорганизмов, добавляя 0,9%-ный стерильный физиологический раствор хлорида натрия в соотношении 1:1000.
В 10 пробирок вносят по 1,0 см образца жидкого СГПР по 6.5.4.1 и добавляют:
образца жидкого СГПР по 6.5.4.1 и добавляют:
- в пробирку N 1 - 10,0 см буферного раствора по 6.5.3.3 и 1,0 см
буферного раствора по 6.5.3.3 и 1,0 см взвеси Bacillus subtilis;
взвеси Bacillus subtilis;
- в пробирку N 2 - 10,0 см буферного раствора по 6.5.3.3 и 1,0 см
буферного раствора по 6.5.3.3 и 1,0 см взвеси Candida albicans;
взвеси Candida albicans;
- в пробирку N 3 - 10,0 см среды по 6.5.3.8 и 1,0 см
среды по 6.5.3.8 и 1,0 см взвеси Escherichia coli;
взвеси Escherichia coli;
- в пробирку N 4 - 10,0 см среды по 6.5.3.14 и 1,0 см
среды по 6.5.3.14 и 1,0 см взвеси Staphylococcus aureus;
взвеси Staphylococcus aureus;
- в пробирку N 5 - 10,0 см среды по 6.5.3.14 и 1,0 см
среды по 6.5.3.14 и 1,0 см взвеси Pseudomonos aeruginosa.
взвеси Pseudomonos aeruginosa.
Контролем служат пробирки с питательными средами и соответствующими тест-культурами, в которые вместо испытуемого жидкого СГПР вносят то же количество стерильной дистиллированной воды.
Посевы инкубируют при температуре (30±1) °С в течение 48 ч. В случае отсутствия роста тест-штаммов микроорганизмов в опытных пробирках на соответствующих питательных средах считают, что данное жидкое СГПР обладает антимикробным действием.
В случае установления антимикробной активности жидкого СГПР перед проведением испытаний на микробиологическую чистоту антимикробную активность устраняют путем увеличения разведения жидкого СГПР или методом мембранной фильтрации по 6.5.5.6.
6.5.5.2 Определение общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
Метод основан на выявлении и количественном подсчете всех выросших колоний микроорганизмов при культивировании посевов в аэробных условиях на питательных средах определенного состава при инкубации в течение 72 ч при температуре (30±1) °С.
Испытание проводят глубинным методом посева в плотные среды в соответствии с ГОСТ 26670.
1 см исследуемого образца в разведении 1:10 и 1:100, приготовленный по 6.5.4.2, вносят в стерильные чашки Петри (по две на каждое разведение).
исследуемого образца в разведении 1:10 и 1:100, приготовленный по 6.5.4.2, вносят в стерильные чашки Петри (по две на каждое разведение).
Чашки заливают расплавленной и охлажденной до температуры 40-50 °С средой по 6.5.3.6. Содержимое чашек быстро и осторожно перемешивают вращательными движениями, дают застыть и переворачивают чашки.
Посевы инкубируют при температуре от 30 °С до 35 °С в течение 72 ч, после чего проводят подсчет колоний в соответствии с ГОСТ 26670.
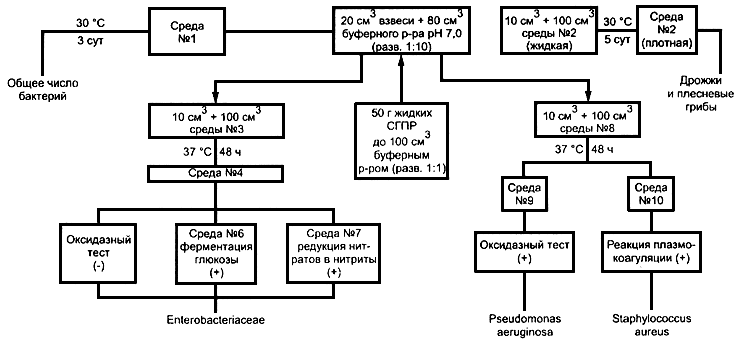
6.5.5.3 Выявление и идентификация бактерий семейства Enterobacteriaceae
Метод основан на выявлении бактерий семейства Enterobacteriaceae с использованием накопительных и селективных агаризованных питательных сред с дальнейшей идентификацией выявленных бактерий по биохимическим тестам, являющимся основой современной классификации кишечных бактерий.
В колбу со 100 см среды обогащения по 6.5.3.8 вносят 10 см
среды обогащения по 6.5.3.8 вносят 10 см исследуемого образца в разведении 1:10 и перемешивают.
исследуемого образца в разведении 1:10 и перемешивают.
Посевы инкубируют при температуре (37±1) °С в течение 24 - 48 ч.
При наличии роста (помутнение среды и изменение ее цвета из красного в желтый при расщеплении глюкозы) делают пересев петлей на чашки с агаром Эндо по 6.5.3.9.
Посевы на указанную среду инкубируют при температуре (37±1) °С 24 - 48 ч.
При отсутствии роста на селективных агаризованных средах, типичных для семейства Enterobacteriaceae колоний (таблица 2), считают, что в образце нет представителей данного семейства.
Таблица 2 - Морфологическая характеристика бактерий семейства Enterobacteriaceae на дифференциально-диагностической среде N 4 (агар Эндо)
|
Характерная морфология колоний |
Микроскопия окрашенных препаратов |
|
|
|
Подозрительные по морфологии колонии пересевают (каждую отдельно) на скошенную в пробирках среду (6.5.3.6) и инкубируют их при температуре (37±1) °С 24 ч.
Из каждой пробирки с чистой культурой готовят мазки и делают пересев на среды по 6.5.3.10 и 6.5.3.11. В половину пробирок со средой по 6.5.3.10 вносят по 0,5 см стерильного вазелинового масла. Все посевы инкубируют при температуре (37±1) °С в течение 20 - 24 ч. Изменение цвета среды по 6.5.3.10 с вазелиновым маслом из красного в желтый свидетельствует о ферментации глюкозы исследуемой культурой. Появление красного окрашивания среды по 6.5.3.11 при внесении в нее реактива Грисса свидетельствует о редукции нитратов в нитриты. Параллельно исследуют чистые культуры на наличие фермента цитохромоксидазы с помощью реактива по 6.5.3.13.
стерильного вазелинового масла. Все посевы инкубируют при температуре (37±1) °С в течение 20 - 24 ч. Изменение цвета среды по 6.5.3.10 с вазелиновым маслом из красного в желтый свидетельствует о ферментации глюкозы исследуемой культурой. Появление красного окрашивания среды по 6.5.3.11 при внесении в нее реактива Грисса свидетельствует о редукции нитратов в нитриты. Параллельно исследуют чистые культуры на наличие фермента цитохромоксидазы с помощью реактива по 6.5.3.13.
На полоску фильтровальной бумаги, смоченной реактивом по 6.5.3.13, наносят петлей или стеклянной палочкой суточную исследуемую культуру бактерий. Синее окрашивание, появляющееся через 2-5 мин, свидетельствует о положительной оксидазной реакции.
Если в образце обнаружены грамотрицательные неспоровые палочки, которые дают отрицательную оксидазную реакцию, ферментируют глюкозу с образованием кислоты (или кислоты и газа) и восстанавливают нитраты в нитриты, препарат содержит бактерии семейства Enterobacteriaceae.
6.5.5.4 Выявление и идентификация Pseudomonas aeruginosa, Staphylococcus aureus
Метод выявления Р. aeruginosa и S. aureus основан на использовании общей жидкой питательной среды и селективных агаризованных питательных сред, рекомендованных для этих видов бактерий, с последующей идентификацией выделенных микроорганизмов с помощью биохимических тестов.
В колбу со 100 см среды по 6.5.3.14 вносят 10 см
среды по 6.5.3.14 вносят 10 см исследуемого образца в разведении 1:10 и перемешивают.
исследуемого образца в разведении 1:10 и перемешивают.
Посевы инкубируют при температуре (37±1) °С в течение 24 - 48 ч.
При наличии роста делают пересев петлей на среды по 6.5.3.15 и 6.5.3.16, разлитые в чашки Петри.
Новые посевы инкубируют при температуре (37±1) °С в течение 24 - 48 ч.
При отсутствии на чашках со средами по 6.5.3.15 и 6.5.3.16 подозрительных колоний, соответствующих морфологической характеристике, данной в таблицах 3 и 4, считают, что в образце нет бактерий Р. aeruginosa и S. aureus.
Таблица 3 - Морфологическая характеристика Р. aeruginosa на дифференциально-диагностической среде (6.5.3.15)
|
Характерная морфология колоний |
Микроскопия окрашенных препаратов |
|
|
|
Таблица 4 - Морфологическая характеристика S. aureus на дифференциально-диагностической среде (6.5.3.16)
|
Характерная морфология колоний |
Микроскопия окрашенных препаратов |
|
|
|
При наличии на среде по 6.5.3.15 зеленоватых флюоресцирующих колоний грамотрицательных неспоровых палочек, выделяющих сине-зеленый пигмент в питательный агар, культуру исследуют на наличие фермента цитохромоксидазы.
Если в образце обнаружены грамотрицательные неспоровые палочки, дающие положительную оксидазную реакцию и образующие сине-зеленый пигмент пиоцианин, препарат содержит Р. aeruginosa.
Наличие на среде по 6.5.3.16 золотисто-желтых колоний грамположительных кокков, окруженных желтыми зонами, свидетельствует о ферментации маннита. Чистую культуру стафилококка исследуют на наличие фермента плазмокоагулазы.
Если в образце обнаружены грамположительные кокки, которые ферментируют маннит и дают положительную реакцию плазмокоагуляции, препарат содержит S. aureus.
Для постановки реакции плазмокоагуляции используют сухую кроличью цитратную плазму, которую разводят согласно инструкции по применению.
Общая схема выделения и идентификации микроорганизмов представлена в приложении А.
6.5.5.5 Выявление плесневых грибов и дрожжей
Метод основан на выявлении жизнеспособных плесневых грибов и дрожжей по характерным для них признакам роста на благоприятных питательных средах и морфологии клеток при микроскопировании.
10 см исследуемого образца в разведении 1:10 вносят в колбу со 100 см
исследуемого образца в разведении 1:10 вносят в колбу со 100 см жидкой питательной среды по 6.5.3.7 (среда Сабуро).
жидкой питательной среды по 6.5.3.7 (среда Сабуро).
Посевы инкубируют при температуре (30±1) °С в течение 5 сут, ежедневно контролируя появление признаков роста микроорганизмов.
В летний период допускается выдерживать посевы при температуре от 20 °С до 25 °С.
При наличии роста (помутнение среды, осадок, пленка, комочки, нити) делают пересев петлей на плотную питательную среду по 6.5.3.7 и готовят препараты для микроскопирования.
При отсутствии роста плесневых грибов и дрожжей в посевах считают, что в образце нет представителей этой группы микроорганизмов.
Обнаружение на питательных средах признаков роста дрожжей или плесеней и подтверждение их присутствия микроскопированием указывают на наличие последних в жидком СГПР.
6.5.5.6 Метод мембранной фильтрации
Фильтрацию проводят в асептических условиях на приборе вакуумного фильтрования ПВФ-47.
Перед проведением испытаний воронку с фильтром стерилизуют любым способом, обеспечивающим стерильность, а также сохранность рабочих характеристик мембраны и всей установки. Фильтрацию проводят при вакууме 93,3 кПа (70 см рт. ст.) при скорости вытекания воды 55-75 см /мин.
/мин.
Пять проб по 10 см жидкого СГПР, приготовленных по 6.5.4.2 (в разведении 1:10), фильтруют через нитроцеллюлозные мембранные фильтры размером пор (0,45±0,02) мкм (мембрана Владипор типа МФАС-Б-5 или МФА-МА-N 5).
жидкого СГПР, приготовленных по 6.5.4.2 (в разведении 1:10), фильтруют через нитроцеллюлозные мембранные фильтры размером пор (0,45±0,02) мкм (мембрана Владипор типа МФАС-Б-5 или МФА-МА-N 5).
После окончания фильтрации каждую мембрану промывают 3-5 порциями по 100 см стерильного физиологического раствора. Отмытые мембраны извлекают из воронки.
стерильного физиологического раствора. Отмытые мембраны извлекают из воронки.
Две мембраны помещают в чашки Петри (по одной на каждую чашку), накладывая их на поверхность питательной среды по 6.5.3.6 для культивирования аэробных и факультативно-анаэробных микроорганизмов.
Остальные мембраны помещают по одной во флаконы с соответствующими питательными средами:
1 - для выращивания плесневых грибов и дрожжей (среда Сабуро) по 6.5.3.7;
2 - для обогащения Enterobacteriaceae по 6.5.3.8;
3 - для выращивания Р. aeruginosa и S. aureus по 6.5.3.14.
Чашки Петри и флаконы инкубируют и проводят подсчет колоний в соответствии с 6.5.5.2 - 6.5.5.5.
Для фильтрования жидкого СГПР, содержащего небольшое количество взвешенных частиц, используют предварительную фильтрацию через префильтр. В качестве префильтров можно использовать фильтры типа АР 15 (Millipore), картон для предварительной фильтрации марки КФБЖ, картон для предварительной фильтрации марки КФМП и другие материалы, способные эффективно задерживать твердые частицы.
6.6 Определение водородного показателя рН - по ГОСТ 29188.2.
6.7 Определение массовой доли суммы тяжелых металлов
Массовую долю суммы тяжелых металлов определяют с N, N-диэтилдитиокарбаматом натрия электрофотометрическим методом (арбитражный метод) по 6.7.1, с сернистым натрием - визуально-колориметрическим методом по 6.7.2.
Допускается использовать для анализа атомно-абсорбционный метод по ГОСТ 30178.
6.7.1 Определение массовой доли суммы тяжелых металлов с N, N-диэтилдитиокарбаматом натрия электрофотометрическим методом (арбитражный метод)
Метод основан на электрофотометрическом измерении оптической плотности окрашенного раствора карбамата меди, полученного после обменной реакции хлороформного экстракта диэтилдитиокарбаматов тяжелых металлов с раствором сернокислой меди.
6.7.1.1 Аппаратура и реактивы
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
Фотоэлектроколориметр типа КФК-3, обеспечивающий измерение оптической плотности при длине волны 400 - 450 нм.
Электроплитка по ГОСТ 14919.
Секундомер.
Печь муфельная, обеспечивающая автоматическое регулирование температуры от 400 °С до 450 °С.
Тигель высокий 3 по ГОСТ 9147.
Колбы 1(2)-50, 100, 1000-2 по ГОСТ 1770.
Цилиндры 1-5, 25, 50 по ГОСТ 1770.
Пипетки 6(7)-1-5, 10 по ГОСТ 29227.
Воронка ВД-1(3)-250 ХС по ГОСТ 25336.
Воронка В-75-110 ХС по ГОСТ 25336.
Стакан В-1-250 ТХС по ГОСТ 25336.
Фильтр “белая лента”.
Бумага индикаторная универсальная.
Аммиак водный по ГОСТ 3760.
Кислота соляная по ГОСТ 3118, раствор 1:1.
Натрия N, N-диэтилдитиокарбамат по ГОСТ 8864, раствор массовой долей 1,0%.
Натрий лимоннокислый 5,5-водный по ГОСТ 22280, раствор массовой долей 4,0%.
Хлороформ фармакопейный [3] или по ГОСТ 20015 очищенный, высший сорт, нестабилизированный.
Натрия гидроокись по ГОСТ 4328, раствор массовой долей 0,1%.
Кислота серная по ГОСТ 4204.
Медь сернокислая по ГОСТ 4165, раствор массовой долей 5,0%.
Натрий сернокислый безводный по ГОСТ 4166.
Вата медицинская гигроскопичная по ГОСТ 5556.
Вода дистиллированная по ГОСТ 6709.
Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов по качеству не ниже вышеуказанных.
6.7.1.2 Приготовление стандартных растворов меди
6.7.1.2.1 Приготовление раствора А
В мерной колбе вместимостью 1000 см растворяют в воде 0,3929 г сернокислой меди, приливают 5 см
растворяют в воде 0,3929 г сернокислой меди, приливают 5 см серной кислоты, доливают до метки водой и перемешивают. 1 см
серной кислоты, доливают до метки водой и перемешивают. 1 см раствора А содержит 0,1 мг меди.
раствора А содержит 0,1 мг меди.
Допускается использование готовых стандартных растворов меди.
6.7.1.2.2 Приготовление раствора Б
В мерную колбу вместимостью 100 см вносят пипеткой 20 см
вносят пипеткой 20 см раствора А, доливают до метки водой и перемешивают.
раствора А, доливают до метки водой и перемешивают.
1 см раствора Б содержит 0,02 мг меди.
раствора Б содержит 0,02 мг меди.
6.7.1.3 Построение градуировочного графика
В делительные воронки вносят пипеткой 0; 1; 2; 3; 4; 5; 6; 7 см раствора Б, что соответствует 0; 0,02; 0,04; 0,06; 0,08; 0,10; 0,12; 0,14 мг меди.
раствора Б, что соответствует 0; 0,02; 0,04; 0,06; 0,08; 0,10; 0,12; 0,14 мг меди.
В каждую воронку приливают 25 см дистиллированной воды, нейтрализуют аммиаком до рН 7,0 - 7,5 по универсальной индикаторной бумаге, приливают 5 см
дистиллированной воды, нейтрализуют аммиаком до рН 7,0 - 7,5 по универсальной индикаторной бумаге, приливают 5 см раствора лимоннокислого натрия, 5 см
раствора лимоннокислого натрия, 5 см раствора диэтилдитиокарбамата натрия (раствор хранят не более 7 дней) и перемешивают. Через 15 мин приливают 15 см
раствора диэтилдитиокарбамата натрия (раствор хранят не более 7 дней) и перемешивают. Через 15 мин приливают 15 см хлороформа, закрывают воронку пробкой и энергично встряхивают в течение 2 мин, периодически открывая пробку. После разделения слоев хлороформный экстракт диэтилдитиокарбамата меди, окрашенный в желтый цвет, фильтруют через слой сернокислого безводного натрия и ватный фильтр в мерную колбу вместимостью 50 см
хлороформа, закрывают воронку пробкой и энергично встряхивают в течение 2 мин, периодически открывая пробку. После разделения слоев хлороформный экстракт диэтилдитиокарбамата меди, окрашенный в желтый цвет, фильтруют через слой сернокислого безводного натрия и ватный фильтр в мерную колбу вместимостью 50 см . Проводят повторную экстракцию, приливая к оставшемуся водному слою еще 15 см
. Проводят повторную экстракцию, приливая к оставшемуся водному слою еще 15 см хлороформа, после разделения слоев хлороформный экстракт фильтруют в ту же мерную колбу. Содержимое мерной колбы доводят хлороформом до метки и перемешивают.
хлороформа, после разделения слоев хлороформный экстракт фильтруют в ту же мерную колбу. Содержимое мерной колбы доводят хлороформом до метки и перемешивают.
Через 5 мин измеряют оптическую плотность полученного раствора на фотоэлектроколориметре при длине волны 400-450 нм в кювете толщиной поглощающего свет слоя 20 мм. В качестве раствора сравнения применяют хлороформный экстракт раствора, не содержащего меди.
Для построения градуировочного графика берут среднее арифметическое результатов трех измерений оптической плотности каждого раствора с известной массой меди. По полученным средним значениям оптической плотности растворов и соответствующим им массам меди в миллиграммах строят градуировочпый график.
6.7.1.4 Подготовка пробы к испытанию
В тигле взвешивают 5,0 г жидкого СГПР, записывают результат до четвертого знака, упаривают досуха на электроплитке, прокаливают в муфельной печи в течение 3 ч при температуре от 400 °С до 450 °С.
После охлаждения содержимое тигля переносят в стакан, тигель нагревают до кипения с раствором соляной кислоты (15 см ), раствор сливают в стакан и снова нагревают до кипения, затем охлаждают, нейтрализуют аммиаком до рН 7,0-7,5 по универсальной индикаторной бумаге и фильтруют в делительную воронку, отфильтровывая осадок гидроокисей железа и алюминия. Осадок на фильтре промывают 2 раза дистиллированной водой по 10 см
), раствор сливают в стакан и снова нагревают до кипения, затем охлаждают, нейтрализуют аммиаком до рН 7,0-7,5 по универсальной индикаторной бумаге и фильтруют в делительную воронку, отфильтровывая осадок гидроокисей железа и алюминия. Осадок на фильтре промывают 2 раза дистиллированной водой по 10 см .
.
К фильтрату в делительной воронке приливают 5 см раствора лимоннокислого натрия, 5 см
раствора лимоннокислого натрия, 5 см раствора диэтилдитиокарбамата натрия и перемешивают. Через 15 мин проводят двукратную экстракцию карбаматов тяжелых металлов хлороформом в тех же условиях, как при построении градуировочного графика (6.7.1.3).
раствора диэтилдитиокарбамата натрия и перемешивают. Через 15 мин проводят двукратную экстракцию карбаматов тяжелых металлов хлороформом в тех же условиях, как при построении градуировочного графика (6.7.1.3).
Хлороформные экстракты сливают во вторую делительную воронку, в которую приливают 50 см промывного раствора гидроокиси натрия для удаления избытка диэтилдитиокарбамата натрия, воронку закрывают пробкой и энергично встряхивают в течение 2 мин. После полного расслоения промытый хлороформный экстракт сливают в третью делительную воронку, в которую приливают 10 см
промывного раствора гидроокиси натрия для удаления избытка диэтилдитиокарбамата натрия, воронку закрывают пробкой и энергично встряхивают в течение 2 мин. После полного расслоения промытый хлороформный экстракт сливают в третью делительную воронку, в которую приливают 10 см раствора сернокислой меди, закрывают воронку пробкой и встряхивают в течение 3 мин. После разделения слоев хлороформный экстракт фильтруют через слой сернокислого безводного натрия и ватный фильтр в мерную колбу вместимостью 50 см
раствора сернокислой меди, закрывают воронку пробкой и встряхивают в течение 3 мин. После разделения слоев хлороформный экстракт фильтруют через слой сернокислого безводного натрия и ватный фильтр в мерную колбу вместимостью 50 см , водный слой промывают еще 10 см
, водный слой промывают еще 10 см хлороформа, который фильтруют в ту же мерную колбу. Содержимое мерной колбы доводят до метки хлороформом, перемешивают и через 5 мин измеряют оптическую плотность раствора.
хлороформа, который фильтруют в ту же мерную колбу. Содержимое мерной колбы доводят до метки хлороформом, перемешивают и через 5 мин измеряют оптическую плотность раствора.
6.7.1.5 Проведение испытания
Оптическую плотность раствора, полученного по 6.7.1.4, измеряют на фотоэлектроколориметре, как указано в 6.7.1.3. Раствором сравнения служит раствор контрольного опыта, проведенный через все стадии испытания.
По оптической плотности раствора по градуировочному графику находят массу меди в миллиграммах, по которой рассчитывают массовую долю суммы тяжелых металлов в жидком СГПР по 6.7.1.6.
6.7.1.6 Обработка результатов
Массовую долю суммы тяжелых металлов 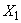 , %, или
, %, или 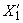 , млн
, млн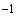 (мг/кг), вычисляют по формулам:
(мг/кг), вычисляют по формулам:
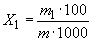 ; (1)
; (1)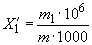 , (2)
, (2)
где 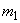 - масса меди, найденная по градуировочному графику, мг;
- масса меди, найденная по градуировочному графику, мг;
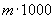 - масса навески жидкого СГПР, мг.
- масса навески жидкого СГПР, мг.
За результат измерения принимают среднее арифметическое результатов двух параллельных измерений, расхождение между которыми не должно превышать 0,0003%; расхождение между результатами измерений в двух лабораториях не должно превышать 0,0007%, пределы абсолютной погрешности измерений ±0,0004% при вероятности 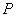 =0,95.
=0,95.
6.7.2 Определение массовой доли суммы тяжелых металлов с сернистым натрием визуально-колориметрическим методом
Метод основан на визуальном сравнении интенсивности окраски растворов сульфидов тяжелых металлов с раствором сравнения - сульфидом свинца.
6.7.2.1 Аппаратура и реактивы
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
Пробирки по ГОСТ 25336 вместимостью 25 см .
.
Пипетки 6(7)-1-5, 10 по ГОСТ 29227.
Колбы 1(2)-50, 100, 1000-2 по ГОСТ 1770.
Бумага фильтровальная по ГОСТ 12026.
Бумага индикаторная универсальная.
рН-метр любой марки с набором электродов погрешностью измерения ±0,1 рН.
Свинец азотнокислый по ГОСТ 4236.
Кислота уксусная по ГОСТ 61, раствор концентрации  (СН
(СН СООН)=1,0 моль/дм
СООН)=1,0 моль/дм (1н.).
(1н.).
Кислота азотная по ГОСТ 4461, раствор концентрации  (НNО
(НNО )=3,0 моль/дм
)=3,0 моль/дм (3н.).
(3н.).
Натрий сернистый по ГОСТ 2053.
Глицерин пo ГOCT 6259.
Вода дистиллированная по ГОСТ 6709.
6.7.2.2 Подготовка к испытанию
6.7.2.2.1 Приготовление основного раствора свинца
В мерной колбе вместимостью 1000 см растворяют 159,8 мг азотнокислого свинца в 100 см
растворяют 159,8 мг азотнокислого свинца в 100 см дистиллированной воды, добавляют 1 см
дистиллированной воды, добавляют 1 см концентрированной азотной кислоты, перемешивают, доводят объем дистиллированной водой до метки и снова перемешивают. Основной раствор содержит 100 мкг свинца в 1 см
концентрированной азотной кислоты, перемешивают, доводят объем дистиллированной водой до метки и снова перемешивают. Основной раствор содержит 100 мкг свинца в 1 см .
.
Готовят и хранят раствор в стеклянных сосудах, свободных от растворимых солей свинца, не более 30 дней.
6.7.2.2.2 Приготовление стандартного раствора свинца
В мерную колбу вместимостью 100 см вносят пипеткой 10 см
вносят пипеткой 10 см основного раствора азотнокислого свинца, доливают водой до метки и перемешивают. Стандартный раствор свинца содержит 10 мкг свинца в 1 см
основного раствора азотнокислого свинца, доливают водой до метки и перемешивают. Стандартный раствор свинца содержит 10 мкг свинца в 1 см .
.
Готовят раствор в день проведения испытаний.
6.7.2.2.3 Приготовление раствора сернистого (сульфида) натрия
2,0 г сернистого натрия растворяют в 80 см дистиллированной воды в мерной колбе вместимостью 100 см
дистиллированной воды в мерной колбе вместимостью 100 см , добавляют 2-3 капли глицерина, доводят объем дистиллированной водой до метки и перемешивают.
, добавляют 2-3 капли глицерина, доводят объем дистиллированной водой до метки и перемешивают.
6.7.2.2.4 Приготовление градуировочных растворов
В пробирки вместимостью 25 см вносят пипеткой 0,5; 1; 1,5 и 2 см
вносят пипеткой 0,5; 1; 1,5 и 2 см стандартного раствора свинца по 6.7.2.2, прибавляют по 10 см
стандартного раствора свинца по 6.7.2.2, прибавляют по 10 см дистиллированной воды, доводят рН раствора уксусной кислотой до рН 3,0-4,0 (по универсальной индикаторной бумаге), добавляют дистиллированную воду до объема 20 см
дистиллированной воды, доводят рН раствора уксусной кислотой до рН 3,0-4,0 (по универсальной индикаторной бумаге), добавляют дистиллированную воду до объема 20 см и перемешивают.
и перемешивают.
Полученные растворы содержат соответственно 5; 10; 15 и 20 мкг свинца.
6.7.2.2.5 Подготовка пробы к испытанию
В колориметрическую пробирку вместимостью 25 см вносят навеску жидкого СГПР массой 1,0 г, прибавляют 10 см
вносят навеску жидкого СГПР массой 1,0 г, прибавляют 10 см дистиллированной воды, доводят рН раствора уксусной кислотой до рН 3,0-4,0, добавляют дистиллированную воду до объема 20 см
дистиллированной воды, доводят рН раствора уксусной кислотой до рН 3,0-4,0, добавляют дистиллированную воду до объема 20 см и тщательно перемешивают.
и тщательно перемешивают.
6.7.2.3 Проведение испытания
В каждую из пробирок, содержащих испытуемый и свежеприготовленный градуировочный растворы, вносят по 0,05 см свежеприготовленного раствора сернистого натрия, перемешивают и выдерживают 5 мин.
свежеприготовленного раствора сернистого натрия, перемешивают и выдерживают 5 мин.
Сравнивают окраску жидкости в испытуемом растворе с окраской градуировочных растворов.
Оценивают визуально окраску жидкости в каждой пробирке просмотром в проходящем свете по оси пробирок на фоне белой поверхности.
6.7.2.4 Обработка результатов
Если интенсивность окраски испытуемого раствора меньше, чем градуировочного с содержанием свинца 5 мкг, делают вывод, что количество тяжелых металлов в испытуемом образце жидкого СГПР меньше 5 мкг (0,0005%).
Если интенсивность окраски испытуемого раствора больше, чем градуировочного с содержанием свинца 5 мкг, и меньше, чем раствора с 10 мкг свинца, делают вывод, что количество тяжелых металлов в испытуемом образце жидкого СГПР меньше 10 мкг (0,0010%).
Если интенсивность окраски испытуемого раствора больше, чем градуировочного с содержанием свинца 10 мкг, и меньше, чем раствора с 15 мкг свинца, делают вывод, что количество тяжелых металлов в испытуемом образце жидкого СГПР меньше 15 мкг (0,0015%).
Если интенсивность окраски испытуемого раствора больше, чем градуировочного с содержанием свинца 15 мкг, и меньше, чем раствора с 20 мкг свинца, делают вывод, что количество тяжелых металлов в испытуемом образце жидкого СГПР меньше 20 мкг (0,002%).
Если интенсивность окраски испытуемого раствора больше, чем градуировочного с содержанием свинца 20 мкг, делают вывод, что количество тяжелых металлов в испытуемом образце жидкого СГПР больше 20 мкг (0,002%).
Результаты испытаний соответствуют значениям массовых долей тяжелых металлов в жидких СГПР [млн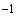 (мг/кг) или %].
(мг/кг) или %].
6.8 Определение массовой доли фторидов
Массовую долю фторидов определяют потенциометрическим методом с фторидным электродом.
6.8.1 Аппаратура и реактивы
рН-метр-милливольтметр-иономер типа pH/ISE-metre ORION модель 920А, АНИОН-410 или аналогичный цифровой прибор, обеспечивающий измерения с точностью ±0,02 ед. pF и имеющий входное сопротивление более 100 МОм.
Электрод фторидный (простой или комбинированный) ORION модель 9409, 9609, Элит-221 или аналогичный с погрешностью не более 2% в диапазоне 10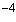 - 10
- 10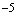 М.
М.
Электрод сравнения хлорсеребряный ORION модель 9001, ЭВЛ-1М3 или аналогичный.
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
Термостат, обеспечивающий температуру 60 °С.
Баня водяная.
Мешалка магнитная.
Секундомер.
Термометр по ГОСТ 28498, диапазоном измерения температуры от 0 °С до 100 °С с ценой деления 1 °С.
Колбы 2-100-2, 2-1000-2 по ГОСТ 1770.
Пипетки 4-1-1, 5-1-1, 6-1-5, 6-1-10, 6-1-25, 7-1-5, 7-1-10, 7-1-25 по ГОСТ 29227.
Сосуды полиэтиленовые вместимостью 100, 250 и 1000 см .
.
Стаканы химические мерные В-1-100-ТС вместимостью 50, 100, 150 см по ГОСТ 25336.
по ГОСТ 25336.
Стаканы полиэтиленовые вместимостью 30 см .
.
Цилиндры 1-25, 3-25 по ГОСТ 1770.
Кислота уксусная ледяная по ГОСТ 61.
Соль динатриевая этилендиамин-N, N, N', N'-тетрауксусной кислоты, 2-водная (трилон Б) по ГОСТ 10652.
Натрий лимоннокислый 5,5-водный по ГОСТ 22280.
Натрий хлористый по ГОСТ 4233.
Натрий фтористый по ГОСТ 4463, предварительно высушенный до постоянной массы при 105 °С.
Натрия гидроокись по ГОСТ 4328, спиртовой раствор концентрации  (NaOH)=0,25 моль/дм
(NaOH)=0,25 моль/дм (0,25н.).
(0,25н.).
ЦДТА (комплексон IV)-циклогексилендинитрило-тетрауксусная кислота или 1,2-диаминциклогексан-N, N, N', N'-тетрауксусная кислота.
Вода дистиллированная по ГОСТ 6709.
Допускается применение аппаратуры с метрологическими и техническими характеристиками и реактивов по качеству не ниже вышеуказанных.
6.8.2 Подготовка к испытанию
6.8.2.1 Приготовление буферных растворов, регулирующих общую ионную силу (БРОИС) рН 5,0-5,5
Раствор 1: помещают в мерный стакан вместимостью 1000 см 58 г хлористого натрия, 57 см
58 г хлористого натрия, 57 см ледяной уксусной кислоты, добавляют 4 г ЦДТА (комплексона IV) или 0,3 г лимоннокислого натрия и 500 см
ледяной уксусной кислоты, добавляют 4 г ЦДТА (комплексона IV) или 0,3 г лимоннокислого натрия и 500 см дистиллированной воды, перемешивают на магнитной мешалке и устанавливают 5 н. раствором гидроокиси натрия рН в пределах 5,0-5,5 (с охлаждением на ледяной бане), добавляют дистиллированную воду до метки.
дистиллированной воды, перемешивают на магнитной мешалке и устанавливают 5 н. раствором гидроокиси натрия рН в пределах 5,0-5,5 (с охлаждением на ледяной бане), добавляют дистиллированную воду до метки.
Раствор 2: в мерную колбу вместимостью 500 см помещают 52,0 г уксуснокислого натрия, 29,2 г хлористого натрия, 3,0 г лимоннокислого натрия, 0,3 г трилона Б и 8 см
помещают 52,0 г уксуснокислого натрия, 29,2 г хлористого натрия, 3,0 г лимоннокислого натрия, 0,3 г трилона Б и 8 см уксусной кислоты. Приливают 200-300 см
уксусной кислоты. Приливают 200-300 см дистиллированной воды и перемешивают. рН раствора проверяют потенциометрическим методом и, при необходимости, доводят до требуемого значения рН раствором гидроокиси натрия или уксусной кислотой.
дистиллированной воды и перемешивают. рН раствора проверяют потенциометрическим методом и, при необходимости, доводят до требуемого значения рН раствором гидроокиси натрия или уксусной кислотой.
Срок хранения растворов - 12 мес.
6.8.2.2 Приготовление основных стандартных растворов фтористого натрия
Раствор 1: в мерную колбу вместимостью 1000 см помещают 2,211 г фтористого натрия, растворяют в дистиллированной воде и доводят объем раствора водой до метки. Концентрация фторида в растворе составляет 1000 мг/дм
помещают 2,211 г фтористого натрия, растворяют в дистиллированной воде и доводят объем раствора водой до метки. Концентрация фторида в растворе составляет 1000 мг/дм .
.
Раствор 2: в мерную колбу вместимостью 1000 см помещают 4,1990 г фтористого натрия, растворяют в дистиллированной воде и доводят объем раствора водой до метки. Концентрация фторида в растворе составляет 1900 мг/дм
помещают 4,1990 г фтористого натрия, растворяют в дистиллированной воде и доводят объем раствора водой до метки. Концентрация фторида в растворе составляет 1900 мг/дм (pF=1).
(pF=1).
Растворы хранят в полиэтиленовом сосуде с плотно закрытой пробкой. Срок хранения - 6 мес.
6.8.2.3 Приготовление рабочих стандартных растворов фтористого натрия
Для приготовления раствора фтористого натрия концентрацией фторида 100 мг/дм 10 см
10 см основного стандартного раствора фтористого натрия 1 помещают в мерную колбу вместимостью 100 см
основного стандартного раствора фтористого натрия 1 помещают в мерную колбу вместимостью 100 см , доводят объем дистиллированной водой до метки и перемешивают.
, доводят объем дистиллированной водой до метки и перемешивают.
Для приготовления раствора фтористого натрия концентрацией фторида 10 мг/дм 10 см
10 см рабочего стандартного раствора фтористого натрия концентрацией фторида 100 мг/дм
рабочего стандартного раствора фтористого натрия концентрацией фторида 100 мг/дм помещают в мерную колбу вместимостью 100 см
помещают в мерную колбу вместимостью 100 см , доводят объем дистиллированной водой до метки и перемешивают.
, доводят объем дистиллированной водой до метки и перемешивают.
Для приготовления раствора фтористого натрия концентрацией фторида 1 мг/дм 10 см
10 см рабочего стандартного раствора фтористого натрия концентрацией фторида 10 мг/дм
рабочего стандартного раствора фтористого натрия концентрацией фторида 10 мг/дм помещают в мерную колбу вместимостью 100 см
помещают в мерную колбу вместимостью 100 см , доводят объем дистиллированной водой до метки и перемешивают.
, доводят объем дистиллированной водой до метки и перемешивают.
Для приготовления раствора фтористого натрия концентрацией фторида 190 мг/дм (pF=2) 10 см
(pF=2) 10 см основного стандартного раствора фтористого натрия 2 помещают в мерную колбу вместимостью 100 см
основного стандартного раствора фтористого натрия 2 помещают в мерную колбу вместимостью 100 см , доводят объем дистиллированной водой до метки и перемешивают.
, доводят объем дистиллированной водой до метки и перемешивают.
Для приготовления раствора фтористого натрия концентрацией фторида 19 мг/дм (pF=3) 10 см
(pF=3) 10 см рабочего стандартного раствора фтористого натрия концентрацией фторида 190 мг/дм
рабочего стандартного раствора фтористого натрия концентрацией фторида 190 мг/дм помещают в мерную колбу вместимостью 100 см
помещают в мерную колбу вместимостью 100 см , доводят объем дистиллированной водой до метки и перемешивают.
, доводят объем дистиллированной водой до метки и перемешивают.
Для приготовления раствора фтористого натрия концентрацией фторида 1,9 мг/дм (pF=4) 10 см
(pF=4) 10 см рабочего стандартного раствора фтористого натрия концентрацией фторида 19 мг/дм
рабочего стандартного раствора фтористого натрия концентрацией фторида 19 мг/дм помещают в мерную колбу вместимостью 100 см
помещают в мерную колбу вместимостью 100 см , доводят объем дистиллированной водой до метки и перемешивают.
, доводят объем дистиллированной водой до метки и перемешивают.
Растворы хранят в полиэтиленовых сосудах с плотно закрытой пробкой. Срок хранения - 6 мес.
6.8.2.4 Градуировка измерительного устройства
Подготавливают электроды и рН-метр-милливольтметр-иономер в соответствии с инструкцией по эксплуатации прибора.
Градуировка заключается в последовательной регистрации показаний иономера (мг/дм или мВ, или ед. pF) при погружении фторидного и хлорсеребряного электродов в рабочие стандартные растворы фторида по 6.8.2.3, предварительно смешанные в объемном соотношении 1:1 с буферным раствором БРОИС 1 или 2.
или мВ, или ед. pF) при погружении фторидного и хлорсеребряного электродов в рабочие стандартные растворы фторида по 6.8.2.3, предварительно смешанные в объемном соотношении 1:1 с буферным раствором БРОИС 1 или 2.
В ходе измерений растворы постоянно перемешивают на магнитной мешалке. Показания милливольтметра регистрируют через 3 мин после погружения электродов. Перед каждым измерением электроды тщательно промывают дистиллированной водой до постоянного значения потенциала, характерного для отмытого электрода, впитывающей бумагой или тканью осторожно высушивают мембрану фторидного электрода.
Все измерения проводят при постоянной температуре растворов, равной (20±1) °С.
Крутизна градуировочной (электродной) функции характерна для каждого электрода и в интервале концентраций фторида 1-10 мг/дм , 10-100 мг/дм
, 10-100 мг/дм , 100-1000 мг/дм
, 100-1000 мг/дм (pF 4-3, pF 3-2, pF 2-1) обычно составляет 52-60 мВ.
(pF 4-3, pF 3-2, pF 2-1) обычно составляет 52-60 мВ.
6.8.3 Проведение испытания
От 5 до 10 см жидкого СГПР помещают в полиэтиленовый стакан вместимостью 30 см
жидкого СГПР помещают в полиэтиленовый стакан вместимостью 30 см , добавляют равный объем буферного раствора БРОИС 1 или 2 и перемешивают на магнитной мешалке. Показания прибора (мг/дм
, добавляют равный объем буферного раствора БРОИС 1 или 2 и перемешивают на магнитной мешалке. Показания прибора (мг/дм или мВ, или ед. pF) регистрируют через 3 мин после погружения электродов.
или мВ, или ед. pF) регистрируют через 3 мин после погружения электродов.
6.8.4 Обработка результатов
Концентрацию фторида в пробе 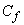 , мг/дм
, мг/дм , определяют следующим образом:
, определяют следующим образом:
- если прибор показывает значение электродного потенциала в мВ, концентрацию определяют расчетным путем по уравнению Нернста (по результатам измерения разности потенциалов)
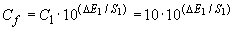 , (3)
, (3)
где 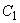 - концентрация фторида в выбранном рабочем стандартном растворе, например 10 мг/дм
- концентрация фторида в выбранном рабочем стандартном растворе, например 10 мг/дм ;
;
 - разность между показаниями прибора для пробы и выбранного рабочего стандартного раствора, мВ;
- разность между показаниями прибора для пробы и выбранного рабочего стандартного раствора, мВ;
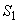 - крутизна электродной функции (разность между показаниями прибора для рабочих стандартных растворов в интервале концентраций фторида, отличающихся в 10 раз, например 100 и 10 мг/дм
- крутизна электродной функции (разность между показаниями прибора для рабочих стандартных растворов в интервале концентраций фторида, отличающихся в 10 раз, например 100 и 10 мг/дм , 190 и 19 мг/дм
, 190 и 19 мг/дм ), мВ;
), мВ;
- если прибор показывает значение электродного потенциала в ед. pF, концентрацию определяют по формуле
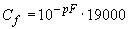 ; (4)
; (4)
- если измерительный прибор позволяет непосредственно считывать показания в единицах концентрации фторида, вышеуказанное расчетное определение концентрации не проводят.
Из двух определений вычисляют среднее арифметическое значение концентрации фторида в пробе (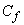 ).
).
Массовую долю фторида 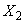 , мг/кг, вычисляют по формуле
, мг/кг, вычисляют по формуле
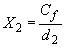 , (5)
, (5)
где 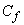 - средняя концентрация фторида в испытуемой жидкости, мг/дм
- средняя концентрация фторида в испытуемой жидкости, мг/дм ;
;
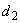 - плотность жидкого СГПР, определенная пикнометрически по ГОСТ 3639, 3.4.2 или ареометром по ГОСТ 14618.10, раздел 3, кг/дм
- плотность жидкого СГПР, определенная пикнометрически по ГОСТ 3639, 3.4.2 или ареометром по ГОСТ 14618.10, раздел 3, кг/дм .
.
Массовую долю фторида 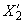 , %, вычисляют по формуле
, %, вычисляют по формуле
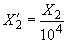 . (6)
. (6)
За результат измерения принимают среднее арифметическое результатов двух параллельных измерений, расхождение между которыми не должно превышать 0,003 %; относительное расхождение между результатами измерений в двух лабораториях не должно превышать 0,005%, пределы абсолютной погрешности измерений ±0,003% при вероятности 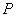 =0,95.
=0,95.
6.9 Определение массы фторидов в единице упаковки
Массу фторида в единице упаковки вычисляют на основании массовой доли фторида, найденной по 6.8.4.
Массу фторида 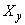 в единице упаковки, мг, вычисляют по формуле
в единице упаковки, мг, вычисляют по формуле
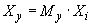 , (7)
, (7)
где 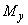 - масса жидкого СГПР в единице упаковки, кг;
- масса жидкого СГПР в единице упаковки, кг;
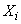 - массовая доля фторида, найденная по 6.8.4, мг/кг.
- массовая доля фторида, найденная по 6.8.4, мг/кг.
6.10 Расчет массовой доли этилового спирта
Массовую долю этилового спирта рассчитывают по таблицам для определения содержания этилового спирта в водно-спиртовых растворах [16], исходя из плотности отгона испытуемого жидкого СГПР, определенной пикнометрически по ГОСТ 3639, 3.4.2 или ареометром по ГОСТ 14618.10, раздел 3.
Для получения отгона 100 см испытуемого жидкого СГПР перегоняют при температуре 78-101 °С. Отгон собирают в мерную колбу вместимостью 100 см
испытуемого жидкого СГПР перегоняют при температуре 78-101 °С. Отгон собирают в мерную колбу вместимостью 100 см по ГОСТ 1770. После охлаждения отгона до 20 °С доводят объем раствора дистиллированной водой до метки.
по ГОСТ 1770. После охлаждения отгона до 20 °С доводят объем раствора дистиллированной водой до метки.
Допускается определять массовую долю этилового спирта газохроматографическим методом по ГОСТ 29188.6.
6.11 Клинические и токсикологические испытания
Клинические и токсикологические испытания проводят в соответствии с методами, утвержденными Минздравом Российской Федерации.
7 Транспортирование и хранение
7.1 Транспортирование и хранение жидких СГПР - по ГОСТ 27429. Жидкие СГПР хранят при температуре не ниже плюс 5 °С и не выше плюс 25 °С в крытых складских помещениях в упаковке изготовителя. Изделия при хранении не должны подвергаться непосредственному воздействию солнечного света.
7.2 Срок годности для каждого конкретного наименования жидкого СГПР устанавливает предприятие-изготoвитель.
ПРИЛОЖЕНИЕ Б
(справочное)
Библиография
|
[1] |
СанПиН |
1.2.676-97 |
Гигиенические требования к производству, качеству и безопасности средств гигиены полости рта |
|
[2] |
ФС |
42-188ВС-90 |
Агар сухой питательный для культивирования микроорганизмов |
|
[3] |
ГФ |
XI изд. |
Государственная Фармакопея СССР |
|
[4] |
ВФС |
42-1801-88, 42-2988-97 |
Питательная среда N 1 для контроля микробной загрязненности, сухая |
|
[5] |
ВФС |
42-1802-88, 42-3068-98 |
Питательная среда N 2 для контроля микробной загрязненности, сухая (Сабуро) |
|
[6] |
ВФС |
42-1803-88, 42-3067-98 |
Питательная среда N 3 для контроля микробной загрязненности, сухая |
|
[7] |
ФС |
42-186ВС-88 |
Питательная среда N 4 для выделения энтеробактерий, сухая (агар Эндо) |
|
[8] |
ВФС |
42-2038-91, 42-3074-98 |
Питательная среда N 6 для контроля микробной загрязненности, сухая |
|
[9] |
ВФС |
42-2020-90, 42-3073-98 |
Питательная среда N 7 для контроля микробной загрязненности, сухая |
|
[10] |
ФС |
42-3181-95, 42-3091-98 |
Питательная среда N 8 для контроля микробной загрязненности, сухая |
|
[11] |
ВФС |
42-1908-89, 42-3092-98 |
Питательная среда N 9 для контроля микробной загрязненности, сухая |
|
[12] |
ВФС |
42-1909-89, 42-3452-99 |
Питательная среда N 10 для контроля микробной загрязненности, сухая |
|
[13] |
ТУ |
6-09-5484-90 |
Д-Маннит |
|
[14] |
ТУ |
6-09-5417-88 |
I-Нафтол |
|
[15] |
ТУ |
6-09-07-1703-90 |
I-Нафтиламин |
|
[16] |
|
Таблицы для определения содержания этилового спирта в водно-спиртовых растворах. Издательство стандартов, г. Москва, 1999 г., т.1, табл.2 |
Текст документа сверен по:
официальное издание
М.: ИПК Издательство стандартов, 2000