РД 34.37.523.10-88
РУКОВОДЯЩИЙ ДОКУМЕНТ
ВОДЫ ПРОИЗВОДСТВЕННЫЕ ТЕПЛОВЫХ ЭЛЕКТРОСТАНЦИЙ.
Методы определения окисляемости воды
Срок действия с 01.04.89
до 01.04.99*
_______________________
* См. ярлык "Примечания"
1. РАЗРАБОТАН Всесоюзным дважды ордена Трудового Красного Знамени теплотехническим научно-исследовательским институтом им. Ф.Э.Дзержинского (ВТИ им. Ф.Э.Дзержинского)
2. ИСПОЛНИТЕЛИ Ю.М.Кострикин докт. техн. наук; Н.М.Калинина, О.М.Штерн, С.Ю.Петрова, Г.К.Корицкий, Л.Н.Федешева
3. УТВЕРЖДЕН Главным научно-техническим управлением энергетики и электрификации Минэнерго СССР 15.12.88
Заместитель начальника А.П.Берсенев
4. Срок первой проверки - 1994 г., периодичность проверки - 5 лет
5. ВЗАМЕН Инструкции по эксплуатационному анализу воды и пара на тепловых электростанциях (М.: СПО Союзтехэнерго, 1979 г.) в части определения органических веществ (раздел 7)
ВНЕСЕНО Изменение N 1, утвержденное Начальником Департамента науки и техники РАО "ЕЭС России" А.П.Берсеневым 30.09.1994 г., введенное в действие с 01.01.1995 г.
Изменение N 1 внесено юридическим бюро
Настоящий руководящий документ распространяется на производственные воды тепловых электростанций и устанавливает методы определения окисляемости питательной воды и ее составляющих (конденсатов и добавочной воды), исходной, теплофикационной (сетевой), известково-коагулированной, обессоленной и котловых вод.
Документ регламентирует два метода - бихроматный и перманганатный, различающиеся применяемыми окислителями, а также условиями окисления. Бихромат окисляет органические примеси в сильно сернокислой среде при длительном кипячении. Перманганат окисляет в гораздо более мягких условиях, при меньшей кислотности и нагревании до кипения только в течение десяти минут. Вследствие этого результаты, получаемые тем и другим методом, существенно различны и не сопоставимы. Бихроматная окисляемость всегда намного выше перманганатной и более объективно характеризует степень загрязненности воды органическими примесями.
(Измененная редакция, Изм. N 1).
1. ОТБОР ПРОБ
Отбор проб - по ОСТ 34-70-953.1-88.
2. АППАРАТУРА, МАТЕРИАЛЫ, РЕАКТИВЫ
Весы лабораторные общего назначения 2 класса точности с пределом взвешивания 200 г;
бюретки с прямым краном по ГОСТ 1770-74;
бюретки по ГОСТ 29251-91;
колбы конические вместимостью 250, 300 см по ГОСТ 25336-82;
по ГОСТ 25336-82;
колбы круглодонные с обратным холодильником;
колбы мерные первого или второго класса вместимостью 100, 200, 250, 500 и 1000 см по ГОСТ 1770-74;
по ГОСТ 1770-74;
пипетки градуированные по ГОСТ 29227-91;
бусинки стеклянные мелкие;
капилляры с запаянными концами;
воронки лабораторные по ГОСТ 25336-82;
калий марганцево-кислый (перманганат калия) х.ч. по ГОСТ 20490-75;
калий двухромово-кислый (бихромат калия) х.ч. по ГОСТ 4220-75;
кислота серная х.ч. - по ГОСТ 4204-77;
кислота щавелевая х.ч. - по ГОСТ 22180-76;
натрий щавелево-кислый по ГОСТ 5839-77;
кислота фенилантраниловая ч.д.а. по ТУ 6-09-3592-87;
двойная соль серно-кислого железа II и аммония (соль Мора) - по ГОСТ 4208-78*;
_______________
* Вероятно ошибка оригинала. Следует читать ГОСТ 4208-72. - Примечание .
кобальт серно-кислый семиводный ч.д.а. - по ГОСТ 4462-78;
медь серно-кислая пятиводная х.ч. - по ГОСТ 4165-78;
ртуть серно-кислая ч.д.а.;
вода дистиллированная - по ГОСТ 6709-72.
Допускается применение других средств измерений с метрологическими характеристиками и оборудование с техническими характеристиками не хуже, a также реактивов по качеству не ниже, указанных в настоящем нормативном документе.
(Измененная редакция, Изм. N 1).
3. БИХРОМАТНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ОКИСЛЯЕМОСТИ ВОД
3.1. Сущность метода заключается в измерения избытка окислителя (бихромата калия) после окисления им веществ, присутствующих в пробе исследуемой воды в сильно сернокислой среде и при длительном кипячении. Метод применим в двух вариантах.
3.1.1. Метод определения для вод, окисляемость которых превышает 100 мг кислорода на 1 дм .
.
3.1.2. Метод определения для вод, окисляемость которых меньше 100 мг кислорода на 1 дм .
.
3.2. Приготовление рабочих растворов
3.2.1. Раствор бихромата калия концентрации  (1/6K
(1/6K Сr
Сr O
O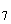 )=0,25 моль/дм
)=0,25 моль/дм . Растворяют в мерной колбе вместимостью 1 дм
. Растворяют в мерной колбе вместимостью 1 дм в дистиллированной воде 12,258 г K
в дистиллированной воде 12,258 г K Cr
Cr O
O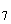 , высушенного в течение двух часов при 110 °С в сушильном шкафу. После полного растворения доливают объем до метки дистиллированной водой и хорошо перемешивают. Реактив устойчив, его хранят в склянке с пришлифованной пробкой.
, высушенного в течение двух часов при 110 °С в сушильном шкафу. После полного растворения доливают объем до метки дистиллированной водой и хорошо перемешивают. Реактив устойчив, его хранят в склянке с пришлифованной пробкой.
Разбавлением точно в десять раз готовят раствор бихромата калия концентрации  (1/6K
(1/6K Сr
Сr O
O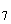 )=0,025 моль/дм
)=0,025 моль/дм (отбирают пипеткой 100 см
(отбирают пипеткой 100 см раствора концентрации
раствора концентрации  (1/6K
(1/6K Сr
Сr O
O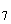 )=0,25 моль/дм
)=0,25 моль/дм в мерную колбу вместимостью 1 дм
в мерную колбу вместимостью 1 дм и доливают до метки дистиллированной водой, раствор хорошо перемешивает). Разбавленный раствор также хранят в склянке с хорошо пришлифованной пробкой. Раствор устойчив.
и доливают до метки дистиллированной водой, раствор хорошо перемешивает). Разбавленный раствор также хранят в склянке с хорошо пришлифованной пробкой. Раствор устойчив.
3.2.2. Раствор соли Мора примерной концентрации  (Fe(NH
(Fe(NH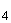 )
) ·(SO
·(SO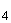 )
) ·6H
·6H O)=0,25 моль/дм
O)=0,25 моль/дм . Растворяют 100 г Fe(NH
. Растворяют 100 г Fe(NH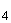 )
) ·(SO
·(SO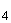 )
) ·6H
·6H O в мерной колбе вместимостью 1 дм
O в мерной колбе вместимостью 1 дм , после полного растворения приливают 25 см
, после полного растворения приливают 25 см концентрированной серной кислоты и охлажденный раствор доливают до метки дистиллированной водой. Хорошо перемешав раствор, устанавливают его титр. Для этого в несколько конических колб помещают отмеренные количества бихроматного раствора (5,0 и 10,0 см
концентрированной серной кислоты и охлажденный раствор доливают до метки дистиллированной водой. Хорошо перемешав раствор, устанавливают его титр. Для этого в несколько конических колб помещают отмеренные количества бихроматного раствора (5,0 и 10,0 см ), вливают по 5 см
), вливают по 5 см концентрированной серной кислоты и дистиллированной воды до 50-60 см
концентрированной серной кислоты и дистиллированной воды до 50-60 см , добавляют по несколько капель раствора фенилантраниловой кислоты и титруют окрашенные в буро-красный цвет растворы до чисто зеленого цвета. Титр раствора соли Мора вычисляют по формуле
, добавляют по несколько капель раствора фенилантраниловой кислоты и титруют окрашенные в буро-красный цвет растворы до чисто зеленого цвета. Титр раствора соли Мора вычисляют по формуле
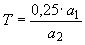 , (1)
, (1)
где 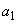 и
и 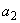 - соответственно объемы бихроматного раствора, см
- соответственно объемы бихроматного раствора, см и раствора соли Мора, см
и раствора соли Мора, см ;
;
0,25 - титр бихроматного раствора.
Из полученных результатов для титра раствора соли Мора, если эти значения расходятся не более чем на 1%, вычисляют среднее арифметическое, которым в дальнейшем и пользуются для расчетов.
Из приготовленного раствора соли Мора готовят точно раствор концентрации  (Fe(NH
(Fe(NH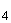 )
) ·(SO
·(SO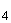 )
) ·6H
·6H O)=0,025 моль/дм
O)=0,025 моль/дм . Для этого объем
. Для этого объем 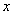 (см
(см ) этого раствора вводят в первую колбу вместимостью 1 дм
) этого раствора вводят в первую колбу вместимостью 1 дм и доливают до метки дистиллированной водой. Хорошо перемешав полученный точно (Fe(NH
и доливают до метки дистиллированной водой. Хорошо перемешав полученный точно (Fe(NH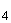 )
) ·(SO
·(SO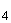 )
) ·6H
·6H O)=0,025 моль/дм
O)=0,025 моль/дм , переливают в склянку с хорошо пришлифованной пробкой. Раствор устойчив. Объем
, переливают в склянку с хорошо пришлифованной пробкой. Раствор устойчив. Объем 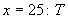 , где
, где 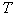 - титр раствора соли Мора.
- титр раствора соли Мора.
3.2.3. Раствор фенилантраниловой кислоты с массовой долей 0,1%. Растворяют 0,2 г реактива в 15-20 см раствора щелочи концентрации
раствора щелочи концентрации  (NaOH)=0,1 моль/дм
(NaOH)=0,1 моль/дм и после растворения разбавляют дистиллированной водой до 200 см
и после растворения разбавляют дистиллированной водой до 200 см . Реактив устойчив, его хранят в склянке темного стекла, отливая по мере надобности в капельницу.
. Реактив устойчив, его хранят в склянке темного стекла, отливая по мере надобности в капельницу.
3.2.1-3.2.3. (Измененная редакция, Изм. N 1).
3.2.4. Раствор катализатора. Растворяют 60 г сернокислой меди пятиводной и 75 г семиводного серно-кислого кобальта в 1 дм дистиллированной воды.
дистиллированной воды.
Раствор устойчив, его хранят в склянке с пришлифованной пробкой.
3.3. Проведение анализа
В круглодонную колбу, снабженную обратным холодильником, помещают отмеренное количество анализируемой воды, но не более 20 см , дистиллированной водой доливают до 20 см
, дистиллированной водой доливают до 20 см , приливают 10 см
, приливают 10 см раствора бихромата калия концентрации
раствора бихромата калия концентрации  (1/6K
(1/6K Сr
Сr O
O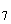 )=0,25 моль/дм
)=0,25 моль/дм для п.3.1.1 и 10 см
для п.3.1.1 и 10 см раствора катализатора или 10 см
раствора катализатора или 10 см раствора бихромата калия
раствора бихромата калия  (1/6 K
(1/6 K Сr
Сr O
O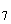 )=0,025 моль/дм
)=0,025 моль/дм концентрации для п.3.1.2, при содержании хлоридов в отобранном объеме более 50 мг, всыпают примерно 0,4 г сульфата ртути. Смесь перемешивают и осторожно вводят 35 см
концентрации для п.3.1.2, при содержании хлоридов в отобранном объеме более 50 мг, всыпают примерно 0,4 г сульфата ртути. Смесь перемешивают и осторожно вводят 35 см концентрированной серной кислоты. После этого присоединяют обратный холодильник и кипятят жидкость в течение двух часов. После охлаждения холодильник отсоединяют, обмывают его внутреннее поверхность дистиллированной водой, сливая ее в колбу, приливают в колбу 100 см
концентрированной серной кислоты. После этого присоединяют обратный холодильник и кипятят жидкость в течение двух часов. После охлаждения холодильник отсоединяют, обмывают его внутреннее поверхность дистиллированной водой, сливая ее в колбу, приливают в колбу 100 см дистиллированной воды, жидкость вновь охлаждает, приливают несколько капель индикатора фенилантраниловой кислоты и титруют избыток окислителя - бихромата калия - раствором соли Мора концентрации
дистиллированной воды, жидкость вновь охлаждает, приливают несколько капель индикатора фенилантраниловой кислоты и титруют избыток окислителя - бихромата калия - раствором соли Мора концентрации  (Fe(NH
(Fe(NH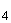 )
) ·(SO
·(SO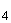 )
) ·6H
·6H O)=0,25 моль/дм
O)=0,25 моль/дм по п.3.1.1 или 0,025 моль/дм
по п.3.1.1 или 0,025 моль/дм по п.3.1.2. Определение окисляемости проводят в 2-3 параллельных пробах.
по п.3.1.2. Определение окисляемости проводят в 2-3 параллельных пробах.
Одновременно проводят холостой опыт с 20 см дистиллированной воды и всеми реактивами, указанными выше.
дистиллированной воды и всеми реактивами, указанными выше.
3.4. Обработка результатов анализа
3.4.1. Бихроматную окисляемость (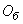 ) для п.3.1.1 вычисляют в миллиграммах окислителя кислорода, расходуемых на кубический дециметр воды по формуле
) для п.3.1.1 вычисляют в миллиграммах окислителя кислорода, расходуемых на кубический дециметр воды по формуле
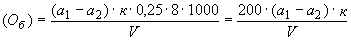 , (2)*
, (2)*
где 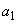 - количество раствора соли Мора, израсходованное на титрование холостой пробы, см
- количество раствора соли Мора, израсходованное на титрование холостой пробы, см ;
;
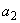 - количество раствора соли Мора, израсходованное на титрование пробы, см
- количество раствора соли Мора, израсходованное на титрование пробы, см ;
;
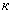 - поправочный коэффициент к точно 0,25 н раствора соли Мора;
- поправочный коэффициент к точно 0,25 н раствора соли Мора;
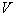 - объем воды, взятый для определения, см
- объем воды, взятый для определения, см ;
;
0,25 - номинальная нормальность раствора соли Мора;
8 - количество кислорода, эквивалентное 1 см точно 1 н раствора.
точно 1 н раствора.
__________________
* Изменением N 1 предлагается экспликацию к формуле (2) изложить в новой редакции: "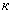 - поправочный коэффициент к точному раствору соли Мopa концентрации 0,25 моль/дм
- поправочный коэффициент к точному раствору соли Мopa концентрации 0,25 моль/дм ; 0,25 - раствор соли Мора; 8 - количество кислорода, эквивалентное 1 см
; 0,25 - раствор соли Мора; 8 - количество кислорода, эквивалентное 1 см точного раствора концентрации соли Мора =1 моль/дм
точного раствора концентрации соли Мора =1 моль/дм ". - Примечание .
". - Примечание .
Среднеарифметические расхождения между параллельными определениями 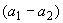 не должны превышать 0,25 см
не должны превышать 0,25 см , что соответствует 0,5 мг кислорода.
, что соответствует 0,5 мг кислорода.
3.4.2. Бихроматную окисляемость (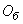 ) для п.3.1.2 вычисляют в миллиграммах окислителя кислорода, расходуемых на кубический дециметр воды по формуле
) для п.3.1.2 вычисляют в миллиграммах окислителя кислорода, расходуемых на кубический дециметр воды по формуле
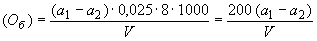 . (3)
. (3)
Все обозначения в этой формуле те же, что и в формуле 2, но 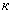 =1, так как раствор соли Мора здесь точно равен 0,025 моль/дм
=1, так как раствор соли Мора здесь точно равен 0,025 моль/дм . Среднеарифметические расхождения между параллельными определениями
. Среднеарифметические расхождения между параллельными определениями 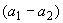 не должны превышать 0,25 см
не должны превышать 0,25 см , что соответствует 0,05 мг кислорода.
, что соответствует 0,05 мг кислорода.
3.3, 3.4, 3.4.1, 3.4.2. (Измененная редакция, Изм. N 1).
3.4.3. Форма журнала записи результатов анализа приведена в приложении 6 ОСТ 34-70-953.3-88.
3.4.4. Допустимая погрешность контроля по разделу 5.
3.4.3, 3.4.4. (Введены дополнительно, Изм. N 1).
4. ПЕРМАНГАНАТНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ОКИСЛЯЕМОСТИ
(ПРИМЕНИМ ДЛЯ ТЕКУЩЕГО ОРИЕНТИРОВОЧНОГО ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ОРГАНИЧЕСКИХ ПРИМЕСЕЙ)
4.1. Сущность метода заключается в измерении избытка окислителя (перманганата калия) после окисления им веществ, присутствующих в пробе исследуемой воды в сернокислой или щелочной среде при кипячении.
Метод можно использовать только для проб, окисляемость которых ниже 100 мг О/дм .
.
4.2. Приготовление рабочих растворов
4.2.1. Калий марганцовокислый, раствор концентрации  (1/5KMnO
(1/5KMnO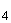 )=0,1 моль/дм
)=0,1 моль/дм готовят из фиксанала, а в случае его отсутствия из марганцовокислого калия. В плоскодонную колбу вместимостью 4-5 дм
готовят из фиксанала, а в случае его отсутствия из марганцовокислого калия. В плоскодонную колбу вместимостью 4-5 дм вливают 3 дм
вливают 3 дм дистиллированной воды, всыпают 10 г марганцовокислого калия и, нагрев до кипения, кипятят 2-3 ч. Прекратив кипячение, закрывают колбу пробкой с отверстием, в которое вставлена хлор-кальциевая трубка, заполненная ватным тампоном для задержания пыли из проникающего в колбу при охлаждении воздуха. Через 2-3 суток осторожно сливают отстоявшийся от мелких частиц оксидов марганца раствор в чистую склянку с хорошо пришлифованной пробкой.
дистиллированной воды, всыпают 10 г марганцовокислого калия и, нагрев до кипения, кипятят 2-3 ч. Прекратив кипячение, закрывают колбу пробкой с отверстием, в которое вставлена хлор-кальциевая трубка, заполненная ватным тампоном для задержания пыли из проникающего в колбу при охлаждении воздуха. Через 2-3 суток осторожно сливают отстоявшийся от мелких частиц оксидов марганца раствор в чистую склянку с хорошо пришлифованной пробкой.
Для установления титра приготовленного раствора в несколько чистых конических колб отмеривают из бюретки вместимостью 50 см со стеклянным краном различные объемы этого раствора (например, по 5 и 7 см
со стеклянным краном различные объемы этого раствора (например, по 5 и 7 см ). Затем в каждую колбу вливают дистиллированную воду примерно до 50 см
). Затем в каждую колбу вливают дистиллированную воду примерно до 50 см , по 10 см
, по 10 см раствора серной кислоты и по 10 см
раствора серной кислоты и по 10 см титрованного раствора щавелевой кислоты концентрации
титрованного раствора щавелевой кислоты концентрации  (1/2Н
(1/2Н С
С О
О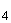 ·2H
·2H O)=0,1 моль/дм
O)=0,1 моль/дм или щавелево-кислого натрия. После полного обесцвечивания жидкостей в колбах избыток оксалат-ионов оттитровывают раствором перманганата калия из упомянутой бюретки до появления весьма слабого, но не исчезающего, розового окрашивания.
или щавелево-кислого натрия. После полного обесцвечивания жидкостей в колбах избыток оксалат-ионов оттитровывают раствором перманганата калия из упомянутой бюретки до появления весьма слабого, но не исчезающего, розового окрашивания.
Поправочный коэффициент К раствора калия марганцовокислого концентрации точно  (1/5KMnO
(1/5KMnO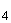 )=0,1 моль/дм
)=0,1 моль/дм вычисляют по формуле
вычисляют по формуле
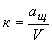 , (4)
, (4)
где 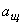 - количество раствора щавелевой кислоты или щавелевокислого натрия, введенное в колбу, см
- количество раствора щавелевой кислоты или щавелевокислого натрия, введенное в колбу, см ;
;
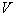 - общий объем раствора перманганата, израсходованный на титрование, см
- общий объем раствора перманганата, израсходованный на титрование, см .
.
Раствор устойчив длительное время, его хранят в защищенном от света месте в хорошо закупоренной склянке.
Этим раствором пользуются для приготовления рабочего раствора концентрации  (1/5KMnO
(1/5KMnO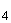 )=0,01 моль/дм
)=0,01 моль/дм . Для этого отбирают пипеткой объем
. Для этого отбирают пипеткой объем 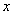 (см
(см ) этого раствора в мерную колбу вместимостью 1 дм
) этого раствора в мерную колбу вместимостью 1 дм , доливают до метки дистиллированной водой и перемешивают. Рабочий раствор пригоден в течение недели. Объем
, доливают до метки дистиллированной водой и перемешивают. Рабочий раствор пригоден в течение недели. Объем 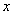 (см
(см ) определяют по формуле
) определяют по формуле
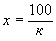 . (5)
. (5)
Его отмеривают из бюретки вместимостью 100 см .
.
4.2.2. Раствор щавелевой кислоты концентрация  (1/2Н
(1/2Н С
С О
О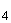 ·2H
·2H O)=0,1 моль/дм
O)=0,1 моль/дм или щавелево-кислого натрия. Раствор щавелевой кислоты готовят из фиксанала, а в случае его отсутствия из щавелево-кислого натрия. Для этого отвешивают точно 6,701 г щавелево-кислого натрия, выдержанного в течение 1 ч в сушильном шкафу при 110 °С, и растворяют это количество в мерной колбе вместимостью 1 дм
или щавелево-кислого натрия. Раствор щавелевой кислоты готовят из фиксанала, а в случае его отсутствия из щавелево-кислого натрия. Для этого отвешивают точно 6,701 г щавелево-кислого натрия, выдержанного в течение 1 ч в сушильном шкафу при 110 °С, и растворяют это количество в мерной колбе вместимостью 1 дм в дистиллированной воде. После полного растворения доливают жидкость в колбе до метки дистиллированной водой и хорошо перемешивают.
в дистиллированной воде. После полного растворения доливают жидкость в колбе до метки дистиллированной водой и хорошо перемешивают.
Растворы щавелевой кислоты и щавелево-кислого натрия устойчивы, их хранят в хорошо закупоренной склянке в защищенном от света месте. Этими растворами пользуются для проверки титра раствора калия марганцовокислого концентрации  (1/5KMnO
(1/5KMnO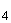 )=0,1 моль/дм
)=0,1 моль/дм .
.
Рабочий раствор концентрации  (1/2H
(1/2H SO
SO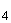 )=0,01 моль/дм
)=0,01 моль/дм готовят разбавлением точно в десять раз. Рабочие растворы не устойчивы, их следует готовить на срок не более 10 суток.
готовят разбавлением точно в десять раз. Рабочие растворы не устойчивы, их следует готовить на срок не более 10 суток.
4.2.3. Раствор серной кислоты концентрации  (1/2KMnO
(1/2KMnO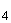 )=10 моль/дм
)=10 моль/дм . К 1 дм
. К 1 дм дистиллированной воды мелкими порциями осторожно приливают 400 см
дистиллированной воды мелкими порциями осторожно приливают 400 см концентрированной химически чистой серной кислоты. После полного остывания жидкости ее переливают в склянку с хорошо пригнанной пришлифованной пробкой. Реактив устойчив.
концентрированной химически чистой серной кислоты. После полного остывания жидкости ее переливают в склянку с хорошо пригнанной пришлифованной пробкой. Реактив устойчив.
4.2.1-4.2.3. (Измененная редакция, Изм. N 1).
4.3. Проведение анализа
В коническую колбу вместимостью 250, 300 см отбирают измеренный объем анализируемой воды, отфильтрованной от взвешенных веществ. Если предполагают, что вода сильно загрязнена органическими примесями, то отбирают не более 5 см
отбирают измеренный объем анализируемой воды, отфильтрованной от взвешенных веществ. Если предполагают, что вода сильно загрязнена органическими примесями, то отбирают не более 5 см ; если воды менее загрязнены - до 20 см
; если воды менее загрязнены - до 20 см , а малозагрязненные воды - 100 см
, а малозагрязненные воды - 100 см . Объем жидкости в колбе доливают дистиллированной водой до 100 см
. Объем жидкости в колбе доливают дистиллированной водой до 100 см , приливают 10 см
, приливают 10 см серной кислоты (по п.4.2.3), нагревают до начинающегося кипения и приливают точно 10 см
серной кислоты (по п.4.2.3), нагревают до начинающегося кипения и приливают точно 10 см раствора перманганата калия (пo п.4.2.1). Кипятят точно 10 мин, после чего вводят точно 10 см
раствора перманганата калия (пo п.4.2.1). Кипятят точно 10 мин, после чего вводят точно 10 см раствора щавелевой кислоты или щавелевокислого натрия (по п.4.2.2). Для равномерного и спокойного кипения в колбу помещают тонкие запаянные с одного конца капилляры или мелкие стеклянные шарики. Обесцветившуюся жидкость титруют из бюретки раствором калия марганцовокислого концентрации
раствора щавелевой кислоты или щавелевокислого натрия (по п.4.2.2). Для равномерного и спокойного кипения в колбу помещают тонкие запаянные с одного конца капилляры или мелкие стеклянные шарики. Обесцветившуюся жидкость титруют из бюретки раствором калия марганцовокислого концентрации  (1/5KMnO
(1/5KMnO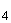 )=0,01 моль/дм
)=0,01 моль/дм (по п.4.2.1) до слабой, но не исчезающей, розовой окраски. Если при кипячении жидкость приобрела бурую окраску или в ней образовался коричневый осадок, то определение повторяют, отобрав меньший объем анализируемой воды. Одновременно проводят определение со 100 см
(по п.4.2.1) до слабой, но не исчезающей, розовой окраски. Если при кипячении жидкость приобрела бурую окраску или в ней образовался коричневый осадок, то определение повторяют, отобрав меньший объем анализируемой воды. Одновременно проводят определение со 100 см дистиллированной воды таким же порядком. Определение окисляемости проводят в 2-3 параллельных пробах, расхождения между которыми не должны превышать 0,25 мг кислорода.
дистиллированной воды таким же порядком. Определение окисляемости проводят в 2-3 параллельных пробах, расхождения между которыми не должны превышать 0,25 мг кислорода.
4.4. Обработка результатов анализа
Перманганатная окисляемость (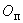 ) определяется в миллиграммах окислителя (кислорода), расходуемых на кубический дециметр воды по формуле
) определяется в миллиграммах окислителя (кислорода), расходуемых на кубический дециметр воды по формуле
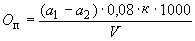 , (6)*
, (6)*
где 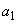 - расход раствора перманганата калия на титрование пробы анализируемой воды, см
- расход раствора перманганата калия на титрование пробы анализируемой воды, см ;
;
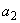 - расход раствора перманганата калия на титрование пробы дистиллированной воды, см
- расход раствора перманганата калия на титрование пробы дистиллированной воды, см ;
;
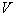 - объем анализируемой воды, отобранный для определения, см
- объем анализируемой воды, отобранный для определения, см ;
;
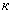 - поправка к точной 0,01 нормальности раствора перманганата калия;
- поправка к точной 0,01 нормальности раствора перманганата калия;
0,08 - количество кислорода, отвечающее 1 см точно 0,01 н раствора, мг;
точно 0,01 н раствора, мг;
1000 - пересчет расхода окислителя (кислорода) к 1 дм .
.
_______________
* Изменением N 1 предлагается изложить экспликацию к формуле (6) в новой редакции: "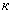 - поправочный коэффициент раствора калия марганцовокислого концентрация точно
- поправочный коэффициент раствора калия марганцовокислого концентрация точно  (1/5KMnO
(1/5KMnO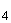 )=0,01 моль/дм
)=0,01 моль/дм ; 0,08 - количество кислорода, отвечающее 1 см
; 0,08 - количество кислорода, отвечающее 1 см этого раствора, мг". - Примечание .
этого раствора, мг". - Примечание .
Среднеарифметические расхождения между параллельными определениями 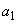 не должны превышать 0,25 см
не должны превышать 0,25 см , что соответствует 0,02 мг кислорода.
, что соответствует 0,02 мг кислорода.
Форма журнала записи результатов анализа приведена в приложении Б ОСТ 34-70-953.3-88.
Допустимая погрешность контроля по разделу 5.
4.3, 4.4. (Измененная редакция, Изм. N 1).
5 ДОПУСТИМАЯ ПОГРЕШНОСТЬ КОНТРОЛЯ
5.1 Повторяемость
Два результата определений, полученные в одной лаборатории одним исполнителем, на одном оборудовании, на одной пробе, признаются достоверными (с доверительной вероятностью (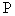 =0,95)), если расхождение между ними не превышает 0,25 см
=0,95)), если расхождение между ними не превышает 0,25 см титранта.
титранта.
5.2 Воспроизводимость
Два результата испытаний, полученные в разных лабораториях с использованием одних и тех же методов и одной и той же пробы, признаются достоверными (с доверительной вероятностью (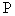 =0,95)), если расхождение между ними не превышает 0,5 см
=0,95)), если расхождение между ними не превышает 0,5 см титранта.
титранта.
Раздел 5. (Введен дополнительно, Изм. N 1).
ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначения НТД, на которые дана ссылка |
Номер пункта, подпункта, перечисления, приложения |
|
2 | |
|
2 | |
|
2 | |
|
ГОСТ 4208-78* |
2 |
|
2 | |
|
2 | |
|
2 | |
|
2 | |
|
2 | |
|
2 | |
|
2 | |
|
2 | |
|
ГОСТ 29251-92 |
2 |
|
ОСТ 34-70-953.1-88 |
1 |
|
ОСТ 34-70-953.3-88 |
3.4.3, 4.3 |
|
ТУ 6-09-3592-87 |
2 |
_______________
* Вероятно ошибка оригинала. Следует читать ГОСТ 4208-72. - Примечание .
(Измененная редакция, Изм. N 1).
Текст документа сверен по:
официальное издание
Воды производственные тепловых электростанций.
Методы определения щелочности; жесткости;
фосфатов; окисляемости воды: РД 34.37.523.7-88,
РД 34.37.523.8-88, РД 34.37.523.9-88, РД 34.37.523.10-88.
Сборник. - М.: ВТИ им. Ф.Э.Дзержинского, 1989
Юридическим бюро в
текст документа внесено Изменение N 1,
утвержденное Начальником Департамента
науки и техники РАО "ЕЭС России"
А.П.Берсеневым 30.09.1994 г.