МУК 4.2.1782-03
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
4.2. МЕТОДЫ КОНТРОЛЯ. МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Метод микробиологического измерения концентрации клеток микроорганизма
Candida tropicalis Y-456 - продуцента ксилита в воздухе рабочей зоны
Дата введения 2003-12-01
1. РАЗРАБОТАНЫ: Российским государственным медицинским университетом (к.б.н. Н.И.Шеиной).
2. УТВЕРЖДЕНЫ Первым заместителем министра здравоохранения Российской Федерации - Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 24 октября 2003 г.
3. ВВЕДЕНЫ В ДЕЙСТВИЕ с 1 декабря 2003 г.
4. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Общие положения и область применения
Настоящие методические указания устанавливают методику проведения микробиологического количественного анализа концентрации клеток штамма Candida tropicalis Y-456 - продуцента ксилита в воздухе рабочей зоны в диапазоне концентраций от 10 до 3000 клеток в 1 м воздуха.
воздуха.
Методические указания разработаны в соответствии с требованиями ГОСТ 12.1.005-88 "ССБТ. Воздух рабочей зоны. Общие санитарно-гигиенические требования" и ГОСТ Р 8.563-96 "Методики выполнения измерений".
Методические указания предназначены для применения в лабораториях предприятий, организаций и учреждений, аккредитованных в установленном порядке на право проведения микробиологических исследований.
Методические указания одобрены и рекомендованы секцией "Гигиенические аспекты биотехнологии и микробного загрязнения окружающей среды" Проблемной комиссии "Научные основы гигиены окружающей среды".
2. Биологическая характеристика Candida tropicalis Y-456
и его гигиенический норматив
На сусло-агаре на 2-3 сутки штамм образует круглые кремоватые колонии с ровным краем, средний диаметр изолированных колоний составляет 0,3 см, а максимальный - 0,8 см. В центре колоний образуется небольшое возвышение - "бугорок", на среде появляется маленькое желто-оранжевое окрашивание. Консистенция колоний мягкая, неплотная, вязкая. Поверхность гладкая, слегка матовая.
Морфологически штамм представлен полиморфными клетками: округлые, овальные, большей частью одиночные 2-4 мкм, иногда цепочки или конгломераты из вытянутых клеток 10-12 мкм. Наблюдается обилие бластоспор.
При выращивании на кукурузном агаре по Дальмау в чашках Петри обильно образуются с многократными разветвлениями и бластоконидиями, расположенными одиночно или цепочками вдоль гиф (7).
Систематическое положение микроорганизма.
|
Класс |
Fungi imperfecti |
|
Порядок |
Blastomycetales |
|
Род |
Candida |
|
Вид |
tropicalis |
|
Штамм |
Y-456 |
Штамм получен из ЦМПМ ВНИИгенетика как продуцент этанола и селектирован по признаку формирования крупных колоний на средах с ксилозой. Штамм является продуцентом ксилита. Продуктивность на средах с 5% содержанием ксилозы: максимальная - 80% ксилита, средняя - 78,8-76,2% (39,5 г/л) ксилита.
Штамм-продуцент растет на жидких и агаризованных средах. Оптимальная температура роста 35-37 °С, рН среды - 5,0-6,0. Для размножения используется сусло-агар 5-6 °Б, среда ДАП - глюкоза (ксилоза) - 20 г, дрожжевой экстракт - 2,0 г, пептон - 2 г, агар-агар - 20 г, вода - 1 л, рН среды - 5,0-6,0.
Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны - 300 кл./м , пометка А.
, пометка А.
3. Пределы измерений
Методика обеспечивает выполнение измерений количества клеток плесневого гриба в воздухе рабочей зоны в диапазоне концентраций от 10 до 3000 клеток в 1 м воздуха при доверительной вероятности 0,95.
воздуха при доверительной вероятности 0,95.
4. Метод измерений
Метод основан на аспирации из воздуха клеток плесневого гриба на поверхность среды сусло-агар и подсчета выросших колоний по типичным культурально-морфологическим признакам на 2 сутки. В качестве дополнительного контроля предлагается отбор пробы на чашку Петри с селективной средой для дифференцирования С. tropicalis от других дрожжеподобных грибов, обладающих способностью к образованию ростковых трубок (8,9).
5. Средства измерений, вспомогательные устройства, реактивы и материалы
При выполнении измерений применяют следующие средства измерений, вспомогательные устройства и материалы.
5.1. Средства измерений, вспомогательные устройства, материалы
|
Прибор для бактериологического анализа воздуха, модель 818 (щелевой прибор Кротова) |
ТУ 64-12791-77 |
|
Термостаты электрические суховоздушные или водяные |
|
|
Автоклав электрический |
ГОСТ 9586-75 |
|
Бокс, оборудованный бактерицидными лампами |
|
|
Холодильник бытовой |
|
|
Весы лабораторные, аналитические типа ВЛА-200 |
|
|
Микроскоп биологический с иммерсионной системой типа "Биолам" Л-211 |
|
|
Лупа с увеличением |
|
|
Чашки Петри бактериологические плоскодонные, стеклянные, диаметром 100 мм |
|
|
Пробирки биологические, вместимостью 20 и 35 мл |
ГОСТ 10515-75 |
|
Пипетки мерные на 1, 5 и 10 мл |
ГОСТ 10515-75 |
|
Пипетки мерные на 1, 5 и 10 мл |
|
|
Колбы конические, вместимостью 250 и 500 мл |
|
|
Секундомер |
ГОСТ 9586-75 |
|
Барометр |
ГОСТ 24696-79 |
|
Марля медицинская |
|
|
Вата медицинская гигроскопическая |
ГОСТ 25556-81 |
5.2. Реактивы, растворы
|
Среда сусло-агар: солодовое сусло (значение Баллинга от 5 до 6°) - 98%, агар-агар - 2%, рН среды 5,0-6,0, режим стерилизации 1,1-1,2 ати, 40 мин |
|
|
Спирт этиловый ректификат |
ГОСТ 5962-67* |
|
_______________ | |
|
Антибиотик биомицин (хлортетрациклина гидрохлорид) |
|
|
Сыворотка или плазма крови человека (вместо них можно использовать среду 199) |
|
6. Требования безопасности
При выполнении измерений концентрации клеток штамма-продуцента в воздухе рабочей зоны соблюдают следующие требования.
6.1. Правила техники безопасности при работе с химическими реактивами по ГОСТ 12.1.005-88.
6.2. Электробезопасность при работе с электроустановками по ГОСТ 12.1.019-79 и инструкции по эксплуатации прибора.
6.3. Руководство "Положение об организации работы по технике безопасности в микробиологической промышленности" (1980), "Инструкции по устройству, требованиям безопасности и личной гигиены при работе в микробиологических лабораториях предприятий микробиологической промышленности" (1977).
6.4. Все виды работ с реактивами проводят только в вытяжном шкафу при работающей вентиляции, работа с биологическим материалом осуществляется в боксе, оборудованном бактерицидными лампами.
7. Требования к квалификации операторов
К выполнению измерений и обработке их результатов допускают лиц с высшим или средним специальным образованием, прошедших соответствующую подготовку и имеющих навыки работы в области микробиологических исследований.
8. Условия измерений
Процессы приготовления растворов и подготовки проб к анализу проводят в нормальных условиях при температуре воздуха (20±5 °С), атмосферном давлении 630-800 мм рт.ст. и влажности воздуха не более 80%.
9. Проведение измерения
9.1. Условия отбора проб воздуха
Для определения концентрации клеток плесневого гриба воздух аспирируют при помощи аппарата Кротова со скоростью 10 л/мин на поверхность среды сусло-агар. Время аспирации воздуха (1-10 мин) зависит от предполагаемой концентрации клеток штамма-продуцента.
Аппарат Кротова перед каждым отбором пробы воздуха тщательно протирают спиртом. Особенно тщательно обрабатывают поверхность подвижного диска и внутреннюю стенку прибора; наружную и внутреннюю стенку крышки. На подвижной диск устанавливают подготовленную чашку Петри со средой, одновременно снимая с нее крышку. Прибор закрывают. Соприкосновение крышки прибора со средой недопустимо. После отбора пробы воздуха и остановки диска, прибор открывают, быстро снимают чашку Петри и закрывают крышкой от данной чашки. На дне чашки Петри стеклографом отмечают точку контроля, время аспирации и дату отбора пробы.
9.2. Выполнение анализа
Метод предполагает учет количества типичных колоний, выросших на 2 сутки после посева проб воздуха по культурально-морфологическим признакам. Метод позволяет учитывать на чашке до 200 колоний продуцента.
Агаризованную среду сусло-агар расплавляют, остужают до 50-60 °С, добавляют антибиотик биомицин из расчета 100 мг/л (для подавления посторонней бактериальной микрофлоры), тщательно перемешивают и разливают по 10 мл в стеклянные чашки Петри на горизонтальной поверхности.
Чашки с застывшей средой помещают в термостат на сутки при температуре 37 °С, после чего проросшие чашки бракуют, стерильные чашки используют для контроля воздуха.
После отбора проб воздуха чашки Петри помещают в термостат при температуре 37 °С. Через 2 суток производят подсчет выросших типичных колоний продуцента. При необходимости культуру подвергают микроскопированию.
Для постановки дополнительного контроля в среду добавляют сыворотку или плазму крови человека (можно также заменить средой 199) из расчета 0,5 мл сыворотки на 5 мл среды. После отбора проб инкубируют при 37 °С в течение 3 часов. При микроскопировании некоторые дрожжеподобные грибы (С. albicans) в отличие от С. tropicalis на селективной среде образуют ростковые трубки диаметром 3-4 мкм и длиной до 20 мкм (они сходны с мицелием, но не дают сужения в месте прикрепления к дрожжевой клетке).
10. Вычисление результатов измерения
Расчет концентрации клеток продуцента в пересчете на 1 м воздуха производят по формуле:
воздуха производят по формуле:
 , кл./м
, кл./м ,
,
где 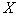 - концентрация клеток продуцента в воздухе;
- концентрация клеток продуцента в воздухе;
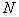 - количество колоний продуцента, выросших на чашке;
- количество колоний продуцента, выросших на чашке;
1000 - коэффициент пересчета на 1 м воздуха;
воздуха;
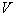 - объем воздуха, л (произведение скорости на время аспирации).
- объем воздуха, л (произведение скорости на время аспирации).
11. Оформление результатов измерений
Результаты измерений оформляют протоколом по форме.
Протокол N
количественного микробиологического анализа штамма-продуцента
Candida tropicalis Y-456 в воздухе рабочей зоны
|
1. Дата проведения анализа |
||||
|
2. Место отбора пробы |
||||
|
3. Название лаборатории |
||||
|
4. Юридический адрес организации |
||||
Результаты микробиологического анализа
|
Шифр или N пробы |
Определяемый микроорганизм |
Концентрация, кл./м |
|
|
Ответственный исполнитель
Научный руководитель
Список литературы
1. ГОСТ 12.1.005-88 "ССБТ. Воздух рабочей зоны. Общие санитарно-гигиенические требования".
2. ГОСТ 8.563-96*. ГСИ "Методики выполнения измерений".
______________
* Вероятно ошибка оригинала. Следует читать ГОСТ Р 8.563-96. ГСИ "Методики выполнения измерений". - Примечание .
3. Положение об организации работы по технике безопасности в микробиологической промышленности. - М., 1980. 27 с.
4. Инструкции по устройству, требованиям безопасности и личной гигиены при работе в микробиологических лабораториях предприятий микробиологической промышленности. - М., 1977. 7 с.
5. Влодавец В.В., Немыря В.И. Санитарно-микологический контроль объектов окружающей среды на предприятиях микробиологической промышленности // Гиг. и сан., 1977. N 1. С.25-28.
6. Бабьева И.П., Зенова Г.М. Биология почв. - М.: МГУ. С.332.
7. Саттон Д., Фотергилл А., Ринальди М. Определитель патогенных и условно патогенных грибов. - М.: Мир, 2001. 110 с.
8. Кашкин П.Н., Лисин В.В. Практическое руководство по медицинской микологии. - М.: Медицина, 1983. 153 с.
9. Kwon-Chung K.J., Bennett J.E. Medical mycology. Philadelphia: Lea & Febiger, 1992. P.61-62.
Текст документа сверен по:
официальное издание
Методические указания. -
М.: Федеральный центр госсанэпиднадзора
Минздрава России, 2004
 10
10