- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ИЗУЧЕНИЮ МУТАГЕННОЙ АКТИВНОСТИ ХИМИЧЕСКИХ ВЕЩЕСТВ
ПРИ ОБОСНОВАНИИ ИХ ПДК В ВОДЕ
РАЗРАБОТАНЫ под руководством проф. Г.Н.Красовского и к.м.н. В.С.Журкова сотрудниками Ордена Трудового Красного Знамени НИИ общей и коммунальной гигиены им. А.Н.Сысина АМН СССР к.м.н. В.С.Журковым, проф. Г.Н.Красовским, к.м.н. З.И.Жолдаковой. Раздел исследований на сальмонелле подготовлен д.б.н. Л.М.Фонштейном, к.б.н. С.А.Абилевым, Е.В.Бобриневым, М.А.Подольной, Н.Г.Облапенко (НИИпоБИХС Минмедпрома СССР); к.б.н. А.М.Дуганом (НИИОКГ им. А.Н.Сысина АМН СССР). При составлении рекомендаций использованы материалы к.б.н. В.В.Соколовского, к.б.н. Е.Г.Фельдт, Л.П.Сычевой (НИИОКГ им. А.Н.Сысина АМН СССР); В.В.Юрченко (ВНИИ дезинфекции и стерилизации МЗ СССР); к.м.н. Р.А.Рязановой (МНИИГ им. Ф.Ф.Эрисмана МЗ РСФСР); Е.Ю.Кагана (КНИИОКГ им. А.Н.Марзеева МЗ УССР); С.П.Сайченко (Свердловский НИИГТиПЗ).
УТВЕРЖДЕНЫ Заместителем Главного государственного санитарного врача СССР А.И.Заиченко 12 июня 1986 г. N 4110-86
Методические указания предназначены для специалистов НИИ и СЭС, занимающихся экспериментальным обоснованием ПДК вредных веществ в воде. Они определяют общие принципы и методические особенности изучения мутагенной активности химических веществ и регламентации в воде водных объектов соединений, показавших мутагенный эффект, с целью повышения надежности гигиенических нормативов в интересах здоровья населения.
1. Введение
Повышение точности и надежности гигиенических нормативов с обязательным учетом отдаленных эффектов - актуальная задача гигиены. Одним из опасных видов отдаленных эффектов является способность вызывать наследуемые изменения генетического материала - мутации. Мутации в половых клетках могут приводить к спонтанным абортам, мертворождениям, врожденным порокам развития, к увеличению частоты наследственных заболеваний. Мутации в соматических клетках связаны с процессами канцерогенеза, старения, с нарушениями эмбрионального развития и др. Необходимость учета мутагенных эффектов при гигиеническом регламентировании химических соединений связана с двумя моментами: возросшей долей наследственной патологии в общей патологии человека и накоплением экспериментальных данных о способности ряда веществ индуцировать мутации у различных организмов.
Однако при гигиенической оценке химических агентов, загрязняющих воду, не всегда учитывается их мутагенная активность. Это в значительной мере связано с недостаточностью методических разработок, с отсутствием четко разработанной стратегии и тактики проведения исследований. Цель настоящих рекомендаций - дать схему исследований мутагенной активности веществ, объекты и методы исследований и подходы к их регламентированию в воде с учетом мутагенной активности.
2. Общие положения
2.1. Анализ мутагенной активности веществ, поступающих в воду, является составной частью исследований по гигиеническому обоснованию ПДК.
2.2. Этапы исследований должны соответствовать этапам установления гигиенических ПДК химических веществ в воде водных объектов (Г.Н.Красовский и соавт., 1979).
2.3. Необходима оценка мутаций в соматических и половых клетках млекопитающих.
2.4. Анализ зависимости "доза-эффект" в исследованиях на млекопитающих.
2.5. Определение на каждом этапе обязательных и дополнительных (факультативных) методов. К последним относятся методы, результаты которых имеют такое же значение, как и результаты обязательных методов, но в силу методических сложностей, высокой трудоемкости не могут в настоящее время широко использоваться в практике. Следует отметить, что с развитием экспериментальной генетики могут появиться методы или приемы, которые позволят факультативные или перспективные методы перевести в обязательные.
2.6. Используемые методы требуют высокой квалифицированной подготовки и должны проводиться сотрудниками, прошедшими специализацию в этой области.
3. Методическая схема изучения мутагенной активности химических загрязнителей воды
Рекомендуемая схема обязательных исследований представлена в таблице 1.
Таблица 1
Этапная схема изучения мутагенной активности химических веществ, загрязняющих воду
|
Этап |
Цель этапа |
Этап общей схемы обоснования ПДК химических веществ в воде водоемов* |
Основные методы |
Дополнительные методы** |
|
I. |
Выявление мутагенов |
Первый |
1. Анализ данных литературы |
1. Анализ аберраций хромосом в культивируемых лимфоцитах человека |
|
|
|
|
2. Полуколичественный метод учета мутаций у Salmonella typhimurium |
2. Анализ сестринских хроматидных обменов в клетках человека |
|
|
|
|
3. Микроядерный тест на мышах |
3. Учет рецессивных мутаций на дрозофиле |
|
II |
Количественная оценка мутагенной активности в опытах на млекопитающих. |
Второй |
1. Метафазный анализ аберраций хромосом в клетках костного мозга млекопитающих. |
1. Ана-телофазный анализ аберраций хромосом в клетках костного мозга. |
|
|
|
|
2. Учет доминантных летальных мутаций у самцов млекопитащих |
2. Транслокационный тест |
|
|
|
|
|
3. Учет хромосомных нарушений в сперматоцитах |
_______________
* Г.Н.Красовский и соавт., 1979.
** Методические рекомендации, 1981 (Учет рецессивных мутаций на дрозофиле; анализ СХО в клетках человека). Методические рекомендации, 1974 (Учет хромосомных аберраций в лимфоцитах). Методические рекомендации, 1978 (Ана-телофазный анализ).
3.1. Этап I - выявление мутагенов.
Необходимость этапа определяется следующими моментами: сравнительно небольшим числом изученных на мутагенность соединений из общего числа нормированных в воде; данными о том, что около 5-10% химических агентов в окружающей среде проявляют мутагенную активность. Методы, используемые на этом этапе, должны быть информативны, просты и нетрудоемки. В качестве обязательных методов рекомендованы: 1. анализ данных литературы; 2. полуколичественный метод учета генных мутаций на S.typhimurium; 3. анализ частоты полихроматофильных эритроцитов с микроядрами в костном мозге мышей (микроядерный тест).
3.1.1. Анализ данных литературы
В настоящее время в литературе постоянно накапливаются данные по изучению мутагенной активности химических веществ на разных тест-объектах. Наиболее информативны данные, полученные в наблюдениях на человеке (эпидемиологические исследования, учет частоты хромосомных аберраций и сестринских хроматидных обменов в лимфоцитах), в опытах на млекопитающих, на культивируемых клетках человека и млекопитающих, на дрозофиле и на S.typhimurium и Е.соIi с использованием системы метаболической активации. Сведения о канцерогенном эффекте вещества также указывают на его возможную мутагенную активность. Наибольшее количество данных можно найти в реферативных журналах ВИНИТИ: РЖБ 04Т "Цитология. Общая генетика"; РЖ 72 "Охрана природы и воспроизводство природных ресурсов"; РЖ 73 "Онкология" раздел "Канцерогенез"; РЖ 75 "Токсикология"; РЖ 40 "Генетика человека". Если данные литературы свидетельствуют о мутагенной активности вещества, то его исследуют на этапе II. При отсутствии или противоречивых данных проводятся экспериментальные исследования этапа I.
3.1.2. Полуколичественный метод учета мутаций Salmonella/микросомы (тест Эймса)
Наиболее широко применяемым методом выявления мутагенной активности химических веществ является тест Эймса Salmonella/микросомы. Сущность метода (Ames et al., 1973) заключается в регистрации способности химического вещества или его метаболитов индуцировать генные мутации у индикаторных штаммов S.typhimurium. Индикаторные штаммы вместе с исследуемым веществом, гомогенатом печени крыс и кофакторами (НАДФ, глюкозо-6-фосфат) вносят в слой верхнего полужидкого агара на чашки Петри. Под влиянием ферментов гомогената печени млекопитающего в результате функционирования системы микросомального окисления вещество может претерпевать ряд метаболических превращений. Если вещество или его метаболиты обладают мутагенной активностью, то увеличивается количество колоний-ревертантов на чашку по сравнению с контролем.
Проведение экспериментов можно организовать на базах микробиологических лабораторий. Подробно методики изложены в ряде руководств (Л.М.Фонштейн и соавт., 1997., Ames et al., 1975). Ниже будут изложены основные этапы проведения экспериментов и учета результатов.
Индикаторные штаммы. В экспериментах рекомендуется использовать гистидинзависимые штаммы S.typhimurium ТА 1535, ТА 1538, ТА 98 и ТА 100. Эти штаммы несут мутации ауксотрофности по гистидину. Наличие мутагенного эффекта у исследуемого препарата учитывается по индукции обратных мутаций от ауксотрофности по гистидину к прототрофности. Характеристики штаммов, правила их ведения и проверки генотипов изложены в вышеуказанных руководствах. Штамм ТА 1535 выявляет соединения, индуцирующие мутации типа замены оснований, штаммы ТА 1538 и ТА 98 - мутации типа сдвига считывания генетического кода, штамм ТА 100 - мутации, образующиеся по обоим механизмам. Использование данного набора штаммов позволяет регистрировать как факт индукции мутаций, так и молекулярный механизм действия мутагенов.
Проведение эксперимента.
Необходимые для опытов оборудование, реактивы, питательные среды, растворы, проведение работ по получению гомогената печени крыс, компоненты активирующей смеси, а также регламент работ с бактериальными культурами описаны в работах Л.М.Фонштейна и соавт. (1977) и Ames et al. (1975).
Для опытов используют свежеприготовленную ночную культуру. Культуру центрифугируют при 5000 об/мин в течение 15 минут и ресуспендируют в буферном растворе до плотности 2-3х10![]() клеток на 1 мл.
клеток на 1 мл.
Исследуемые вещества растворяют в стерильной дистиллированной воде или диметилсульфоксиде до концентраций 1, 10, 100, 1000 и 10000 мкг/мл. Селективный полуобогащенный 0,6% агар в пробирках плавят в водяной бане при 100 °С и помещают в термостатированную водяную баню при 45-46 °С.
Микросомальная активирующая смесь готовится следующим образом: в 1 мл смеси должно содержаться 0,1-0,3 мл фракций S-9, 4мМ НАДФ, 5мМ глюкозо-6-фосфата, 33мМ ![]() , 8мМ М
, 8мМ М ![]() и 0,1 М фосфатного буфера, рН 7,4 до 1 мл. В случае тестирования полициклических ароматических соединений в смесь вносят 0,1 мл фракции S-9 печени крыс, которым предварительно вводили метилхолантрен (однократно, 40 мг/кг внутрибрюшинно за 48 часов до забоя) для индукции микросом. При тестировании других групп соединений в смесь вносят 0,3 мл фракции S-9 печени крыс, которым вводили в качестве индуктора фенобарбитал (в течение 3 дней по 80 мг/кг внутрибрюшинно). Данные объемы вносимой в активирующую смесь фракции S-9 соответствуют количеству микросомального белка на чашку, оптимальному при тестировании большинства групп химических соединений (Belser et al., 1981).
и 0,1 М фосфатного буфера, рН 7,4 до 1 мл. В случае тестирования полициклических ароматических соединений в смесь вносят 0,1 мл фракции S-9 печени крыс, которым предварительно вводили метилхолантрен (однократно, 40 мг/кг внутрибрюшинно за 48 часов до забоя) для индукции микросом. При тестировании других групп соединений в смесь вносят 0,3 мл фракции S-9 печени крыс, которым вводили в качестве индуктора фенобарбитал (в течение 3 дней по 80 мг/кг внутрибрюшинно). Данные объемы вносимой в активирующую смесь фракции S-9 соответствуют количеству микросомального белка на чашку, оптимальному при тестировании большинства групп химических соединений (Belser et al., 1981).
В пробирки с полужидким агаром вносят 0,1 мл раствора исследуемого вещества (конечные дозы 0,1, 1,0, 10, 100, 1000 мкг на чашку); 0,1 мл суспензии бактерий; 0,5 мл микросомальной активирующей смеси. Содержимое пробирки быстро размешивают и выливают на слой нижнего минимального агара на чашке Петри. Продолжительность времени внесения активирующей смеси и разливка полужидкого агара должна быть не более 10-15 секунд. Полужидкий агар должен покрыть поверхность чашки ровным слоем. Чашки оставляют при комнатной температуре 30-40 минут и после полного застывания переносят в термостат при 37 °С. Учет результатов (подсчет числа колоний-ревертантов на чашке) проводят через 48 часов инкубации.
Параллельно в опыт включают варианты с полной микросомальной смесью (ПМАС) и неполной микросомальной активирующей смесью (НМАС). В состав первой входят: S-9 фракция гомогената печени крыс и кофакторы; второй - вместо кофакторов вносят соответствующий объем воды. В вариантах с НМАС регистрируются мутагены, проявляющие эффект непосредственно. В вариантах с ПМАС выявляется эффект метаболитов вещества. В контрольных вариантах используют соответствующий растворитель.
Эксперимент сопровождают позитивными контролями со стандартными мутагенами. Для штаммов ТА 1535 и ТА 100 при НМАС - нитрозометилмочевина (100 мкг/чашку) или тиофосфамид (200 мкг/чашку); для штаммов ТА 1538 и ТА 98 при НМАС - ДДДТДП (100 мкг/чашку) (Абилев и соавт., 1979) или 2-нитрофлуорен (100 мкг/чашку). Активность гомогената контролируют, используя циклофосфан (500 мкг/чашку) на штаммах ТА 1535 и ТА 100 параллельно в вариантах с ПМАС и НМАС при работе с фенобарбитал-индуцированными микросомами, или бенз(а)пирен или 2-ацетиламинофлуорен (10 мкг/чашку) на штаммах ТА 1538, ТА 100 и ТА 98 при работе с 3-метилхолантрен-индуцированными микросомами. Необходимым условием возможности учета результатов является наличие мутагенного эффекта во всех вариантах позитивных контролей, а также в контроле на активность гомогената.
В каждом опытном и контрольном вариантах используют по 3 чашки. Статистическая обработка данных проводится по методу множественных сравнений Даннета (Dunnett, 1955) (табл.2). Эффективность и рациональность этого метода по сравнению с методами попарного сравнения опытных и контрольных вариантов выражается прежде всего в снижении частоты ложно-положительных результатов, поскольку вероятность ошибки I рода (обычно принимаемая за 5%) задается для всего эксперимента, а не для каждой отдельной группы. Метод предполагает оценивание случайной дисперсии (![]() ) по всем исследованным дозам в варианте (НМАС или ПМАС каждого штамма), что увеличивает точность оценки и разрешающую способность метода.
) по всем исследованным дозам в варианте (НМАС или ПМАС каждого штамма), что увеличивает точность оценки и разрешающую способность метода.
Таблица 2
Значения ![]() для сравнения опытных групп с контрольной (Dunnett, 1955)
для сравнения опытных групп с контрольной (Dunnett, 1955)
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
5 |
2,02 |
2,44 |
2,68 |
2,85 |
2,98 |
3,08 |
3,16 |
3,24 |
3,30 |
|
6 |
1,94 |
2,34 |
2,56 |
2,71 |
2,83 |
2,92 |
3,00 |
3,07 |
3,12 |
|
7 |
1,89 |
2,27 |
2,48 |
2,62 |
2,73 |
2,82 |
2,89 |
2,95 |
3,01 |
|
8 |
1,86 |
2,22 |
2,42 |
2,55 |
2,66 |
2,74 |
2,81 |
2,87 |
2,92 |
|
9 |
1,83 |
2,18 |
2,37 |
2,50 |
2,60 |
2,68 |
2,75 |
2,81 |
2,86 |
|
10 |
1,81 |
2,15 |
2,34 |
2,47 |
2,56 |
2,64 |
2,70 |
2,76 |
2,81 |
|
11 |
1,80 |
2,13 |
2,31 |
2,44 |
2,53 |
2,60 |
2,67 |
2,72 |
2,77 |
|
12 |
1,78 |
2,11 |
2,29 |
2,41 |
2,50 |
2,58 |
2,64 |
2,69 |
2,74 |
|
13 |
1,77 |
2,08 |
2,27 |
2,39 |
2,48 |
2,55 |
2,61 |
2,66 |
2,71 |
|
14 |
1,76 |
2,08 |
2,25 |
2,37 |
2,46 |
2,53 |
2,59 |
2,64 |
2,69 |
|
15 |
1,75 |
2,07 |
2,24 |
2,36 |
2,44 |
2,51 |
2,57 |
2,62 |
2,67 |
|
16 |
1,75 |
2,06 |
2,23 |
2,34 |
2,43 |
2,50 |
2,56 |
2,61 |
2,65 |
|
17 |
1,74 |
2,05 |
2,22 |
2,33 |
2,42 |
2,49 |
2,54 |
2,59 |
2,64 |
|
18 |
1,73 |
2,04 |
2,21 |
2,32 |
2,41 |
2,48 |
2,53 |
2,58 |
2,62 |
|
19 |
1,73 |
2,03 |
2,20 |
2,31 |
2,40 |
2,47 |
2,52 |
2,57 |
2,61 |
|
20 |
1,72 |
2,03 |
2,19 |
2,30 |
2,39 |
2,46 |
2,51 |
2,56 |
2,60 |
|
24 |
1,71 |
2,01 |
2,17 |
2,28 |
2,36 |
2,43 |
2,48 |
2,53 |
2,57 |
|
30 |
1,70 |
1,99 |
2,15 |
2,25 |
2,33 |
2,40 |
2,45 |
2,50 |
2,54 |
|
40 |
1,68 |
1,97 |
2,13 |
2,23 |
2,31 |
2,37 |
2,42 |
2,47 |
2,51 |
|
60 |
1,67 |
1,95 |
2,10 |
2,21 |
2,28 |
2,35 |
2,39 |
2,44 |
2,48 |
|
120 |
1,66 |
1,93 |
2,08 |
2,18 |
2,26 |
2,32 |
2,37 |
2,41 |
2,45 |
|
|
1,64 |
1,92 |
2,06 |
2,16 |
2,23 |
2,29 |
2,34 |
2,38 |
2,42 |
При обработке первичного материала для стабилизации дисперсии проводится логарифмирование числа колоний-ревертантов на чашку. Описываемый подход не предусматривает использование концентраций, при которых хотя бы на одной из чашек получено нулевое значение числа колоний-ревертантов. Такие ситуации бывают при работе с веществами, обладающими бактерицидными свойствами.
Введем следующие обозначения: ![]() - число колоний-ревертантов в
- число колоний-ревертантов в ![]() -й чашке при
-й чашке при ![]() -дозе (
-дозе (![]() );
); ![]() - число используемых в эксперименте доз;
- число используемых в эксперименте доз; ![]() ;
; ![]() - число чашек Петри при
- число чашек Петри при ![]() -дозе вещества. Ход вычислений следующий:
-дозе вещества. Ход вычислений следующий:
1. для каждой дозы вещества и контроля определяется среднее значение 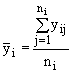 ;
; ![]()
2. оценивается случайная дисперсия варианта 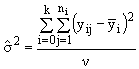 где
где ![]() число степеней свободы
число степеней свободы ![]() *.
*.
_______________
* Формула соответствует оригиналу. - Примечание
3. вычисляется величина доверительного интервала для варианта - 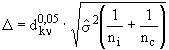 , где
, где ![]() - коэффициент, значения которого приведены в таблице 1,
- коэффициент, значения которого приведены в таблице 1, ![]() - число чашек на
- число чашек на ![]() -дозе вещества,
-дозе вещества, ![]() - число чашек в контроле с растворителем.
- число чашек в контроле с растворителем.
4. при ![]() (
(![]() ) различие между средним числом колоний-ревертантов при
) различие между средним числом колоний-ревертантов при ![]() -дозе (
-дозе (![]() ) и таковым в контроле (
) и таковым в контроле (![]() ) статистически значимо.
) статистически значимо.
Пример статистической обработки данных.
В таблице 3 приведены результаты эксперимента по анализу мутагенной активности вещества на штамме ТА 1535 в варианте ПМАС. Всего 5 доз (![]() =5) и контроль. На каждую дозу вещества ставили по 3 чашки (
=5) и контроль. На каждую дозу вещества ставили по 3 чашки (![]() ). Число колоний-ревертантов на чашку (
). Число колоний-ревертантов на чашку (![]() ) и их логарифмы (
) и их логарифмы (![]() ) даны в столбцах 3, 4, 5. Вычисляем среднее значение (
) даны в столбцах 3, 4, 5. Вычисляем среднее значение (![]() ) и сумму квадратов отклонений от средней для каждой дозы
) и сумму квадратов отклонений от средней для каждой дозы ![]() и вносим значения соответственно в столбец 6 и 7.
и вносим значения соответственно в столбец 6 и 7.
Таблица 3
Пример обработки результатов эксперимента на штамме ТА 1535 в варианте ПMAC
|
Доза |
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
0,1 |
3 |
10 |
9 |
7 |
|
|
|
|
|
|
|
2,30 |
2,20 |
1,95 |
2,15 |
0,0434 |
0,09 |
-0,69 |
|
1,0 |
3 |
4 |
10 |
11 |
|
|
|
|
|
|
|
1,39 |
2,30 |
2,40 |
2,03 |
0,6194 |
-0,03 |
-0,81 |
|
10,0 |
3 |
10 |
11 |
9 |
|
|
|
|
|
|
|
2,30 |
2,40 |
2,20 |
2,30 |
0,0200 |
0,24 |
-0,54 |
|
100,0 |
3 |
8 |
15 |
16 |
|
|
|
|
|
|
|
2,08 |
2,71 |
2,77 |
2,52 |
0,3283 |
0,46 |
-0,32 |
|
1000,0 |
3 |
56 |
25 |
31 |
|
|
|
|
|
|
|
4,03 |
3,22 |
3,43 |
3,56 |
0,3534 |
1,50 |
0,72 |
|
контроль |
3 |
5 |
12 |
8 |
|
|
|
|
|
|
|
1,61 |
2,48 |
2,08 |
2,06 |
0,3793 |
|
|
Число степеней свободы ![]()
Дисперсия варианта ![]()
Величина доверительного интервала для варианта при табличном значении ![]() равна
равна ![]() . В столбец 8 вносим для каждой дозы величину
. В столбец 8 вносим для каждой дозы величину ![]() . Вычитаем для каждой дозы из этой величины величину доверительного интервала
. Вычитаем для каждой дозы из этой величины величину доверительного интервала ![]() . Только при максимальной дозе вещества эта разность больше 0 (0,72). Следовательно, мутагенный эффект показан только при этой дозе вещества. В итоговую таблицу вносят значения среднего числа колоний-ревертантов для каждой дозы, представляющие собой антилогарифмы средних, полученных при логарифмировании числа колоний-ревертантов на отдельных чашках (
. Только при максимальной дозе вещества эта разность больше 0 (0,72). Следовательно, мутагенный эффект показан только при этой дозе вещества. В итоговую таблицу вносят значения среднего числа колоний-ревертантов для каждой дозы, представляющие собой антилогарифмы средних, полученных при логарифмировании числа колоний-ревертантов на отдельных чашках (![]() ). Степень мутагенного эффекта определяется кратностью превышения числа колоний-ревертантов при данной дозе над таковым в контроле. При отсутствии статистически значимых различий степень мутагенного эффекта оценивается баллом "0". При наличии статистически значимых различий и превышении числа колоний при данной дозе над контролем до 10 раз мутагенный эффект оценивается как слабый (балл "1"), от 10 до 100 раз - средний (балл "2") и более, чем в 100 раз - сильный (балл "3").
). Степень мутагенного эффекта определяется кратностью превышения числа колоний-ревертантов при данной дозе над таковым в контроле. При отсутствии статистически значимых различий степень мутагенного эффекта оценивается баллом "0". При наличии статистически значимых различий и превышении числа колоний при данной дозе над контролем до 10 раз мутагенный эффект оценивается как слабый (балл "1"), от 10 до 100 раз - средний (балл "2") и более, чем в 100 раз - сильный (балл "3").
Если ни в одном из вариантов не получено статистически значимых различий, эксперимент прекращают. Эксперимент прекращают и в том случае, когда на данном штамме выявлен эффект с четкой дозовой зависимостью. Если в 1-м опыте на данном штамме получен позитивный статистически значимый результат с максимумом эффекта на одной из промежуточных доз, опыт повторяют с целью подтверждения эффекта и уточнения степени мутагенной активности. Опыт проводят только на штамме (штаммах), на котором выявлен эффект. За среднюю точку на шкале доз берут дозу, на которой показан максимальный эффект. В опыт вводят еще 4 дозы: в 2 и 5 раз больше и меньше средней дозы.
Если в повторном опыте на какой-либо из промежуточных доз степень мутагенного эффекта выше, чем в 1 опыте, то мутагенную активность вещества характеризуют на основе балла, полученного в повторном опыте. Если при проведении повторного опыта эффект не обнаружен, то проводится еще один дополнительный опыт. Заключение о наличии или отсутствии мутагенной активности вещества делается на основе совпадения результатов двух опытов.
Степень мутагенного эффекта вещества определяется максимальным баллом, полученным в опытах на всем наборе штаммов в использованном диапазоне доз.
3.1.3. Анализ частоты полихроматофильных эритроцитов с микроядрами в костном мозге мышей (микроядерный тест)
Метод предложен независимо Heddle и Schmid в начале 70-х годов. Сущность феномена состоит в том, что во время деления клеток ацентрические фрагменты хромосом и отставшие хромосомы, не вошедшие в дочерние ядра, формируют в цитоплазме клеток одно, реже два ДНК-содержащих образования, получивших название микроядер (МЯ). Таким образом, учет частоты клеток с микроядрами указывает на цитогенетическую активность изучаемого фактора. Самый надежный результат дает анализ МЯ в созревающих эритроцитах костного мозга - полихроматофильных эритроцитах (ПХЭ). Дифференциальное окрашивание позволяет легко отличить эти недавно прошедшие митоз клетки от зрелых эритроцитов. Продолжительность стадии ПХЭ около 24 часов, поэтому целесообразно применять микроядерный тест только в острых опытах. Кроме показателя частоты ПХЭ с МЯ можно на тех же препаратах оценить клеточный состав костного мозга.
Лабораторные животные. Эксперименты проводят на белых нелинейных мышах весом 18-20 г или крысах весом 180-200 г. Можно использовать другие виды лабораторных животных.
Реактивы: 1. Сыворотка крови человека IV группы (АВО) хранится в морозилке. Перед опытом разморозить и инактивировать в водяной бане при 60 °С в течение 2-х часов; 2. краситель Май-Грюнвальд; 3. краситель Гимза; 4. фосфатный буфер рН=7,0: 2,85 мл раствора А (2,26 г, ![]() на 250 мл дистиллированной воды)+2,15 мл раствора Б (5,97 г
на 250 мл дистиллированной воды)+2,15 мл раствора Б (5,97 г ![]() на 250 мл дистиллированной воды) на 1 литр дистиллированной воды. Растворы А и Б хранят в холодильнике. (Фосфатный буфер применяется на всех этапах окрашивания препаратов).
на 250 мл дистиллированной воды) на 1 литр дистиллированной воды. Растворы А и Б хранят в холодильнике. (Фосфатный буфер применяется на всех этапах окрашивания препаратов).
Ход методики. Применяют методику в модификации В.В.Юрченко и Е.Г.Фельдт. Животных забивают методом цервикальной дислокации; выделяют бедренные кости (у крыс - одну кость) и очищают марлей от мышц. Отрезают верхний конец бедренной кости так, чтобы было видно отверстие канала кости. В серологические пробирки объемом до 1 мл наливают 0,8 мл сыворотки. Набирают в шприц 0,2-0,5 мл сыворотки из пробирки и, вставив иглу шприца в канал кости, вымывают костный мозг в пробирку. Эту процедуру повторяют 2-3 раза. Пробирки с суспензией клеток центрифугируют 5 минут при 1000 об. в минуту. Супернатант отсасывают. Осадок ресуспендируют пастеровской пипеткой до получения гомогенной суспензии. Каплю суспензии пастеровской пипеткой наносят на конец сухого обезжиренного стекла и другим стеклом делают мазок. После высушивания на воздухе мазок окрашивают по следующей методике: а) мазок фиксируют в метаноле в течение 3 минут; б) наносят на мазок краситель Гимза, разведенный 1:6 в буфере - 10 мин; в) препараты дважды промывают в дистиллированной воде; г) наносят на стекло неразведенный краситель Май-Грюнвальд - 3 мин; д) препарат дважды промывают в дистиллированной воде и высушивают на воздухе.
Анализ препаратов. Анализ проводят под микроскопом с использованием иммерсионного объектива 10х90. Пригодными для анализа считаются препараты с хорошо расправленными эритроцитами, поверхность которых не имеет выростов и складок. Полихроматофильные эритроциты имеют серовато-голубоватую окраску, нормохромные - оранжево-розовую. Микроядра представляют собой округлые, с четкой границей образования, имеющие темную окраску, сходную с окраской ядер в препарате. Анализ проводят на зашифрованных препаратах. Подсчитывают 1000 ПХЭ и определяют количество ПХЭ с МЯ. У интактных животных количество ПХЭ с МЯ колеблется от 0 до 5 на 1000 ПХЭ. Средний уровень ПХЭ с МЯ у белых беспородных самцов мышей (73 животных) составил 0,2±0,02%.
Схема проведения опытов. Изучение мутагенного эффекта химических веществ в микроядерном тесте проводится в остром опыте. Вещество вводится зондом внутрижелудочно 2-кратно с интервалом между введениями 24 часа. Забой животных проводится через 6 часов после последнего введения. Обычно исследуются 4 дозы в интервале от 1/5 ЛД![]() до 1/500 ЛД
до 1/500 ЛД![]() . Контрольным животным вводят растворитель. На группу берется по 6 животных.
. Контрольным животным вводят растворитель. На группу берется по 6 животных.
Статистическая обработка результатов. Сравнение частот ПХЭ с МЯ в опыте и контроле проводится по критерию Стьюдента при предварительном преобразовании данных по каждому животному:
![]() ,
,
где ![]() - число ПХЭ с МЯ у животного;
- число ПХЭ с МЯ у животного; ![]() - общее число ПХЭ у животного.
- общее число ПХЭ у животного.
3.1.4. Заключение по данным этапа I
Вещества, не проявившие мутагенную активность на этапе, регламентируются без учета мутагенных эффектов. Вещества, обнаружившие мутагенный эффект в исследованиях на этапе I, относятся к потенциальным мутагенам и должны быть изучены на этапе II. Вещества, пороговая концентрация которых по органолептическому признаку вредности в 100 и более раз ниже, чем экспериментально или расчетом установленная МНД по общетоксическому действию, не исследуются на этапе II.
3.2. Этап II. Количественная оценка мутагенной активности в опытах на млекопитающих
На втором этапе исследуется мутагенная активность веществ, показавших положительный эффект на этапе I. Обоснование методов и схем экспериментов (дозы, длительность) даны в работе В.С.Журкова (1981 г.). В качестве обязательных тестов рекомендованы анализ аберраций хромосом в клетках костного мозга млекопитающих и анализ доминантных летальных мутаций в половых клетках самцов млекопитающих.
3.2.1. Метафазный анализ аберраций хромосом в клетках костного мозга млекопитающих
В основе метода лежит регистрация структурных повреждений хромосом (хромосомных аберраций) в клетках костного мозга на стадии метафазы. Это позволяет оценивать цитогенетическую активность (способность вызывать хромосомные мутации) химических веществ на соматических клетках млекопитающих.
Лабораторные животные. Эксперименты проводят на самцах белых нелинейных мышей весом 18-20 г или крысах весом 180-200 г. Для проведения экспериментов рекомендовано также (Малашенко, 1977) использовать мышей линии C57BI/6 или гибридов первого поколения CBAхC57BI/6.
Реактивы: а) раствор колхицина в концентрации 2,5 мг/мл для опытов на крысах и 0,25 мг/мл для опытов на мышах; б) раствор Хенкса; в) фиксатор - ледяная уксусная кислота+метанол в соотношении 1:3 (готовится перед фиксацией, хранится в холодильнике); г) гипотонический раствор - 0,55% раствор хлористого калия; д) азур-эозин для окраски препаратов: 10 мл дистиллированной воды+5 капель 5% бикарбоната натрия+2,0 мл 0,1% раствора эозинна+5,0 мл 0,1% раствора азура (краску готовят перед применением).
Ход методики. За 2 часа до забоя животным вводят внутрибрюшинно раствор колхицина в объеме 0,1% от веса тела (при весе тела крысы 200 г - 0,2 мл раствора колхицина). Конечная доза колхицина 2,5 мг/кг. Животных забивают методом цервикальной дисплокации. Выделяют и очищают бедренные кости (для мышей две, для крыс - одну). Ножницами срезают эпифизы бедренных костей. С помощью шприца вымывают из кости костный мозг подогретым до 37 °С (в термостате) раствором Хенкса в центрифужную пробирку с тем же раствором. Суспензию клеток в растворе Хенкса можно хранить в термостате при 37 °С до 2-х часов.
Сразу после выделения костного мозга или хранения в термостате пробирки с суспензией центрифугируют при 1000 об/мин 5 минут. Надосадочную жидкость отсасывают. К осадку добавляют 8 мл подогретого до 37 °С гипотонического раствора и тщательно ресуспендируют. Пробирки помещают в термостат при 37 °С на 10 минут, после чего вновь центрифугируют. Отсасывают надосадочную жидкость, оставляя 0,3 мл. После тщательного ресуспендирования встряхиванием к осадку добавляют 6-8 мл охлажденного фиксатора. Пробирки закрывают пробками, перемешивают суспензию встряхиванием и помещают в холодильник на 10-15 минут. Затем суспензию вновь центрифугируют, отсасывают надосадочную жидкость и добавляют 5-6 мл свежего фиксатора. Смену фиксатора проводят таким образом 2-3 раза.
Перед приготовлением препаратов суспензию центрифугируют при 1000 об/мин 5 минут. Отсасывают нaдoсaдoчнyю жидкость, оставляя 1 мл. Осадок ресуспендируют пастеровской пипеткой. На обезжиренные, мокрые и охлажденные предметные стекла наносят 8-10 капель суспензии. Фиксатор выжигают в пламени горелки. Стекла высушивают на воздухе. Препараты окрашивают приготовленным раствором азур-эозина, нанося промывают водопроводной водой и высушивают на воздухе.
Анализ препаратов. Анализ препаратов проводят на микроскопах под иммерсионным объективом. Увеличение 10х90. На каждое животное анализируют 100 метафаз. Анализ хромосомных аберраций проводят на зашифрованных препаратах. Требования к отбору метафаз и классификация типов аберраций изложены в методических рекомендациях ИМГ АМН СССР (1974). Учитывают следующие показатели: процент клеток с аберрациями хромосом; число одиночных фрагментов, хроматидных обменов, парных фрагментов, хромосомных обменов и всего аберраций на 100 метафаз. Пробелы в качестве аберраций не регистрируются. При наличии в клетке 10 и более аберраций их регистрируют как клетки с множественными аберрациями. Для анализа митотической активности определяют митотический индекс, подсчитывая число митозов на 1000 ядер.
Согласно полученным нами данным средняя частота клеток с аберрациями хромосом в костном мозге самцов белых беспородных мышей составляет 1% (колебания от опыта к опыту от 0,5 до 2%); в костном мозге крыс - 0,8% (колебания между опытами от 0,2 до 1,6%). Половых различий в частоте аберрантных метафаз у контрольных животных не было отмечено.
Схема проведения опытов. Экспериментальные результаты и данные литературы показывают, что для прогноза величины цитогенетического эффекта химических веществ в клетках костного мозга млекопитающих при хроническом воздействии достаточно ограничиться подострым экспериментом (В.С.Журков, 1981). Мы рекомендуем проведение 15-суточного эксперимента. Вещество вводится зондом внутрижелудочно с интервалом 24 часа. Контрольным животным вводится растворитель. Животных забивают через 6 часов после последнего введения препарата. Исследуется 5 доз - от 1/10 ЛД![]() и ниже с 5-кратным интервалом между дозами. На каждую группу берется по 6 животных.
и ниже с 5-кратным интервалом между дозами. На каждую группу берется по 6 животных.
Статистическая обработка. Основным показателем цитогенетического действия является % клеток с аберрациями хромосом. Сравнение частот клеток с аберрациями хромосом проводится с помощью критерия Стьюдента при предварительном преобразовании ![]() , где
, где ![]() - % клеток с аберрациями хромосом у животного. При работе с линейными животными можно использовать метод
- % клеток с аберрациями хромосом у животного. При работе с линейными животными можно использовать метод ![]() .
.
3.2.2. Учет доминантных летальных мутаций в половых клетках самцов млекопитающих
Доминантные летальные мутации - генетические изменения в половых клетках родительских особей, приводящие к гибели потомков первого поколения на эмбриональных стадиях развития. Основной вклад в индуцированные доминантные летали дают хромосомные мутации, меньше - геномные (нарушение числа хромосом) и генные мутации. Мутагенный эффект проявляется в повышенной эмбриональной смертности потомков первого поколения до и после имплантации.
Лабораторные животные. Опыты обычно проводятся на самцах белых нелинейных мышей, реже - крыс. Для снижения генетически обусловленной вариабильности результатов предлагается использование линейных мышей С57Вl/6 или гибридов первого поколения СВАхС57Вl/6 (Малашенко и соавт., 1977, Методические рекомендации, 1981). Для скрещивания используют самок из той же партии.
Ход методики и схема опыта. Экспериментальные данные показывают, что для прогноза величины мутагенного эффекта химических веществ в опытах по индукции доминантных летальных мутаций длительность эксперимента должна захватывать все стадии сперматогенеза, т.е. 8 недель для мышей и 11 недель для крыс (В.С.Журков, 1981). Вещество вводят зондом внутрижелудочно по 5 дней в неделю. Контрольным животным вводят растворитель. Исследуются 4 дозы в интервале от 1/15 ЛД![]() до 1/5000-1/10000 ЛД
до 1/5000-1/10000 ЛД![]() . На каждую группу берется минимум 15 самцов. После окончания воздействия к каждому самцу подсаживают по 3 виргинных самки на 1 неделю.
. На каждую группу берется минимум 15 самцов. После окончания воздействия к каждому самцу подсаживают по 3 виргинных самки на 1 неделю.
Самок мышей вскрывают на 15-17, самок крыс - на 19-20 день беременности. Подсчитывают число живых (ЖЭ) и мертвых (МЭ) эмбрионов. Большая часть доминантных леталей вызывает гибель эмбрионов во время имплантации или сразу после нее. Погибшие на этой стадии эмбрионы выглядят как темные гомогенные округлые тела диаметром 2,5-3 мм.
Анализ результатов и статистическая обработка. Учитывают следующие показатели: число самок, % беременных самок (фертильность), количество имплантаций, живых и мертвых эмбрионов на 1 беременную самку, показатель постимплантационных потерь ![]() . Основным показателем доминантных леталей служит уровень постимплантационных потерь. Сравнение этих показателей в опыте и контроле проводят либо непараметрическим методом по критерию Вилкинсона, беря за единицу измерения показатель постимплантационных потерь на 1 самца, у которого есть хотя бы одна беременная самка (Методические рекомендации, 1981), либо по методам, рекомендованным в работе М.А.Подольной и соавт. (1981).
. Основным показателем доминантных леталей служит уровень постимплантационных потерь. Сравнение этих показателей в опыте и контроле проводят либо непараметрическим методом по критерию Вилкинсона, беря за единицу измерения показатель постимплантационных потерь на 1 самца, у которого есть хотя бы одна беременная самка (Методические рекомендации, 1981), либо по методам, рекомендованным в работе М.А.Подольной и соавт. (1981).
По полученным данным средний уровень постимплантационных потерь у белых беспородных мышей и крыс составляет 3-8%.
3.2.3. Анализ данных экспериментов этапа II
По результатам исследований веществ в экспериментах на млекопитающих их можно подразделить на 2 группы: а) вещества, не показавшие мутагенной активности; б) вещества, обнаружившие мутагенный эффект. Для последней группы веществ определяется минимально-действующая доза мутагена (![]() ).
). ![]() - та наименьшая доза вещества, при которой было статистически значимое увеличение частоты мутаций в опытной группе по сравнению с контрольной в наиболее чувствительном тесте.
- та наименьшая доза вещества, при которой было статистически значимое увеличение частоты мутаций в опытной группе по сравнению с контрольной в наиболее чувствительном тесте.
4. Обоснование ПДК веществ, обладающих мутагенной активностью
4.1. Все вещества по результатам исследования мутагенной активности можно разделить на 3 группы:
1. Вещества, не показавшие мутагенный эффект на этапе I;
2. вещества, проявившие мутагенный эффект на этапе I, но не эффективные в экспериментах этапа II;
3. вещества, проявившие мутагенную активность на этапе II.
Вещества I и II групп нормируются без учета мутагенной активности. Для веществ 3-й группы устанавливается допустимая доза мутагена, определяется ПДК с учетом мутагенного эффекта.
4.2. В настоящее время отсутствуют общепринятые рекомендации к переходу от пороговой дозы (ПДК) к максимальной недействующей дозе (МНД), или к допустимой дозе мутагенного эффекта (![]() ).
).
В оценке различных отдаленных эффектов во всех областях гигиенического нормирования веществ уделяется внимание зоне специфического действия, (![]() ) (И.В.Саноцкий, В.Н.Фоменко), который представляет собой частное от деления пороговой дозы хранического общетоксического действия (
) (И.В.Саноцкий, В.Н.Фоменко), который представляет собой частное от деления пороговой дозы хранического общетоксического действия (![]() ) на порог отдаленного эффекта. Величина
) на порог отдаленного эффекта. Величина ![]() свидетельствует о преобладании отдаленных эффектов,
свидетельствует о преобладании отдаленных эффектов, ![]() - о преобладании общетоксического действия. Обобщение накопленного опыта в гигиеническом нормировании обладающих мутагенной активностью веществ в воде (З.И.Жолдакова, 1985) свидетельствует о том, что ни в одном случае
- о преобладании общетоксического действия. Обобщение накопленного опыта в гигиеническом нормировании обладающих мутагенной активностью веществ в воде (З.И.Жолдакова, 1985) свидетельствует о том, что ни в одном случае ![]() не были меньше
не были меньше ![]() в тысячи или сотни раз. Например, из 49 веществ, для которых была установлена мутагенная активность на лабораторных животных,
в тысячи или сотни раз. Например, из 49 веществ, для которых была установлена мутагенная активность на лабораторных животных, ![]() составляла 0,1 для 16 веществ, 1 - для 17, 1-5 для 14, 5-10 - для 10 и 20 - для 1 вещества, т.е. большинство веществ имеет близкие пороговые дозы или превалирует общетоксическое действие. Лишь у единичных веществ
составляла 0,1 для 16 веществ, 1 - для 17, 1-5 для 14, 5-10 - для 10 и 20 - для 1 вещества, т.е. большинство веществ имеет близкие пороговые дозы или превалирует общетоксическое действие. Лишь у единичных веществ ![]() могут быть ниже
могут быть ниже ![]() в 10-20, но не в 100 раз. При этом мутагенную активность проявляли вещества, обладающие сравнительно высокой токсичностью и кумулятивностью, a среди малотоксичных соединений не было выявлено ни одного мутагена.
в 10-20, но не в 100 раз. При этом мутагенную активность проявляли вещества, обладающие сравнительно высокой токсичностью и кумулятивностью, a среди малотоксичных соединений не было выявлено ни одного мутагена.
Поэтому при обосновании ПДК необходимо уделять внимание не только ![]() , но и
, но и ![]() , а при выборе коэффициента запаса (
, а при выборе коэффициента запаса (![]() ) учитывать полученные соотношения по
) учитывать полученные соотношения по ![]() .
.
4.3. По мнению И.В.Саноцкого и В.Н.Фоменко, при ![]() необходимо вводить
необходимо вводить ![]() ; при
; при ![]()
![]() ; при
; при ![]()
![]() , а при
, а при ![]() коэффициент запаса не применяется.
коэффициент запаса не применяется.
4.4. Предложенный В.С.Журковым (1981) подход основан на том, что максимальное превышение спонтанного уровня мутаций от действия отдельного средового мутагенного не должно превышать 1%. Так как применяемые на этапе II обязательные методы и схемы экспериментов на млекопитающих позволяют достоверно выявить повышение спонтанного уровня на 100-200%, то допустимая доза мутагена (![]() ) определяется как 1/200 от минимально действующей дозы мутагена (
) определяется как 1/200 от минимально действующей дозы мутагена (![]() ):
):
![]()
При регламентировании веществ 3 группы проводится сравнение ![]() с МНД и пороговыми концентрациями по общесанитарному и органолептическому признакам вредности. Если
с МНД и пороговыми концентрациями по общесанитарному и органолептическому признакам вредности. Если ![]() не меняется. Если
не меняется. Если ![]() , для расчета ПДК используется величина
, для расчета ПДК используется величина ![]() как лимитирующего признака вредности,
как лимитирующего признака вредности,
4.5. Уточнение и унификация ![]() для расчета ПДК веществ, вызывающих мутагенный эффект, будет дано после практической апробации данного методического документа.
для расчета ПДК веществ, вызывающих мутагенный эффект, будет дано после практической апробации данного методического документа.
ЛИТЕРАТУРА
1. Журков B.C., 1981. Подходы к регламентации химических загрязнителей окружающей среды, обладающих мутагенной активностью. "Медицинские проблемы охраны окружающей среды". Сб. научных трудов (под ред. академика АМН СССР Г.И.Сидоренко), М., 88-95.
2. Жолдакова З.И. "Методические подходы к определению коэффициента запаса при обосновании ПДК веществ в воде". - Тезисы докл. научно-практической конференции по санитарной охране водоемов. Пермь, 1985, с. 24-26.
3. Красовский Г.Н., 1977. Принципы и критерии поэтапного гигиенического нормирования веществ в воде. В кн.: "Вопросы охраны окружающей среды". Пермь, 19-22.
4. Красовский Г.Н., Жолдакова З.И., Егорова Н.А., 1979. Методические основы ускоренного гигиенического нормирования вредных веществ в воде. В кн.: "Проблема пороговости в токсикологии", М., 27-50.
5. Малашенко А.М., Суркова Н.И., Семенов Х.Х., 1977. Определение мутагенности химических соединений (генетический скрининг) на лабораторных мышах (Методические указания). М., 1-12.
6. Методические рекомендации, 1974. - "Метод учета хромосомных аберраций как биологический индикатор влияния факторов внешней среды на человека". М., 1-32.
7. Методические рекомендации, 1978. - "Методы экспериментального исследования по установлению порогов действия промышленных ядов на генеративную функцию с целью гигиенического нормирования". М. (Составители: И.В.Саноцкий, В.Н.Фоменко, Л.С.Сальникова и др.), 1-35.
8. Методические рекомендации, 1981. - "Методические рекомендации по проверке мутагенных свойств у новых лекарственных препаратов", М., 1-56.
9. Подольная М.А., Бобринев Е.В., Ревазова Ю.А., 1981 - Анализ некоторых методов статистической обработки результатов экспериментов по индукции доминантных летальных мутаций в зародышевых клетках мышей. Генетика, т.17, N 4, 651-657.
10. Саноцкий И.В., Фоменко В.Н. - Отдаленные последствия влияния химических соединений на организм. М., "Медицина", 1979, 330.
11. Фонштейн Л.М., Калинина Л.М. Полухина Г.Н., Абилев С.К., Шапиро А.А., 1977 - Тест-система оценки мутагенной активности загрязнителей среды на Salmonella (Методические указания), М., 1-52.
12. Ames B.N., Durston W.E. Yamasaki E., Lee F.D., 1973 - Carcinogens are mutagens: a simple test system combining liver homogenates for activation and bacteria for detection. Proc. Nat. Acad. Sci. USA, v.70, p.2281-2285.
13. Ames B.N., McCann Y., Yamasaki E., 1975 - Methods for detecting carcinogens and mutagens with the Salmonella/mammalian-microsome mutagenicity test. Mutat. Res., v.31, p.347-364.
14. Belser W.L.Yr., Shaffer S.D., Bliss R.D., Hynds P.M., Yamamoto L., Pitts Y.N.Yr., Winer Y.А., 1981 - A standardized procedure for quantification of the Ames Salmonella/mammalian-microsome mutageniciti test. Environ. Mutagen., v.3, p.123-139.
15. Dunnett С. - J. Amer. Stat. Assoc. 1955, v.5, p.1096.
Текст документа сверен по:
/ Минздрав СССР; Главное санитарно-эпидемиологическое
управление. - М., 1986


 Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов