- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
МУК 4.2.1913-04
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы количественного определения генетически модифицированных
источников (ГМИ) растительного происхождения в продуктах питания
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: ГУ НИИ питания РАМН (В.А.Тутельян, Е.Ю.Сорокина, О.Н.Чернышева, А.Б.Левицкая), ГУ ЦНИИ эпидемиологии Минздрава России (Г.А.Шипулин, С.Б.Яцышина), Департамент госсанэпиднадзора Минздрава России (А.И.Петухов), Федеральный центр госсанэпиднадзора Минздрава России (Е.Н.Беляев, И.В.Брагина, Т.В.Воронцова, Т.Н.Потапова, Т.Ф.Авдеенко, С.Ю.Терехова, М.В.Зароченцев), Центр "Биоинженерия" РАН (К.Г.Скрябин, Д.Б.Дорохов, Б.Б.Кузнецов).
2. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Главным государственным санитарным врачом Российской Федерации - Первым заместителем Министра здравоохранения Российской Федерации 06.03.04.
3. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
1.1. Настоящие методические указания устанавливают методы определения количественного содержания ГМИ растительного происхождения в пищевой продукции.
1.2. Методические указания предназначены для применения в лабораториях учреждений санитарно-эпидемиологической службы Российской Федерации, осуществляющих контроль за качеством продовольственного сырья и пищевых продуктов, в т.ч. импортируемых в Российскую Федерацию, гигиеническую оценку и выдачу санитарно-эпидемиологических заключений, лабораториях других организаций, аккредитованных в установленном порядке на право проведения контроля безопасности пищевой продукции и продовольственного сырья.
1.3. Методические указания являются обязательными при контроле пищевых продуктов на наличие генетически модифицированных источников и применяются на этапах поставки на производство, гигиенической экспертизы, государственной регистрации, закупки, ввоза в страну и реализации.
1.4. Методические указания разработаны с целью обеспечения единого методического подхода для количественного контроля генетически модифицированных источников в пищевых продуктах, продовольственном сырье, пищевых и биологически активных добавках к пище.
2. Общие положения
Методические указания содержат описание методов определения количественного содержания ГМИ растительного происхождения в пищевых продуктах, основанных на идентификации рекомбинантной ДНК с использованием метода полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени (RealTime PCR).
Описанные методы направлены на выявление регуляторной последовательности промотора 35S из вируса мозаики цветной капусты. Определение количественного содержания этой регуляторной последовательности параллельно с определением количественного содержания референсной последовательности генома растения позволяет проводить анализ количественного содержания ГМИ (в %). Окончательное количественное определение ГМИ в пищевой продукции, разрешенных для реализации населению и использованию в пищевой промышленности в Российской Федерации, проводится с применением методов исследований для конкретных трансформационных событий, описание которых представляется разработчиком в Минздрав России.
В методических указаниях представлены методы определения генетических конструкций для наиболее часто встречаемых на мировом и внутреннем продовольственном рынках генетически модифицированных растений.
Представленные методы состоят из следующих этапов: выделение ДНК из пищевого продукта, проведение амплификации с детекцией в режиме реального времени с использованием специального оборудования, проведение анализа результатов амплификации, расчет процентного содержания генетически модифицированных источников и оформление результатов в документах.
Метод количественного определения сои линии 40-3-2, являющейся доминирующей генетически модифицированной культурой на мировом и внутреннем продовольственном рынках, основан на количественном иммуноферментном анализе модифицированного белка, определяющего устойчивость к глифосату.
Анализ пищевого продукта на содержание ГМИ включает на первом этапе качественное определение ГМИ методом полимеразной цепной реакции (идентификация рекомбинантной ДНК: промотор 35S и/или терминатор NOS). При получении положительного результата проводится определение конкретного ГМИ, который был использован при производстве исследуемого продукта, с целью выявления разрешенных и неразрешенных для реализации в Российской Федерации. В случае решения вопроса о маркировке продукта проводится количественное определение ГМИ (прилож.1).
3. Аппаратура, материалы и реактивы
3.1. Амплификаторы с оптической приставкой типа Rotor Gene - 3000, ABI Prism 7000 и другие |
|
3.2. Холодильник бытовой электрический |
|
Камера морозильная, обеспечивающая температуру минус 20 °С |
|
3.3. Микроцентрифуга настольная типа Эппендорф и другие (частота вращения не менее 13000 об./мин) |
|
3.4. Термостат типа "TERMO 24-15" и другие под пробирки типа Эппендорф, вместимостью 1,5 мл, диапазон температур от 15 °С до 120 °С, количество гнезд - не менее 20, точность поддержания температуры - 0,2 °С, разность температур между соседними ячейками - не более 0,5 °С |
|
3.5. Аппарат для встряхивания типа "Вортекс" и другие (скорость вращения 250-3000 об./мин ) |
|
3.6. Весы лабораторные общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г |
|
3.7. Анализатор потенциометрический, погрешность измерений рН±0,01 |
ГОСТ 19881 |
3.8. Стерилизаторы паровые медицинские или аналогичные |
ГОСТ 19569* |
_______________ | |
3.9. Дистиллятор, обеспечивающий качество дистиллированной воды |
ГОСТ 6709 |
3.10. Гомогенизатор перистальтического типа "Стомайкер" или других моделей |
|
3.11. Облучатель бактерицидный настенный ОБН-150 или других видов |
ТУ 16-535 |
3.12. Дозаторы с переменным объемом дозирования: |
|
0,2-2,0 мм |
|
0,5-10,0 мм |
|
2-20 мм |
|
20-200 мм |
|
100-1000 мм |
|
2-10 см |
|
3.13. Пинцет медицинский |
|
3.14. Ножницы медицинские |
|
3.15. Скальпель хирургический |
|
3.16. Штативы для пробирок микроцентрифужных типа Эппендорф, вместимостью 0,2 см |
|
3.17. Ступка фарфоровая с пестиком |
|
3.18. Шпатель под размер микроцентрифужной пробирки, вместимостью 1,5 см |
|
3.19. Бумага фильтровальная лабораторная |
ГОСТ 12026 |
3.20. Воронки стеклянные |
ГОСТ 25336 |
3.21. Колбы стеклянные мерные плоскодонные конические, вместимостью 25, 50, 100, 200, 1000 см |
ГОСТ 12738 |
3.22. Цилиндры стеклянные мерные лабораторные, вместимостью 25, 100, 1000 см |
ГОСТ 1770 |
3.23. Пробирки микроцентрифужные типа Эппендорф, вместимостью 0,2 см |
|
3.24. Наконечники с фильтром для дозаторов с переменным объемом дозирования до: 10; 20; 200; 1000 мм |
|
3.25. Оптические 96-луночные планшеты типа MicroAmp |
|
3.26. Оптические крышки типа MicroAmp |
|
3.27. Оптические прозрачные адгезивные пленки |
|
3.28. Оптические пробирки объемом 0,2 см |
|
3.29. Кислота соляная, хч |
ГОСТ 3118 |
3.30. Кислота борная, хч |
ГОСТ 9656 |
3.31. Натрия гидроокись, хда |
ГОСТ 4328 |
3.32. Натрий хлористый, хч |
ГОСТ 4233 |
3.33. Этилендиаминтетрауксусная кислота (ЭДТА), хч |
ТУ 6-09-11-1721 |
3.34. Гексадецилтриметиламмониум бромид (СТАБ) |
|
3.35. Трис (оксиметил) аминометан, хч |
ТУ 6-09-4292 |
3.36. Спирт этиловый ректификованный |
|
3.37. Спирт изопропиловый, хч |
ТУ 6-09-402-85 |
3.38. Хлороформ, хч |
|
3.39. Вода дистиллированная |
ГОСТ 6709 |
3.40. Вода деионизированная |
ОСТ 11.029.003 |
3.41. 2-меркаптоэтанол, хч |
ТУ 6-09-08-1024 |
Допускается использование другого оборудования, инструментов, лабораторной посуды и реактивов с аналогичными техническими характеристиками, разрешенных к применению в установленном порядке.
4. Отбор, хранение и подготовка проб пищевых продуктов для анализа
Отбор проб проводят по государственным стандартам, устанавливающим порядок отбора проб для однородных групп пищевой продукции: ГОСТ 5904, 9163, 12292, 10852, 12430, 13979, 26313, 22617.0, 27668, 26312.1, 9792, 7631.
4.1. Отбор образцов
От партии сырья или сыпучих продуктов отбирают общую пробу следующим образом:
- от исследуемой партии сырья или сыпучих продуктов отбирают не менее 10 образцов проб (по 5-10 г) в одноразовый плотный полиэтиленовый пакет размером 20х30 см с использованием одноразовых хирургических перчаток и перемешивают, формируя общую пробу (50-100 г);
- из общей пробы отбирают среднюю пробу в 10-20 г, помещают в полиэтиленовый пакет с застежкой-молнией размером не более 10x15 см, который, в свою очередь, помещают в одноразовый плотный полиэтиленовый пакет размером 20х30 см, опечатывают и отправляют на анализ.
От партии продуктов плотной консистенции отбирают общую пробу весом 10-50 г в одноразовый плотный полиэтиленовый пакет с застежкой-молнией размером не более 10х15 см, используя одноразовые перчатки и фламбированные (выдержанные в 96%-ном этаноле и обожженные в пламени газовой горелки) инструменты, опечатывают и отправляют на анализ.
Пробы жидких продуктов отбирают в чистые емкости из стекла или пластика с герметично закрывающимися крышками объемом не более 50 см , опечатывают и отправляют на анализ.
, опечатывают и отправляют на анализ.
При отборе проб составляют акт отбора проб, который вместе с отобранной пробой отправляют в лабораторию.
4.2. Подготовка проб к анализу
Для подготовки проб необходимо использовать одноразовые полипропиленовые пробирки, ступки и пестики, предварительно обработанные хромовой смесью и фламбированные инструменты - пинцеты, скальпели, ножницы.
Пробы сухих гранулированных и сыпучих продуктов отбирают в ступку по 3-5 г и растирают пестиком до гомогенного состояния.
Пробы плотных продуктов (сырых или подвергшихся кулинарной обработке) весом 3-5 г помещают в ступку, измельчают ножницами, затем растирают пестиком до гомогенного состояния.
Пробы продуктов консистенции крахмала весом 100-300 мг помещают в одноразовые пластиковые пробирки и добавляют 1,0 см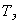 физиологического раствора. Для анализа необходимо 50-150 мм
физиологического раствора. Для анализа необходимо 50-150 мм образца.
образца.
Пробы жидкой консистенции отбирают автоматическими микродозаторами с одноразовыми наконечниками в одноразовые пробирки из полипропилена. Для анализа необходимо 50-150 мкл образца.
Из полученных гомогенатов и суспензий проводят выделение ДНК.
4.3. Условия хранения и транспортирования образцов
Образцы сырья и продуктов хранят в течение 1 месяца (при необходимости повторного анализа) согласно условиям, указанным производителем продукта питания. Образцы скоропортящихся продуктов хранят в замороженном состоянии (при температуре минус 20 °С) в течение 1 месяца (при необходимости повторного анализа).
Транспортирование образцов осуществляют при температуре, рекомендованной для хранения сырья или пищевого продукта. Длительность транспортирования не должна превышать сроков годности продукта.
5. Количественное определение рекомбинантной ДНК методом ПЦР
в режиме реального времени
Количественное определение рекомбинантной ДНК осуществляется методом полимеразной цепной реакции в режиме реального времени с использованием наборов реактивов, разрешенных к применению для этих целей в установленном порядке.
5.1. На примере метода, разработанного с использованием наборов TaqMan для анализа сои ("TaqMan GMO Soy Detection Kit") и кукурузы ("TaqMan GMO Maize Detection Kit").
5.1.1. Метод выделения ДНК с помощью СТАБ (гексадецилтриметиламмониум бромид).
Приготовление растворов
- СТАБ-буфер.
В мерную колбу вносят 4 г СТАБ; 16,4 г NaCl; 3,15 г ТРИС - НСl; 1,5 г Nа ЭДТА, добавляют 100 мл деионизированной воды, доводят рН раствора до 8,0 1 М NaOH, доводят объем деионизированной водой до 200 см
ЭДТА, добавляют 100 мл деионизированной воды, доводят рН раствора до 8,0 1 М NaOH, доводят объем деионизированной водой до 200 см .
.
Хранить при 4 °С не более 6 месяцев.
Перед использованием раствор выдерживают при комнатной температуре или подогревают в термостате при температуре 65 °С до полного растворения осадка. Непосредственно перед использованием в приготовленный лизирующий буфер вносят 2-меркаптоэтанол из расчета 4 мм на 1 см
на 1 см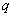 лизирующего буфера и перемешивают.
лизирующего буфера и перемешивают.
- СТАБ - осаждающий раствор.
В мерную колбу вносят 1 г СТАБ; 0,5 г NaCl, добавляют 100 см деионизированной воды, доводят рН раствора до 8,0 1 М NaOH, доводят объем деионизированной водой до 200 см
деионизированной воды, доводят рН раствора до 8,0 1 М NaOH, доводят объем деионизированной водой до 200 см .
.
Хранить при 4 °С не более 6 месяцев.
- 1,2 M NaCl.
Растворяют 7,0 г NaCl в 100 см деионизированной воды, перемешивают.
деионизированной воды, перемешивают.
Хранить в колбе с притертой пробкой при комнатной температуре до 1 года.
Приготовленные растворы автоклавируют при 1 атм., 121 °С 15-20 мин или фильтруют через мембраны Millipore 0,4 мм .
.
- 70%-ный раствор этилового ректификованного спирта.
Смешивают 70 см 96%-ного этилового ректификованного спирта с 26 см
96%-ного этилового ректификованного спирта с 26 см деионизированной воды.
деионизированной воды.
Хранить при температуре от 4 до 5 °С - не более 2 мес., в темной склянке.
Процедура выделения ДНК
- Навеску исследуемого гомогенизированного продукта массой 100 мг помещают в микроцентрифужную пробирку типа Эппендорф на 1,5 см .
.
- Добавляют 300 мм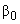 деионизированной воды, перемешивают шпателем.
деионизированной воды, перемешивают шпателем.
- Добавляют 500 мм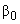 СТАБ-буфера с меркаптоэтанолом, тщательно перемешивают шпателем.
СТАБ-буфера с меркаптоэтанолом, тщательно перемешивают шпателем.
- Инкубируют при 65 °С 90 мин.
- Центрифугируют 10 мин на настольной микроцентрифуге типа Эппендорф при частоте вращения 13000 об./мин.
- Переносят 500 мм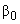 супернатанта в чистую пробирку типа Эппендорф вместимостью 1,5 см
супернатанта в чистую пробирку типа Эппендорф вместимостью 1,5 см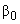 .
.
- Добавляют 500 мм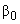 хлороформа, перемешивают на аппарате для встряхивания типа "Вортекс" 30 с.
хлороформа, перемешивают на аппарате для встряхивания типа "Вортекс" 30 с.
- Центрифугируют 10 мин при частоте вращения 13000 об./мин.
- Переносят 500 мм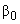 верхней фракции в чистую пробирку, добавляют 500 мм
верхней фракции в чистую пробирку, добавляют 500 мм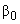 хлороформа, перемешивают.
хлороформа, перемешивают.
- Центрифугируют 5 мин при частоте вращения 13000 об./мин.
- Переносят верхнюю фракцию в чистую пробирку типа Эппендорф вместимостью 1,5 см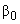 , не захватывая слой хлороформа.
, не захватывая слой хлороформа.
- Добавляют 2 объема СТАБ-осаждающего буфера, перемешивают пипетированием.
- Инкубируют 60 мин при комнатной температуре.
- Центрифугируют 5 мин при частоте вращения 13000 об./мин.
- Удаляют супернатант.
- Растворяют осадок в 350 мм NaCl (1,2 М).
NaCl (1,2 М).
- Добавляют 350 мм хлороформа, перемешивают на аппарате для встряхивания типа "Вортекс" 30 с.
хлороформа, перемешивают на аппарате для встряхивания типа "Вортекс" 30 с.
- Центрифугируют 10 мин при частоте вращения 13000 об./мин.
- Переносят верхнюю фракцию в чистую пробирку типа Эппендорф вместимостью 1,5 см .
.
- Добавляют 0,6 объема изопропилового спирта, перемешивают.
- Центрифугируют 10 мин при частоте вращения 13000 об./мин.
- Удаляют супернатант.
- Добавляют 500 мм 70%-ного раствора этилового спирта и перемешивают на аппарате для встряхивания типа "Вортекс".
70%-ного раствора этилового спирта и перемешивают на аппарате для встряхивания типа "Вортекс".
- Центрифугируют 10 мин при частоте вращения 13000 об./мин.
- Удаляют супернатант.
- Подсушивают осадок не более 5 мин при 65 °С для удаления капель спирта.
- Растворяют осадок в 100 мм деионизированной воды, осторожно встряхивая.
деионизированной воды, осторожно встряхивая.
- Полученный раствор ДНК готов для проведения ПЦР, хранить при минус 20 °С.
5.1.2. Метод выделения ДНК с помощью набора реагентов "Prep-Man Ultra".
- Взвешивают по 20 мг каждого образца и соответствующих стандартов в центрифужные пробирки с крышками вместимостью 2 см .
.
- Вносят по 400 см реагента PrepMan Ultra в пробирки с образцами и стандартами.
реагента PrepMan Ultra в пробирки с образцами и стандартами.
- Встряхивают образцы и стандарты до полностью суспендированного состояния.
- Инкубируют пробирки в течение 10 мин при 100 °С на водяной бане.
- Центрифугируют образцы и стандарты на микроцентрифуге 2 мин при 14000 об./мин.
- Переносят супернатант из каждой пробы в чистую пробирку.
Замечание: супернатанты могут быть слабо окрашены. Иногда довольно быстро или при хранении образуется помутнение. Это не требует никаких дополнительных действий.
- Для количественного определения ГМИ в реакцию добавляют по 5 мм супернатанта.
супернатанта.
- Хранить супернатанты при минус 20 °С, время хранения не ограничено.
5.1.3. Метод выделения ДНК с помощью набора реагентов "ДНК-сорб-С".
Выделение ДНК осуществляется в соответствии с инструкцией, прилагаемой к набору реагентов (см. пункт 5.1.1).
5.1.4. Метод выделения ДНК с использованием ABI Prism 6100 Nucleic Acid PrepStation и реагентов TransPrep chemistry.
6100 Nucleic Acid PrepStation и реагентов TransPrep chemistry.
Применение данного метода позволяет выделять ДНК в течение 1,5 часа в 96-луночном формате из пищевых продуктов и кормов. Выделенная ДНК свободна от ингибиторов и может быть использована для амплификации. Использование данного метода целесообразно в случае анализа большого количества образцов. Выделение ДНК осуществляют в соответствии с инструкцией, прилагаемой к набору реагентов.
Проведение реакции амплификации
Амплификацию проводят с использованием наборов реагентов для анализа сои "TaqMan GMO Soy Detection Kit" и наборов реагентов для анализа кукурузы "TaqMan GMO Maize Detection Kit".
Наборы реагентов предназначены для определения присутствия в образцах генетически модифицированных кукурузы или сои. В анализе используют полимеразную цепную реакцию (ПЦР), позволяющую амплифицировать эндогенную контрольную мишень, которая является уникальной для кукурузы или сои, а также мишень, указывающую на присутствие генетически модифицированных кукурузы или сои.
В наборе реактивов для анализа ГМИ с зондами TaqMan используется 5' - экзонуклеазная активность Taq-полимеразы.
Интенсивность флуоресценции измеряют с помощью приборов с детекцией фрагментов ПЦР в режиме реального времени типа ABI-PRISM 7000, Rotor Gene 3000 и анализируют с помощью программного обеспечения приборов.
С помощью наборов реактивов TaqMan определяют присутствие продуктов ПЦР путем регистрации увеличения флуоресценции двух флуоресцентных красителей (FАМ и VIC). Реакционная система включает две независимые системы ПЦР (находящиеся в каждой реакционной пробирке), каждая из которых содержит свои собственные праймеры и меченый флуоресцентными красителями зонд.
С помощью первой системы ПЦР выявляют последовательность ДНК-мишени, специфичной для ГМИ. Вторая представляет собой систему эндогенного контроля (ЭК), с помощью которого определяют генетически модифицированные или не модифицированные кукурузу или сою. Красители выбирают в окне Plate Setup программного обеспечения приборов для выполнения соответствующего анализа результатов, полученных в двух указанных системах ПЦР: специфичной к ГМИ и к ЭК.
Зонд системы ГМИ включает флуоресцентный краситель FАМ.
Зонд системы ЭК включает флуоресцентный краситель VIC. Результаты, полученные с помощью красителя FАМ (специфичного к ГМИ), сравнивают с результатами, полученными с помощью соответствующего красителя VIC, и, таким образом, определяют процентное содержание ГМИ в каждом образце.
Праймеры и зонды для определения ЭК включены в состав смеси GMO TaqMan mix, которую используют в каждой реакционной пробирке. С их помощью определяют ген, специфичный для кукурузы (набор для анализа кукурузы TaqMan GMO Maize Detection Kit) или сои (набор для анализа сои TaqMan GMO Soy Detection Kit). Системы ЭК являются ключевыми для количественного анализа, а также позволяют определить присутствие ДНК исследуемого растения (кукурузы или сои) в образце.
Для определения количества ГМИ с помощью набора реактивов для анализа GMO TaqMan следует использовать контрольные стандарты ГМИ, выпускаемые Институтом контрольных материалов и методов, Бельгия (Institute for Reference Materials and Methods). Используют отдельные наборы стандартных образцов для генетически модифицированной сои и генетически модифицированной кукурузы. Экстракты ДНК из стандартов ГМИ должны быть приготовлены тем же методом, что и анализируемые образцы продуктов питания. Контрольные стандарты ГМИ следует анализировать в каждом реакционном планшете с помощью набора реактивов GMO TaqMan.
Для проведения лабораторных исследований рекомендуется использовать 2 положительных контроля и 2 отрицательных контроля. К набору реактивов прилагается инструкция по применению.
Критерии достоверности результатов
Результаты анализа образцов принимают, если коэффициент корреляции калибровочной кривой, построенной по сертифицированным стандартным образцам, по методу наименьших квадратов (R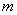 )>0,97.
)>0,97.
Метрологические характеристики метода
Границы интервала, в котором погрешность определения находится с доверительной вероятностью 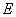 =0,95, составляют от 0,1 до 5%. Нижнюю и верхнюю границы погрешности определяют доступными сертифицированными контрольными образцами, а стандартные отклонения повторяемости результатов (
=0,95, составляют от 0,1 до 5%. Нижнюю и верхнюю границы погрешности определяют доступными сертифицированными контрольными образцами, а стандартные отклонения повторяемости результатов (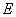 ) составляют от 0,067 (для стандарта 0,1%) до 0,540 (для стандарта 5%), что соответствует погрешности сертифицированных контрольных образцов.
) составляют от 0,067 (для стандарта 0,1%) до 0,540 (для стандарта 5%), что соответствует погрешности сертифицированных контрольных образцов.
5.2. На примере метода, разработанного с использованием набора "Ампликвант ГМ соя".
Выделение ДНК
Рекомендуется метод выделения ДНК с помощью набора реагентов "ДНК-сорб-С", рассчитанный на выделение ДНК из 50 проб.
- Буфер для лизирующего реагента и раствор для отмывки 1 (если они хранились при 2-8 °С) прогревают при 64 °С до полного растворения кристаллов.
- Отбирают необходимое количество одноразовых пробирок, включая отрицательный контроль выделения ДНК. В пробирки, предназначенные для исследуемых проб, вносят образцы проб (см. раздел "Подготовка проб к анализу"). В пробирку отрицательного контроля выделения ДНК (ОК) вносят 100 мм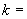 отрицательного контрольного образца (ОКО).
отрицательного контрольного образца (ОКО).
- Отдельными наконечниками с аэрозольным барьером вносят в каждую пробирку по 400 мм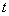 буфера для лизирующего реагента и по 17 мм
буфера для лизирующего реагента и по 17 мм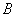 лизирующего реагента. Тщательно перемешивают содержимое пробирок.
лизирующего реагента. Тщательно перемешивают содержимое пробирок.
- Инкубируют пробирки при 64 °С в течение 1 ч, периодически встряхивая на аппарате для встряхивания типа "Вортекс" (5 раз через каждые 10-12 мин).
- Осаждают нерастворенные частицы образцов центрифугированием при 12000-14000 об./мин в течение 5 мин.
- Надосадочную жидкость в объеме 200-350 мм очень аккуратно (так, чтобы не попали взвешенные частицы и капли жира) отбирают отдельными наконечниками с аэрозольными барьерами и переносят в новые пробирки.
очень аккуратно (так, чтобы не попали взвешенные частицы и капли жира) отбирают отдельными наконечниками с аэрозольными барьерами и переносят в новые пробирки.
- Пробы центрифугируют в течение 5 с при 5000 об./мин на микроцентрифуге для сброса капель с крышки пробирок.
- Тщательно ресуспендируют сорбент на аппарате для встряхивания типа "Вортекс". В каждую пробирку отдельным наконечником добавляют по 25 мм ресуспендированного сорбента. Перемешивают на аппарате для встряхивания типа "Вортекс", оставляют в штативе на 10-15 мин, перемешивая через каждые 2 мин.
ресуспендированного сорбента. Перемешивают на аппарате для встряхивания типа "Вортекс", оставляют в штативе на 10-15 мин, перемешивая через каждые 2 мин.
- Осаждают сорбент в пробирках центрифугированием при 5000 об./мин в течение 1 мин. Удаляют супернатант, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
- Добавляют в пробы по 300 мм раствора для отмывки 1, перемешивают на аппарате для встряхивания типа "Вортекс" до полного ресуспендирования сорбента. Осаждают сорбент центрифугированием при 5000 об./мин на микроцентрифуге в течение 1 мин. Удаляют супернатант, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
раствора для отмывки 1, перемешивают на аппарате для встряхивания типа "Вортекс" до полного ресуспендирования сорбента. Осаждают сорбент центрифугированием при 5000 об./мин на микроцентрифуге в течение 1 мин. Удаляют супернатант, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
- Добавляют в пробы по 500 мм раствора для отмывки 2, перемешивают на аппарате для встряхивания типа "Вортекс" до полного ресуспендирования сорбента, центрифугируют 1 мин при 10000-12000 об./мин на микроцентрифуге. Отбирают супернатант, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
раствора для отмывки 2, перемешивают на аппарате для встряхивания типа "Вортекс" до полного ресуспендирования сорбента, центрифугируют 1 мин при 10000-12000 об./мин на микроцентрифуге. Отбирают супернатант, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
- Повторяют процедуру отмывки раствором 2, отбирают супернатант полностью.
- Помещают пробирки в термостат 64 °С на 5-10 мин для подсушивания сорбента. При этом крышки пробирок должны быть открыты.
- В пробирки добавляют по 50 мм ТЕ-буфера для элюции ДНК. Перемешивают на аппарате для встряхивания типа "Вортекс". Помещают в термостат 64 °С на 5-8 мин, периодически (1 раз в мин) встряхивая на аппарате для встряхивания типа "Вортекс".
ТЕ-буфера для элюции ДНК. Перемешивают на аппарате для встряхивания типа "Вортекс". Помещают в термостат 64 °С на 5-8 мин, периодически (1 раз в мин) встряхивая на аппарате для встряхивания типа "Вортекс".
- Центрифугируют пробирки при 12000-14000 об./мин в течение 1 мин на микроцентрифуге. Супернатант содержит очищенную ДНК. Пробы готовы к постановке ПЦР.
Очищенную ДНК можно хранить в течение 1 недели при температуре от 2 до 8 °С и в течение 1 года - при температуре минус 20 °С.
Проведение реакции амплификации
Амплификацию проводят с использованием набора "Ампликвант ГМ соя".
Набор реагентов предназначен для определения присутствия в образцах генетически модифицированной сои. В анализе используют полимеразную цепную реакцию (ПЦР), позволяющую амплифицировать эндогенную контрольную мишень, которая является уникальной для сои, а также мишень, указывающую на присутствие генетически модифицированной сои (35S промотор вируса мозаики цветной капусты).
В наборе реактивов с зондами TaqMan используется 5' - экзонуклеазная активность Taq-полимеразы. Интенсивность флуоресценции измеряют с помощью приборов с детекцией фрагментов ПЦР в режиме реального времени типа Rotor Gene 3000 и ABI-PRISM 7000 и анализируют с помощью программного обеспечения прибора.
С помощью наборов реактивов TaqMan определяют присутствие продуктов ПЦР путем регистрации увеличения флуоресценции двух флуоресцентных красителей (FАМ и JOE). Реакционная система включает две независимые системы ПЦР (находящиеся в каждой реакционной пробирке), каждая из которых содержит свои собственные праймеры и меченый флуоресцентными красителями зонд.
С помощью первой системы ПЦР выявляют последовательность ДНК-мишени, специфичной для ГМИ (промотора 35S вируса мозаики цветной капусты). Вторая представляет собой систему эндогенного контроля (ЭК), с помощью которого определяют генетически модифицированную или не модифицированную сою. Зонд системы ГМИ включает флуоресцентный краситель FАМ. Зонд системы ЭК включает флуоресцентный краситель JOE. Результаты, полученные с помощью красителя FАМ (специфичного к ГМИ), сравнивают с результатами, полученными с помощью соответствующего красителя JOE, и, таким образом, определяют процентное содержание ГМИ в каждом образце.
Праймеры и зонд для определения ЭК включены в состав готовой смеси, которую используют в каждой реакционной пробирке. С их помощью определяют ген, специфичный для сои. Система ЭК является ключевой для количественного анализа, а также позволяет определить присутствие ДНК исследуемого растения (сои) в образце.
Для определения количества ГМИ следует использовать контрольные стандарты ГМИ сои, выпускаемые Институтом контрольных материалов и методов, Бельгия (Institute for Reference Materials and Methods). Экстракты ДНК из стандартов ГМИ должны быть приготовлены тем же методом, что и анализируемые образцы продуктов питания. Контрольные стандарты ГМИ следует анализировать в каждой постановке ПЦР.
Для проведения лабораторных исследований рекомендуется использовать 1 положительный контроль и 2 отрицательных контроля. К набору реактивов прилагается инструкция по применению.
5.3. На примере метода, разработанного Центром "Биоинженерия" РАН, количественно определяется содержание сои линии 40-3-2, кукурузы линий: GA 21, NK 603, MON 863 методом ПЦР с детекцией результатов в режиме реального времени.
Выделение ДНК
Рекомендуется использовать метод выделения ДНК с применением технологии Wizard.
Подготовка пробы (раствора ДНК)
- Навеску исследуемого продукта массой 100 мг помещают в микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 см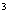 .
.
- Добавляют 300 мм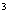 буфера I (50 мМоль Трис НСl, рН 8,0; 10 мМоль ЭДТА; 50 мкг/см
буфера I (50 мМоль Трис НСl, рН 8,0; 10 мМоль ЭДТА; 50 мкг/см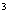 панкреатической РНКазы свободной от ДНКаз, 3 М гуанидин тиоцианата) при комнатной температуре. Растирают пробу в пробирке пестиком до гомогенного состояния.
панкреатической РНКазы свободной от ДНКаз, 3 М гуанидин тиоцианата) при комнатной температуре. Растирают пробу в пробирке пестиком до гомогенного состояния.
- Добавляют 400 мм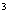 буфера II (2% додецилсульфат натрия, 0,2 М NaOH) перемешивают на аппарате для встряхивания типа "Вортекс".
буфера II (2% додецилсульфат натрия, 0,2 М NaOH) перемешивают на аппарате для встряхивания типа "Вортекс".
- Инкубируют при 65 °С 30 мин, перемешивают на аппарате для встряхивания типа "Вортекс", охлаждают до комнатной температуры.
- Добавляют 400 мм буфера III (5 М ацетат калия, рН 4,5), перемешивают на аппарате для встряхивания типа "Вортекс" в течение 2 мин.
буфера III (5 М ацетат калия, рН 4,5), перемешивают на аппарате для встряхивания типа "Вортекс" в течение 2 мин.
- Центрифугируют 10 мин на настольной микроцентрифуге типа Эппендорф при частоте вращения 13000 об./мин.
- Надосадок отбирают и переносят в чистую пробирку типа Эппендорф вместимостью 1,5 см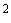 .
.
- Добавляют смолу Wizard MaxiPreps из расчета 100 мм смолы на 200 мм
смолы на 200 мм надосадочной жидкости.
надосадочной жидкости.
- Перемешивают на аппарате для встряхивания типа "Вортекс".
- При помощи стерильного шприца емкостью 2 см прокачивают смесь через микроцентрифужную колонку.
прокачивают смесь через микроцентрифужную колонку.
- Новым стерильным шприцом емкостью 2 см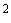 прокачивают через микроцентрифужную колонку 2 см
прокачивают через микроцентрифужную колонку 2 см промывочного буфера (0,2 М NaCl, 20 мМ Трис НСl, рН 8,0, 5 мМ ЭДТА смешивают в соотношении 5:7 с 96% этанолом).
промывочного буфера (0,2 М NaCl, 20 мМ Трис НСl, рН 8,0, 5 мМ ЭДТА смешивают в соотношении 5:7 с 96% этанолом).
- Помещают микроколонку в микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 см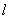 .
.
- Центрифугируют 1 мин при частоте вращения 13000 об./мин.
- Помещают микроколонку в чистую микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 см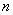 .
.
- Добавляют в колонку 100 мкл деионизованной воды, нагретой до 65 °С.
- Центрифугируют 15 с при частоте вращения 13000 об./мин.
- Полученный раствор ДНК готов для проведения ПЦР, хранить при минус 20 °С.
Проведение реакции амплификации
Наборы предназначены для количественного определения в пищевых продуктах следующих генетически модифицированных линий (трансформационных событий) кукурузы: GA 21, устойчивой к глифосату, NK 603, устойчивой к глифосату, MON 810, устойчивой к стеблевому мотыльку, и сои линии 40-3-2, устойчивой к глифосату, производства фирмы Монсанто. Набор предназначен для проведения 300 анализов.
Наборы реактивов оптимизированы для работы на амплификаторах типа ABI Prism 7000/7700. Для работы с другими моделями амплификаторов требуется дополнительная оптимизация.
В состав каждого набора входят:
- 2 пробирки матричной реакционной смеси, общий объем смеси - 2775 мм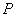 ;
;
- 1 пробирка с термостабильной полимеразой, объем - 225 мм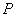 ;
;
- 8 пробирок со стандартными разведениями рекомбинантной ДНК, содержание - 0%, 0,5%, 1%, 2%, 5%, 10%, 50%, 100%. Объем ДНК в каждой пробирке - 200 мм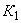 , концентрация - 10 нг/мм
, концентрация - 10 нг/мм . Достаточно для проведения 25 стандартных реакций (получение стандартных кривых титрования).
. Достаточно для проведения 25 стандартных реакций (получение стандартных кривых титрования).
Приготовление реакционной смеси
Реакционная смесь на одну пробу:
- 9,25 мм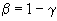 матричной реакционной смеси;
матричной реакционной смеси;
- 0,75 мм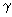 термостабильной полимеразы;
термостабильной полимеразы;
- 32,0 мм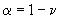 деионизованной воды.
деионизованной воды.
Реакционную смесь разливают в пробирки по 42 мм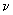 на пробу.
на пробу.
Далее в отдельном помещении, в вытяжном шкафу или ламинарном боксе, добавляют по 8 мм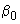 раствора ДНК в следующем порядке - контроль без ДНК, ДНК 0%, ГМИ 0,5%, ГМИ 100%, исследуемые образцы. Конечный объем каждой пробы - 50 мм
раствора ДНК в следующем порядке - контроль без ДНК, ДНК 0%, ГМИ 0,5%, ГМИ 100%, исследуемые образцы. Конечный объем каждой пробы - 50 мм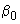 .
.
Центрифугируют для осаждения реакционной смеси (удаление пузырьков воздуха проводят только при закрытых крышках стрипов или при заклеенном планшете, пузырьки воздуха должны быть обязательно удалены из реакционной смеси).
Условия амплификации
Рекомендуемый протокол для всех наборов реактивов:
94 °С - 9 мин - 1 цикл
(94 °С - 30 с)+(62 °С - 30 с)+(72 °С - 1 мин) - 40 циклов
В окне Well Inspector необходимо установить следующие параметры:
Reporter - Sybr, Quencher - none, Task - Standart, Passive - Joe
К набору реактивов прилагается инструкция по применению.
5.4. На примере метода, разработанного с использованием наборов реагентов GeneScan Analytics GmbH.
5.4.1. Метод выделения ДНК с помощью СТАБ (гексадецилтриметиламмониумбромид), см. п.5.1.1.
5.4.2. Метод выделения ДНК с помощью набора реагентов "GENESpin".
Набор предназначен для выделения геномной ДНК из пищевых продуктов преимущественно растительного или животного происхождения. Для работы с набором используется до 200 мг исследуемого образца, выход составляет 0,1-10 мкг ДНК, которая может быть использована в ПЦР и ПЦР в реальном времени.
Принцип метода: после гомогенизации исследуемого образца, ДНК экстрагируют с использованием лизирующих буферов, содержащих денатурирующие агенты и детергенты. Лизат подлежит очистке центрифугированием или фильтрованием. К супернатанту добавляется связывающий буфер и этанол для создания оптимальных условий осаждения ДНК на фильтре со специально подобранным силикагелем. После промывки буферами для удаления потенциальных ингибиторов ДНК-полимеразы, ДНК элюируют водой или буфером с низкой ионной силой, после чего она готова для использования в реакции. Набор реагентов содержит инструкцию по применению и протокол выделения.
Проведение реакции амплификации
Амплификация проводится с использованием наборов реагентов для анализа:
- сои линии 40-3-2, устойчивой к глифосату, фирмы Монсанто, США (GMOQuant Roundup Ready Soy);
Soy);
- кукурузы линии Bt-176, устойчивой к стеблевому мотыльку, фирмы Сингента Сидс, США (GMOQuant Maximizer Bt 176 corn);
Bt 176 corn);
- кукурузы линии Bt-11, устойчивой к стеблевому мотыльку фирмы Сингента Сидс, США (GMOQuant Bt-11 Corn);
- кукурузы линии MON 810, устойчивой к стеблевому мотыльку, фирмы Монсанто, США (GMOQuant YieldCard MON 810);
MON 810);
- кукурузы линии Т-25, устойчивой к глюфосинату аммония, фирмы Байер Кроп Сайенс, Германия (GMOQuant LibertyLink T25 Corn);
T25 Corn);
- кукурузы линии GA 21, устойчивой к глифосату, фирмы Монсанто, США (GMOQuant Roundup Ready GA 21 Corn).
GA 21 Corn).
При проведении анализа используют реакционную смесь N 1, позволяющую амплифицировать эндогенную ДНК-мишень, характерную для кукурузы или сои или реакционную смесь N 2, позволяющую амплифицировать целевую мишень, указывающую на присутствие рекомбинантной ДНК. Каждая реакционная смесь содержит соответствующие праймеры и зонд, меченый флуоресцентным красителем FАМ и экзогенную внутреннюю контрольную систему для возможности отделения истинно негативного результата от результата, полученного при ингибировании ПЦР. Внутренняя контрольная система содержит зонд, меченый флуоресцентным красителем VIC. Наборы реактивов оптимизированы для работы на амплификаторах типа ABI Prism 7000/7700 и iQiCycler. Для работы с другими моделями амплификаторов требуется дополнительная оптимизация.
Наборы реагентов содержат контрольные стандартные образцы, необходимые для построения калибровочной кривой. Каждый набор рассчитан на анализ 96 проб при качественном определении и 72 проб при количественном определении.
Для определения ГМИ пищевой продукции допускается использование тест-систем с техническими характеристиками, аналогичными указанным выше и разрешенными к использованию для этих целей в установленном порядке.
6. Источники появления ложных положительных сигналов
при проведении ПЦР-диагностики и их предотвращение
Наиболее мощные источники загрязнений (в порядке вклада):
- загрязнение продуктами предыдущих реакций;
- положительный контроль (клонированная ДНК или сырье);
- перекрестное загрязнение образцов;
- загрязнение из других источников при взятии образцов (возможно даже загрязнение от перчаток);
Стадии анализа |
Источники загрязнений | |
Окружающая среда |
Сбор образцов |
Посуда, шпатели, перчатки |
Транспортировка образцов |
Техника, резервуары | |
Лаборатория |
Приготовление образцов |
Ошибки персонала, загрязнение положительным контролем (материалом) |
Выделение ДНК |
Загрязнения продуктами предыдущих ПЦР | |
Постановка ПЦР |
Положительные контроли, реактивы | |
Анализ продуктов ПЦР |
Ошибки персонала | |
Следует отметить, что хотя большинство причин ложных положительных сигналов (ЛПС) являются следствием внутрилабораторных загрязнений, не стоит сбрасывать со счетов и загрязнения, происходящие вне лаборатории - во время сбора образцов, их первичной обработки (фасовка, упаковка, транспортировка), поскольку именно на этой стадии наиболее сложно обеспечить стерильные условия работы.
Для повышения точности анализа необходимо постоянно использовать в работе отрицательные контроли, исследования должны выполняться не менее чем в двух повторностях (исследовать от одного образца продукта сразу две пробы). В случае получения постоянных положительных сигналов на отрицательных контролях все исходные реактивы подлежат немедленной замене.
Предотвращение появления ложно положительных сигналов (ЛПС)
Этапы приема, регистрации проб и выделения ДНК, приготовления реакционных смесей и амплификации должны размещаться в разных помещениях. Выделение ДНК и приготовление реакционных смесей следует проводить в ПЦР-боксах.
Правила работы для персонала
На каждом этапе ПЦР-исследования необходимо использовать индивидуальный набор соответствующего лабораторного оборудования, расходных материалов и одежды.
Одноразовые перчатки подлежат смене при каждой новой операции. Работа без перчаток не допускается.
Не допускается перемещать личные вещи, лабораторные журналы, лабораторную одежду и канцелярские принадлежности между зонами лаборатории.
Работа с оборудованием
Лабораторное оборудование и рабочие поверхности следует ежедневно облучать ультрафиолетовым излучением не менее чем в течение 1 ч.
Сменные наконечники для микродозаторов и полипропиленовые пробирки разрешается использовать только из заводской упаковки. Автоклавирование одноразового пластика не производится.
Для того, чтобы избежать аэрозольного загрязнения микродозаторов, использовать только наконечники с антиаэрозольными барьерными вставками.
Работа с реактивами
Серийные аликвоты реагентов должны быть пронумерованы и занесены в специальный журнал с указанием номера партии реактивов, из которой произведено аликвотирование, даты приготовления аликвот и лица, производившего разлив реагентов.
Перед работой с ДНК или перед переносом приготовленных к проведению реакции ПЦР смесей все исходные реагенты должны быть убраны в морозильную камеру, предназначенную для рабочих реактивов. Не допускается возвращать частично использованные реактивы в холодильник для хранения аликвот, равно как и в холодильник для хранения исходных растворов в промышленных упаковках.
7. Организация рабочих мест
Исследования по идентификации ГМИ растительного происхождения могут проводиться и на базе лабораторий, проводящих исследования методом ПЦР с патогенными биологическими агентами. В таком случае должно быть предусмотрено разграничение проведения исследований во времени. При организации исследований по идентификации ГМИ необходимо предусмотреть наличие вспомогательных помещений (комнаты ведения учетных документов; раздевалки для сотрудников; комнаты приема пищи; туалета; подсобных помещений), которые могут быть общими с другими подразделениями учреждения.
Сотрудников лаборатории обеспечивают спецодеждой: медицинским халатом, шапочкой, перчатками и сменной обувью.
Пробирки с продуктами ПЦР и использованные наконечники к микродозаторам подвергают первичной обработке растворами, вызывающими деградацию ДНК.
По окончании работ обрабатывают рабочие поверхности растворами, вызывающими деградацию ДНК (например, 0,2% раствор ДП-2Т или аналогичные ему, разрешенные к применению для этих целей в установленном порядке). Перед началом работы рабочую поверхность столов дополнительно обрабатывают 70%-ным этиловым спиртом. Ежемесячно проводят профилактическую обработку рабочей поверхности столов и штативов 1 N соляной кислотой.
Во всех помещениях лаборатории ежедневно проводят влажную уборку. Для каждого этапа проведения исследований выделяют индивидуальный промаркированный набор уборочного инвентаря. Уборочный инвентарь не допускается использовать для уборки других помещений.
8. Количественное определение сои линии 40-3-2
с использованием иммуноферментного анализа
Для количественного определения белка, устойчивого к действию глифосата [CP4EPSPS] сои линии 40-3-2, используется иммуноферментный иммуносорбентный метод (ELISA) с моноклональными антителами против белка [CP4EPSPS], иммобилизированными в планшетах ELISA, и с поликлональными антителами, конъюгированными с пероксидазой хрена в качестве системы определения. В качестве субстрата для пероксидазы хрена используется тетраметилбензидин (ТМВ).
Материалы и оборудование
Набор реагентов GMO Soya RUR Test Kit для определения пороговых уровней генетически модифицированных источников в обработанных продуктах питания.
Набор реагентов предназначен для количественного определения белка, устойчивого к действию глифосата [CP4EPSPS], который экспрессируется в соевых бобах генетически модифицированного сорта Roundup Ready .
.
Состав набора.
1. Экстракционный буфер 500 см .
.
2. Стрипованный планшет - 8 стрипов по 12 лунок в рамке 1
3. Конъюгат 1 15 см
4. Конъюгат 2 15 см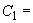
5. Цветной субстрат 20 см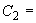
6. Стоп раствор 20 см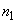
7. 10х буфер для промывки 100 см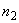
9. Пленка для планшетов 3
Дополнительные обязательные материалы
- Стандартные образцы изолята соевого белка, содержащие 0%, 0,3%, 1,25% и 2,5% массовых фракций сои Roundup Ready .
.
- Стандартные образцы муки соевой, содержащие 0%, 0,3%, 1,25% и 2,5% массовых фракций сои Roundup Ready .
.
- Микродозаторы с переменным объемом дозирования 100-1000 мм .
.
- Многоканальный микродозатор 50-300 мм .
.
- Кюветы для отбора реагентов многоканальной микропипеткой.
- Емкость для промывки вместимостью 500 см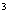 при ручной промывке планшета.
при ручной промывке планшета.
- Полипропиленовые конические пробирки с завинчивающейся пробкой, вместимостью 15 см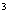 .
.
- Подложки для взвешивания проб одноразовые.
- Шпатели одноразовые.
- Лабораторная пленка типа "Парафильм".
- Штатив для пробирок на 15 мм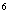 .
.
Оборудование
- Многоканальный спектрофотометр для микропланшетов с фильтром на 450 нм.
- Автоматическое промывочное устройство.
- Аппарат для встряхивания типа "Вортекс".
- Весы лабораторные общего назначения 2-го класса точности
Подготовка реагентов
Перед использованием все реагенты доводят до комнатной температуры.
Подготовка стрипов
Извлекают стрипы и рамку из фольги. Если образцов меньше чем общее количество лунок в стрипах, сразу же помещают не использованные стрипы обратно в упаковку и запечатывают ее. Прикрепляют лабораторной пленкой стрипы к рамке во избежание случайного падения на стадии промывки. Заполняют пустые места в рамке использованными стрипами.
Анализ каждой пробы и стандартного образца выполняют в двух повторностях.
Калибровочную кривую строят для каждого анализа.
Подготовка рабочего раствора буфера для промывки
В емкость для промывки вносят 50 см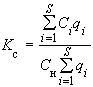 10х буфера для промывки, добавляют 450 см
10х буфера для промывки, добавляют 450 см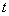 деионизированной или бидистиллированной воды.
деионизированной или бидистиллированной воды.
При автоматической промывке планшета подключают емкость с рабочим раствором промывочного буфера к промывочному устройству.
Подготовка образца к количественному анализу
Готовят навески анализируемых и стандартных образцов. Рекомендуется использовать одноразовые шпатели.
Величины навесок стандартных и анализируемых образцов и объемы экстракционного буфера приведены в таблице.
Образец |
Навеска, г |
Объем экстракционного буфера, см |
Время перемешивания на вортексе, мин |
Мука соевая |
1,0 |
14 |
1 |
Изолят соевого белка |
0,1 |
7 |
3 |
Концентрат соевого белка (осажденный кислотой) |
0,1 |
10 |
3 |
Концентрат соевого белка (промытый спиртом) |
1,0 |
6 |
3 |
Вносят в пробирки с навесками анализируемых и стандартных образцов указанное количество экстракционного буфера, перемешивают на аппарате для встряхивания типа "Вортекс" минимум 1 мин (3 мин для изолятов и концентратов).
Дают суспензии осесть в течение 5 мин, отбирают экстракты в том порядке, в каком экстрагировали.
Примечание. Анализируют экстракты сразу же после их приготовления.
Процедура анализа
В подготовленные стрипы вносят по 100 мм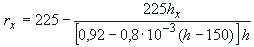 каждого экстракта в двух повторностях.
каждого экстракта в двух повторностях.
Лунки накрывают прилагаемой пленкой во избежание загрязнения и испарения.
Инкубируют пробы при комнатной температуре в течение 1 ч.
Промывка
Промывают 4 раза буфером для промывки (300 мм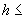 на лунку), используя автоматическое промывочное устройство.
на лунку), используя автоматическое промывочное устройство.
Примечание. Не допускайте высыхания лунок. Это может сказаться на результатах.
Добавление коньюгата 1.
Вносят в каждую лунку по 100 мм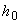 коньюгата 1. Накрывают лунки прилагаемой пленкой во избежание испарения.
коньюгата 1. Накрывают лунки прилагаемой пленкой во избежание испарения.
Инкубация с коньюгатом 1.
Инкубируют стрипы при комнатной температуре в течение 30 мин.
Промывка
Промывают 4 раза буфером для промывки (300 мм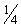 на лунку), используя автоматическое промывочное устройство.
на лунку), используя автоматическое промывочное устройство.
Добавление коньюгата 2.
Вносят в каждую лунку по 100 мм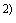 конъюгата 2. Накрывают лунки прилагаемой пленкой во избежание испарения.
конъюгата 2. Накрывают лунки прилагаемой пленкой во избежание испарения.
Инкубация с конъюгатом 2.
Инкубируют стрипы при комнатной температуре в течение 30 мин.
Промывка
Промывают 4 раза буфером для промывки (300 мм на лунку), используя автоматическое промывочное устройство.
на лунку), используя автоматическое промывочное устройство.
Цветная реакция
Вносят в каждую лунку по 100 мм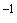 цветного субстрата.
цветного субстрата.
Инкубируют при комнатной температуре в течение 30 мин.
По окончании инкубации останавливают реакцию внесением 100 мм стоп-раствора в каждую лунку в той же последовательности, в которой добавляли цветной субстрат.
стоп-раствора в каждую лунку в той же последовательности, в которой добавляли цветной субстрат.
Определяют оптическую плотность в каждой лунке при длине волны 450 нм, используя многоканальный спектрофотометр для микропланшетов с фильтром на 450 нм.
Исходные данные сохраняются.
Критерии отбора результатов
Результаты анализа последовательности образцов принимают, если:
а) Среднее значение в повторностях негативного стандартного образца (0%) при длине волны 450 нм 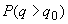 0,15 ед. ОП (оптической плотности).
0,15 ед. ОП (оптической плотности).
б) Среднее значение в повторностях стандартного образца (2,5%) на длине волны 450 нм 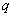 0,8 ед. ОП (оптической плотности).
0,8 ед. ОП (оптической плотности).
в) Коэффициент вариации (% CV) в повторностях стандартных образцов 0,3%, 1,25% и 2,5% 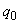 5%.
5%.
г) Коэффициент корреляции калибровочной прямой по методу наименьших квадратов (R 2)>0,96.
д) Допустимым принимают коэффициент вариации (% CV) в повторностях исследуемого образца меньше 15%. Этот критерий применим только тогда, когда среднее значение поглощения в повторностях образца 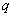 0,20.
0,20.
Интерпретация результатов
Количественный анализ.
Рассчитывают среднее значение поглощения в повторностях стандартных и исследуемых образцов.
Строят калибровочную кривую зависимости оптической плотности стандартных образцов от процентного содержания белка сои Roundup Ready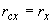 .
.
Выполняют анализ регрессии, учитывая негативный стандартный образец 0%.
Определяют по калибровочной кривой процентное содержание белка сои Roundup Ready в исследуемом образце.
в исследуемом образце.
При наличии многоканального спектрофотометра для микропланшетов с соответствующим программным обеспечением результаты получают на дисплее прибора.
Предупреждения и ограничения
- Хранят все компоненты набора в холодильнике (2-8 °С). В день анализа допускается хранение при температуре окружающей среды.
- Не допускается замораживание реагентов или инкубация при температуре выше 37 °С.
- Перед использованием все реагенты необходимо доводить до комнатной температуры (18-27 °С) (занимает 1 час).
- Не оставляйте цветной субстрат на прямом солнечном свету.
- Не смешивайте реагенты разных партий.
- Не допускайте разведения реагентов.
Допускается использование оборудования, наборов реактивов, тест-систем с аналогичными характеристиками и разрешенными к применению для этих целей в установленном порядке.
9. Библиографические данные
1. Федеральный закон "О санитарно-эпидемиологическом благополучии населения" N 52-ФЗ от 30 марта 1999 г.
2. Федеральный закон от 9 января 1996 г. "О внесении изменений и дополнений в Закон Российской Федерации "О защите прав потребителей" и Кодекс РСФСР об административных правонарушениях" N 2-ФЗ (ред. от 30.12.01).
3. Федеральный закон от 2 января 2000 г. N 29-ФЗ "О качестве и безопасности пищевых продуктов".
4. Федеральный закон от 5 июня 1996 г. N 86-ФЗ "О государственном регулировании в области генно-инженерной деятельности" (ред. от 12.07.00).
5. Федеральный закон от 21 июня 2000 г. N 96-ФЗ "О внесении изменений и дополнений в Федеральный закон о государственном регулировании в области генно-инженерной деятельности".
6. "Основы законодательства Российской Федерации об охране здоровья граждан" от 22 июля 1993 г. N 5487-1 (ред. от 30.06.03).
7. постановлением Правительства Российской Федерации от 24 июля 2000 г. N 554.
8. Постановление Главного государственного санитарного врача Российской Федерации от 8 ноября 2000 г. N 14 "О порядке проведения санитарно-эпидемиологической экспертизы пищевой продукции, полученной из генетически модифицированных источников".
9. СанПиН 2.3.2.1078-01 "Гигиенические требования к безопасности и пищевой ценности пищевых продуктов".
10. Приказ МЗ РФ от 15 августа 2001 г. "О санитарно-эпидемиологической экспертизе продукции" (зарегистрирован в МЮ РФ 19.10.01 N 2978). N 325 (ред. от 18.03.02).
11. Lipp M., Brodman P., Pietsch et al IUPAC Collaborative Trial Study of a Method to detect Genetically Modified Soy Beans and Maize in Dried Powder //J. of AOAC International 1999. V.82. N.4. P.923-929.
12. M.Lipp. E.Anklam Validation of an Immunoassay for Detection and Quantitation of Genetically Modified Soybean in Food and Food Fractions Using Reference Materials: Interlaboratery Study //J. of AOAC International, 200, V.83. N 4, pp.919-927).
13. Yap E.P.H., Lo Y.-M.O., K. A. Fleming K.A., McGee J.O'D. False-positives and Contamination in PCR. In: PCR Technology, Current Innovations. Ed. G.Griffin, A.M.Griffin, CRC Press, 1994).
Приложение 1
Схема идентификации ГМИ в пищевых продуктах
Приложение 2
Генетически модифицированные культуры, разрешенные для реализации
населению и использования в пищевой промышленности
на территории Российской Федерации
Культура |
Фирма |
N санитарно-эпидемиологического заключения |
Дата |
СОЯ, линия 40-3-2, устойчивая к глифосату |
"Монсанто Ко", США |
77.99.02.916.Г.000006.08.02 |
28.08.02 |
КАРТОФЕЛЬ, сорт Рассет Бурбанк Ньюлив, устойчивый к колорадскому жуку |
"Монсанто Ко", США |
77.99.02.916.Г.000019.05.03 |
30.05.03 |
КАРТОФЕЛЬ, сорт Супериор Ньюлив, устойчивый к колорадскому жуку |
"Монсанто Ко", США |
77.99.02.916.Г.000020.05.03 |
30.05.03 |
КУКУРУЗА, линия GA21, устойчивая к глифосату |
"Монсанто Ко", США |
77.99.8.971.Г.84.12.00 |
14.12.00 |
КУКУРУЗА, линия MON 810, устойчивая к стеблевому мотыльку |
"Монсанто Ко", США |
77.99.8.971.Г.85.12.00 |
14.12.00 |
САХАРНАЯ СВЕКЛА, линия 77, устойчивая к глифосату |
"Монсанто Ко", США, "Сингента Сидс С. А.", Франция |
77.99.11.911.Д.006696.11.01 |
16.11.01 |
КУКУРУЗА, линия Т-25, устойчивая к глюфосинату аммония |
"Байер Кроп-Сайнс", ФРГ |
77.99.04.916.Д.007484.12.01 |
24.12.01 |
КУКУРУЗА, линия NK-603, устойчивая к глифосату |
"Монсанто Ко", США |
77.99.04.916.Г.000003.07.02 |
17.07.02 |
СОЯ, линия А 2704-12, устойчивая к глюфосинату аммония |
"Байер Кроп-Сайнс", ФРГ |
77.99.04.972.Г.000004.07.02 |
19.07.02 |
СОЯ, линия А 5547-127, устойчивая к глюфосинату аммония |
"Байер Кроп-Сайнс", ФРГ |
77.99.04.972.Г.000005.07.02 |
19.07.02 |
КУКУРУЗА, линия MON 863, устойчивая к стеблевому мотыльку |
"Монсанто Ко", США |
77.99.02.916.Г.000010.04.03 |
07.04.03 |
КУКУРУЗА, линия Bt 11, устойчивая к стеблевому мотыльку и глюфосинату аммония |
"Сингента Сидс С.А.", Франция |
77.99.02.916.Г.000026.09.03 |
15.09.03 |
РИС, линия LL62, устойчивая к глюфосинату аммония |
"Байер Кроп-Сайнс", ФРГ |
77.99.02.916.Г.000030.11.03 |
19.11.03 |
Текст документа сверен по:
официальное издание
М.: Федеральный центр
госсанэпиднадзора Минздрава России, 2004

 с шагом 0,01 мм
с шагом 0,01 мм с шагом 0,01 мм
с шагом 0,01 мм , 1,5 см
, 1,5 см


 ; 10 см
; 10 см и другие
и другие и другие
и другие
 «Это вообще жесть, это нереально и невозможно». Блогер из...
«Это вообще жесть, это нереально и невозможно». Блогер из...  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов