- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
МУ 3.3.2.1758-03
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
3.3.2. МЕДИЦИНСКИЕ ИММУНОБИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ
Методы определения показателей качества иммунобиологических препаратов
для профилактики и диагностики гриппа
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: Государственным научно-исследовательским институтом стандартизации и контроля медицинских биологических препаратов им. Л.А.Тарасевича (Т.А.Бектимиров, Н.И.Лонская, Л.В.Агафонова, Н.Кастрикина, Н.А.Озерецковский, Н.В.Медуницын, А.А.Мовсесянц); Департаментом госсанэпиднадзора Минздрава России (Г.Ф.Лазикова).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Министерстве здравоохранения Российской Федерации (протокол N 19 от 19 сентября 2003 г.).
3. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 28.09.03.
4. ВВЕДЕНЫ ВЗАМЕН "Методических указаний по проведению контроля противогриппозных препаратов" от 16.11.84, утв. начальником Главного управления карантинных инфекций МЗ СССР В.П.Сергиевым.
1. Область применения
Настоящие методические указания устанавливают методы определения показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа с целью установления их эффективности и безопасности.
Методические указания предназначены для специалистов органов и учреждений государственной санитарно-эпидемиологической службы и организаций, осуществляющих определение показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа.
2. Общие положения
Целью введения настоящих методических указаний является регламентация методов определения показателей качества противогриппозных препаратов на их соответствие требованиям нормативных документов.
Методические указания содержат описание общих методов определения показателей качества противогриппозных препаратов. Особенности методов оценки качества противогриппозных препаратов, не охватываемые настоящим документом, описаны в документах на эти препараты.
Задачей проведения контроля является установление эффективности и безопасности противогриппозных препаратов.
3.1. Метод постановки реакции торможения гемагглютинации (РТГА)
с вирусом гриппа (макрометод)
Реакцию торможения гемагглютинации применяют для установления типа и подтипа вируса, т.е. специфичности, а также для определения нарастания титров специфических антител.
Постановка РТГА включает следующие этапы работы: приготовление взвеси эритроцитов, определение гемагглютинирующего титра антигена в РГА и рабочей дозы вируса, постановка самой реакции.
Для постановки реакции необходимы следующие ингредиенты:
- антиген (вакцина, вируссодержащая жидкость - аллантоисная или культуральная);
- иммунные сыворотки к различным вирусам гриппа;
- буферно-солевой раствор рН 7,2±0,2 (Na-фосфатный буфер 0,01 M c 0,16 M NaCl);
- взвесь куриных эритроцитов, 1%.
3.1.1. Приготовление взвеси куриных эритроцитов
Для постановки РТГА используют эритроциты петухов. Кровь у петухов берут из сердца или подкрыльцовой вены.
Свежеполученную от 3-5 петухов кровь помещают во флакон со стеклянными бусами или же с одним из антикоагулянтов (раствор Альсевера, 5%-ный раствор лимонно-кислого натрия). Дефибринирование крови проводят немедленно путем интенсивного встряхивания флакона в течение 5-7 мин при температуре (20±2) °С до выпадения волокон фибрина.
Дефибринированную кровь фильтруют через 4 слоя марли, затем трехкратно отмывают буферно-солевым раствором (на 1 объем крови - 4 объема буферно-солевого р-ра) путем центрифугирования при (800±200) об./мин в течение (15±5) мин. Надосадочную жидкость удаляют. Из осадка, принимаемого за 100%, готовят 1%-ную суспензию куриных эритроцитов с помощью фотоколориметрирования на ФЭК-56.
3.1.2. Приготовление 1%-ной суспензии куриных эритроцитов с помощью фотоколориметрирования
Для получения стандартных концентраций эритроцитарных суспензий рекомендуется использовать фотометрический метод, позволяющий определять их концентрацию по величине оптической плотности. Основанием для этого служит наличие линейной зависимости между оптической плотностью и концентрацией эритроцитов в определенном интервале концентраций - от 0,15 до 1,00%.
Величину оптической плотности для 1%-ной суспензии куриных эритроцитов определяют экспериментально, в ряду нескольких (~20) параллельных проб с последующим вычислением среднеарифметической величины, принимаемой за исходный показатель оптической плотности.
3.1.3. Определение показателя оптической плотности 1%-ной суспензии куриных эритроцитов
Для приготовления одной пробы отбирают градуированной пипеткой 0,2 мл осадка эритроцитов в емкость, содержащую 19,8 мл буферно-солевого раствора; содержимое тщательно перемешивают, заполняют им объем прямоугольной кюветы фотоколориметра (толщина слоя =1 мм) и немедленно измеряют оптическую плотность суспензии при длине волны 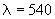 нм.
нм.
В качестве контрольного раствора используют дистиллированную воду, предварительно заполняя ею объем второй такой же кюветы ФЭК.
3.1.4. Приготовление 1%-ной суспензии куриных эритроцитов по показателю оптической плотности
Готовят требуемое количество суспензии куриных эритроцитов несколько большей, чем 1%-ной концентрации. Добавлением буферно-солевого раствора рН 7,2±0,2 к полученной суспензии и измерением оптической плотности ее на ФЭК доводят концентрацию суспензии до такой, показатель оптической плотности которой равен величине, определенной ранее (п.3.1.2).
Примечание. Поскольку значение оптической плотности суспензии эритроцитов может изменяться в зависимости от качества эритроцитов (на что влияет сезон года, климатические условия, состояние и возраст животных и т.п.), а также зависит от технических характеристик измерительного прибора (ФЭК), величину оптической плотности 1%-ной суспензии куриных эритроцитов следует определять периодически (1 раз в 3-4 месяца) и на одном и том же приборе.
3.1.5. Определение гемагглютинирующего титра антигена
В лунках плексигласовой планшеты готовят двукратные разведения антигена в объеме 0,4 мл на буферно-солевом растворе, начиная с 1:10 до 1:1280. В каждую лунку вносят по 0,4 мл 1%-ной суспензии эритроцитов. Содержимое лунок перемешивают встряхиванием планшеты и оставляют при температуре (20±2) °С на 40-45 мин (до оседания эритроцитов в контроле, см. ниже).
Реакцию оценивают по четырехкрестовой системе. За титр антигена, или одну агглютинирующую единицу (1АЕ), принимают наибольшее разведение антигена, дающее четко выраженную агглютинацию эритроцитов (3 или 4 креста).
Определение титра антигена сопровождается отрицательным контролем на отсутствие спонтанной агглютинации эритроцитов. С этой целью в контрольную лунку той же плексигласовой доски вносят 0,4 мл буферно-солевого раствора и 0,4 мл 1%-ной суспензии эритроцитов. При отсутствии спонтанной агглютинации на дне лунки выпадает гомогенный с ровными краями осадок эритроцитов (отрицательная реакция).
3.1.6. Приготовление рабочей дозы антигена
В РТГА рабочей дозой антигена является то разведение антигена, в 0,2 мл которого содержится 4 агглютинирующие единицы (4 АЕ). Для вычисления ее следует установленную величину титра антигена разделить на 8. Полученная от деления цифра указывает, во сколько раз нужно развести антиген, чтобы в 0,2 мл его содержалось 4 АЕ (рабочая доза).
Перед постановкой основного опыта проверяют точность приготовления рабочей дозы (4 АЕ). Для этого в пять лунок горизонтального ряда плексигласовой доски, начиная со второй, вносят по 0,2 мл буферно-солевого раствора. В 1-ю и 2-ю лунки добавляют по 0,2 мл приготовленной рабочей дозы антигена. После перемешивания переносят 0,2 мл смеси из 2-й лунки в 3-ю, из 3-й - в 4-ю, из 4-й - в 5-ю, из 5-й лунки 0,2 мл удаляют. Затем в каждую лунку добавляют по 0,2 мл буферно-солевого раствора и по 0,4 мл 1%-ной суспензии куриных эритроцитов. В 6-й лунке ставят контроль на отсутствие спонтанной агглютинации эритроцитов (см. выше). После встряхивания смесь оставляют при температуре (20±2) °С на 40-45 мин (до оседания эритроцитов в контроле).
При правильном выборе рабочей дозы полная (++++) агглютинация эритроцитов должна наблюдаться только в первых трех лунках. В 4-й и 5-й лунках агглютинация должна отсутствовать. В случае отклонения от указанного выше разведение антигена должно быть изменено путем добавления соответствующего количества антигена или буферно-солевого раствора для получения необходимой рабочей дозы. При этом необходимо повторно проверить правильность приготовления рабочей дозы.
3.1.7. Постановка реакции торможения гемагглютинации
Сыворотки, используемые в РТГА, могут содержать неспецифические ингибиторы гемагглютинации. Поэтому для их удаления перед постановкой РТГА сыворотки необходимо обработать нейраминидазой холерных вибрионов (см. примеч.).
После удаления неспецифических ингибиторов готовят двукратные разведения сывороток в лунках плексигласовой доски, начиная с 1:10 до 1:640 и выше в объеме 0,2 мл. К каждому разведению сыворотки добавляют по 0,2 мл рабочей дозы антигена (4 АЕ). Смесь встряхивают, оставляют при температуре (20±2) °С на 30 мин, затем в каждую лунку добавляют по 0,4 мл 1%-ной суспензии куриных эритроцитов. Смесь повторно встряхивают, оставляют при температуре (20±2) °С в течение 40-45 мин (до оседания эритроцитов в контроле), после чего производят учет результатов реакции (п.4.1.6).
При наличии специфических антител в сыворотке наступает задержка агглютинации эритроцитов. За титр сыворотки принимают предельное разведение, вызывающее полную задержку гемагглютинации.
Задержка гемагглютинации указывает на соответствие типа антигена и взятой сыворотки; отсутствие задержки гемагглютинации свидетельствует о несоответствии типа взятой сыворотки.
Препарат считают специфичным, если он не реагирует в РТГА с гетерологичной сывороткой.
Примечание. Удаление неспецифических ингибиторов гемагглютинации из иммунных сывороток с помощью нейраминидазы холерных вибрионов.
При наличии инструкции по применению нейраминидазы необходимо следовать требованиям, изложенным в данном документе.
Метод основан на способности нейраминидазы холерных вибрионов, не действуя на специфические антитела, разрушать ингибиторы гемагглютинации к вирусам гриппа А и В в сыворотках крови человека, кур, крыс, кролика.
Содержимое ампулы (1 мл лиофилизированного препарата нейраминидазы холерных вибрионов) растворяют в 1 мл дистиллированной воды, тщательно перемешивают.
Готовят рабочее разведение препарата в буферно-солевом растворе, равное 1:50. В разведенном виде препарат хранят в холодильнике при температуре (4±20*) °С не более 3 суток.
________________
* Соответствует оригиналу. - Примечание .
К 0,1 мл цельной сыворотки добавляют 0,5 мл нейраминидазы в рабочем разведении 1:50.
Смесь ставят на 18 ч в термостат при (36±0,5) °С.
Смесь прогревают при (56±10) °С в водяной бане в течение 1 ч.
К смеси (сыворотка плюс нейраминидаза) добавляют 0,4 мл буферно-солевого раствора, чтобы получить разведение сыворотки 1:10.
Сыворотка, обработанная нейраминидазой, может быть использована для РТГА в течение 2 недель при условии хранения ее при температуре (5±1) °С.
3.1.8. Приготовление растворов
Приготовление буферно-солевого раствора рН 7,2±0,2
(0,01 М Na-фосфатный буфер, содержащий 0,15 M NaCI):
- 26,8 г двузамещенного натрия Na HPO
HPO ·7H
·7H O растворяют в дистиллированной воде и объем в мерной колбе доводят до 1 л (0,1 М Na
O растворяют в дистиллированной воде и объем в мерной колбе доводят до 1 л (0,1 М Na HPO
HPO );
);
- 13,8 г однозамещенного натрия NaH PO
PO ·H
·H O растворяют в дистиллированной воде и объем в мерной колбе доводят до 1 л (0,1 М NaH
O растворяют в дистиллированной воде и объем в мерной колбе доводят до 1 л (0,1 М NaH PO
PO );
);
- к 720 мл 0,1 М раствора Na HPO
HPO добавляют 280 мл 0,1 М раствора NaH
добавляют 280 мл 0,1 М раствора NaH PO
PO ; рН такого раствора должен быть равным 7,2±0,05;
; рН такого раствора должен быть равным 7,2±0,05;
- 100 мл полученного 0,1 М Na-фосфатного буфера разбавляют дистиллированной водой до 1 л и добавляют 8,5 г хлористого натрия (NaCl); рН полученного раствора - 7,2±0,05. Если рН выше или ниже требуемого, добавляют 1 N раствор HCl или 1 N раствор NaOH, соответственно.
Приготовление раствора Альсевера
Состав:
- 2,05% глюкозы;
- 0,42% натрия хлорида;
- 0,8% натрия цитрата;
- 100,0 мл бидистиллированной воды.
Реакцию среды раствора доводят с помощью 5%-ной лимонной кислоты до рН от 6,15 до 5,6 (примерно 10 мл кислоты на 1 л раствора). Стерилизуют фильтрацией или автоклавированием в течение 3 последовательных дней при 100 °С и 0,7 атм. Для консервирования добавляют на 1 мл крови 1,2 мл раствора Альсевера.
В этом виде эритроциты можно хранить при (4±2) °С в течение 1-2 недель. Перед употреблением их необходимо трехкратно отмыть буферно-солевым раствором с помощью центрифугирования при (800±200) об./мин в течение 10 мин.
Приготовление консервирующего раствора 5%-ного натрия цитрата
Перед употреблением 5%-ный раствор цитрата натрия на дистиллированной воде разводят в 2 раза буферно-солевым раствором и к одной части полученного раствора натрия цитрата добавляют 2 части крови. В этом консерванте эритроциты можно хранить при (4±2) °С в течение 3-5 суток.
3.2. Метод постановки реакции торможения гемагглютинации (РТГА)
с вирусом гриппа (микрометод)
Принцип метода, его учет и ингредиенты для реакции, проводимой микрометодом, те же, что и для проведения РТГА макрометодом. Изменяются только концентрации и объемы ингредиентов.
Реакцию ставят на микропанели с "U"-образными лунками.
3.2.1. Приготовление 0,5%-ной взвеси эритроцитов петуха
Взвесь готовят из 1%-ной суспензии эритроцитов (см. макрометод) разведением ее в 2 раза (т.е. в соотношении 1:1) буферно-солевым раствором.
3.2.2. Определение гемагглютинирующего титра антигена
В каждую лунку микропанели вносят буферно-солевой раствор в объеме 50 мкл. Затем в первую лунку вносят 50 мкл антигена в разведении 1:10 и далее проводят титрование по принципу двукратного разведения. Из последней лунки удаляют 50 мкл. Затем в каждую лунку вносят по 50 мкл 0,5%-ной суспензии эритроцитов. Содержимое лунок перемешивают встряхиванием и оставляют при комнатной температуре (20±2) °С на 40-45 мин до оседания эритроцитов в контроле (см. ниже).
Реакцию оценивают по четырехкрестовой системе. За титр антигена или одну агглютинирующую единицу (1 АЕ) принимают наибольшее разведение антигена, дающее четко выраженную агглютинацию эритроцитов на 3 или 4 креста.
Определение титра антигена сопровождается постановкой отрицательного контроля на отсутствие спонтанной агглютинации эритроцитов. В качестве отрицательного контроля служат несколько лунок панели, в которые вместо антигена внесен буферно-солевой раствор.
3.2.3. Приготовление рабочей дозы антигена
Рабочая доза антигена при постановке РТГА микрометодом равна 8 ГАЕ. Для ее приготовления гемагглютинирующий титр делят на 16. Полученная цифра означает, во сколько раз необходимо развести антиген.
Пример. Титр антигена равен 1:160. Разделив 160 на 16, получаем цифру 10, указывающую, что антиген необходимо развести в 10 раз.
Перед постановкой основного опыта проверяют точность приготовления рабочей дозы (8 АЕ). Для этого в шесть лунок микропанели, начиная со второй, вносят по 25 мкл буферно-солевого раствора. В 1-ю и 2-ю лунки добавляют по 25 мкл приготовленной рабочей дозы антигена. После перемешивания смеси 25 мкл ее объема переносят из 2-й лунки в 3-ю, из 3-й - в 4-ю и т.д. Из последней лунки панели 25 мкл удаляют. Затем во все лунки добавляют по 25 мкл буферно-солевого раствора и по 50 мкл 0,5%-ной суспензии эритроцитов. После встряхивания смесь оставляют при температуре (20±2) °С на 40-45 мин до оседания эритроцитов в контроле.
При правильном выборе рабочей дозы агглютинация эритроцитов должна наблюдаться только в четырех лунках панели. В остальных лунках агглютинация должна отсутствовать. В случае отклонения от указанного результата добавляют антиген или буферно-солевой раствор для получения необходимой рабочей дозы.
3.2.4. Постановка реакции торможения гемагглютинации
Постановка реакции микрометодом соответствует описанному для макрометода, за исключением объемов используемых ингредиентов реакции.
Готовят двукратные разведения сыворотки в объеме 25 мкл, вносят рабочую дозу антигена (8 АЕ) в объеме 25 мкл и после контакта антигена и сыворотки (от 30 мин до 1 ч) при температуре (20±2) °С в каждую лунку панели вносят по 50 мкл 0,5%-ной взвеси эритроцитов. После оседания эритроцитов в контроле (как правило, через 40-45 мин) проводят учет результатов.
За титр активности принимают разведение сыворотки, при котором отсутствует агглютинация эритроцитов.
4. Метод определения инфекционной активности вируса гриппа
на куриных эмбрионах
Определение проводят на развивающихся куриных эмбрионах 10-12-дневного возраста.
Десятикратные разведения вируса (вакцины) готовят в 4,5 мл буферно-солевого раствора рН от 7,4 до 7,0, меняя при каждом разведении пипетку.
Вводят в аллантоисную полость 0,2 мл вируссодержащей жидкости из разведений от 10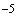 до 10
до 10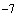 (разведения могут меняться в зависимости от целей исследования и предполагаемой инфекционной активности вируса), используя на каждое разведение по 4 эмбриона. Для заражения эмбрионов используют разные шприцы или проводят заражение одним шприцем, начиная с большего разведения.
(разведения могут меняться в зависимости от целей исследования и предполагаемой инфекционной активности вируса), используя на каждое разведение по 4 эмбриона. Для заражения эмбрионов используют разные шприцы или проводят заражение одним шприцем, начиная с большего разведения.
Эмбрионы инкубируют при температуре 35 °С в течение 48 ч для вируса гриппа (вакцины) типа А и 72 ч для вируса гриппа (вакцины) типа В. По истечении срока инкубации отдельно из каждого эмбриона отбирают по 0,4-0,5 мл аллантоисной жидкости, которую помещают в 4 отдельные лунки плексигласовой доски. Затем в каждую лунку добавляют по 0,4-0,5 мл 1%-ной суспензии куриных эритроцитов. Через 30-40 мин контакта при температуре (20±2) °С, после оседания эритроцитов в контроле, проводят учет гемагглютинации.
Контроль: проводят как описано выше, но вместо аллантоисной жидкости из куриного эмбриона в свободные 4 лунки панели вносят по 0,4-0,5 мл буферно-солевого раствора рН 7,2±0,2.
Вычисление биологического титра проводят по методу Рида и Менча.
Метод основан на логической предпосылке, что тканевая культура или животное, погибшие при заражении их каким-либо разведением вируса, погибнут и при заражении любым более низким разведением.
Пример подсчета показан ниже.
Подсчет 50%-ной дозы (ТЦД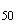 ) по методу Рида и Менча
) по методу Рида и Менча
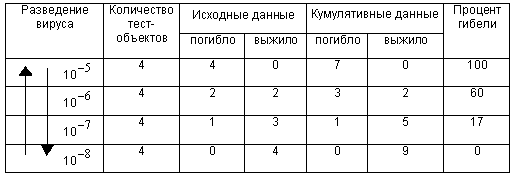
Из таблицы видно, что 50%-ная доза находится между разведениями вируса 10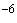 и 10
и 10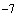 .
.
Далее расчет величины 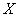 , которую необходимо прибавить к разведению непосредственно ниже 50%-ной дозы (
, которую необходимо прибавить к разведению непосредственно ниже 50%-ной дозы (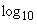 ), производится по следующей формуле:
), производится по следующей формуле:
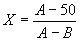 ,
,
где 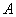 - процент гибели при разведении, непосредственно ниже искомой 50%-ной дозы (в данном случае 60%);
- процент гибели при разведении, непосредственно ниже искомой 50%-ной дозы (в данном случае 60%);
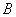 - процент гибели при разведении непосредственно выше искомой 50%-ной дозы (в данном случае 17%).
- процент гибели при разведении непосредственно выше искомой 50%-ной дозы (в данном случае 17%).
Подставляя полученные значения в формулу 1, находим:
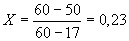 , откуда
, откуда
титр вируса (в обратных 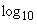 ) равен
) равен
6+0,23=6,23,
другими словами, одна ТЦД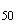 или LD
или LD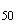 соответствует разведению вируса 10
соответствует разведению вируса 10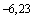 .
.
Если в титрование были взяты разведения вируса с интервалом 0,5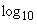 , то величину
, то величину 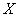 в формуле 1 следует умножить на 0,5.
в формуле 1 следует умножить на 0,5.
Поскольку при титровании вируса в пробирочных культурах обычно получаются четкие результаты и культуры со 100%-ной дегенерацией отделены от культур с полным отсутствием дегенерации всего одним разведением вируса, удобно пользоваться при подсчете титров по Риду и Менчу упрощенной схемой.
|
Количество эмбрионов, зараженных разведением 10 |
Количество эмбрионов с наличием гемагглютинации в аллантоисной жидкости |
Титр вируса |
|
4 |
1 |
|
|
4 |
2 |
|
|
4 |
3 |
|
|
4 |
4 |
|
Пример.
|
10 |
++++ | |
|
10 |
+++ | |
|
10 |
--- |
Титр вируса в 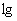 ИД
ИД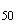 /0,2 равен:
/0,2 равен: 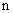 , 33 т.е. 5,33 ИД
, 33 т.е. 5,33 ИД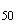 /0,2 мл.
/0,2 мл.
Указание объема вирусной взвеси, вводимой при заражении эмбрионов, обязательно, так как величина инфекционной активности будет различной.
Для вычисления ТЦД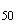 (количества цитопатогенных доз) вируса в 1 мл исследуемой жидкости к показателю величины титра вируса (
(количества цитопатогенных доз) вируса в 1 мл исследуемой жидкости к показателю величины титра вируса (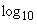 ) прибавляют в зависимости от количества вируссодержащего материала, взятого для заражения одной культуры, соответствующие величины поправок.
) прибавляют в зависимости от количества вируссодержащего материала, взятого для заражения одной культуры, соответствующие величины поправок.
|
Объем материала в миллилитрах, |
Величина поправки |
|
0,1 |
1,0 |
|
0,2 |
0,7 |
|
0,25 |
0,6 |
|
0,3 |
0,52 |
|
0,4 |
0,4 |
|
0,5 |
0,3 |
|
0,6 |
0,22 |
|
0,7 |
0,16 |
|
0,8 |
0,1 |
Например, если во всех пробирочных культурах, зараженных по 0,2 мл материалом в разведении 10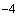 , наблюдается цитопатогенный эффект, а в культурах, инокулированных разведением 10
, наблюдается цитопатогенный эффект, а в культурах, инокулированных разведением 10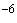 , цитопатогенного эффекта не наблюдается (при инокуляции же разведением 10
, цитопатогенного эффекта не наблюдается (при инокуляции же разведением 10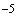 цитопатогенный эффект отмечен в одной из четырех пробирок), то титр вируса в
цитопатогенный эффект отмечен в одной из четырех пробирок), то титр вируса в 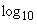 будет равен 10
будет равен 10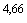 . Содержание же его в 1 мл будет равно 10
. Содержание же его в 1 мл будет равно 10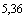 ТЦД
ТЦД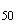 .
.
5. Метод количественного (мкг/мл) определения гемагглютинина вируса гриппа
в реакции одиночной радиальной иммунодиффузии (ОРИД)
Принцип метода
Гемагглютинин (ГА), диффундируя из лунок агарозного геля в радиальном направлении, реагирует со специфическими антителами сыворотки, находящейся в агарозе, и образует в геле зону преципитации. Размеры окружающей лунку зоны преципитации находятся в прямой зависимости от количества антигена, внесенного в лунку.
5.1. Ингредиенты для проведения ОРИД:
- стандарт моноспецифической сыворотки к гемагглютинину вируса гриппа;
- стандартный антиген (гемагглютинин) вируса гриппа;
- агароза;
- детергент;
- краситель - Кумасси бриллиантовый голубой;
- раствор для обесцвечивания агарозных гелей;
- буферно-солевой раствор (БСР) - 0,01 М фосфатный буфер рН 7,2, содержащий 0,15 М натрия хлорида и 0,01%-ный натрия азид. Можно вместо БСР использовать 0,01 М трис-HCl буфер рН 7,2-7,3, содержащий 0,15 М натрия хлорида и 0,01%-ный натрия азид;
- 1-10%-ный натрия азид.
5.2. Приготовление стандартных образцов иммунореагентов
5.2.1. Приготовление стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа
Иммунизируют кролика или барана гемагглютинином, который должен содержать белок (не менее 100 мкг/мл), быть электрофоретически гомогенным при электрофорезе в полиакриламидном геле. Моноспецифические сыворотки получают иммунизацией животных очищенным белком гемагглютинина с равным объемом адъюванта Фрейнда. Первая иммунизация по 0,5 мл смеси в две точки, вторая и третья иммунизация - через 2 недели в том же объеме в две точки внутримышечно и по 0,1 мл гемагглютинина без адъюванта в четыре точки внутрикожно. Обескровливание животных проводится через 2 недели. Предварительно проводится отбор пробной партии крови. При необходимости проводят дополнительно введение антигена. Титр сыворотки в РТГА должен быть не ниже 1:5000.
Полученную сыворотку прогревают при температуре 56 °С, разводят ФБР, содержащим 0,01% азида натрия, в 2-4 раза в зависимости от активности, разливают по 0,5 мл в ампулы и высушивают.
5.2.2. Приготовление стандартного антигена (ГА) вируса гриппа
Стандарт гемагглютинина (антиген) для ОРИД должен содержать 20-50 мкг ГА в 1 мл и не ниже 1:32000 ГАЕ.
Используют полуфабрикат инактивированной гриппозной вакцины с содержанием белка 25-400 мкг/мл. Соотношение экстинкции полуфабриката Е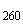 /Е
/Е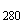 должно быть 1,1-1,18. Содержание сахарозы - 5-7% (в случае отсутствия сахарозы подбирают наполнитель для сушки). Жидкий препарат разливают по 1,0 мл в ампулы и подвергают лиофильной сушке.
должно быть 1,1-1,18. Содержание сахарозы - 5-7% (в случае отсутствия сахарозы подбирают наполнитель для сушки). Жидкий препарат разливают по 1,0 мл в ампулы и подвергают лиофильной сушке.
5.3. Оборудование:
- стеклянные пластины 6х9 см;
- микрошприц на 0,1 мл или автоматические микропипетки, регулируемые на 0-20 мкл, а также автоматические пипетки объемом 100-1000 мкл;
- водяная баня (до 100);
- прибор для измерения диаметра колец преципитации;
- горизонтальный столик с уровнем;
- камера (влажная) для инкубации;
- пробойник из нержавеющей стали с внешним диаметром 3 мм.
5.4. Проведение ОРИД
Для реакции используют тщательно вымытые и сухие пластины размером 6х9 см. Для этого пластины кипятят в воде с добавлением моющих средств, затем промывают водопроводной и дистиллированной водой, помещают на сутки в раствор 1 N едкого натра и затем на сутки в смесь Никифорова (спирт:эфир =1:1). Обезжиренные пластины промывают водопроводной и дистиллированной водой и высушивают.
Перед нанесением агарозы пластину равномерно протирают марлей, смоченной расплавленной горячей агарозой, для последующего закрепления геля на пластине. Для этих целей следует использовать специально отлитую в отдельную пробирку агарозу; ее можно использовать многократно. Приготовленные заранее порции агарозы объемом по 12 мл расплавляют в кипящей водяной бане при температуре 100 °С и затем охлаждают до 56 °С в водяной бане в течение не менее 30 мин. При 56 °С к агарозе добавляют предварительно подогретую моноспецифическую сыворотку в объеме, указанном в описании к стандарту. Агарозу с сывороткой тщательно перемешивают, не допуская образования пузырьков воздуха. Расплавленную агарозу с сывороткой быстро и равномерно наносят на пластины, помещенные на столик с "уровнем", и оставляют на 30 мин при комнатной температуре. Приготовленные пластины с сывороткой можно хранить во влажной камере при 4 °С в течение 6-7 суток.
В застывшей агарозе пробойником из нержавеющей стали с внешним диаметром 3 мм делают 6 рядов лунок по 4 лунки в каждом на расстоянии не менее 1,5 см от края пластины. Расстояние между лунками должно быть не менее 1 см. Агарозу из прорезанных лунок удаляют под легким вакуумом.
Определение антигенной активности вакцин, т.е. содержания антигена (ГА) в мкг/мл, проводят на двух пластинах. На каждой пластине исследуют стандарт и две серии вакцины, отводя под каждый образец по два ряда лунок. На второй пластине проверяют те же образцы, но расположение вакцин и стандарта произвольно меняют. Предварительно готовят смесь детергента и антигенов (50 мкл детергента +450 мкл антигена), инкубируют при комнатной температуре в течение 30 мин. Затем готовят разведения антигенов: неразведенный антиген, 0,75, 0,50 и 0,25 (или 1:0, 3:1, 1:1, 1:3), используя для разбавления БСР.
Схема разведений антигена
|
Разведение |
Объем в мкл | ||
|
Антиген |
Растворитель | ||
|
неразвед. |
1:0 |
100 |
0 |
|
0,75 |
3:1 |
150 |
50 |
|
0,5 |
1:1 |
100 |
100 |
|
0,25 |
1:3 |
100 |
300 |
Для реакции важно, чтобы вакцина и стандартный антиген содержали близкие количества ГА, так, чтобы размеры зон преципитации могли быть сравнимы. Если вакцина, согласно паспортным данным, содержит меньше ГА, чем стандарт, необходимо провести предварительное разведение стандарта и, наоборот: в случае если стандарт менее активен, чем вакцина, то разводится вакцина. В описании к стандарту указаны рекомендуемые разведения стандарта и сыворотки.
В лунки вносят по 10 или 20 мкл каждого разведения, начиная с разведения 1:3, с помощью микрошприца или, что точнее, - с помощью автоматической микропипетки со сменой наконечников при переходе от одного разведения к другому. Через 30 мин пластины помещают во влажную камеру на 18-24 ч при комнатной температуре. Затем для удаления из геля неспецифических белков пластины помещают в БСР на несколько часов при двух- - четырехкратной смене БСР. После этого слой геля покрывают смоченной в БСР плотной фильтровальной бумагой, избегая образования воздушных пузырьков на поверхности геля, затем несколькими слоями сухой фильтровальной бумаги и помещают под груз (не более 10 г на 1 см поверхности). Бумагу, за исключением первого слоя, меняют через каждые 10-15 мин до тех пор, пока она не перестанет впитывать влагу из агарозы. Для дальнейшего высушивания пластины помещают под вентилятор, не снимая первого слоя бумаги. Высушивают до момента, когда фильтровальная бумага первого слоя будет свободно отделяться от агарозы. Заливают красителем и окрашивают не менее 30 мин. После окрашивания обесцвечивают в растворе для обесцвечивания гелей до проявления четких колец преципитации на слабо окрашенном фоне. После подсушивания кольца преципитации измеряют в двух взаимно перпендикулярных направлениях. Затем рассчитывают квадраты диаметров колец преципитации каждого антигена на основании средних величин по двум пластинам и строят график, откладывая по оси ординат квадраты диаметров, а по оси абсцисс - разведения антигенов. На графике зависимость квадрата диаметров от разведений для каждой вакцины должна быть выражена прямой линией, которая должна располагаться по оси ординат в пределах 3 мм
поверхности). Бумагу, за исключением первого слоя, меняют через каждые 10-15 мин до тех пор, пока она не перестанет впитывать влагу из агарозы. Для дальнейшего высушивания пластины помещают под вентилятор, не снимая первого слоя бумаги. Высушивают до момента, когда фильтровальная бумага первого слоя будет свободно отделяться от агарозы. Заливают красителем и окрашивают не менее 30 мин. После окрашивания обесцвечивают в растворе для обесцвечивания гелей до проявления четких колец преципитации на слабо окрашенном фоне. После подсушивания кольца преципитации измеряют в двух взаимно перпендикулярных направлениях. Затем рассчитывают квадраты диаметров колец преципитации каждого антигена на основании средних величин по двум пластинам и строят график, откладывая по оси ординат квадраты диаметров, а по оси абсцисс - разведения антигенов. На графике зависимость квадрата диаметров от разведений для каждой вакцины должна быть выражена прямой линией, которая должна располагаться по оси ординат в пределах 3 мм от стандартной кривой. Если расстояние между начальными точками тестируемого и стандартного антигена превышает 3 мм
от стандартной кривой. Если расстояние между начальными точками тестируемого и стандартного антигена превышает 3 мм , такие результаты не учитывают; в этом случае необходимо более точно подобрать концентрации антисыворотки и антигенов (прилож.2, рис.1: а) - правильно подобранные концентрации, б) - неправильно подобранная концентрация для вакцины 2).
, такие результаты не учитывают; в этом случае необходимо более точно подобрать концентрации антисыворотки и антигенов (прилож.2, рис.1: а) - правильно подобранные концентрации, б) - неправильно подобранная концентрация для вакцины 2).
Затем на оси ординат между начальными точками кривой стандарта и каждого антигена находят среднюю точку, от нее проводят прямую, параллельную оси абсцисс, а от нее на уровне разведения 1:3 находят расстояния до кривой тестируемого антигена и стандартного (прилож.2, рис.2). Количество ГА в вакцине рассчитывают по формуле:
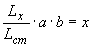 ,
,
где 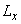 ,
, 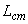 - расстояния по перпендикуляру на уровне разведения 1:0 от срединной линии до пересечения с кривыми тестируемого и стандартного антигенов, соответственно;
- расстояния по перпендикуляру на уровне разведения 1:0 от срединной линии до пересечения с кривыми тестируемого и стандартного антигенов, соответственно;
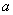 - содержание ГА в мкг/мл в стандарте;
- содержание ГА в мкг/мл в стандарте;
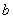 - предварительное разведение вакцины;
- предварительное разведение вакцины;
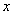 - содержание ГА в мкг/мл в вакцине.
- содержание ГА в мкг/мл в вакцине.
Приготовление рабочих растворов и разведений иммунореагентов
Моноспецифическая сыворотка к ГА
Разводят дистиллированной водой до объема, указанного на ампуле; последующие разведения получают с помощью БСР.
Стандартный антиген
Разводят дистиллированной водой в объеме, указанном на ампуле; дальнейшие разведения получают с помощью БСР. Растворенный антиген хранят при 4 °С не более 6 ч.
Агароза
Используют агарозу, разрешенную к применению для этих целей в установленном порядке. Агарозу заливают БСР (конечная концентрация 1,5%) и нагревают в кипящей водяной бане до полного растворения. Расплавленную агарозу фильтруют в горячем виде через ватно-марлевый фильтр, разливают по 12 мл и перекрывают резиновыми пробками. В таком виде агароза может храниться не менее 3 мес при комнатной температуре. (Если агароза начинает отделяться от стенок пробирки, ее не используют.)
Детергенты
Используют детергенты, указанные в описании к стандарту. Обычно применяют: 5%-ный лаурилсаркозинат натрия (саркозил натрия) NL 97, или 20%-ный (по объему) малгофен (триди-силоксиполи-(этилен-окси)-этанол) ВС - 720, или детергент - 10% Дезинтегрон-Б, или другие, разрешенные к применению для этих целей в установленном порядке. Растворы детергентов готовят на дистиллированной воде и хранят при комнатной температуре в течение 6 мес.
Краситель
Используют Кумасси бриллиантовый голубой G-250 или R-250 или другие, разрешенные к применению для этих целей в установленном порядке. Готовят 0,3%-ный раствор в растворе для обесцвечивания гелей и фильтруют. Краситель хранится при комнатной температуре и может использоваться до выпадения в осадок кристаллов.
Раствор для обесцвечивания окрашенных агарозных гелей
Смешивают 200 мл ледяной уксусной кислоты с 500 мл этилового спирта и доводят объем до 1 л дистиллированной водой. Раствор хранят неограниченное время в посуде с притертой пробкой.
6. Метод радиальной иммунодиффузии (РИД) для определения овальбумина
Принцип метода РИД заключается в том, что растворенный овальбумин (ОА), внесенный в лунки на поверхности геля агарозы, радиально диффундирует, образуя зону преципитации со специфическими антителами, находящимися в геле. Площадь зоны преципитации прямо пропорциональна концентрации антигена.
6.1. Получение тест-системы
Для постановки метода необходимо получить тест-систему, состоящую из раствора ОА и моноспецифической антиовальбуминовой сыворотки.
6.1.1. Получение раствора овальбумина (ОА)
Вариант N 1
Навеску ОА (пятикратно кристаллизованного) растворяют в фосфатном буферном растворе (ФБР) рН от 7,2 до 7,4 до концентрации 1,2 мг/мл. Полученный раствор подвергают стерилизующей фильтрации через миллипоровый фильтр с диаметром пор 0,45 мк и разводят тем же растворителем в стерильных условиях в мерной колбе в 10 раз. Содержимое колбы разливают в стерильные ампулы из стекла марки НС-1 и запаивают. Химическую устойчивость стекла предварительно проверяют в соответствии с действующим ГОСТ. Проводят контроль стерильности полученного раствора антигена и содержания белка по белковому азоту методом с применением реактива Несслера. Концентрацию белка в растворе ОА рассчитывают путем усреднения результатов 10 параллельных определений (ориентировочная концентрация белка должна быть около 100 мкг/мл).
Стерильный препарат может храниться при температуре (6±2) °С в течение 2-х лет без изменения своих свойств.
Вариант N 2
Для приготовления стандартного раствора ОА в концентрации 2 мкг/мл взвешивают на аналитических весах 2 мг кристаллического ОА и растворяют их в 1 мл ФБР, получая раствор ОА в концентрации 2 мг/мл, который затем последовательно разводят в 1000 раз. Стандартный раствор ОА пригоден для использования в течение 4 ч.
6.1.2. Получение антиовальбуминовой сыворотки
Кроликов массой от 2,0 до 2,5 кг иммунизируют по следующей схеме, состоящей из трех циклов:
1-й цикл - 0,5 мг ОА растворяют в 0,5 мл изотонического раствора хлорида натрия, смешивают с 0,5 мл полного адъюванта Фрейнда и вводят кролику подкожно по 0,2 мл в 5 точек тела одновременно;
2-й цикл - спустя 5 недель проводят 2 иммунизации с интервалом в 3 сут, вводя одновременно животному внутримышечно и внутривенно по 0,5 мл раствора, содержащего 0,5 мг ОА;
3-й цикл - осуществляют спустя 3 недели после последней инъекции и, в отличие от второго цикла, проводят трехкратную иммунизацию. Через 2 недели после окончания третьего цикла кроликов обескровливают. Сыворотку разливают по 0,3 мл в ампулы и хранят при температуре минус (18±2) °С или подвергают лиофилизации и хранят при температуре (6±2) °С.
6.1.3. Требования к антиовальбуминовой сыворотке
Оптимальное разведение сыворотки для обнаружения ОА в концентрации от 0,5 до 10,0 мкг/мл должно быть не менее 1:100.
Определение оптимального разведения антиовальбуминовой сыворотки
Проводят пробное титрование антисыворотки в РИД на предметных стеклах. Готовят ряд последовательных разведений антисыворотки в 1,25%-ном растворе агарозы при температуре (59±1) °С - 1:50; 1:75; 1:100; 1:150; 1:200; 1:250; 1:300; 1:400; 1:500 и так далее до 1:1000. Общий объем каждого разведения - 4 мл. Раствор наслаивают на предметные стекла и оставляют при комнатной температуре для застывания. В застывшем слое агарозного геля пробивают в шахматном порядке 6 лунок диаметром 3 мм, в которые вносят по 10 мкл каждого из следующих разведений раствора ОА - 1; 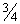 ;
; 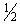 ;
; 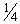 (п.8.1.4.2).
(п.8.1.4.2).
Оптимальным разведением сыворотки считают то разведение, при котором вокруг всех лунок образуются видимые зоны преципитации с четкими, не размытыми краями.
Определенное оптимальное разведение антисыворотки, установленное при пробном титровании на предметных стеклах, является ориентировочным и обязательно уточняется при воспроизведении опыта на пластинах размером 6х9 см.
Антаовальбуминовая сыворотка в оптимальном разведении не должна давать зоны преципитации с антигенами: кональбумином, овомукоидом, лизоцимом в концентрации от 1 до 50 мкг/мл.
В иммуноэлектрофорезе неразведенная антиовальбуминовая сыворотка должна давать одну специфическую линию преципитации с раствором ОА, пятикратно кристаллизованного, в концентрации 1 мг/мл.
6.1.4. Ингредиенты и их подготовка к постановке РИД
Фосфатный буферный раствор (ФБР) рН от 7,2 до 7,4
Точные навески солей: Na HPО
HPО ·2Н
·2Н О - 1,2470 г, KН
О - 1,2470 г, KН РО
РО - 0,4084 г, NaCI - 8,5 г - растворяют в небольшом объеме воды и доводят общий объем до 1 л.
- 0,4084 г, NaCI - 8,5 г - растворяют в небольшом объеме воды и доводят общий объем до 1 л.
Рабочие разведения раствора ОА
К 1,0 мл раствора ОА добавляют 9,0 мл ФБР. Полученный раствор разводят ФБР по следующей схеме (см. ниже), получая ряд рабочих разведений; при этом разведение первой пробы, содержащей 8 мкг/мл белка, разводят в 4 раза, получая при этом концентрацию в 2 мкг/мл, принимаемую условно за 1.
Схема приготовления рабочих разведений раствора ОА
|
Разведение |
Ориентировочное содержание ОА, мкг/мл |
Объем раствора ОА |
Объем ФБР, |
|
1 |
2 |
1 |
0 |
|
|
1,5 |
0,3 |
0,1 |
|
|
1,0 |
0,2 |
0,2 |
|
|
0,5 |
0,1 |
0,3 |
Рабочие разведения стандартного раствора ОА хранят при температуре (6±2) °С в течение 1 месяца.
Антиовальбуминовая сыворотка (п.6.1.2)
Агароза
Используют агарозу, разрешенную к применению для этих целей в установленном порядке.
В ФБР добавляют азид натрия до конечной концентрации 100 мкг/мл.
1,25%-ную суспензию агарозы в этом растворителе расплавляют в кипящей водяной бане, затем емкость, содержащую расплавленную агарозу, помещают в водяной термостат, где ее выдерживают при температуре (59±1) °С не менее 30 мин. Содержимое разливают по 12 мл теплыми пипетками в пробирки. Закрытые резиновыми пробками пробирки с гелем агарозы могут храниться при комнатной температуре в течение 3 мес.
Краситель
Кумасси бриллиантовый голубой G-250 или R-150, или другие, разрешенные к применению для этих целей в установленном порядке.
Готовят 0,3%-ный раствор красителя в растворе для обесцвечивания геля агарозы. На следующие сутки приготовленный раствор фильтруют через стеклянный фильтр N 2. Раствор хранят при комнатной температуре под тягой в склянке с притертой пробкой.
Раствор для обесцвечивания геля агарозы
Смешивают 200,0 мл ледяной уксусной кислоты с 500,0 мл этилового спирта и объем доводят до 1 л дистиллированной водой. Раствор хранят при комнатной температуре под тягой в склянке с притертой пробкой.
6.1.5. Оборудование. Подготовка к постановке РИД
Стеклянные пластины размером 6х9 см
Пластины кипятят в воде с добавлением моющих средств, тщательно промывают водопроводной, затем дистиллированной водой. Сухие пластины заливают свежеприготовленной хромовой смесью не менее чем на 3 ч, затем многократно промывают водопроводной и ополаскивают дистиллированной водой. Пластины высушивают при 100 °С.
Сухие пластины протирают марлей, смоченной в горячем 1,25%-ном расплаве агарозы и высушивают на воздухе (гель агарозы для этой цели используют многократно и хранят отдельно). Образующийся тонкий слой геля способствует более прочной связи нанесенного в последующем на пластину слоя агарозы. Приготовленные таким образом пластины могут длительно храниться в сухом месте.
Микрошприцы объемом 100 мкл
Для добавления антисыворотки к агарозе и внесения препаратов в лунки.
Для последней цели могут быть использованы автоматические микропипетки регулируемого от 0 до 20 мкл объема.
Трафарет
На листе миллиметровой бумаги размером 6х9 см обозначают 6 рядов на расстоянии 1,5 см от края, по 4 точки (соответствующие лункам на пластине) в каждом ряду. Расстояние между точками (лунками) должно быть не менее 1 см.
Пробойник из нержавеющей стали с внешним диаметром 4 мм
На него сверху надевают небольшую резиновую грушу для создания небольшого разряжения, за счет которого удаляют гель из лунок.
Измеритель из чертежного набора и линейка с ценой деления 0,1 мм
Может быть использована линейка к набору типа Partigen или другая с аналогичными техническими характеристиками.
Камера для инкубации
Водяная баня для термостатирования расплавленной агарозы
6.1.6. Постановка метода
Пробирки с приготовленным гелем агарозы (п.6.1.4) помещают в кипящую водяную баню и выдерживают в ней до полного расплавления геля. Затем пробирки переносят в водяной термостат с температурой (59±1) °С и выдерживают в нем не менее 30 мин.
К расплавленной агарозе с помощью микрошприца осторожно добавляют необходимое количество антиовальбуминовой сыворотки, нагретой до температуры (59±1) °С.
Вносимый объем антисыворотки 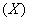 в мкл, необходимый для создания ее оптимальной концентрации в геле агарозы, рассчитывают по формуле:
в мкл, необходимый для создания ее оптимальной концентрации в геле агарозы, рассчитывают по формуле:
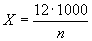 ,
,
где 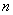 - степень оптимального разведения антисыворотки, определенная согласно п.7.1.3;
- степень оптимального разведения антисыворотки, определенная согласно п.7.1.3;
12 - объем геля агарозы в пробирках, мл;
1000 - единица перевода мл в мкл.
Пример расчета
Если оптимальное разведение сыворотки 1:200, количество ее, вносимое в пробирку, составит:
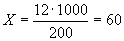 мкл.
мкл.
Содержимое пробирки быстро перемешивают вращательными движениями, не допуская образования пузырьков воздуха, и наливают на поверхность пластины.
Приготовленные пластины с нанесенным слоем геля толщиной 2 мм могут храниться во влажной камере при температуре (6±2) °С в течение 5-7 сут или использоваться немедленно. Для этой цели под пластину кладут трафарет и над каждой его точкой в слое геля с помощью пробойника с грушей проделывают лунки диаметром 3 мм. Общее количество лунок на каждой пластине - 24.
Пластины с лунками могут находиться на воздухе не более 15-20 мин или их помещают во влажную камеру. В последнем случае перед внесением испытуемых растворов пластины выдерживают на воздухе в течение 10-15 мин для испарения влаги из лунок.
На каждой пластине одновременно анализируют в 2-х параллельных рядах 3 препарата:
1) раствор ОА в разведениях 1; 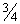 ;
; 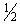 ;
; 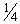 и
и
2) 2 испытуемых препарата в 4-х разведениях - 1; 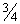 ;
; 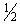 ;
; 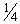 .
.
Готовят рабочие разведения раствора ОА согласно п.8.1.4.2. Испытуемые препараты разводят в соответствии со схемой, приведенной ниже.
Схема приготовления разведений испытуемых препаратов
|
Разведение |
Объем, мл | |
|
неразведенного препарата |
растворителя | |
|
1* |
1,0 |
0 |
|
|
0,3 |
0,1 |
|
|
0,2 |
0,2 |
|
|
0,1 |
0,3 |
|
* Содержание ОА в пробе, разведение которой принято за 1, не должно превышать 2 мкг/мл. При больших концентрациях препарат предварительно разводят в "
| ||
Исследуемые растворы вносят в лунки с помощью микрошприца в объеме 10 мкл, вначале - растворитель, затем раствор ОА, начиная с максимального разведения. Затем шприц тщательно промывают ФБР и в той же последовательности (от большего разведения к меньшему) вносят разведения первого испытуемого раствора. Вновь многократно промывают шприц и таким же образом в лунки вносят приготовленные растворы второго, затем - третьего препарата.
Расположение на пластине разведений каждого анализируемого образца произвольное и должно отличаться от расположения разведений этого же образца в параллельном опыте (т.е. на другой пластине).
Через 10-15 мин после внесения растворов в лунки пластины помещают во влажную камеру и выдерживают при комнатной температуре в течение 18 ч.
Неспецифические белки удаляют из геля путем выдерживания пластин в нескольких сменах ФБР в течение 3-5 ч при комнатной температуре. Возможно изменение режима отмывки, если отсутствуют четкие кольца преципитации.
Затем гель покрывают слоем фильтровальной бумаги, проделывают иглой отверстия над каждой лункой и ставят в воздушный поток вентилятора. Через 2-3 ч гель высыхает, и бумага легко отделяется от агарозы, ее снимают. Пластины помещают в раствор красителя на 30 мин, затем переносят на 5-10 мин (не более) в раствор для обесцвечивания геля. Отмывку окрашенного геля следует производить до появления четких зон преципитации на слабо окрашенном фоне. Окраску и отмывку пластин проводят под тягой в закрытых кюветах. Отмытые пластины выдерживают на воздухе до высыхания геля.
6.1.7. Учет результатов
Результат оценивают по величине квадрата среднего диаметра окрашенной зоны преципитации. С этой целью с помощью измерителя определяют под прямым углом два диаметра каждой зоны преципитации (если зона овальна, то измеряют максимальный и минимальный диаметры). Поскольку каждое разведение поставлено на пластине дважды, находят среднее арифметическое средних диаметров двух зон и полученную величину возводят в квадрат (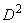 , мм
, мм ).
).
Строят график зависимости полученной величины от концентрации антигена, откладывая на оси ординат 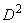 , а на оси абсцисс - разведения препарата.
, а на оси абсцисс - разведения препарата.
График зависимости представляет собой прямую линию, пересекающую ось ординат в определенной точке 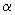 (см. рис.3). Значение
(см. рис.3). Значение 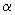 должно быть практически идентичным для всех препаратов. Отклонение в значениях
должно быть практически идентичным для всех препаратов. Отклонение в значениях 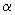 между графиками стандартного антигена и любой испытуемой вакцины не должно превышать 3 мм. В противном случае результаты не учитывают, а опыт повторяют.
между графиками стандартного антигена и любой испытуемой вакцины не должно превышать 3 мм. В противном случае результаты не учитывают, а опыт повторяют.
Расчет содержания ОА в препаратах производят следующим образом. Путем усреднения всех значений, определенных графически для каждой кривой, находят среднее арифметическое 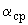 и проводят через эту точку линию, параллельную оси абсцисс. Далее для каждой кривой рассчитывают величину
и проводят через эту точку линию, параллельную оси абсцисс. Далее для каждой кривой рассчитывают величину 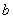 , вычитая значение
, вычитая значение 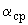 из значения
из значения 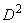 , определенного по графику на уровне разведения 1.
, определенного по графику на уровне разведения 1.
Содержание ОА в препарате в мкг/мл 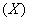 определяют по формуле:
определяют по формуле:
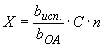 ,
,
где 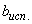 ,
, 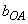 - величина "
- величина "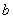 " для испытуемого препарата и раствора ОА, соответственно;
" для испытуемого препарата и раствора ОА, соответственно;
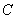 - концентрация ОА (по белку) в растворе ОА (разведение 1), мкг/мл;
- концентрация ОА (по белку) в растворе ОА (разведение 1), мкг/мл;
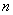 - степень разведения испытуемого препарата.
- степень разведения испытуемого препарата.
7. Метод иммуноферментного анализа (ИФА) для определения овальбумина
Для количественного определения овальбумина (ОА) в иммунобиологических препаратах (интерферон, гриппозная вакцина) используется твердофазный иммуноферментный метод (простой сэндвич).
Ингредиенты для проведения реакции:
- антитела к овальбумину (ИГ-ОА), сухие;
- положительный контрольный образец (КПАГ-ОА), жидкий;
- отрицательный контрольный образец (КОАГ-БСА), жидкий;
- конъюгат-антитела к ОА, меченные пероксидазой (АТП), сухие;
- карбонатно-бикарбонатный буферный раствор (КБР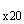 ), жидкий;
), жидкий;
- фосфатный солевой буферный раствор, содержащий твин-20 (ФСБ-Т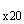 );
);
- солевой буферный раствор (СБ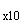 );
);
- индикатор - ортофенилендиамин (ОФД);
- гидроперит по ФС 42-2140-86;
- планшет полистироловый плоскодонный (типа "Нунк" или другие с аналогичными характеристиками, разрешенные к применению для этих целей в установленном порядке).
7.1. Приготовление ингредиентов реакции
7.1.1. Получение антител к овальбумину (ИГ-ОА)
Кристаллический овальбумин в количестве 5,0 мг растворяют в 10,0 мл физиологического раствора. Полученный исходный раствор разводят физиологическим раствором в 10 раз. Полученным антигеном иммунизируют кроликов шестикратно с интервалом в 1 неделю введением по 0,5 мл в 2 точки подкожно. Через 1 неделю после последней иммунизации производят забор крови. Получают иммунную сыворотку, которую подвергают осаждению добавлением раствора сульфата аммония с целью выделения иммуноглобулинов (ИГ-ОА). Раствор ИГ-ОА в фосфатном буфере разливают по ампулам и лиофильно высушивают.
7.1.2. Приготовление положительного контрольного образца (КПАГ-ОА)
Растворяют 10,0 мг овальбумина (ОА) в пробирке в 10,0 мл 0,87%-ного раствора натрия хлористого и 1,0 мл полученного раствора смешивают с 99,0 мл 0,87%-ного раствора натрия хлористого в мерном цилиндре вместимостью 100 мл. Отбирают 2,0 мл полученного раствора в другой мерный цилиндр вместимостью 200 мл, в котором, используя 0,87%-ный раствор натрия хлористого, доводят объем до метки 200 мл. Полученный таким образом раствор КПАГ-ОА в концентрации 100 нг/мл стерилизуют пропусканием через стерильный фильтр типа "Владипор" N 2 с диаметром пор 0,22 мкм или другие с диаметром пор 0,22 мкм, разрешенные к применению для этих целей в установленном порядке.
7.1.3. Приготовление отрицательного контрольного образца (КОАГ-БСА)
5,0 мг бычьего сывороточного альбумина (БСА) растворяют в пробирке в 10,0 мл 0,87%-ного раствора натрия хлористого и 1,0 мл полученного раствора смешивают с 99,0 мл 0,87%-ного раствора натрия хлористого в мерном цилиндре вместимостью 100 мл. Отбирают 2,0 мл полученного раствора в другой мерный цилиндр вместимостью 200 мл, в котором, используя 0,87%-ный раствор натрия хлористого, доводят объем до метки 200 мл. Полученный таким образом раствор КОАГ-БСА в концентрации 50 нг/мл стерилизуют пропусканием через стерильный фильтр типа "Владипор" N 2 с диаметром пор 0,22 мкм или другие с диаметром пор 0,22 мкм, разрешенные к применению для этих целей в установленном порядке.
7.1.4. Приготовление конъюгата антител к ОА, меченных пероксидазой (АТП)
В пробирку вносят 7-8 мл раствора, содержащего равное количество антител к ОА и пероксидазы хрена, перемешивают до полного осветления и добавляют 150 мкл 1%-ного раствора глютарового альдегида. После выдерживания полученного содержимого в течение 1 ч при температуре 22 °С проводят диализ против фосфатного буфера. Конъюгат антител к ОА с пероксидазой подвергают гельфильтрации через колонку с сефадексом. Активность полученного конъюгата должна быть не менее 1:2500, ОП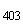 конъюгата должна быть 0,55±0,05. Конъюгат разливают по 0,5 мл в пробирки и лиофильно высушивают. Высушенный конъюгат должен иметь активность не менее 1:500.
конъюгата должна быть 0,55±0,05. Конъюгат разливают по 0,5 мл в пробирки и лиофильно высушивают. Высушенный конъюгат должен иметь активность не менее 1:500.
7.1.5. Приготовление 20-кратного концентрата карбонатно-бикарбонатного буферного раствора (КБР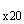 )
)
Последовательно растворяют 3,18 г натрия углекислого и 5,8 г натрия двууглекислого в очищенной воде, доводя объем до метки 100 мл в мерном цилиндре. Полученный раствор фильтруют через обеззоленный фильтр.
7.1.6. Приготовление 20-кратного концентрата фосфатного солевого буферного раствора, содержащего твин-20 (ФСБ-Т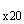 )
)
Последовательно растворяют в очищенной воде 48,3 г натрия фосфорно-кислого двузамещенного, 4,38 г натрия фосфорно-кислого однозамещенного, 212,5 г натрия хлористого и 12,5 мл твина-20, доводя объем в мерном цилиндре до метки 1250 мл. Полученный раствор фильтруют через обеззоленный фильтр.
7.1.7. Приготовление 10-кратного концентрата солевого буферного раствора (СБ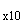 )
)
Последовательно растворяют 1,9 г натрия фосфорно-кислого однозамещенного двуводного и 0,77 г лимонной кислоты в очищенной воде и доводят объем до 100 мл в мерном цилиндре. Полученный раствор фильтруют через обеззоленный фильтр.
7.1.8. Приготовление индикатора - ортофенилендиамина (ОФД)
Ортофенилендиамин расфасовывают по 9,0 г во флаконы, флаконы закрывают резиновыми пробками.
7.2. Приготовление рабочих растворов и разведений иммунореагентов
7.2.1. Раствор 1. К 1,0 мл КБР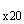 добавляют 19,0 мл воды.
добавляют 19,0 мл воды.
7.2.2. Раствор 2. К 1,0 мл ФСБ-Т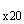 добавляют 19,0 мл воды.
добавляют 19,0 мл воды.
7.2.3. Раствор 3. К 2,0 мл СБ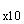 добавляют 18,0 мл воды.
добавляют 18,0 мл воды.
7.2.4. Раствор 4. Растворяют 9,0 мг ОФД в 20,0 мл раствора 3. Готовят непосредственно перед использованием.
7.2.5. Раствор 5. Таблетку гидроперита растворяют в 10,0 мл воды при комнатной температуре. Готовят непосредственно перед использованием.
7.2.6. Раствор 6. К 20,0 мл раствора 4 добавляют 5 мкл раствора 5. Готовят непосредственно перед использованием.
7.2.7. Раствор 7. К 90,0 мл воды добавляют 10,0 мл серной кислоты.
7.2.8. Рабочее разведение ИГ-ОА. Содержимое ампулы с ИГ-ОА растворяют в 0,5 мл воды при комнатной температуре и полученный раствор разводят в 10,0 мл раствора 1.
7.2.9. Рабочее разведение АТП. Содержимое 2-х ампул с АТП растворяют в 0,5 мл воды при комнатной температуре и полученный раствор разводят в 10,0 мл раствора 2.
7.2.10. Рабочее разведение КПАГ-ОА. Из КПАГ-ОА с использованием раствора 2 готовят рабочие разведения с концентрациями: 50,0; 25,0; 12,5; 6,25; 3,12; 1,56 нг/мл. Для этого в шесть пробирок вносят по 0,5 мл раствора 2. В первую из пробирок вносят 0,5 мкл КПАГ-ОА, содержимое пробирки перемешивают и 0,5 мл его переносят в пробирку N 2. Содержимое пробирки N 2 перемешивают и 0,5 мл его переносят в пробирку N 3 и т.д. до пробирки N 6 включительно.
7.3. Методика проведения иммуноферментного анализа (ИФА)
7.3.1. Во все лунки планшета вносят по 100 мкл рабочего разведения ИГ-ОА.
7.3.2. Планшет закрывают крышкой и выдерживают при температуре от 4 до 8 °С в течение 18 ч.
7.3.3. Содержимое лунок удаляют резким встряхиванием перевернутого планшета и каждую лунку промывают раствором 2 в объеме 0,3 мл трехкратно. Раствор 2 таким же образом удаляют из лунок планшета и осушают их постукиванием планшета по фильтровальной бумаге, сложенной в 4 слоя.
7.3.4. В лунки A-F 1-го и 2-го рядов планшета вносят по 100 мкл рабочих разведений КПАГ-ОА с концентрациями 50,0; 25,0; 12,5; 6,25; 3,12; 1,56 нг/мл (попарно: каждое разведение КПАГ-ОА - в одну лунку каждого из двух рядов планшета).
7.3.5. В лунки G 1-го и 2-го рядов планшета вносят по 100 мкл КОАГ-БСА, в лунки Н тех же рядов - по 100 мкл раствора 2 (контрольный образец без антигена).
7.3.6. Планшет закрывают крышкой и выдерживают при температуре от 35 до 39 °С в течение 1,5 ч.
7.3.7. Содержимое лунок удаляют и планшет промывают, как указано в п.7.3.3.
7.3.8. Во все лунки планшета вносят по 100 мкл рабочего разведения АТП.
7.3.9. См. п.7.3.6.
7.3.10. См. п.7.3.3.
7.3.11. Во все лунки планшета вносят по 100 мкл раствора 6 (п.7.2.6).
7.3.12. Планшет закрывают крышкой и выдерживают при комнатной температуре в течение 1 ч в защищенном от света месте.
7.3.13. Реакцию останавливают внесением в лунки планшета по 25 мкл раствора 7 (п.7.2.7).
7.4. Учет результатов
Учет результатов проводят на спектрофотометрах типа "Мультискан", "Унискан" или других с аналогичными техническими характеристиками, разрешенных к применению для этих целей в установленном порядке, при длине волны 480 нм. Концентрацию ОА в КПАГ-ОА определяют по прямолинейному участку калибровочного графика, выстраиваемого по данным оптической плотности (ОП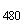 ) рабочих разведении КПАГ-ОА, приготовленных в соответствии с описанным в п.8.1.2 (по оси абсцисс откладывают концентрацию ОА в нг/мл, по оси ординат - ОП
) рабочих разведении КПАГ-ОА, приготовленных в соответствии с описанным в п.8.1.2 (по оси абсцисс откладывают концентрацию ОА в нг/мл, по оси ординат - ОП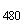 ).
).
Величина ОП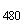 контрольных образцов без антигена должна быть не более 0,15. Величина ОП
контрольных образцов без антигена должна быть не более 0,15. Величина ОП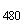 КПАГ-ОА в концентрации 3,12 нг/мл и более должна не менее чем в 2 раза превышать ОП
КПАГ-ОА в концентрации 3,12 нг/мл и более должна не менее чем в 2 раза превышать ОП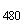 контрольных образцов без антигена. Величина ОП
контрольных образцов без антигена. Величина ОП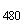 КОАГ-БСА должна превышать ОП
КОАГ-БСА должна превышать ОП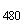 контрольных образцов без антигена менее чем в 2 раза.
контрольных образцов без антигена менее чем в 2 раза.
8. Метод определения количественного содержания овальбумина
в непрямой реакции торможения гемагглютинации (нРТГА)
Овальбумин в препарате определяют в реакции непрямой гемагглютинации (РНГА) путем сравнения его титра с титром стандартного раствора овальбумина. Реакцию ставят на микротитраторе типа Такачи или других с аналогичными техническими характеристиками, разрешенных к применению для этих целей в установленном порядке. Короткие ряды панелей с "U"-образными лунками нумеруют от 1 до 12. В первые 6 лунок всех 12 рядов панели калиброванной пипеткой микротитратора вносят по 25 мкл (1 капля) 1%-ного раствора нормальной кроличьей сыворотки (НКС): в первые лунки рядов малой петлей типа Такачи или другой (емкостью 25 мкл), разрешенной к применению для этих целей в установленном порядке, вносят исследуемый материал. Перемешивая содержимое лунок вращательными движениями петель и перенося их в следующие лунки до 10-й включительно, получают ряды последовательных двукратных разведений от 1:2 (1-я лунка) до 1:1024 (10-я лунка). Четыре ряда являются контрольными, в них проводят "гашение" антигена с целью проверки специфичности реакции. Для этого во все 8 лунок четных рядов вносят по 25 мкл (1 капля) 1% иммунной сыворотки. В каждую из 8 лунок остальных рядов (для выравнивания объемов реагирующей смеси с объемами контрольных рядов) вносят по 25 мкл 1%-ного раствора НКС. Содержимое лунок встряхивают постукиванием пальцами по торцу панели (или перемешивают на вибростолике) и оставляют на 10 мин при комнатной температуре. Затем во все лунки панели вносят калиброванной пипеткой по 25 мкл (1 капля) 1%-ной взвеси эритроцитарного диагностикума. Панель снова встряхивают, накрывают стеклянной пластинкой и оставляют при 18-20 °С на 1-1,5 ч. Результаты РНГА учитывают по виду осадков на дне лунок по общепринятой 4-крестовой схеме.
Контрольные процедуры
Контроль на специфичность
В четных рядах (ряды "гашения") реакция должна быть отрицательная, так как антиовальбуминовая сыворотка, добавленная к разведениям пробы до внесения диагностикума, нейтрализует антиген. При недостаточной активности иммунной сыворотки специфическая нейтрализация антигена может отсутствовать в первых лунках ряда "гашения". В этом случае контроль на специфичность считают достоверным, если титр агглютинации в ряду "гашения" не менее чем в 8 раз ниже, чем титр того же материала без добавления иммунной сыворотки.
Контроль на отсутствие спонтанной агглютинации эритроцитарного диагностикума
в 1%-ном растворе НКС
Реакция должна быть отрицательная в 7-й и 8-й лунках нечетных рядов.
Контроль на отсутствие агглютинации эритроцитарного диагностикума
в 1%-ном растворе иммунной сыворотки
Реакция должна быть отрицательной в 7-й и 8-й лунках четных рядов.
Реакцию с исследуемым материалом учитывают в том случае, если отсутствует агглютинация в вышеуказанных контрольных пробах.
Количественное содержание овальбуминового антигена в исследуемом материале вычисляют по формуле:
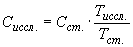 ,
,
где 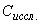 - концентрация антигена в исследуемом материале;
- концентрация антигена в исследуемом материале;
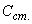 - концентрация антигена в рабочем растворе стандартного антигена;
- концентрация антигена в рабочем растворе стандартного антигена;
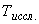 - величина, обратная титру исследуемого материала.
- величина, обратная титру исследуемого материала.
Ингредиенты для РНГА
Диагностикум эритроцитарный овальбуминовый кроличий (сухой)
Диагностикум регидратируют в указанном на этикетке ампулы объеме дистиллированной воды и разводят в 3 раза 1%-ным раствором НКС. Регидратированный препарат пригоден для использования не ранее 3 ч и не позднее 7 сут с момента регидратации (хранить при 4 °С).
Стандартный антиген - овальбумин кристаллический, ОХ3
Растворяют 10 мл стандартного антигена в 10 мл 0,1%-ного раствора НКС. Полученный исходный раствор консервируют мертиолятом натрия до конечной концентрации 1:10000 и хранят при 4 °С. Пригоден в течение 1 мес с момента приготовления. Непосредственно перед исследованием исходный раствор разводят в 1000 раз 0,1%-ным раствором НКС путем последовательных десятикратных разведений (по схеме: 4,5 мл 0,1%-ного раствора НКС+0,5 мл раствора антигена). Полученный при этом рабочий раствор стандартного антигена содержит 1 мкг овальбумина в 1 мл. Пригоден для реакции в течение одного рабочего дня.
Нормальную кроличью сыворотку (НКС), прогретую при 56 °С в течение 30 мин, истощенную бараньими эритроцитами, законсервированную мертиолятом натрия, разводят физиологическим раствором до концентрации 0,1%.
Иммунную кроличью сыворотку антиовальбуминовую, прогретую при 56 °С в течение 30 мин, истощенную бараньими эритроцитами, законсервированную мертиолятом натрия, разводят физиологическим раствором до концентрации 1%.
Физиологический раствор.
Дистиллированная вода.
Исследуемый материал прогревают на водяной или суховоздушной бане с вентилятором при 56 °С в течение 30 мин.
9. Метод определения специфичности нейраминидазы вируса гриппа
в реакции ингибирования нейраминидазной активности штаммов
вируса гриппа (РИНА)
Процедура состоит из 2-х этапов:
- определение нейраминидазной активности;
- определение специфичности нейраминидазы вируса гриппа в реакции ингибирования нейраминидазной активности (РИНА).
Определение нейраминидазной активности
Определение нейраминидазной активности включает в себя:
- выделение свободной N-ацетилнейраминовой кислоты из субстрата под действием нейраминидазы вируса;
- превращение N-ацетилнейраминовой кислоты в 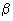 -формилпировиноградную кислоту в результате окисления;
-формилпировиноградную кислоту в результате окисления;
- образование хромофора под действием тиобарбитуровой кислоты;
- экстракция хромофора органическим растворителем для спектрофотометрического анализа.
Основными стадиями РИНА являются:
- инкубирование стандартной нейраминидазы вируса с серийными разведениями нормальной и испытуемой сывороток;
- определение ингибиторного действия сыворотки на нейраминидазную активность;
- вычисление титра РИНА.
Ход определения
Готовят двукратные разведения антигена (для аллантоисной жидкости с 1:2 до 1:64) на дистиллированной воде. К 0,1 мл антигена в разведении добавляют 0,1 мл 0,15 М фосфатного буфера рН 5,9-6,0 (или 0,2 мл, если определяется доза для РИНА) и 0,2 мл овомуцина. Для контроля берут 0,2 мл фосфатного буфера и 0,2 мл овомуцина. После контакта вируса с овомуцином при 37 °С в течение 2,5 ч добавляют 0,1 мл ортофосфорной кислоты и 0,15 мл йодной кислоты и ставят на дополнительный контакт при 37 °С в течение 30 мин. Добавляют 0,2 мл арсенита натрия и энергично встряхивают до исчезновения желтой окраски. На этой стадии реакцию можно остановить и смесь выдержать до 18 ч при температуре 4 °С. Приливают 2,0 мл тиобарбитуровой кислоты и тщательно перемешивают. Смесь прогревают в кипящей водяной бане в течение 10 мин. Содержимое пробирок охлаждают в ледяной воде и добавляют 4,0 мл бутилового спирта. Тщательно встряхивают. Пробирки центрифугируют на холоде в течение 2-5 мин при 500-1000 об./мин. Слой бутилового спирта при этом должен стать прозрачным. Затем верхнюю фазу (бутиловый спирт) осторожно отбирают пипеткой и переносят в кювету для колориметрирования. Поглощение измеряют при длине волны 549 нм на спектрофотометре с использованием кювет толщиной 1 см. Для уравновешивания системы используют бутанол.
Реакция ингибирования нейраминидазной активности (РИНА)
Для идентификации нейраминидазы используют иммунные сыворотки против выделенных нейраминидазных антигенов или против вирусных рекомбинантов, гемагглютинин которых не родственен антигенам испытуемых штаммов.
Двукратные разведения сыворотки на физиологическом растворе в объеме 0,1 мл соединяют с равным объемом вируса в разведении, обеспечивающем оптическую плотность 0,4-0,8. Нейтрализацию проводят в течение 1 ч при температуре 18-22 °С. Затем проводят операции так же, как для определения активности нейраминидазы. Одновременно ставят контроль используемой дозы (две пробы). Титр сыворотки определяют как разведение сыворотки, при котором достигается 50%-ное снижение ферментативной активности.
Реактивы
0,2 М фосфатный буфер рН 6,0:
- растворяют 7,16 г Na HPO
HPO ·12H
·12H O в 100 мл бидистиллированной воды, рН 9,0;
O в 100 мл бидистиллированной воды, рН 9,0;
- растворяют 2,72 г KН РО
РО в 100 мл бидистиллированной воды, рН 4,92;
в 100 мл бидистиллированной воды, рН 4,92;
- к 100 мл KН РО
РО добавляют 10 мл Na
добавляют 10 мл Na HPO
HPO ·12H
·12H O, pH 6,0.
O, pH 6,0.
0,025 N йодная кислота: 570 г HJO растворяют в 100 мл H
растворяют в 100 мл H O.
O.
Ортофосфорная кислота (готовая, 85%).
2%-ный раствор арсенита натрия: 2 г NaAsO в 0,1 N H
в 0,1 N H SO
SO +1,42 г Na
+1,42 г Na SO
SO .
.
Тиобарбитуровая кислота
Растворяют 1,2 г тиобарбитуровой кислоты, 14,2 г безводного сульфата натрия в 200 мл дистиллированной воды при нагревании в кипящей водяной бане.
Бутиловый спирт
Растворяют 5 мл концентрированной соляной кислоты в 100 мл бутилового спирта. Готовят в день проведения реакции.
Овомуцин.
10. Метод определения иммуногенности на мышах
Для определения антигенной активности (иммуногенности) шести белым мышам однократно внутрибрюшинно вводят по 0,6 мл препарата, содержащего два антигена: A(H3N2) и A(H1N1), и по 0,9 мл препарата, содержащего три антигена: A(H3N2), A(H1N1) и В. Через 10 сут мышей обескровливают, сыворотки ставят в РТГА с гомологичными (ингибиторорезистентными) вирусами по методу, изложенному выше.
Средний геометрический титр сывороток должен быть не ниже 1:80 к каждому штамму.
Примечание: при постановке РТГА в качестве контроля необходимо включить в процедуру смесь сывороток от 2-3 неиммунных мышей.
11. Метод определения эффективности инактивации вируса гриппа
Определение отсутствия живого вируса проводят путем заражения 10 куриных эмбрионов (9-11-дневных) по 0,2 мл препарата в аллантоисную полость. Через 48 ч - для вируса гриппа типа А и через 72 ч - для вируса гриппа типа В инкубации эмбрионов в термостате при 35-37 °С аллантоисную жидкость проверяют на наличие гемагглютининов с эритроцитами петухов (1%-ная суспензия). Не менее 7 из 10 куриных эмбрионов должны остаться живыми. Собирают по 0,5 мл аллантоисной жидкости из каждого эмбриона, объединяя жидкость от всех групп. Затем заражают по 0,2 мл неразведенной смеси аллантоисной жидкости 10 эмбрионов. Эмбрионы инкубируют при тех же условиях, после чего определяют наличие гемагглютининов аллантоисной жидкости после второго пассажа. Результаты реакции после 2-го пассажа должны быть отрицательными.
12. Метод проверки реактогенности инактивированных гриппозных вакцин
(для людей)
Контролю подлежат первые три серии препарата из антигенно актуального штамма; в дальнейшем, при отсутствии смены штамма, - не менее трех серий в год.
Серию вакцины испытывают на той же группе людей численностью 30 человек в возрасте 18-55 лет, на которой контролируют иммуногенность. Добровольцам, отобранным в соответствии с инструкцией по применению препарата, вводят прививочную дозу вакцины методом, предусмотренным инструкцией.
Если препарат предназначен только для детей, испытание его реактогенности проводят согласно соответствующей инструкции на детях прививаемого возраста; при наличии данных проверки реактогенности штамма (штаммов) - на взрослых добровольцах.
Наблюдение за привитыми проводят в течение 5 сут. Ежедневно измеряют температуру и регистрируют общие и местные реакции. Полученные данные вносят в протокол контроля реактогенности (табл.1). В протоколе отмечают также все необычные реакции, в том числе аллергического характера, выявленные в течение периода наблюдения.
Таблица 1
Протокол контроля реактогенности*
|
Препарат | ||||||||||||||||||||
|
Серия |
Дата вакцинации | |||||||||||||||||||
|
N п/п |
Ф., И., О. |
Возраст |
Температурная реакция |
Местная реакция | ||||||||||||||||
|
до вакц. |
гиперемия |
инфильтрат | ||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
1 |
2 |
3 |
4 |
5 |
1 |
2 |
3 |
4 |
5 | ||||||
|
|
|
|
||||||||||||||||||
|
|
|
|
||||||||||||||||||
|
|
|
|
||||||||||||||||||
* В графах протокола проставляют величины температурной реакции и диаметр гиперемии (инфильтрата) при местной реакции в мм в дни наблюдения или отсутствие местной реакции (-).
Общая реакция может наблюдаться у части привитых и выражаться в недомогании и подъеме температуры; местная реакция - в покраснении, легкой отечности и развитии инфильтратов.
Наличие температуры до 37,5 °С включительно расценивают как слабую реакцию, от 37,6 до 38,5 °С включительно - как среднюю, от 38,6 °С и выше - как сильную. Длительность температурной реакции не должна превышать 3 сут.
Красноту без инфильтрата диаметром до 50,0 мм на месте прививки или инфильтрат диаметром до 25,0 мм расценивают как слабую местную реакцию, красноту диаметром более 50,0 мм или инфильтрат диаметром 26,0-50,0 мм - как среднюю, инфильтрат более 50,0 мм в диаметре - как сильную местную реакцию. Местные реакции угасают обычно в течение 4-5 сут.
Серию вакцины считают реактогенной, если средние или сильные местные реакции или наличие температуры выше 37,5 °С длительностью более 3 сут будут зарегистрированы более чем у одного из 30 привитых.
Изученные серии препарата и протоколы контроля реактогенности высылают в национальный орган контроля (ГИСК им. Л.А.Тарасевича).
При несоответствии требованиям по реактогенности серия вакцины не подлежит выпуску. В таком случае контролируют следующие 3 серии вакцины. При несоответствии одной из серий требованиям по реактогенности вопрос о дальнейшем применении препарата решает национальный орган контроля (ГИСК им. Л.А.Тарасовича).
13. Метод проверки иммуногенности инактивированных гриппозных вакцин
(для людей)
Контролю подлежат первые три серии препарата из нового штамма; в дальнейшем, при отсутствии смены штамма, - не менее трех серий в год.
Иммуногенность исследуют на той же группе лиц, на которой контролируют реактогенность. Исходный титр антител должен быть не выше 1:20.
До вакцинации или в день прививки у людей берут кровь из пальца в количестве 0,5-1,0 мл. Вторую пробу крови берут через 2-3 нед после иммунизации. Парные сыворотки хранят при температуре (4±2) °С, а затем исследуют в РТГА по методу, изложенному выше.
Вакцина должна вызывать прирост гомологичных антител в крови в 4 и более раз у 70% после однократного введения вакцины типа А и у 60% - вакцины типа В.
При несоответствии требованиям по иммуногенности контролируют следующие 3 серии вакцины. При несоответствии одной из серий требованиям по иммуногенности вопрос о дальнейшем применении препарата решает национальный орган контроля (ГИСК им. Л.А.Тарасевича).
14. Метод проверки реактогенности живых гриппозных вакцин и вакцинных штаммов
(для людей)
Контролю подлежат первые три серии препарата, в дальнейшем, при отсутствии смены штамма, - не менее трех серий в год.
Серию вакцины испытывают на той же группе людей, численностью 50 человек, на которой контролируют иммуногенность.
Если препарат предназначен для детей, испытание его реактогенности проводят согласно соответствующей инструкции на детях прививаемого возраста поэтапно: в первую очередь - на лицах подросткового возраста (14-15 лет), затем - на детях дошкольного возраста (3-6 лет), в связи с чем следует предусмотреть две равноценные группы (по 25 человек соответствующего возраста) на серию.
Лицам, отобранным в соответствии с инструкцией по применению препарата, вводят прививочную дозу вакцины методом, предусмотренным инструкцией.
Наблюдение за привитыми ведут в течение 5 сут. Ежедневно измеряют температуру и регистрируют общие и местные реакции. Полученные данные вносят в протокол контроля реактогенности (табл.2). В протоколе отмечают также все необычные реакции, в том числе аллергического характера, выявленные в течение периода наблюдения.
Таблица 2
Протокол контроля реактогенности*
|
Препарат | ||||||||||||
|
Серия |
Дата вакцинации | |||||||||||
|
N |
Ф., И., О. |
Возраст |
Температурная реакция | |||||||||
|
До вакц.
|
1 |
2 |
3 |
4 |
5 | |||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
* В графах протокола проставляют величины температурной реакции у привитых в дни наблюдения.
Общая реакция может наблюдаться у части привитых и выражаться в недомогании и подъеме температуры; могут развиться легкие катаральные явления со стороны верхних дыхательных путей. Указанные явления по контакту здоровым лицам не передаются.
Наличие температуры до 37,5 °С включительно расценивают как слабую реакцию, от 37,6 до 38,5 °С включительно - как среднюю, от 38,6 °С и выше - как сильную. Длительность температурных реакций и катаральных явлений, связанных с вакцинацией, не должна превышать 3 сут.
Красноту без инфильтрата диаметром до 50,0 мм на месте прививки или инфильтрат диаметром до 25,0 мм расценивают как слабую местную реакцию, красноту диаметром более 50,0 мм или инфильтрат диаметром 26,0-50,0 мм - как среднюю, инфильтрат более 50,0 мм в диаметре - как сильную местную реакцию. Местные реакции угасают обычно в течение 4-5 сут.
Серию вакцины считают реактогенной, если средние или сильные местные реакции или катаральные явления длительностью более 3 сут будут зарегистрированы более чем у одного из 50 привитых.
Изученные серии препарата и протоколы контроля реактогенности высылают в национальный орган контроля (ГИСК им. Л.А.Тарасевича).
При несоответствии требованиям по реактогенности серия вакцины не подлежит выпуску. В таком случае контролируют следующие 3 серии вакцины. При несоответствии одной из серий требованиям по реактогенности вопрос о дальнейшем применении препарата решает национальный орган контроля (ГИСК им. Л.А.Тарасовича).
Примечание. В случае необходимости формируют контрольную группу, которой вводят плацебо (например, дистиллированную или кипяченую воду). Формирование обеих групп проводят в одних и тех же коллективах методом случайной выборки (единица выборки - человек). Привитых контрольной группы наблюдают в те же сроки и с соблюдением тех же требований, что и группы привитых. Показатель реактогенности вакцины вычисляют по сопоставлению частоты температурных реакций у привитых и в контрольной группе.
15. Метод проверки иммуногенности живых гриппозных вакцин
и вакцинных штаммов (для людей)
Контролю подлежат первые три серии препарата из нового штамма, в дальнейшем, при отсутствии смены штамма, - не менее трех серий в год.
Иммуногенность исследуют на той же группе лиц, на которой контролируют реактогенность. Исходный титр антител должен быть не выше 1:16.
До вакцинации или в день прививки у людей берут кровь из пальца в количестве 0,5-1,0 мл. Вторую пробу крови берут через 2-3 нед после иммунизации. Парные сыворотки хранят при температуре (4±2) °С, а затем исследуют в РТГА по методу, изложенному выше.
Вакцинный штамм должен вызывать прирост гомологичных антител в крови в 4 и более раз у не менее чем 70% после двукратного или 50% после однократного введения вакцины типа А и у не менее чем 50% после двукратного и 40% после однократного введения вакцины типа В.
Вакцина должна вызывать прирост гомологичных антител в крови в 4 и более раз у не менее чем 60% после двукратного введения вакцины типа А и 40% после двукратного введения вакцины типа В.
При несоответствии требованиям по иммуногенности серия вакцины не подлежит выпуску. В таком случае контролируют следующие 3 серии. При несоответствии одной из серий требованиям по иммуногенности вопрос о дальнейшем применении препарата решает национальный орган контроля (ГИСК им. Л.А.Тарасовича).
Библиографические данные
1. Об иммунопрофилактике инфекционных болезней: Закон РФ N 157-ФЗ от 17 сентября 1998 г.
2. Методы контроля медицинских иммунобиологических препаратов, вводимых людям: Методические указания по методам контроля МУК 4.1/4.2.588-96.
3. О подготовке новых вакцинных производственных и диагностических штаммов вируса гриппа и их внедрение в производство вакцин и диагностических препаратов Минздрава России и Российской академии медицинских наук: Приказ Минздрава России N 156/29 от 07.05.98.
4. Государственный стандарт качества лекарственных средств: ОСТ, 2001.
Приложение 1
Термины и определения
Медицинские иммунобиологические препараты (МИБП) - вакцины, анатоксины, иммуноглобулины, сыворотки, аллергены, эубиотики и другие лекарственные препараты, предназначенные для иммунопрофилактики, иммунотерапии и иммунодиагностики инфекционных заболеваний и аллергических состояний.
Качество МИБП - совокупность свойств продукции, обусловливающих ее способность удовлетворять определенные потребности в соответствии с ее назначением.
Готовая серия препарата - совокупность емкостей, полученных из одного готового к розливу полуфабриката, разлитых из одной емкости и, в случае лиофильной сушки, высушенных в одинаковых условиях.
Оценка результатов (учет реакции) - определение положительного или отрицательного результата.
Разведение - величина, указывающая во сколько раз был разведен препарат, антиген, сыворотка в отношении исходного.
Титр - величина, обратная разведению, указывающая на завершение реакции.
ЭИД - обозначение инфекционной активности вируса в эмбриональных инфекционных единицах.
- обозначение инфекционной активности вируса в эмбриональных инфекционных единицах.
ГАЕ или АЕ - гемагглютинирующая или агглютинирующая единица, условно принимаемая за точку отсчета.

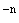
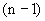 , 66
, 66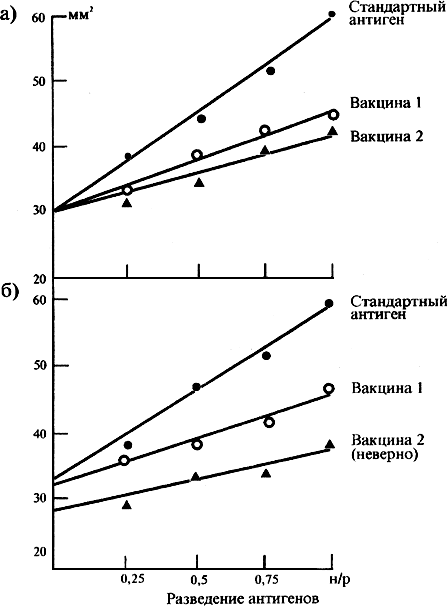
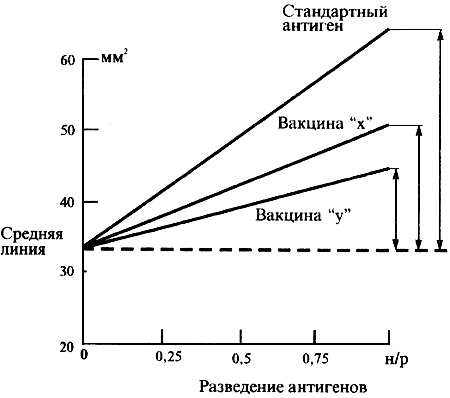
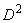 от разведений раствора ОА и испытуемых препаратов I и II
от разведений раствора ОА и испытуемых препаратов I и II Краснодар стал лидером среди миллионников по скидкам на вторичку в первом...
Краснодар стал лидером среди миллионников по скидкам на вторичку в первом...  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов