- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
ГОСТ 10444.2-94
Группа Н09
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Методы выявления и определения количества
Staphylococcus aureus
Food products. Methods for detection and quantity determination
of Staphylococcus aureus
МКС 07.100.30
ОКСТУ 9109
Дата введения 1996-01-01
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским институтом консервной и овощесушильной промышленности (ВНИИКОП) и Техническим комитетом по стандартизации ТК 93 "Продукты переработки плодов и овощей"
ВНЕСЕН Госстандартом России
2 ПРИНЯТ Межгосударственным Советом по стандартизации, метрологии и сертификации (протокол N 6 от 21 октября 1994 г.)
За принятие проголосовали:
|
Наименование государства |
Наименование национального органа по стандартизации |
|
Азербайджанская Республика |
Азгосстандарт |
|
Республика Белоруссия |
Госстандарт Белоруссии |
|
Республика Армения |
Армгосстандарт |
|
Грузия |
Грузстандарт |
|
Республика Казахстан |
Госстандарт Республики Казахстан |
|
Киргизская Республика |
Киргизстандарт |
|
Российская Федерация |
Госстандарт России |
|
Республика Молдова |
Молдовастандарт |
|
Республика Узбекистан |
Узгосстандарт |
|
Украина |
Госстандарт Украины |
3 Настоящий стандарт представляет собой полный аутентичный текст ИСО 6888-83 "Общее руководство по определению Staphylococcus aureus. Метод подсчета колоний" в части определения количества Staphylococcus aureus и содержит дополнительные требования, отвечающие потребности экономики страны
4 Постановлением Государственного комитета Российской Федерации по стандартизации, метрологии и сертификации от 21 февраля 1995 г. N 76 ГОСТ 10444.2-94 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1 января 1996 г.
5 ВЗАМЕН ГОСТ 10444.2-75
6 ПЕРЕИЗДАНИЕ
1 ОБЛАСТЬ ПРИМЕНЕНИЯ
Настоящий стандарт распространяется на пищевые продукты, кроме молока и молочных продуктов, и устанавливает методы выявления и определения количества Staphylococcus aureus (S. aureus) посевом: в жидкую селективную среду (с предварительным обогащением) и на агаризованные селективно-диагностические среды.
Метод выявления S. aureus посевом в жидкую селективную среду предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 150 или в 1 см жидкого продукта менее 15 колониеобразующих единиц (КОЕ) S. aureus.
жидкого продукта менее 15 колониеобразующих единиц (КОЕ) S. aureus.
Метод выявления S. aureus посевом на агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 150 или в 1 см жидкого продукта более 15 КОЕ S. aureus.
жидкого продукта более 15 КОЕ S. aureus.
Метод определения наиболее вероятного числа (НВЧ) посевом в жидкую селективную среду предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 1500 или в 1 см жидкого продукта менее 150 КОЕ S. aureus.
жидкого продукта менее 150 КОЕ S. aureus.
Метод определения количества S. aureus посевом на агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 1500 или в 1 см жидкого продукта более 150 КОЕ S. aureus.
жидкого продукта более 150 КОЕ S. aureus.
2 НОРМАТИВНЫЕ ССЫЛКИ
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
ГОСТ 24104-88* Весы лабораторные общего назначения и образцовые. Общие технические условия
______________
* С 01.07.2002 г. вводится в действие ГОСТ 24104-2001.
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
3 СУЩНОСТЬ МЕТОДОВ
Методы выявления и определения НВЧ S. aureus посевом с предварительным обогащением основаны на высеве навески продукта и (или) разведении навески продукта в жидкую селективную среду, инкубировании посевов, пересеве культуральной жидкости на поверхность агаризованной селективно-диагностической среды, подтверждении по биохимическим признакам принадлежности выделенных характерных колоний к S. aureus.
Методы выявления и определения количества S. aureus посевом на агаризованные селективно-диагностические среды основаны на высеве навески продукта или разведения навески продукта на агаризованную селективно-диагностическую среду, инкубировании посевов, подсчете количества характерных колоний (при определении количества S. aureus), подтверждении по биохимическим признакам принадлежности выделенных характерных колоний к S. aureus.
4 ОТБОР И ПОДГОТОВКА ПРОБ
Отбор и подготовка проб - по ГОСТ 26668, ГОСТ 26669 или по нормативно-технической документации на анализируемый продукт.
5 АППАРАТУРА, МАТЕРИАЛЫ, РЕАКТИВЫ
Для проведения анализа применяют аппаратуру, материалы и реактивы по ГОСТ 10444.1, а также указанные ниже:
весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 24104 с наибольшим пределом взвешивания 200 г, 2-го класса точности (для взвешивания реактивов);
весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 24104 с наибольшим пределом взвешивания 1 кг, 4-го класса точности (для взвешивания продукта);
лупа с увеличением 5-10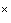 ;
;
микроскоп световой биологический с увеличением 900-1000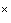 ;
;
петля бактериологическая;
стекла предметные по ГОСТ 9284;
стекла покровные по ГОСТ 6672;
термостат с диапазоном рабочих температур 28-55 °С, позволяющий поддерживать заданную температуру с допустимой погрешностью ±1 °С;
дезоксирибонуклеиновая кислота (ДНК);
кальций хлористый;
сухая плазма кроличья;
толуидин синий "С";
трисаминометан.
6 ПОДГОТОВКА К АНАЛИЗУ
6.1 Приготовление растворов и реактивов
6.1.1 Физиологический раствор готовят по ГОСТ 10444.1.
6.1.2 Раствор лимоннокислого натрия концентрации 50 г/дм : 5,0 г лимоннокислого натрия переносят в колбу вместимостью 100 см
: 5,0 г лимоннокислого натрия переносят в колбу вместимостью 100 см , растворяют в дистиллированной воде. Раствор доводят до метки, разливают по колбам или пробиркам и стерилизуют при температуре (121±1) °С в течение 20 мин.
, растворяют в дистиллированной воде. Раствор доводят до метки, разливают по колбам или пробиркам и стерилизуют при температуре (121±1) °С в течение 20 мин.
6.1.3 Раствор хлористого кальция концентрации 1 г/дм : 0,1 г хлористого кальция переносят в колбу вместимостью 100 см
: 0,1 г хлористого кальция переносят в колбу вместимостью 100 см , растворяют в дистиллированной воде. Раствор доводят до метки.
, растворяют в дистиллированной воде. Раствор доводят до метки.
6.1.4 Раствор с объемной долей перекиси водорода 3% готовят по ГОСТ 10444.1, п.4.33.
6.1.5 Растворы и реактивы для окраски по Граму готовят по ГОСТ 10444.1, п.4.25.
6.1.6 Раствор толуидина синего "С" концентрации 10 г/дм : 1,0 г толуидина синего "С" переносят в колбу вместимостью 100 см
: 1,0 г толуидина синего "С" переносят в колбу вместимостью 100 см , растворяют в дистиллированной воде, доводят дистиллированной водой до метки.
, растворяют в дистиллированной воде, доводят дистиллированной водой до метки.
6.1.7 Цитратная плазма крови кролика: свежеполученную в асептических условиях из сердца кровь кролика тщательно смешивают в соотношении 4:1 со стерильным раствором лимоннокислого натрия, приготовленного по п.6.1.2. Полученную смесь центрифугируют в течение 15 мин при 3000 об/мин или отстаивают на холоде, затем плазму отсасывают пипеткой и разводят ее из расчета 1 см плазмы на 4 см
плазмы на 4 см физиологического раствора. Разведенную плазму по 0,5 см
физиологического раствора. Разведенную плазму по 0,5 см разливают в стерильные пробирки.
разливают в стерильные пробирки.
6.2 Приготовление питательных сред
6.2.1 Байрд-Паркер агар готовят по ГОСТ 10444.1, п.5.1.
6.2.2 Молочно-солевой агар готовят по ГОСТ 10444.1, п.5.4.
6.2.3 Мясо-пептонный агар (бульон) готовят по ГОСТ 10444.1, п.5.12.
6.2.4 Солевой или сахарный бульон: 6,0 г хлористого натрия или 1,0 г глюкозы растворяют в 100 см мясо-пептонного бульона, приготовленного по ГОСТ 10444.1, устанавливают рН так, чтобы после стерилизации он составлял при температуре 25 °С 6,9±0,1. Бульон разливают в колбы или пробирки и стерилизуют при температуре (121±1) °С в течение 15 мин.
мясо-пептонного бульона, приготовленного по ГОСТ 10444.1, устанавливают рН так, чтобы после стерилизации он составлял при температуре 25 °С 6,9±0,1. Бульон разливают в колбы или пробирки и стерилизуют при температуре (121±1) °С в течение 15 мин.
6.2.5 Среду из сухого питательного агара готовят по прописи, указанной на этикетке.
6.2.6 Среда с ДНК: растворяют в 1000 см дистиллированной воды 6,1 трисаминометана и доводят по ГОСТ 10444.1 рН раствора до 9,0±0,1.
дистиллированной воды 6,1 трисаминометана и доводят по ГОСТ 10444.1 рН раствора до 9,0±0,1.
К раствору добавляют 0,3 г ДНК, 10,0 г хлористого натрия, 1,1 см раствора хлористого кальция концентрации 1 г/дм
раствора хлористого кальция концентрации 1 г/дм , 15,0 г агара, нагревают до полного расплавления агара. К охлажденной до 65-55 °С среде добавляют 9,2 см
, 15,0 г агара, нагревают до полного расплавления агара. К охлажденной до 65-55 °С среде добавляют 9,2 см раствора толуидина синего, приготовленного по п.6.1.6, тщательно перемешивают и разливают по стерильным чашкам Петри. Допускается хранение среды при температуре (6±2) °С не более 7 сут.
раствора толуидина синего, приготовленного по п.6.1.6, тщательно перемешивают и разливают по стерильным чашкам Петри. Допускается хранение среды при температуре (6±2) °С не более 7 сут.
6.2.7 Яично-желточно-азидный агар готовят по ГОСТ 10444.1, п.5.7.
6.2.8 Яично-желточно-солевой агар готовят по ГОСТ 10444.1, п.5.8.
6.2.9 Среда Гисса с мальтозой выпускается в сухом виде и готовится по прописи, указанной на этикетке.
7 ПРОВЕДЕНИЕ АНАЛИЗА
7.1 Посевы для определения количества S. aureus
7.1.1 Из навески продукта готовят исходное и ряд десятикратных разведений по ГОСТ 26669 так, чтобы можно было определить в 1 г (см ) продукта предполагаемое количество S. aureus или их количество, указанное в нормативно-технической документации на анализируемый продукт.
) продукта предполагаемое количество S. aureus или их количество, указанное в нормативно-технической документации на анализируемый продукт.
7.1.2 При определении количества S. aureus посевом на агаризованные селективно-диагностические среды по 0,1 или 0,2 см продукта или его разведения наносят на поверхность одной из сред, указанных в п.6.2: Байрд-Паркер агара, молочно-солевого агара, яично-желточно-азидного агара или яично-желточно-солевого агара. Преимущественно для посева используют Байрд-Паркер агар. Для посева продукта или каждого его разведения используют две параллельные чашки Петри со средой. Подготовку чашек Петри со средой к посеву и посев проводят по ГОСТ 26670.
продукта или его разведения наносят на поверхность одной из сред, указанных в п.6.2: Байрд-Паркер агара, молочно-солевого агара, яично-желточно-азидного агара или яично-желточно-солевого агара. Преимущественно для посева используют Байрд-Паркер агар. Для посева продукта или каждого его разведения используют две параллельные чашки Петри со средой. Подготовку чашек Петри со средой к посеву и посев проводят по ГОСТ 26670.
7.1.3 При определении количества S. aureus по методу НВЧ высевают три последовательные навески продукта и (или) его разведения, отличающиеся по количеству продукта в них в 10 раз.
Каждую навеску продукта и (или) его разведение в трехкратной повторности высевают в колбы или пробирки с одной из сред, приготовленных по п.6.2.4.
Соотношение между количеством высеваемого продукта или его разведения и питательной средой 1:6 или 1:7.
7.2 Посевы для выявления S. aureus в определенной навеске продукта
7.2.1 При выявлении S. aureus в определенной навеске продукта или его эквивалентном разведении с предварительным обогащением эту навеску или разведение вносят в одну из питательных сред, приготовленных по п.6.2.4.
Соотношение между количеством высеваемого продукта или его эквивалентным разведением и питательной средой 1:6 или 1:7.
7.2.2 При выявлении S. aureus в определенной навеске продукта или его эквивалентном разведении без предварительного обогащения эту навеску или разведение в количестве 0,1 или 0,2 см наносят на поверхность одной из селективно-диагностических сред, как указано в п.7.1.2.
наносят на поверхность одной из селективно-диагностических сред, как указано в п.7.1.2.
7.3 При посеве жидких высококислотных продуктов для предотвращения снижения рН сахарного или солевого бульона на 0,5 и более рН продукта перед посевом доводят до 7,0±0,2.
При посеве твердых высококислотных продуктов доводят рН до 7,0±0,2 в посевах, или при приготовлении сахарного или солевого бульона рН устанавливают выше указанного в п.6.2.4, с учетом его последующего снижения при внесении продукта. Если высевают не твердый продукт, а его исходное разведение, то рН доводят в исходном разведении.
Доведение рН проводят асептически с помощью стерильных растворов гидроокиси натрия и соляной или лимонной кислоты, приготовленных по ГОСТ 10444.1. Количество добавляемого раствора гидроокиси натрия устанавливают опытным путем.
7.4 При анализе пищевых продуктов с большим содержанием NaCI проводят посев продукта или его исходного разведения в сахарный бульон, во всех других случаях для посева используют солевой бульон.
7.5 Посевы по пп.7.1 и 7.2 на агаризованных жидких средах инкубируют при температуре (36±1) °С в течение 48 ч. Чашки Петри с посевами инкубируют дном вверх.
7.6 Для подтверждения роста микроорганизмов в жидких средах из них после инкубирования по п.7.5 делают пересевы петлей по ГОСТ 26670 на поверхность одной из селективно-диагностических сред, указанных в п.7.1.2. Посевы инкубируют при температуре (36±1) °С в течение 24-48 ч.
7.7 Посевы по пп.7.1.2, 7.2.2, 7.6 на агаризованных средах после инкубирования просматривают и отмечают рост характерных колоний.
На Байрд-Паркер агаре колонии S. aureus выглядят черными, блестящими, 1,5-2,5 мм в диаметре, окружены зоной лецитиназной активности.
На молочно-солевом агаре колонии S. aureus круглые, слегка возвышающиеся над поверхностью агара, с ровными краями, диаметром 2-2,5 мм, окрашены в желтый, золотистый, лимонно-желтый, кремовый, палевый или белый цвет.
На яично-желточно-азидном и яично-желточно-солевом агаре колонии S. aureus окружены зоной лецитиназной активности.
В посевах по п.7.1.2 отбирают чашки, на которых выросло от 15 до 150 характерных колоний, и подсчитывают их.
В посевах по пп.7.2.2 и 7.6 отмечают рост характерных колоний без подсчета их количества.
7.8 Подтверждение принадлежности характерных колоний к S. аureus
7.8.1 Для подтверждения принадлежности характерных колоний к S. aureus отбирают не менее 5 колоний (если при посеве по пп.7.2.2 и 7.6 выросло менее 5 колоний, то отбирают все выросшие колонии) и пересевают на поверхность одной из скошенных питательных сред: мясо-пептонного агара, приготовленного по п.6.2.3, или среды из сухого питательного агара, приготовленного по п.6.2.5.
Посевы инкубируют при температуре (36±1) °С в течение 24 ч.
У выросших микроорганизмов определяют отношение к окраске по Граму, способность коагулировать плазму крови кролика, образовывать каталазу и ферментировать мальтозу в анаэробных условиях.
7.8.2 Окраска по Граму
Из культур, выросших как указано в п.7.8.1, готовят мазки, окрашивают их по Граму (по ГОСТ 30425) и микроскопируют.
S. aureus положительно окрашивается по Граму, имеет шарообразную форму, клетки диаметром 0,6-1,0 мкм, располагающиеся чаще (но не всегда) в виде скоплений, напоминающих гроздья винограда.
7.8.3 Определение каталазы
Способность выросших микроорганизмов образовывать каталазу определяют по ГОСТ 30425. S. aureus образует каталазу.
7.8.4 Определение способности коагулировать плазму крови кролика
Способность коагулировать плазму крови кролика определяют у микроорганизмов, окрашивающихся положительно и образующих каталазу.
К плазме крови кролика, приготовленной и разлитой по пробиркам по п.6.1.7, добавляют по одной петле испытуемых культур, оставляя одну пробирку с разведенной плазмой в качестве контроля незасеянной.
Внесенную культуру тщательно размешивают и помещают в термостат при температуре (36±1) °С. Если через 6 ч коагуляции плазмы не произошло, то пробирки оставляют при температуре (30±1) °С на 24 ч. Если и через 24 ч плазма не скоагулировала, то испытуемую культуру стафилококка относят к коагулазоотрицательной.
При определении коагулазной активности реакцию считают отрицательной в тех случаях, когда в плазме не образуются отдельные нити или сгустки, или в тех случаях, когда в плазме появились отдельные нити (реакцию плазмокоагуляции оценивают на один плюс).
Реакцию считают положительной, если:
в плазме образовался небольшой компактный сгусток (реакцию оценивают на два плюса);
в плазме образовался большой уплотненный сгусток (реакцию оценивают на три плюса);
плазма вся скоагулировала, сгусток не меняет своего положения при перевертывании пробирки (реакцию оценивают на четыре плюса).
С целью ускорения выявления коагулазоположительных стафилококков вместо суточных культур, выросших на агаризованных средах, допускается применять культуру, выращенную на мясо-пептонном бульоне, и использовать ее для постановки реакции плазмокоагуляции спустя 2 ч после появления видимых признаков роста микроорганизмов. При постановке реакции плазмокоагуляции к 0,5 см разведенной плазмы добавляют две капли суточной бульонной культуры. Учет результатов коагуляции плазмы в данном случае проводят в сроки от 30 мин до 2-4 ч. Оценка степени коагулирования плазмы такая же, как описано выше.
разведенной плазмы добавляют две капли суточной бульонной культуры. Учет результатов коагуляции плазмы в данном случае проводят в сроки от 30 мин до 2-4 ч. Оценка степени коагулирования плазмы такая же, как описано выше.
При использовании сухой кроличьей цитратной плазмы руководствуются наставлением по ее применению.
7.8.5 Определение ферментации мальтозы в анаэробных условиях
Способность ферментации мальтозы в анаэробных условиях определяют с целью дифференциации S. aureus от других коагулазоположительных видов S. intermedius и S. hyicus subsp. hyicus.
Для определения ферментации мальтозы в анаэробных условиях культуры, подлежащие исследованию, высевают уколом петлей в среду Гисса с мальтозой, приготовленную по п.6.2.9. На поверхность среды наслаивают голодный агар, приготовленный по ГОСТ 10444.1 п.4.1 высотой 2-2,5 см.
Посевы инкубируют при температуре (36±1) °С в течение 48 ч.
При ферментации мальтозы в анаэробных условиях с образованием кислоты цвет среды Гисса изменяется.
S. aureus - ферментирует мальтозу в анаэробных условиях, S. intermedius - слабо ферментирует мальтозу в анаэробных условиях, S. hyicus subsp. hyicus - не ферментирует мальтозу в анаэробных условиях.
7.9 Интерпретация результатов подтверждения принадлежности характерных колоний к S. aureus
Если при испытании характерных колоний в них обнаружены грамположительные кокки, способные коагулировать плазму крови, образующие каталазу, ферментирующие мальтозу в анаэробных условиях, то считают, что выявленные микроорганизмы относятся к S. aureus.
7.10 Определение термостабильной нуклеазы
Способность выявленного S. aureus образовывать термостабильную нуклеазу устанавливают при необходимости, для определения его потенциальной энтеротоксигенности.
Для определения термостабильной нуклеазы в среде, приготовленной по п.6.2.6 и разлитой по стерильным чашкам Петри, вырезают асептически колодцы диаметром не более 4 мм, расстояние между колодцами должно быть не менее 7-8 мм. Культуры, выросшие на мясо-пептонном бульоне после инкубирования при температуре (36±1) °С в течение 24 ч, прогревают в кипящей водяной бане в течение 15 мин, охлаждают до комнатной температуры и вносят в приготовленные в среде колодцы пастеровской пипеткой по 1-2 капли. Засеянные чашки помещают в термостат при температуре (36±1) °С, результаты учитывают через 1, 2 и 5 ч. При наличии термостабильной нуклеазы появляется ярко розовая зона вокруг колодца на синем фоне среды.
Способность S. aureus образовывать термостабильную нуклеазу подтверждает его энтеротоксигенные свойства.
8 ОБРАБОТКА РЕЗУЛЬТАТОВ
8.1 Результаты оценивают по каждой пробе отдельно.
8.2 Оценка результатов посевов на жидкие среды:
при определении НВЧ S. aureus посевы считают положительными, если при последующем пересеве на агаризованные селективно-диагностические среды и подтверждении характерных колоний, выросших на этих средах, хотя бы в одной колонии будет обнаружен S. aureus. НВЧ S. aureus в 1 г (см ) продукта подсчитывают по количеству положительных посевов по ГОСТ 26670;
) продукта подсчитывают по количеству положительных посевов по ГОСТ 26670;
при выявлении S. aureus в определенной навеске продукта посевы считают положительными (то есть S. aureus выявлен в анализируемой навеске продукта), если при последующем пересеве на агаризованные селективно-диагностические среды и подтверждении характерных колоний, выросших на этих средах, хотя бы в одной колонии будет обнаружен S. aureus.
8.3 Оценка результатов посевов на агаризованные селективно-диагностические среды:
при выявлении S. aureus в определенной навеске продукта посевы считают положительными, если при подтверждении характерных колоний хотя бы в одной колонии будет обнаружен S. aureus;
при определении количества S. aureus в 1 г/см продукта подсчет числа характерных колоний (см. п.7.7) подлежит корректировке в зависимости от результатов подтверждения принадлежности этих колоний к S. aureus:
продукта подсчет числа характерных колоний (см. п.7.7) подлежит корректировке в зависимости от результатов подтверждения принадлежности этих колоний к S. aureus:
если при подтверждении характерных колоний в 80% случаев, то есть не менее чем в 4 из 5 колоний подтвержден рост S. aureus, то считают, что все характерные колонии принадлежат к S. aureus.
В остальных случаях количество характерных колоний (см. п.7.7), принадлежащих к S. aureus, определяют исходя из процентного отношения подтвержденных колоний к общему количеству характерных колоний, взятых для подтверждения
Пересчет количества S. aureus на 1 г (см ) продукта проводят по ГОСТ 26670.
) продукта проводят по ГОСТ 26670.
8.4 Результаты определения количества S. aureus в 1 г (см ) продукта и выявления его в определенной навеске продукта записывают по ГОСТ 26670.
) продукта и выявления его в определенной навеске продукта записывают по ГОСТ 26670.
Текст документа сверен по:
официальное издание
Консервы. Методы микробиологического анализа:
Сб. ГОСТов. - М.: ИПК Издательство стандартов, 2002

 Семейная выплата будет защищена от списания за долги
Семейная выплата будет защищена от списания за долги  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов