- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
ГОСТ 10444.9-88
Группа Н09
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Метод определения Clostridium perfringens
Food products.
Method of determination of Clostridium perfringens
ОКСТУ 9109
Дата введения 1990-01-01
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Государственным агропромышленным комитетом СССР
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 25.08.88 N 3020
3. В стандарт введен международный стандарт ИСО 7937 (1985)
4. ВЗАМЕН ГОСТ 10444.9-75
5. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначение НТД, на который дана ссылка |
Номер пункта |
|
2.1 | |
|
ГОСТ 6672-75 |
2.1 |
|
1.2 | |
|
ГОСТ 9284-75 |
2.1 |
|
1.2, 2.1, 3.2.3, 3.2.4, 3.2.7, 3.2.8, 3.2.9 | |
|
3.2.6, 4.2.5 | |
|
2.1 | |
|
1.1 | |
|
1.2 | |
|
3.1.1, 3.1.3, 4.1.2, 5.4 | |
|
1.1 | |
|
4.1.3, 4.2.1, 4.2.3 |
6. Ограничение срока действия снято по протоколу N 4-93 Межгосударственного Совета по стандартизации, метрологии и сертификации (ИУС 4-94)
7. ПЕРЕИЗДАНИЕ
Настоящий стандарт распространяется на пищевые продукты и устанавливает метод определения Clostridium perfringens.
Метод основан на выделении С. perfringens из колоний, полученных при глубинном посеве продукта, его разведения или культуральной жидкости в селективные среды. Принадлежность выделенных колоний к С. perfringens определяют по морфологическим и биохимическим свойствам. В зависимости от требований нормативно-технической документации подсчитывают количество или учитывают присутствие (отсутствие) С. perfringens в исследуемом продукте.
Метод предназначен для:
установления соответствия микробиологических показателей качества пищевого продукта требованиям нормативно-технической документации;
исследования продукта по санитарно-эпидемиологическим показаниям;
анализа микрофлоры посевов (культуральной жидкости), в которых обнаружены мезофильные анаэробные клостридии, при необходимости подтверждения присутствия в посевах С. perfringens.
1. ОТБОР И ПОДГОТОВКА ПРОБ
1.1. Отбор проб пищевых продуктов - по ГОСТ 26668, ГОСТ 26809.
1.2. Подготовка проб пищевых продуктов к анализу по ГОСТ 26669.
Консервы проверяют на герметичность по ГОСТ 8756.18.
Полные консервы, нормальные по внешнему виду, перед испытанием термостатируют при 30-37 °С в таре вместимостью до 1 дм включительно не менее 5 сут, в таре вместимостью свыше 1 дм
включительно не менее 5 сут, в таре вместимостью свыше 1 дм - не менее 7 сут.
- не менее 7 сут.
Пищевые продукты, в которых нормируется допустимое количество С. perfringens, термостатированию не подлежат.
Масса (объем) навески, предназначенной для приготовления гомогената продукта или исходного разведения - не менее (10,0±0,1) г (см ).
).
Исходные разведения продуктов с массовой долей NaCI более 5% готовят с использованием пептонной воды; исходные разведения мясных, молочных продуктов и молока готовят с использованием физиологического раствора. Для приготовления последующих десятикратных разведении используют пептонно-солевой раствор. Пептонную воду и пептонно-солевой раствор готовят по ГОСТ 26669, физиологический раствор - по ГОСТ 10444.1.
Из пробы пищевого продукта, в котором нормируется количество С. perfringens, или его исходного разведения готовят ряд разведений в соответствии с допустимым количеством С. perfringens, указанном в нормативно-технической документации на конкретный вид пищевого продукта. Культуральную жидкость разводят так, чтобы получить при высеве раздельные колонии.
2. АППАРАТУРА, МАТЕРИАЛЫ И РЕАКТИВЫ
2.1. Для проведения испытания применяют аппаратуру, материалы, реактивы по ГОСТ 10444.1, а также аппаратуру, материалы, реактивы, указанные ниже:
анаэростат или другое оборудование, обеспечивающее анаэробные условия культивирования;
весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 24104*, с наибольшим пределом взвешивания до 200 г и поверочной ценой деления не более 2 мг (для взвешивания реактивов);
_____________
* С 01.07.2002 г. вводится в действие ГОСТ 24104-2001.
весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 24104*, с наибольшим пределом взвешивания до 200 г и поверочной ценой деления не более 20 мг (для взвешивания продукта);
_____________
* С 01.07.2002 г. вводится в действие ГОСТ 24104-2001.
микроскоп световой биологический с приспособлением для фазовоконтрастного микроскопирования;
стекла покровные по ГОСТ 6672;
стекла предметные по ГОСТ 9284;
петлю бактериологическую;
термостат с диапазоном рабочих температур от 28 до 55 °С, позволяющий поддерживать заданную температуру с погрешностью ±1 °С;
кислоту 5-амино-2-нафтален сульфоновую;
галактозу;
квасцы железоаммонийные;
натрий сернистокислый;
натрий тиосульфит (Na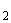 S
S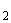 O
O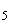 безводный);
безводный);
неомицина сульфат в таблетках по 0,25 г и 0,1 г;
неомицина сульфат во флаконах по 0,5 г (50000 ЕД);
полимиксин В сульфат во флаконах по 25 мг (250000 ЕД) и по 50 мг (500000 ЕД);
полимиксин М сульфат во флаконах по 500000 ЕД;
кислота сульфаниловая;
циклосерин в таблетках по 0,25 г;
феноловый красный, индикатор;
цинк - порошок по ГОСТ 3640;
цитрат аммонийного железа.
3. ПОДГОТОВКА К ИСПЫТАНИЮ
3.1. Приготовление растворов
3.1.1. Раствор массовой концентрации неомицина сульфата 50 г/дм : во флакон с 0,5 г неомицина сульфата (для инъекций) доливают до 10 см
: во флакон с 0,5 г неомицина сульфата (для инъекций) доливают до 10 см стерильную дистиллированную воду.
стерильную дистиллированную воду.
При приготовлении раствора массовой концентрации неомицина сульфата 10 г/дм из таблеток:
из таблеток:
2 таблетки по 0,25 г или 5 таблеток по 0,1 г растирают в ступке, порошок переносят в мерную посуду вместимостью 50 см , смывая дистиллированной водой, объем доводят до метки. Раствор стерилизуют методом мембранной фильтрации по ГОСТ 26670.
, смывая дистиллированной водой, объем доводят до метки. Раствор стерилизуют методом мембранной фильтрации по ГОСТ 26670.
3.1.2. Раствор массовой концентрации полимиксина В сульфата 2,5 и 5 г/дм или полимиксина М сульфата 5 г/дм
или полимиксина М сульфата 5 г/дм : во флакон с 25 мг или 50 мг полимиксина (для инъекций) вносят до 10 см
: во флакон с 25 мг или 50 мг полимиксина (для инъекций) вносят до 10 см стерильную дистиллированную воду, получая растворы массовых концентраций 2,5 и 5 г/дм
стерильную дистиллированную воду, получая растворы массовых концентраций 2,5 и 5 г/дм .
.
3.1.3. Раствор массовой концентрации циклосерина 40 г/дм : 4 таблетки циклосерина по 0,25 г растирают в ступке, порошок переносят в мерную посуду вместимостью 25 см
: 4 таблетки циклосерина по 0,25 г растирают в ступке, порошок переносят в мерную посуду вместимостью 25 см , смывая дистиллированной водой, объем доводят до метки.
, смывая дистиллированной водой, объем доводят до метки.
Раствор стерилизуют методом мембранной фильтрации по ГОСТ 26670.
3.2. Приготовление питательных сред
3.2.1. Агар триптозо-сульфит-циклосериновый: основу питательной среды готовят следующим образом: 15,0 г триптозы, 5,0 г ферментативного пептона, 25 см дрожжевого экстракта, 1,0 г безводного тиосульфита натрия, 1,0 г цитрата аммонийного железа, 20,0 г агара растворяют в 1 дм
дрожжевого экстракта, 1,0 г безводного тиосульфита натрия, 1,0 г цитрата аммонийного железа, 20,0 г агара растворяют в 1 дм кипящей дистиллированной воды. Устанавливают рН таким образом, чтобы после стерилизации он составлял при температуре 25 °С 7,6±0,1. Основу среды стерилизуют при температуре (121±1,0) °С в течение 20 мин и хранят при температуре (4±2) °С не более 14 сут.
кипящей дистиллированной воды. Устанавливают рН таким образом, чтобы после стерилизации он составлял при температуре 25 °С 7,6±0,1. Основу среды стерилизуют при температуре (121±1,0) °С в течение 20 мин и хранят при температуре (4±2) °С не более 14 сут.
К 100 см основы, расплавленной и охлажденной до 45-55 °С, добавляют непосредственно перед употреблением 1 см
основы, расплавленной и охлажденной до 45-55 °С, добавляют непосредственно перед употреблением 1 см раствора массовой концентрацией циклосерина 40 г/дм
раствора массовой концентрацией циклосерина 40 г/дм .
.
Допускается при отсутствии триптозы заменять ее равным количеством ферментативного пептона.
3.2.2. Агар сульфит-полимиксин-неомициновый; основу питательной среды готовят следующим образом: 17,0 г ферментативного пептона, 15 см дрожжевого экстракта, 5,0 г хлорида натрия, 1,0 г безводного тиосульфита натрия, 1,0 г цитрата аммонийного железа, 12,0-15,0 г агара добавляют к 1 дм
дрожжевого экстракта, 5,0 г хлорида натрия, 1,0 г безводного тиосульфита натрия, 1,0 г цитрата аммонийного железа, 12,0-15,0 г агара добавляют к 1 дм дистиллированной воды. Смесь, периодически перемешивая, подогревают до кипения и кипятят до полного растворения всех составных частей. Устанавливают рН таким образом, чтобы после стерилизации он соответствовал при температуре (25±1) °С 7,6±0,1. Стерилизуют при температуре (121±1) °С в течение 20 мин. Основу среды хранят при температуре (4±2) °С не более 14 сут.
дистиллированной воды. Смесь, периодически перемешивая, подогревают до кипения и кипятят до полного растворения всех составных частей. Устанавливают рН таким образом, чтобы после стерилизации он соответствовал при температуре (25±1) °С 7,6±0,1. Стерилизуют при температуре (121±1) °С в течение 20 мин. Основу среды хранят при температуре (4±2) °С не более 14 сут.
К 1 дм основы, расплавленной и охлажденной до 45-55 °С, непосредственно перед употреблением добавляют 1 см
основы, расплавленной и охлажденной до 45-55 °С, непосредственно перед употреблением добавляют 1 см раствора массовой концентрации неомицина сульфата 50 г/дм
раствора массовой концентрации неомицина сульфата 50 г/дм или 5 см
или 5 см раствора массовой концентрации неомицина сульфата 10 г/дм
раствора массовой концентрации неомицина сульфата 10 г/дм (50 мкг/см
(50 мкг/см основы среды) и 8 см
основы среды) и 8 см раствора массовой концентрации полимиксина 2,5 г/дм
раствора массовой концентрации полимиксина 2,5 г/дм или 4 см
или 4 см раствора массовой концентрацией полимиксина 5 г/дм
раствора массовой концентрацией полимиксина 5 г/дм (20 мкг/см
(20 мкг/см основы среды).
основы среды).
3.2.3. Среду Вильсон Блера, измененную для анаэробов, готовят по ГОСТ 10444.1.
3.2.4. Среду для анаэробов готовят по ГОСТ 10444.1.
3.2.5. Желатин-лактозная среда: 15,0 г триптозы или ферментативного пептона, 50 см дрожжевого экстракта, 120,0 г желатина, 5,0 г двузамещенного фосфорнокислого натрия растворяют в 1 дм
дрожжевого экстракта, 120,0 г желатина, 5,0 г двузамещенного фосфорнокислого натрия растворяют в 1 дм кипящей дистиллированной воды. Добавляют 10,0 г лактозы и 5 см
кипящей дистиллированной воды. Добавляют 10,0 г лактозы и 5 см 1%-ного раствора индикатора фенолового красного. Устанавливают рН таким образом, чтобы после стерилизации он соответствовал при температуре (25±1) °С 7,4±0,1. Разливают в пробирки по 10 см
1%-ного раствора индикатора фенолового красного. Устанавливают рН таким образом, чтобы после стерилизации он соответствовал при температуре (25±1) °С 7,4±0,1. Разливают в пробирки по 10 см и стерилизуют при температуре (121±1) °С в течение 15 мин. Хранят при температуре (4±2) °С не более 21 сут. Перед употреблением среду кипятят в течение 10 мин на водяной бане.
и стерилизуют при температуре (121±1) °С в течение 15 мин. Хранят при температуре (4±2) °С не более 21 сут. Перед употреблением среду кипятят в течение 10 мин на водяной бане.
3.2.6. Среда для изучения редукции нитратов и подвижности бактерий: 5,0 г галактозы, 5,0 г глицерина, 1,0 г нитрата калия (не содержащего нитрит), 2,5 г двузамещенного фосфорнокислого натрия (безводного), 3,0 г агара растворяют в 1 дм кипящего мясо-пептонного бульона. Устанавливают рН раствора таким образом, чтобы после стерилизации он соответствовал при температуре (25±1) °С 7,3±0,1. Разливают в пробирки по 10 см
кипящего мясо-пептонного бульона. Устанавливают рН раствора таким образом, чтобы после стерилизации он соответствовал при температуре (25±1) °С 7,3±0,1. Разливают в пробирки по 10 см и стерилизуют при температуре (121±1) °С в течение 20 мин. В готовой питательной среде контролируют по ГОСТ 10444.8 отсутствие нитритов.
и стерилизуют при температуре (121±1) °С в течение 20 мин. В готовой питательной среде контролируют по ГОСТ 10444.8 отсутствие нитритов.
Хранят при температуре (4±2) °С не более 28 сут. Перед употреблением среду кипятят в течение 10 мин в кипящей водяной бане и быстро охлаждают до комнатной температуры. Среда должна иметь студнеобразную консистенцию.
3.2.7. Среду Роберта готовят по ГОСТ 10444.1.
3.2.8. Молоко лакмусовое готовят по ГОСТ 10444.1.
3.2.9. Сахарный кровяной агар по Цейсслеру с антибиотиками: к 100 см сахарного кровяного агара по Цейсслеру, приготовленного по ГОСТ 10444.1, перед розливом по чашкам Петри добавляют 1 см
сахарного кровяного агара по Цейсслеру, приготовленного по ГОСТ 10444.1, перед розливом по чашкам Петри добавляют 1 см раствора массовой концентрации циклосерина 40 г/дм
раствора массовой концентрации циклосерина 40 г/дм или 0,5 см
или 0,5 см раствора массовой концентрацией неомицина сульфата 10 г/дм
раствора массовой концентрацией неомицина сульфата 10 г/дм .
.
Хранят при температуре (4±2) °С не более 3 сут.
4. ПРОВЕДЕНИЕ ИСПЫТАНИЯ
4.1. Выявление характерных колоний.
4.1.1. Для проведения испытания отбирают объем (1±0,1) см подготовленной пробы продукта, его разведения или разведения культуральной жидкости.
подготовленной пробы продукта, его разведения или разведения культуральной жидкости.
Допускается для получения раздельных колоний проводить посев культуральной жидкости петлей (штрихом) на поверхность питательной среды.
4.1.2. Подготовленную пробу продукта, его разведения или разведения культуральной жидкости высевают глубинным методом по ГОСТ 26670 параллельно в две чашки Петри. Посевы заливают триптозо-сульфит-циклосериновым или сульфит-полимиксин-неомициновым агаром, или сахарным кровяным агаром по Цейсслеру, или агаром Вильсон-Блера. Содержимое чашек Петри быстро, осторожными круговыми движениями перемешивают. После застывания среды чашки подсушивают и заливают той же средой так, чтобы высота второго слоя питательной среды была не менее 4 мм.
4.1.3. Посевы на чашках Петри термостатируют при температуре (37±1) °С в течение 18-24 ч в анаэростатах с разряжением 0,6-0,8 атм [(0,4-0,6)·10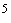 Па] или в анаэробных условиях, указанных в ГОСТ 30425.
Па] или в анаэробных условиях, указанных в ГОСТ 30425.
4.1.4. После окончания термостатирования отбирают те чашки, на которых выросло от 15 до 150 характерных колоний. Подсчитывают количество выросших характерных колоний. Характеристика колоний С. perfringens на селективных питательных средах приведена в приложении.
Корректировку подсчета количества С. perfringens проводят после изучения морфологических и биохимических особенностей микроорганизмов из колоний, характерных для С. perfringens.
4.2. Подтверждение принадлежности характерных колоний к С. perfringens.
4.2.1. Для подтверждения принадлежности обнаруженных колоний к С. perfringens отбирают произвольно не менее пяти, характерных для С. perfringens, колоний и пересевают их в жидкую (вязкую) среду для мезофильных анаэробных микроорганизмов (см. п.3.2.4).
Жидкие (вязкие) среды подготавливают к анализу по ГОСТ 30425.
Посевы термостатируют при температуре (37±1) °С в течение 18-24 ч. Культуральную жидкость используют для изучения морфологических и биохимических свойств микроорганизмов.
4.2.2. Если колонии в посевах на чашках Петри растут в виде ковра или среди обнаруженных колоний много нетипичных для С. perfringens, то мазок из ковра или кажущиеся характерные колонии пересевают, как указано в п.4.2.1, в питательные жидкие (вязкие) среды для мезофильных анаэробов и термостатируют при температуре (37±1) °С в течение 18-24 ч, полученную культуральную жидкость вновь высевают на чашки Петри (см. 4.1.2) так, чтобы получить раздельные колонии, предназначенные для определения культуральных, морфологических и биохимических свойств микроорганизмов, предположительно относящихся к С. perfringens. Питательные среды, используемые для вторичного посева на чашки Петри, не должны содержать циклосерина. Вторичные посевы термостатируют, как указано в п. 4.1.3.
4.2.3. Из посевов (см. пп.4.2.1, 4.2.2) готовят препараты, окрашивают их по Граму по ГОСТ 30425 и микроскопируют. С. perfringens представляет собой грамположительные палочки размером 0,9-1,3х3,0-9,0 мкм, плохо или необразующие в посевах споры. Палочки с закругленными концами располагаются в одиночку, попарно, в виде цепочек штакетообразных скоплений.
В спороносных палочках спора расположена субтерминально. В посевах устанавливают отсутствие каталазы по ГОСТ 30425.
4.2.4. Культуры, указанные в пп.4.2.1, 4.2.2, высевают в пробирки с лакмусовым молоком. Посевы инкубируют при температуре (37±1) °С в течение 8-12 ч.
С. perfringens вызывает бурную ферментацию лактозы с образованием газа, редукцию лакмуса, коагуляцию молока с последующим его свертыванием и образованием губчатого сгустка красновато-сиреневого цвета в верхней части пробирки и просветлением сыворотки.
При инкубации посевов при температуре (45±1) °С характерную реакцию ферментации молока С. perfringens вызывают уже через 3-5 ч.
4.2.5. Исследуемую культуру высевают бактериологической петлей уколом в полужидкую питательную среду для изучения подвижности и редукции нитратов. Посев термостатируют при температуре (37±1) °С в течение 24 ч. С. perfringens неподвижен, он растет по ходу линии посева, не вызывая помутнения всей среды. После учета подвижности в эту же пробирку вносят реактив на нитриты. Редукцию нитратов оценивают по ГОСТ 10444.8. Культуры, которые показывают слабую реакцию на нитриты (т.е. розовый цвет), не учитывают, так как С. perfringens стойко дает сильную и немедленную реакцию (красный цвет).
4.2.6. Исследуемую культуру высевают бактериологической петлей уколом в питательную среду (см. п.3.2.5) для определения способности к ферментации лактозы и разжижению желатина. Посев термостатируют при температуре (37±1) °С в течение 18-24 ч. О ферментации лактозы свидетельствует желтое окрашивание среды и выделение пузырьков газа в толще среды. После учета ферментации лактозы пробирки с посевом выдерживают при температуре (4±2) °С в течение 1 ч. Если среда вновь не застыла, то это свидетельствует о гидролизе желатина. При сохранении вязкости среды пробирку со средой вновь помещают в термостат с температурой (37±1) °С на 24 ч, охлаждают при температуре (4±2) °С и дают окончательную оценку способности выделенной культуры к гидролизу желатина.
С. perfringens ферментирует лактозу и, как правило, разжижает желатин.
4.2.7. Подвижность, редукцию нитратов, разжижение желатина допускается определять путем посева 6-8-часовой культуры, как указано в п.4.2.1 или 4.2.2 на среду Роберта. Среду непосредственно перед использованием прогревают 20 мин на кипящей водяной бане, охлаждают до застывания в холодильнике. В подготовленную среду посев проводят уколом. Посевы инкубируют при температуре (37±1) °С в течение 24 ч, после этого посевы помещают на 20 мин в холодильник.
С. perfringens на среде Роберта образует прямую (вследствие неподвижности клеток) красную (вследствие редукции нитратов и появлению нитритов) линию, превращая среду в желеобразное состояние и не затвердевающую при температуре 2-4 °С в холодильнике (вследствие разжижения желатина).
5. ОБРАБОТКА РЕЗУЛЬТАТОВ
5.1. Результаты испытания продукта оценивают по каждой пробе отдельно.
5.2. Если при изучении культуральных, морфологических и биохимических свойств микроорганизмов, выделенных из колоний, обнаружены неподвижные, грамположительные, каталазоотрицательные, редуцирующие нитраты, ферментирующие лактозу, разжижающие желатин и дающие характерный рост в лакмусовом молоке палочки, то дают заключение о том, что обнаруженные микроорганизмы относятся к С. perfringens.
5.3. При необходимости подсчета С. perfringens если в 80% случаев, т.е. не менее чем в четырех из пяти колоний, подтвержден рост С. perfringens, то считают, что все характерные колонии, выросшие в чашке, принадлежат к С. perfringens. В остальных случаях количество С. perfringens определяют, исходя из процентного отношения подтвержденных колоний к общему количеству характерных колоний, взятых для изучения морфологических и биохимических свойств.
5.4. Результаты испытаний пересчитывают на 1 г или 1 см продукта и записывают в соответствии с требованиями ГОСТ 26670.
продукта и записывают в соответствии с требованиями ГОСТ 26670.
Если на чашках Петри обнаружено более 150 колоний С. perfringens, допускается выражать результаты следующим образом: количество С. perfringens в 1 г или в 1 см более 1,5·10
более 1,5·10 , где
, где 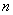 - используемое разведение испытуемого продукта.
- используемое разведение испытуемого продукта.
ПРИЛОЖЕНИЕ
Справочное
ХАРАКТЕРИСТИКА КОЛОНИЙ С. PERFRINGENS НА СЕЛЕКТИВНЫХ ПИТАТЕЛЬНЫХ СРЕДАХ
|
Название питательной среды |
Характеристика колоний |
|
1. Агар триптозо-сульфит-циклосериновый или агар сульфит-полимиксин-неомициновый, или Вильсон-Блера |
Колонии черного цвета различной интенсивности окраски, имеющие форму двояковыпуклой линзы, комочка ваты или "самолетика" |
|
2. Сахарный кровяной агар по Цейсслеру с антибиотиками |
Колонии, зеленеющие на воздухе, окружены одной или двумя зонами гемолиза. |
|
|
Одна полупрозрачная зона гемолиза обусловлена действием лецитиназы. |
|
|
При образовании двух зон гемолиза внутренняя прозрачная зона обусловлена действием гемолизинов, а наружная - действием лецитиназы |
Текст документа сверен по:
официальное издание
Консервы. Методы микробиологического анализа:
Сб. ГОСТов. - М.: ИПК Издательство стандартов, 2002

 Танцы кубанского блогера Каграманова в шоу “Звездные танцы” не понравятся...
Танцы кубанского блогера Каграманова в шоу “Звездные танцы” не понравятся...  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов