- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
ГЛАВНЫЙ ГОСУДАРСТВЕННЫЙ САНИТАРНЫЙ ВРАЧ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ПОСТАНОВЛЕНИЕ
от 30 ноября 2007 года N 80
О надзоре за оборотом пищевых продуктов, содержащих ГМО
Я, Главный государственный санитарный врач Российской Федерации Г.Г.Онищенко, проанализировав материалы государственного надзора за выполнением обязательных требований при обороте пищевых продуктов, содержащих компоненты, полученные с применением генно-инженерно-модифицированных организмов (далее - ГМО), отмечаю.
В Российской Федерации с 1996 года разработана и функционирует законодательная, нормативная и методическая база, позволяющая осуществлять оценку безопасности, и организован мониторинг за оборотом пищевой продукции, полученной из ГМО. Действующая система в значительной степени гармонизирована с требованиями Международных организаций и Европейского союза.
За период с 1996 по 2007 год в мире площади посевов генетически модифицированных культур возросли в 60 раз, достигнув более 110 млн.га. В настоящее время разрешено к применению в разных странах более 120 видов трансгенных растений, в том числе 86 - в Европе.
В Российской Федерации за эти годы прошли полный цикл исследований 17 видов генетически модифицированных культур. На 30.11.2007 на территории Российской Федерации действуют санитарно-эпидемиологические заключения и свидетельства о государственной регистрации на 12 видов пищевой продукции растительного происхождения, полученных с применением трансгенных технологий: 6 сортов кукурузы, 4 сорта картофеля, 1 сорт риса и 1 сорт сахарной свеклы.
В мире существуют разные подходы к этикетированию пищевых продуктов, полученных из ГМО. В США, Канаде, Аргентине данные продукты не этикетируются, в странах ЕЭС принят 0,9% пороговый уровень, в странах Японии, Австралии - 5%. При этом введение порогового уровня содержания ГМО, при котором необходимо этикетировать пищевые продукты, не связано с вопросом их безопасности, а преследует цели информирования населения об использовании технологии получения пищевых продуктов.
С 12 декабря 2007 года вступает в силу Закон Российской Федерации от 07.02.92 N 2300-1 "О защите прав потребителей" (Собрание законодательства Российской Федерации, 1996, N 3, ст.140) был гармонизирован с требованиями Европейского союза по этикетированию пищевых продуктов, полученных из ГМО, установленными Директивой Европейского парламента и Совета от 22.09.2003 N 1829/2003 о генетически модифицированной пище и кормах, которая с апреля 2004 года ввела в странах Европейского Союза 0,9% пороговый уровень для этикетирования пищевых продуктов, полученных из ГМО.
Ранее аналогичный показатель был закреплен санитарно-эпидемиологическими правилами СанПиН 2.3.2.2227-07 "Дополнения и изменения N 5 к санитарно-эпидемиологическим правилам СанПиН 2.3.2.1078-01 "Гигиенические требования безопасности и пищевой ценности пищевых продуктов" (зарегистрированы в Минюсте России 16.06.2007, регистрационный номер 9852), установившими с 01.09.2007, что содержание в пищевых продуктах 0,9% и менее компонентов, полученных с применением ГМО, является случайной или технически неустранимой примесью и пищевые продукты, содержащие указанное количество таких компонентов, не относятся к категории пищевых продуктов, содержащих компоненты, полученные с применением ГМО.
Система оценки безопасности пищевых продуктов, полученных из ГМО, включает проведение пострегистрационного мониторинга за ее оборотом, для осуществления которого разработаны методы идентификации ГМО в пищевых продуктах.
В системе Роспотребнадзора в субъектах Российской Федерации имеется лабораторная база по исследованию пищевых продуктов на наличие ГМО. Постановлением Главного государственного санитарного врача Российской Федерации от 31.12.2004 N 13 "Об усилении надзора за пищевыми продуктами, полученными из ГМО" (по заключению Минюста России от 18.02.2005 N 01/1203-ВЯ данное постановление не нуждается в государственной регистрации) определены головные центры по количественному исследованию пищевых продуктов на наличие ГМО в каждом федеральном округе.
За 9 месяцев 2007 года учреждениями Роспотребнадзора на наличие компонентов, полученных с применением ГМО, исследовано 29816 проб (2006 год - 37879, 2005 год - 18872, 2004 год - 12956, 2003 год - 4300) продовольственного сырья и пищевых продуктов. Из них компоненты ГМО содержали 652 пробы (2006 год - 1452, 2005 год - 1443, 2004 год - 1552, 2003 год - 511), что составило 2,2% (2006 год - 2,7%, 2005 год - 7,6%, 2004 год - 12%, 2003 год - 11,9%). Наиболее часто ГМО встречаются в мясных продуктах - 3,8% (2006 год - 6,6%, 2005 год - 15,8%, 2004 год - 20,5%, 2003 год - 14,8%), птицеводческих продуктах - 5,6% (2006 год - 3,8%, 2005 год - 9,1%, 2004 год - 15,43%, 2003 год - 29,5%), группе продуктов "прочие" (в основном растительные белки) - 3,3% (2006 год - 3,9%, 2005 год - 10,8%, 2004 год - 16,7%, 2003 год - 16,4%). В 2007 году увеличилась доля содержания компонентов ГМО в молочных продуктах (9 месяцев 2007 года - 5,1%, 2006 год - 1,3%).
Учреждениями Роспотребнадзора при исследовании пищевых продуктов количественным методом определения ГМО, по предварительным данным, выявлено, что оборот пищевых продуктов, содержащих компоненты ГМО более 0,9%, составляет менее 1% от оборота всех пищевых продуктов, однако 90% из них не имеют обязательной информации о наличии ГМО.
В связи с вышеизложенным с целью усиления Госсанэпиднадзора за пищевыми продуктами и в соответствии с Федеральным законом от 30.03.99 N 52-ФЗ "О санитарно-эпидемиологическом благополучии населения" (Собрание законодательства Российской Федерации, 1999, N 14, ст.1650; 2002, N 1 (ч.1), ст.1; 2003, N 2, ст.167; N 27 (ч.1), ст.2700; 2004, N 35, ст.3607; 2005, N 19, ст.1752; 2006, N 1, ст.10; 2006, N 52 (ч.1), ст.5498; 2007, N 1 (ч.1), ст.21; 2007, N 1 (1 ч.), ст.29; 2007, N 27, ст.3213, 2007, N 46, ст.5554) и Федеральным законом от 01.01.2000* N 29-ФЗ "О качестве и безопасности пищевых продуктов" (Собрание законодательства Российской Федерации, 2000, N 2, ст.150; 2002, N 1 (ч.1), ст.2; 2003, N 2, ст.167, N 27 (ч.1), ст.2700; 2004, N 35, ст.3607; 2005, N 19, ст.1752, N 50, ст.5242; 2006, N 1, ст.10, N 14, ст.1458)
________________
* Вероятно, ошибка оригинала. Следует читать "от 02.01.2000". - Примечание изготовителя базы данных.
постановляю:
1. Организациям, осуществляющим ввоз, производство и оборот пищевых продуктов, принять меры по обязательному доведению до потребителя информации о наличии в продуктах питания компонентов, полученных с применением ГМО, в случае если их содержание составляет более 0,9%.
2. Утвердить методические указания:
2.1. МУ 2.3.2.2306-07 "Медико-биологическая оценка безопасности генно-инженерно-модифицированных организмов растительного происхождения" (приложение 1);
2.2. МУК 4.2.2304-07 "Методы идентификации и количественного определения генно-инженерно-модифицированных организмов растительного происхождения" (приложение 2);
2.3. МУК 4.2.2305-07 "Определение генетически модифицированных микроорганизмов и микроорганизмов, имеющих генетически модифицированные аналоги, в пищевых продуктах методами полимеразной цепной реакции (ПЦР) в реальном времени и ПЦР с электрофоретической детекцией" (приложение 3).
3. Управлениям Роспотребнадзора по субъектам Российской Федерации и по железнодорожному транспорту:
3.1. Считать осуществление надзора за пищевыми продуктами, полученными из ГМО, приоритетным направлением деятельности на 2008 год;
3.2. Усилить государственный надзор за производством и оборотом пищевых продуктов, содержащих ГМО;
3.3. Обеспечить выполнение необходимых лабораторных исследований по исследованию пищевых продуктов, содержащих ГМО;
3.4. Осуществлять в средствах массовой информации и среди населения разъяснительную работу по вопросам безопасности пищевых продуктов, полученных из ГМО, и прав потребителей на получение полной и достоверной информации;
3.5. Доложить о проделанной работе до 01.04.2008.
4. Управлениям Роспотребнадзора по г.Москве, г.Санкт-Петербургу, Ростовской области, Нижегородской области, Свердловской области, Новосибирской области, Хабаровскому краю активизировать работу головных центров по количественному исследованию пищевых продуктов на наличие ГМО в федеральных округах.
5. ФГУЗ Центры гигиены и эпидемиологии принять меры по дооснащению лабораторных подразделений аналитическим оборудованием по исследованию количественного состава ГМО.
6. ФГУЗ "Федеральный центр гигиены и эпидемиологии" Роспотребнадзора до 01.03.2008 представить в Роспотребнадзор информацию о наличии в ФГУЗ "Центры гигиены и эпидемиологии" в субъектах Российской Федерации аналитического оборудования по качественному и количественному методам определения ГМО в пищевых продуктах и подготовке врачей-лаборантов.
7. Просить научно-исследовательские учреждения РАМН, РАН, РАСХН совместно с научно-исследовательскими учреждениями Роспотребнадзора уделять приоритетное внимание совершенствованию методов оценки безопасности и контроля за пищевой продукцией, содержащей ГМО.
8. Контроль за исполнением настоящего постановления возложить на заместителя Главного государственного санитарного врача Российской Федерации Л.П.Гульченко.
Г.Онищенко
Зарегистрировано
в Министерстве юстиции
Российской Федерации
6 февраля 2008 года,
регистрационный N 11117
Приложение 1
УТВЕРЖДЕНО
постановлением
Главного государственного
санитарного врача
Российской Федерации
от 30 ноября 2007 года N 80
2.3.2. Пищевые продукты и пищевые добавки
Медико-биологическая оценка безопасности
генно-инженерно-модифицированных организмов
растительного происхождения
Методические указания
МУ 2.3.2.2306-07
I. Общие положения и область применения
1.1. Методические указания устанавливают требования к проведению оценки безопасности генно-инженерно-модифицированных организмов растительного происхождения (ГМО).
1.2. Требования, изложенные в настоящих Методических указаниях, применяются на этапе государственной регистрации ГМО, впервые поступающих на продовольственный рынок Российской Федерации.
1.3. Методические указания разработаны с целью обеспечения единой, научно- обоснованной системы оценки безопасности ГМО, и учитывают новые методические подходы, как разработанные в России, так и рекомендованные международными организациями (ВОЗ, ФАО и др.).
II. Экспертный анализ и оценка данных, характеризующих
заявленные генно-инженерно-модифицированные организмы
2.1. Общая характеристика ГМО включает анализ информации, представленной заявителем:
- информации, позволяющей идентифицировать ГМО (вид, сорт, трансформационное событие);
- информации об исходном родительском организме (таксономическая характеристика, описание способа размножения и распространения; данные о токсических, аллергенных и других неблагоприятных свойствах);
- информации об организмах-донорах вносимых генов (таксономическая характеристика, история использования);
- информации о методе генетической модификации (описание метода модификации, структуры вектора, структуры вставки);
- информации о ГМО (описание свойств, приобретенных растением в результате модификации, описание структуры генетической конструкции (внесенной или удаленной) и места ее локализации, характеристику экспрессии встроенных генов (экспрессия в процессе онтогенеза растения, интенсивность экспрессии в структурных компонентах растения, и др.), характеристику различий с родительским организмом (способ размножения, способность к перекрестному опылению, устойчивость к стрессовым воздействиям и др.), характеристику генетической и фенотипической стабильности (должны быть представлены данные, полученные в результате исследований нескольких поколений ГМО), характеристику способности к переносу генов в другие организмы (растения, микроорганизмы).
Оценка композиционной эквивалентности проводится на основании сведений, представленных заявителем, о результатах сравнения химического состава ГМО с химическим составом его традиционного аналога по следующим параметрам:
- содержание белка;
- аминокислотный состав;
- содержание жира;
- жирнокислотный состав;
- углеводный состав;
- содержание витаминов;
- содержание макро- и микроэлементов;
- содержание биологически активных веществ;
- содержание аллергенов;
- содержание антропогенных и природных контаминантов (токсичных элементов, микотоксинов, пестицидов, радионуклидов, вредных примесей и др.);
- содержание антинутриентов и других веществ, характерных для растительных организмов данного вида.
Перечень показателей варьируется в зависимости от свойств изучаемого растительного организма.
2.3. Оценка композиционной эквивалентности ГМО и его традиционного аналога проводится с учетом биологических колебаний значений показателей, характерных для растений данного вида.
2.4. Анализ результатов токсикологических исследований проводится на основании сведений, представленных заявителем, включающих:
- результаты оценки безопасности одного или нескольких белков, определяющих проявление заданных признаков у ГМО (молекулярная и биохимическая характеристика белка; наличие или отсутствие гомологии с токсинами белковой природы, а также с белками, обладающими фармакологической, или иной биологической активностью (при использовании баз данных PIR, EMBL, SwissProt, GenBank, и др.); изучение стабильности белка при обработке, хранении, технологической переработке; влияние температуры и рН, возможные модификации и/или образование стабильных белковых фрагментов в результате различных воздействий; устойчивость белка к обработке протеолитическими ферментами в эксперименте in vitro; исследования острой пероральной токсичности белка в эксперименте на грызунах; и др.);
- результаты оценки безопасности нативного продукта (данные 90-дневных исследований на грызунах, данные исследований на молодых быстро растущих животных (цыплятах-бройлерах, ягнятах и др.), - в случае если такие исследования проводились;
- результаты других токсикологических исследований.
2.5. Анализ результатов аллергологических исследований проводится на основании сведений, представленных заявителем, включающих:
- результаты оценки аллергенных свойств одного или нескольких белков, определяющих проявление заданных признаков у ГМО (сравнение с известными аллергенами с использованием баз данных, содержащих информацию о трехмерной структуре и функции известных аллергенов и родственных им белков); определение потенциальной аллергенности белка в иммунохимических исследованиях in vitro с использованием IgE, выделенных из сыворотки крови пациентов, страдающих аллергией; определение устойчивости к воздействию протеолитических ферментов (пепсина); скрининговые исследования с использованием сывороток крови пациентов, страдающих аллергией; дополнительные исследования (в т.ч. in vivo);
- результаты аллергологических исследований нативного продукта (сравнение набора аллергенов исследуемого ГМО с набором аллергенов его традиционного аналога и др.), - должны быть проведены в случае, если имеются данные об аллергенных свойствах организма-донора.
2.6. Анализ результатов других исследований (в случае, если такие исследования были выполнены) проводится на основании сведений, представленных заявителем, включающих:
- результаты определения пищевой ценности (так как заданные и незаданные эффекты генетической модификации могут являться причиной изменения баланса макро- и микронутриентов, и, следовательно, вести к изменению пищевой ценности продукта);
- результаты применения новейших аналитических методов, таких как профильные технологии и др.
2.7. Анализ результатов пострегистрационного мониторинга в стране-заявителе и других странах, осуществляемого с целью выявления незаданных эффектов генетической модификации, которые не могли быть обнаружены на стадии регистрационных исследований, проводится на основании сведений, представленных заявителем.
III. Методы обнаружения, идентификации и количественного
определения генно-инженерно-модифицированных организмов
в пищевых продуктах
3.1. Экспертная оценка методов идентификации ГМО направлена на подтверждение их адекватности инструментальной и методической базе, используемой в учреждениях Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека для контроля за обращением ГМО и маркировкой пищевых продуктов, содержащих ГМО.
3.2. Экспертная оценка методов обнаружения, идентификации и количественного определения ГМО в пищевых продуктах проводится на основании сведений, представленных заявителем, включающих:
- метод идентификации одного или нескольких трансформационных событий;
- метод количественного определения одного или нескольких трансформационных событий;
- протоколы проведения анализов;
- описание праймеров;
- стандартные образцы состава и свойств.
IV. Медико-генетическая оценка генно-инженерно-модифицированных
организмов
4.1. Медико-генетическая оценка ГМО включает проверку присутствия одной или нескольких синтетических генетических конструкций методом полимеразной цепной реакции (ПЦР).
4.2. Медико-генетические исследования проводятся на основании сведений, представленных заявителем, включающих:
- описание молекулярной структуры одной или нескольких синтетических генетических конструкций (нуклеотидная последовательность);
- метод идентификации и количественного определения одного или нескольких трансформационных событий;
- протокол проведения анализа;
- описание праймеров;
- стандартные образцы состава и свойств.
V. Оценка функционально-технологических свойств
генно-инженерно-модифицированных организмов
5.1. Перечень и объем исследований по разделу V определяются экспертными (учеными) советами соответствующих аккредитованных испытательных центров Российской Федерации на основании анализа представленных материалов.
5.2. Изучаемые функциональные свойства:
- рН водной суспензии;
- растворимость;
- реологические свойства водных дисперсий;
- водоудерживающая и жироудерживающая способность;
- критическая концентрация гелеобразования;
- эмульсионная стабильность и др.
VI. Медико-биологическая оценка безопасности
генно-инженерно-модифицированных организмов
6.1. Перечень и объем исследований по разделу VI определяются экспертными (учеными) советами соответствующих аккредитованных испытательных центров Российской Федерации на основании анализа представленных материалов.
6.2. Гигиенические исследования ГМО включают определение показателей качества и безопасности:
6.2.1. Перечень показателей безопасности определяется на основании требований СанПиН 2.3.2.1078-01 "Гигиенические требования безопасности и пищевой ценности пищевых продуктов" для соответствующей группы продуктов.
Изучаемые показатели:
- содержание токсичных элементов;
- содержание микотоксинов;
- содержание пестицидов;
- содержание радионуклидов;
- содержание вредных примесей;
- микробиологические показатели;
- другие показатели (в случае необходимости).
6.2.2. Перечень показателей качества определяется на основании свойств соответствующего растительного организма, а также анализа представленных заявителем материалов. В случае если заявителем представлены исчерпывающие данные по оценке композиционной эквивалентности ГМО (содержание белка, аминокислотный состав, содержание жира, жирнокислотный состав, углеводный состав, содержание витаминов, макро- и микроэлементов, специфических компонентов, биологически активных веществ, антинутриентов и других веществ, характерных для растений данного вида) исследования могут быть ограничены определением влажности, золы, содержания белка, жира, углеводов, пищевых волокон.
6.2.3. В случае если генетическая модификация направлена на изменение химического состава ГМО, должны быть проведены исследования, подтверждающие заявленные изменения.
6.3. Токсикологические исследования ГМО проводятся в эксперименте на лабораторных животных:
6.3.1. Схема проведения эксперимента
|
Вид животных |
крысы линии Вистар |
|
Пол |
самцы |
|
Возраст |
40-50 дней |
|
Исходная масса тела |
70-80 г |
|
Количество животных в группе в начале эксперимента |
не менее 50 особей в каждой группе |
|
Распределение по группам |
Животных делят на 2 группы: |
|
Рацион |
Пищевая и биологическая ценность рациона полностью удовлетворяет физиологические потребности животных |
|
Карантин |
не менее 7 дней |
|
Условия содержания |
Животные получают свободный доступ к корму и воде; содержатся в отапливаемом, вентилируемом помещении. |
|
Продолжительность эксперимента |
180 дней |
|
Забор материала для гематологических, биохимических, морфологических исследований |
На 30-й и 180-й дни эксперимента |
|
Количество животных, взятых на исследование |
Не менее 10/группу |
6.3.2. На протяжении эксперимента животные получают полусинтетический казеиновый рацион (ПКР). Исследуемый ГМО и его традиционный аналог включают в состав корма в максимально возможном количестве, не нарушающем баланс основных пищевых веществ. Замена ингредиентов рациона должна быть проведена с учетом содержания белков, жиров и углеводов во вводимом продукте при соблюдении принципа изокалорийности.
Продуктовый набор и химический состав базового ПКР представлены в табл.1-2.
Таблица 1
СОСТАВ
базового полусинтетического казеинового рациона
|
Ингредиенты |
Кол-во |
Белок |
Жиры |
Углеводы |
Калорийность | |
|
г |
г |
г |
г |
ккал |
% | |
|
Казеин |
25,0 |
20,20 |
0,38 |
- |
84,22 |
22,1 |
|
Крахмал маисовый |
58,0 |
0,58 |
- |
50,2 |
203,12 |
53,3 |
|
Масло подсолнечное нерафинированное |
5,0 |
- |
4,99 |
- |
44,91 |
11,8 |
|
Лярд |
5,0 |
- |
4,98 |
- |
44,82 |
11,8 |
|
Солевая смесь* |
4,0 |
- |
- |
- |
- |
- |
|
Смесь в/р витаминов** |
1,0 |
- |
- |
1,0 |
4,00 |
1,0 |
|
Смесь ж/р витаминов*** |
0,1 |
- |
0,1 |
- |
- |
- |
|
Микрокристалли- |
2,0 |
- |
- |
- |
- |
- |
|
ИТОГО |
100,1 |
20,78 |
10,45 |
51,2 |
381,07 |
100 |
_______________
* состав солевой смеси представлен в табл.2
** 1 г содержит: тиамина (В1) - 0,4 мг, рибофлавина (В2) - 0,6 мг,
пиридоксина (В6) - 0,4 мг, никотиновой кислоты - 3,0 мг,
пантотената кальция - 1,5 мг, фолиевой кислоты - 0,2 мг,
цианкобаламина (В12) - 0,003 мг, викасола - 0,1 мг, L-метионина - 50 мг,
глюкозы - до 1 г.
*** 0,1 мл содержит: ретинола ацетата 800 МЕ, эргокальциферола - 70 МЕ,
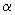 -токоферола ацетата - 5 мг, подсолнечного масла - до 0,1 мл.
-токоферола ацетата - 5 мг, подсолнечного масла - до 0,1 мл.
Таблица 2
СОСТАВ
солевой смеси
|
N |
Название соли |
Химическая формула |
Количество, г |
|
1 |
Хлористый натрий |
NaCl |
139,3 |
|
2 |
Калий фосфорнокислый, |
KH |
388,8 |
|
3 |
Магний сернокислый |
MgSO |
57,4 |
|
4 |
Кальций углекислый |
CaCO |
380,4 |
|
5 |
Железо сернокислое |
FeSO |
26,4 |
|
6 |
Калий йодистый |
KI |
0,77 |
|
7 |
Марганец сернокислый |
MnSO |
4,55 |
|
8 |
Цинк сернокислый |
ZnSO |
0,53 |
|
9 |
Медь сернокислая |
CuSO |
0,48 |
|
10 |
Кобальт хлористый |
CoCl |
0,024 |
|
11 |
Натрий фтористый |
NaF |
0,50 |
|
12 |
Алюмокалиевые квасцы |
K |
0,11 |
|
ИТОГО |
1000 |
6.3.3. Исследуемые показатели:
6.3.3.1. Интегральные показатели
|
Изучаемые показатели |
Периодичность |
|
Общее состояние животных (внешний вид, двигательная активность, состояние шерстного покрова) |
каждые 2 дня |
|
Поедаемость корма |
ежедневно |
|
Масса тела |
каждые 7 дней |
|
Масса внутренних органов (головной мозг, сердце, селезенка, легкие, тимус, гипофиз, печень, почки, надпочечники, семенники) |
На 30-й и 180-й дни эксперимента |
6.3.3.2. Гематологические показатели
|
Изучаемые показатели |
Периодичность сбора данных |
|
- концентрация гемоглобина; |
На 30-й и 180-й дни |
6.3.3.3. Биохимические показатели
6.3.3.3.1. Общий биохимический анализ крови.
Материал для исследований: сыворотка крови.
|
Изучаемые показатели |
Периодичность сбора данных |
|
- аланинаминотрансфераза (АЛТ); |
На 30-й и 180-й дни |
6.3.3.3.2. Общий анализ мочи.
Материал для исследований: моча.
|
Изучаемые показатели |
Периодичность сбора данных |
|
- суточный диурез; |
На 30-й и 180-й дни |
6.3.3.3.3. Системные биомаркеры
6.3.3.3.3.1. Система антиоксидантной защиты.
|
Изучаемые показатели |
Периодичность сбора данных |
|
Активность ферментов антиоксидантной защиты. Материал для исследований: эритроциты |
|
|
Содержание продуктов перекисного окисления липидов. Материал для исследований: кровь, печень |
6.3.3.3.3.2. Система ферментов метаболизма ксенобиотиков.
Материал для исследований: печень.
|
Изучаемые показатели |
Периодичность сбора данных |
|
Активность ферментов 1-й и 2-й фазы метаболизма ксенобиотиков |
На 30-й и 180-й дни эксперимента |
6.3.3.3.3.3. Система регуляции апоптоза.
1) стабильность мембран лизосом.
Материал для исследований: печень.
|
Изучаемые показатели |
Периодичность сбора данных |
|
Общая и неседиментируемая активность |
На 30-й и 180-й дни |
2) другие методы.
6.3.3.4. Морфологические исследования
|
Исследуемые органы |
Методы исследований |
|
- кожа; |
На 30-й и 180-й дни эксперимента (плановый забор)
|
|
- лимфатические узлы; |
Вскрытие погибших в течение эксперимента животных (внеплановый забор)
|
|
- поджелудочная железа; |
Дополнительные исследования
|
6.4. Иммунологические исследования ГМО проводятся в эксперименте на мышах линий СВА и С57Bl/6 и включают изучение его иммуномодулирующих и сенсибилизирующих свойств по четырем тестам:
действие на гуморальное звено иммунитета - в тесте определения уровня гемагглютининов к эритроцитам барана;
действие на клеточное звено иммунитета - в реакции гиперчувствительности замедленного типа (ГЗТ) к эритроцитам барана;
действие как сенсибилизирующего агента - в тесте чувствительности к гистамину;
действие на естественную резистентность мышей к Salmonella typhimurium (сальмонеллы мышиного тифа).
В табл.3 представлены сравнительные характеристики мышей линий СВА и С57Bl/6.
Таблица 3
Характеристики мышей линий СВА и С57Bl/6
|
Действующий фактор |
Линия мышей | |
|
СВА |
С57B1/6 | |
|
Эритроциты барана |
высокочувствительны |
низкочувствительны |
|
Гистамин |
не чувствительны |
чувствительны |
|
Salmonella typhimurium |
не чувствительны |
чувствительны |
6.4.1. Схема проведения эксперимента
|
Вид животных |
мыши линий СВА и С57B1/6 |
|
Пол |
самцы |
|
Возраст |
половозрелые |
|
Исходная масса тела |
18-20 г |
|
Распределение по группам |
Животных каждой линии делят на 2 группы: |
|
Рацион* |
Пищевая и биологическая ценность рациона полностью удовлетворяет физиологические потребности животных |
|
Карантин |
не менее 7 дней |
|
Условия содержания |
Животные получают свободный доступ к корму и воде; содержатся в отапливаемом, вентилируемом помещении. |
_______________
* Состав базового рациона приведен в п.6.3.2.
Исследования начинают через 21 день с момента перевода мышей на экспериментальные рационы. В течение эксперимента ведутся наблюдения за поедаемостью корма и общим состоянием животных.
6.4.2. Исследуемые показатели:
1) действие ГМО на гуморальное звено иммунитета.
Через 21 день эксперимента мышам контрольной (не менее 20 животных) и опытной (не менее 20 животных) групп обеих линий внутрибрюшинно вводят 0,5 мл эритроцитов барана (20 млн. клеток/мл). Забор крови для исследований проводится на 7-й, 14-й и 21-й день после введения эритроцитов барана. Сыворотку крови титруют в реакции гемагглютинации общепринятым методом. Полученные данные обрабатывают методами вариационной статистики с использованием t-критерия Стьюдента. Результаты приводятся в виде Мm, где М - выборочное среднее измеряемых величин, m - стандартная ошибка.
2) действие ГМО на клеточное звено иммунитета.
Через 21 день эксперимента мышам контрольной (не менее 15 животных) и опытной (не менее 15 животных) групп обеих линий подкожно в межлопаточную область вводят 0,5 мл эритроцитов барана (2 млн. клеток/мл). Через пять дней всем мышам в подушечку одной задней лапы вводят разрешающую дозу эритроцитов барана - 0,02 мл (1 млрд. клеток/мышь); в контрлатеральную лапу - 0,02 мл 0,95%-ного раствора хлорида натрия. Местную воспалительную реакцию оценивают через 18-20 часов путем определения массы опытной и контрольной лапок. Интенсивность местной реакции определяют по индексу реакции (ИР).
3) действие ГМО как сенсибилизирующего агента к гистамину.
Через 21 день эксперимента мышам контрольной (не менее 15 животных) и опытной (не менее 15 животных) групп обеих линий внутрибрюшинно вводят гистамин гидрохлорид (2,5 мг/мышь в 0,5 мл физиологического раствора). Реакцию учитывают через 24 часа по проценту гибели мышей.
4) действие ГМО на естественную резистентность мышей к S. typhimurium изучают на модели внутрибрюшинного заражения мышей десятикратно отличающимися дозами S. typhimurium штамм 415. Через 21 день эксперимента мышей контрольной (не менее 30 животных) и опытной (не менее 30 животных) групп обеих линий заражают тремя дозами культуры: 1000, 100, 10 микробных клеток/мышь. После заражения за животными наблюдают в течение 21 дня. Вычисляют ЛД50, а также процент гибели животных по каждой дозе, затем проводят сравнительный анализ результатов.
6.5. Аллергологические исследования ГМО проводятся в эксперименте на лабораторных животных: потенциальную аллергенность оценивают, определяя тяжесть протекания системной анафилаксии и уровня циркулирующих сенсибилизирующих антител (cубклассов IgG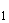 + IgG
+ IgG ) у крыс, получающих в составе рациона исследуемый ГМО (группа "опыт") и его традиционный аналог (группа "контроль"). Метод основан на количественной сравнительной оценке тяжести реакции системной анафилаксии, возникающей при внутрибрюшинной (в/б) сенсибилизации взрослых крыс пищевым антигеном - овальбумином куриного яйца (ОВА) с последующим внутривенным (в/в) введением сенсибилизированным животным разрешающей дозы того же белка.
) у крыс, получающих в составе рациона исследуемый ГМО (группа "опыт") и его традиционный аналог (группа "контроль"). Метод основан на количественной сравнительной оценке тяжести реакции системной анафилаксии, возникающей при внутрибрюшинной (в/б) сенсибилизации взрослых крыс пищевым антигеном - овальбумином куриного яйца (ОВА) с последующим внутривенным (в/в) введением сенсибилизированным животным разрешающей дозы того же белка.
6.5.1. Схема проведения эксперимента
|
Вид животных |
Крысы линии Вистар |
|
Пол |
Самцы |
|
Возраст |
Половозрелые |
|
Исходная масса тела |
150-180 г |
|
Количество животных в группе в начале эксперимента |
не менее 25 особей в каждой группе |
|
Распределение по группам |
Животных делят на 2 группы: |
|
Рацион (табл.4) |
Пищевая и биологическая ценность рациона полностью удовлетворяет физиологические потребности животных Рацион не содержит яичного белка. |
|
Карантин |
не менее 7 дней |
|
Условия содержания |
Животные получают свободный доступ к корму и воде; содержатся в отапливаемом, вентилируемом помещении. |
|
Продолжительность эксперимента |
29 дней |
|
Забор материала для исследований |
На 29-й день эксперимента |
Таблица 4
Стандартный рацион вивария
|
Ингредиент |
Масса, г |
|
Крупа овсяная |
2,5 |
|
Зерновая смесь |
14,0 |
|
Хлеб 2 сорт |
4,0 |
|
Творог |
2,0 |
|
Рыбная мука |
0,5 |
|
Мясо 2 категория |
4,0 |
|
Морковь |
8,0 |
|
Зелень |
8,0 |
|
Рыбий жир |
0,1 |
|
Дрожжи |
0,1 |
|
NaCl |
0,15 |
|
Основные нутриенты | |
|
Белок |
3,69 |
|
Жир |
1,28 |
|
Углеводы |
12,42 |
|
Энергия, ккал |
76,0 |
6.5.2. Исследуемые показатели:
На 1-й, 3-й, 5-й день опыта крыс в/б сенсибилизируют ОВА, а на 21-й день эксперимента вводят дополнительную ("бустерную") дозу антигена, уменьшенную в 10 раз в сравнении с первоначальной. Кормление рационами продолжают до утра 29-го дня эксперимента и затем вводят раствор ОВА в/в, после чего оценивают на протяжении 24 ч тяжесть развивающейся реакции анафилаксии по показателям числа летальных реакций, общего числа судорожных реакций и величины анафилактического индекса. Непосредственно перед введением разрешающей дозы у крыс отбирают 0,1-0,2 мл крови из хвостовой вены для определения уровня специфических антител.
Иммуноферментное определение уровней циркулирующих специфических антител к ОВА проводят согласно. Статистическую обработку результатов проводят согласно U-критерию Фишера для долевых показателей, непараметрическим критериям хи-квадрат и Мана-Уитни с использованием пакетов программ Excel и SPSS 11.5.
6.6. Генотоксикологические исследования ГМО проводятся в эксперименте на лабораторных животных. Оценка потенциальной генотоксичности ГМО включает выявление повреждений ДНК и выявление мутагенной активности в эксперименте in vivo. Метод выявления мутагенной активности основан на учете хромосомных аберраций в метафазных клетках пролиферирующих тканей. Регистрация повреждений ДНК предусматривает оценку целостности структуры ДНК методом щелочного гель-электрофореза изолированных клеток (метод ДНК-комет).
6.6.1. Схема проведения эксперимента
|
Вид животных |
мыши линии С57B1/6 |
|
Пол |
самцы |
|
Возраст |
половозрелые |
|
Исходная масса тела |
18-20 г |
|
Количество животных в группе в начале эксперимента |
не менее 15 особей в каждой группе |
|
Распределение по группам |
Животных делят на 2 группы: |
|
Рацион* |
Пищевая и биологическая ценность рациона полностью удовлетворяет физиологические потребности животных |
|
Карантин |
не менее 7 дней |
|
Условия содержания |
Животные получают свободный доступ к корму и воде; содержатся в отапливаемом, вентилируемом помещении. |
|
Продолжительность эксперимента |
30 дней |
|
Забор материала для исследований |
На 30-й день эксперимента |
_______________
* Состав базового рациона приведен в п.6.3.2.
6.6.2. Исследуемые показатели:
1) в основе метода выявления мутагенной активности лежит регистрация видимых структурных нарушений хромосом в клетках костного мозга на стадии метафазы. Анализируют 100 метафаз от каждого животного. Учитывают число одиночных и парных фрагментов, хроматидных и хромосомных обменов, ахроматических пробелов (гепов) и разрывов по центромере, число клеток с множественными повреждениями и клеток с полной деструкцией хромосом. Оценку результатов цитогенетического анализа проводят путем сопоставления долей клеток с хромосомными аберрациями в контрольной и опытной группах.
2) регистрация повреждений ДНК предусматривает оценку целостности структуры ДНК методом щелочного гель-электрофореза изолированных клеток (метод ДНК-комет). Метод основан на регистрации различной подвижности ДНК и возможных фрагментов ДНК лизированных клеток, заключенных в агарозный гель, в постоянном электрическом поле. При этом ДНК мигрирует к аноду, формируя электрофоретический след, напоминающий "хвост кометы", параметры которого зависят от степени поврежденности исследуемой ДНК. Общая схема метода включает получение гель-слайдов (подложки), получение микропрепаратов, лизис, щелочную денатурацию, электрофорез, нейтрализацию/фиксацию, окрашивание и микроскопический анализ.
Микроскопический анализ проводят на эпифлуоресцентном микроскопе с соответствующими для конкретного красителя фильтрами при увеличении 200х-400х. На каждый микропрепарат анализируют не менее 100 "ДНК-комет". Анализ "ДНК-комет" может проводиться визуально или с помощью программно-аппаратного комплекса.
6.7. Исследования репродуктивной токсичности ГМО проводятся в эксперименте на лабораторных животных и включают:
1) изучение влияния на генеративную функцию;
2) изучение эмбриотоксического и тератогенного действий, регистрируемых в пренатальном и постнатальном периодах развития.
6.7.1. Схема проведения эксперимента
|
Вид животных |
крысы линии Вистар |
|
Пол |
самцы, самки |
|
Возраст |
40-50 дней |
|
Исходная масса тела |
70-80 г |
|
Количество животных в группе в начале эксперимента |
не менее 50 особей в каждой группе |
|
Распределение по группам |
Животных делят на 2 группы: |
|
Рацион* |
Пищевая и биологическая ценность рациона полностью удовлетворяет физиологические потребности животных |
|
Карантин |
не менее 7 дней |
|
Начало опытного вскармливания |
за 45-50 дней перед первым спариванием |
|
Условия содержания |
Животные получают свободный доступ к корму и воде; содержатся в отапливаемом, вентилируемом помещении. |
_______________
* Состав базового рациона приведен в п.6.3.2.
6.7.2. Исследуемые показатели:
6.7.2.1. Интегральные показатели
|
Изучаемые показатели |
Периодичность сбора данных |
|
Общее состояние животных (внешний вид, двигательная активность, состояние шерстного покрова) |
каждые 2 дня |
|
Поедаемость корма |
ежедневно |
|
Масса тела |
каждые 7 дней |
6.7.2.2. Показатели, характеризующие генеративную функцию
|
Изучаемые показатели |
Сроки сбора данных |
|
Морфологические исследования семенников (определяют индекс сперматогенеза, среднее количество нормальных сперматогоний в каждом канальце, относительное количество канальцев с 12-й стадией мейоза) |
|
|
Морфологические исследования яичников (примордиальные фолликулы, фолликулы с двумя и более слоями фолликулярных клеток, третичные фолликулы, атретические тела, желтые тела, общее количество генеративных форм) |
6.7.2.3. Показатели, характеризующие пренатальное развитие потомства
|
Изучаемые показатели |
Сроки сбора данных |
|
1. Забой и вскрытие не менее 7 беременных самок на группу |
|
|
2. Визуальное исследование матки, плаценты, плодов: выявление живых и мертвых плодов, подсчет количества желтых тел, мест имплантации, количество резорбций по правому и левому рогу матки (с последующим вычислением пред- и постимплантационной эмбриональной смертности) |
|
|
3. Анализ эмбрионального материала (не менее 5 плодов от каждой крысы) |
6.7.2.4. Показатели, характеризующие постнатальное развитие потомства
|
Изучаемые показатели |
Сроки сбора данных |
|
1. Контроль рождения потомства |
20-22-й дни беременности |
|
2. Учет величины помета в день родов, подсчет количества живых и мертвых крысят, подсчет особей разного пола, установление внешних уродств, измерение массы тела, определение краниокаудального размера |
1-й день жизни |
|
3. Учет показателей физиологического развития крысят: срок отлипания ушных раковин, появление первичного волосяного покрова, прорезывание резцов, открытие глаз, опускание семенников, открытие влагалища; выживаемость потомства. |
1-30 дни жизни |
|
4. Измерение массы тела и роста крысят |
1, 4, 7, 14, 21 и 25 дни жизни |
6.7.3. Отчет по результатам исследований репродуктивной токсичности ГМО должен включать цифровые данные в форме таблиц, содержащих основные сведения, необходимые для суждения о наличии или отсутствии у исследуемого ГМО неблагоприятного действия на внутриутробное развитие и процессы репродукции.
Приложение 2
УТВЕРЖДЕНО
постановлением Главного
государственного
санитарного врача
Российской Федерации
от 30 ноября 2007 года N 80
Методы контроля и микробиологические факторы.
Пищевые продукты и пищевые добавки
Методы идентификации и количественного определения
генно-инженерно-модифицированных организмов
растительного происхождения
Методические указания
МУК 4.2.2304-07
I. Область применения
1.1. Настоящие методические указания устанавливают методы идентификации и количественного определения генно-инженерно-модифицированных организмов (ГМО) растительного происхождения в пищевых продуктах.
1.2. Представлены скрининговые методы, направленные на выявление и количественное определение рекомбинантной ДНК: промотора 35S из вируса мозаики цветной капусты, терминатора NOS из Agrobactetium tumefaciens и маркерных генов, позволяющие проводить предварительную проверку пищевой продукции.
1.3. Представлены методы, направленные на идентификацию и количественное определение рекомбинантной ДНК, характерной для генетических конструкций и уникальных трансформационных событий, для осуществления окончательной идентификации линии ГМО растительного происхождения.
II. Аппаратура, инструменты, лабораторная посуда, реактивы
2.1. Для проведения идентификации и количественного определения ГМО растительного происхождения используются следующая аппаратура и инструменты:
- амплификаторы типа ABI Prism 7000, iCycler iQ, Rotor Gene-3000 (6000), АНК -32, "Терцик МС-2" и другие;
- комплекс аппаратно-программный для анализа биологических микрочипов типа "ДЕРМИГЕН-001";
- прибор для горизонтального электрофореза типа "Mini-Sub Cell GT System" с комплектом кювет и гребенок;
- источник напряжения типа "Power Pac 300" с диапазоном регулируемого напряжения 50-300 В;
- трансиллюминатор типа Т12 с защитным экраном, диапозон излучения 300-400 нм;
- видеосистема типа "Gel Doc 2000 ", предназначенная для ввода в компьютер, анализа и документирования изображений люминисцирующих следов ДНК в гелях, окрашенных бромистым этидием, чувствительность - не менее 10 нг ДНК (по бромистому этидию);
", предназначенная для ввода в компьютер, анализа и документирования изображений люминисцирующих следов ДНК в гелях, окрашенных бромистым этидием, чувствительность - не менее 10 нг ДНК (по бромистому этидию);
- холодильник бытовой электрический типа "Электролюкс", с температурой морозильной камеры минус 20°С;
- микроцентрифуга настольная типа Эппендорф (частота вращения не менее 13000 мин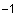 );
);
- термостат типа "TERMO 24-15" под пробирки типа Эппендорф вместимостью 0,5 и 1,5 мл, диапазон температур от 15°C до 120°C, количество гнезд - не менее 20 каждого типа, точность поддержания температуры - 0,2°C, разность температур между соседними ячейками - не более 0,5°C;
- термостат суховоздушный типа ТВЗ-25 с рабочей температурой 42°C, рабочий диапазон от 20°C до 60°C, точность поддержания температуры 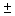 1°C;
1°C;
- аппарат для встряхивания типа "Вортекс", скорость вращения 250-3000 мин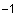 ;
;
- печь микроволновая (мощностью не менее 400 W);
- весы лабораторные общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г;
- анализатор потенциометрический типа МР 220, погрешность измерений рН ±0,01;
- гомогенизатор перистальтического типа "Стомайкер" или других моделей;
- облучатель бактерицидный настенный типа ОБН-150;
- дозаторы с переменным объемом дозирования: 0,2-2,0 мкл с шагом 0,01 мкл, с точностью 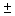 1,2%; 0,5-10,0 мкл с шагом 0,01 мкл, с точностью
1,2%; 0,5-10,0 мкл с шагом 0,01 мкл, с точностью 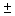 0,8%; 2-20 мкл с шагом 0,01 мкл, с точностью
0,8%; 2-20 мкл с шагом 0,01 мкл, с точностью 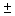 0,8%; 20-200 мкл с шагом 0,1 мкл, с точностью
0,8%; 20-200 мкл с шагом 0,1 мкл, с точностью 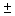 0,6%; 100-1000 мкл с шагом 1 мкл, с точностью
0,6%; 100-1000 мкл с шагом 1 мкл, с точностью 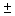 3%; 2-10 мл с шагом 0,1 мл, с точностью
3%; 2-10 мл с шагом 0,1 мл, с точностью 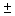 0,5%.
0,5%.
2.2. Для проведения идентификации и количественного определения ГМО растительного происхождения используется следующая лабораторная посуда:
- цилиндры мерные лабораторные вместимостью 10, 25, 100, 1000 мл, корпорация "Сигма Алдрич" (Sigma), кат. N Z 327263-2 ЕА, Z 327301-2 ЕА, Z 327379-2 ЕА, Z 327476-2 ЕА;
- колбы мерные лабораторные вместимостью 25, 50, 100, 250, 1000 мл, корпорация "Сигма Алдрич" (Sigma), кат. N Z 329517-1 ЕА, Z 329525-1 ЕА, Z 329533-1 ЕА, Z329541-1 ЕА, Z 329576-1 ЕА;
- пробирки микроцентрифужные типа Эппендорф вместимостью 0,2, 0,5, 1,5 мл;
- наконечники с фильтром для дозаторов с переменным объемом дозирования до: 10; 20; 200; 1000 мкл; 10 мл.
2.3. Для проведения идентификации и количественного определения ГМО растительного происхождения используются следующие реактивы:
- кислота соляная, корпорация "Сигма Алдрич" (Sigma), кат. N Н 1758;
- кислота борная, корпорация "Сигма Алдрич" (Sigma), кат. N В 7901;
- натрий едкий, корпорация "Сигма Алдрич" (Sigma), кат. N 221465;
- натрий хлористый, корпорация "Сигма Алдрич" (Sigma), кат. N S 3014;
- этилендиаминтетрауксусная кислота (ЭДТА), корпорация "Сигма Алдрич" (Sigma), кат. N Е 5134;
- гексадецилтриметиламмониум бромид (СТАВ), корпорация "Сигма Алдрич" (Sigma), кат. N Н 5882;
- трис (оксиметил) аминометан, корпорация "Сигма Алдрич" (Sigma), кат. N Т 6791;
- альбумин бычий сывороточный сухой (БСА), корпорация "Сигма Алдрич" (Sigma), кат. N B 4287;
- этидий бромистый, корпорация "Сигма Алдрич" (Sigma), кат. N Е 4391;
- спирт этиловый, корпорация "Сигма Алдрич" (Sigma), кат N 459836;
- спирт изопропиловый, корпорация "Сигма Алдрич" (Sigma), кат. N 19516;
- хлороформ, корпорация "Сигма Алдрич" (Sigma), кат. N 151823;
- вода деионизированная, корпорация "Сигма Алдрич" (Sigma), кат. N W 4502;
- вода дистиллированная, корпорация "Сигма Алдрич" (Sigma), кат. N W 3500;
- 2-меркаптоэтанол, корпорация "Сигма Алдрич" (Sigma), кат. N M 3148;
- термостабильный фермент Taq-полимераза, оптимум работы в области 70С-72С, корпорация "Сигма Алдрич" (Sigma), кат. N Д 1806;
- буфер для ПЦР с MgCl , корпорация "Сигма Алдрич" (Sigma), кат. N Р 2192;
, корпорация "Сигма Алдрич" (Sigma), кат. N Р 2192;
- агароза для электрофореза (тип П), корпорация "Сигма Алдрич" (Sigma), кат. N A 6877;
- маркер молекулярной массы ДНК, корпорация "Сигма Алдрич" (Sigma), кат. N Р 1473;
- стандартный образец состава генетически немодифицированного организма растительного происхождения, корпорация "Сигма Алдрич" (Fluka), кат. N 53198;
- стандартный образец состава ГМО растительного происхождения, корпорация "Сигма Алдрич" (Fluka), кат. N 44386;
- 2'-дезоксиаденозин-5'трифосфорной кислоты тетранатриевая соль, тригидрат (АТФ), корпорация "Сигма Алдрич" (Sigma), кат. N Д 4788;
- 2'-дезоксицитидин-5' трифосфорной кислоты тетранатриевая соль, тригидрат (ЦТФ), корпорация "Сигма Алдрич" (Sigma), кат. N Д 4913;
- 2'-дезоксигуанозин-5'трифосфорной кислоты тетранатриевая соль, тригидрат (ГТФ), корпорация "Сигма Алдрич" (Sigma), кат. N Д 5038;
- 2'-дезокситимидин-5' трифосфорной кислоты тетранатриевая соль, тригидрат (ТТФ), корпорация "Сигма Алдрич" (Sigma), кат. N T 9656;
- праймеры, ЗАО "Синтол", (Россия);
- натрия додецилсульфат (SDS), корпорация "Сигма Алдрич" (Sigma), кат. N L 4390;
- 3%-ный раствор перекиси водорода, корпорация "Сигма Алдрич" (Sigma), кат. N 7722.
2.4. Допускается использование другой аппаратуры, инструментов и реактивов с техническими характеристиками не хуже указанных выше отечественного и зарубежного производства, разрешенные для применения в установленном порядке.
III. Подготовка к анализу
3.1. Приготовление растворов:
- для приготовления 1М ТРИС - НСl (рН 7,5) в мерной колбе на 100 мл растворить 12,11 г Трис (оксиметил) аминометана в 80 мл дистиллированной воды, довести рН концентрированной соляной кислотой до 7,5, довести объем раствора до метки деионизованной водой, перемешать, хранить при температуре -20С° в течение не более года;
- для приготовления 5М NaCl растворить 29,22 г натрия хлористого в 100 мл дистиллированной воды, перемешать, хранить в колбе с притертой пробкой при комнатной температуре до 1 года;
- для приготовления 30%-ной NaОН растворить 3 г натрия гидроокиси в 7 мл дистиллированной воды;
- для приготовления 0,5 М ЭДТА (рН 8,0) в мерной колбе на 100 мл растворить 18,62 г этилендиаминтетрауксусной кислоты в 80 мл дистиллированной воды, раствором 30%-ной натрия гидроокиси довести рН раствора до 8,0, дистиллированной водой объем раствора довести до метки, перемешать, хранить в колбе с притертой пробкой при комнатной температуре до 1 года.
3.2. Приготовление хлороформа, насыщенного водой:
- смешать 100 мл( )хлороформа с 20 мл деионизированной воды и оставить на 24 ч для насыщения;
- срок хранения при температуре от 4°С до 5°С - не более 6 мес.
3.3. Приготовление 70%-ного раствора этилового спирта:
- смешать 70 мл( )96%-ного этилового спирта с 26 мл деионизированной воды;
- срок хранения при температуре от 4°С до 5°С - не более 2 мес.
3.4. Приготовление раствора БСА (20 мкг/ мл):
- растворить 0,002 г сухого альбумина бычьего сывороточного в 1 мл деионизиованной воды, 10 мкл полученного раствора смешать с 990 мкл деионизированной воды;
- срок хранения в морозильной камере при температуре минус 20°С - не более 6 мес.
3.5. Приготовление лизирующего буфера (2%-ного "СТАВ"):
- растворить 0,5 г гексадецилтриметиламмония бромида в 10 мл деионизированной воды, добавить 2,5 мл 1M Трис - HCl, 7 мл 5M NaCl, 1 мл 0,5 М ЭДТА, довести объем раствора деионизированной водой до 25 мл, перемешать;
- срок хранения при температуре от 4°С до 5°С - не более 6 мес.
3.6. Приготовление 1 х ТВЕ буфера для электрофореза:
- в мерной колбе на 1000 мл растворить 10,8 г Трис (оксиметил) аминометана, 5,5 г борной кислоты и 0,92 г этилендиаминтетрауксусной кислоты, довести дистиллированной водой до метки, перемешать до полного растворения;
- срок хранения 1 х раствора - 10 дней.
3.7. Приготовление раствора бромистого этидия - C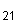 H
H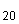 N
N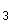 Br (10 мг/мл):
Br (10 мг/мл):
- растворить 1 г бромистого этидия в 100 мл дистиллированной воды;
- срок хранения в посуде темного стекла при температуре от 4°С до 5°С - 12 мес.
3.8. Приготовление осаждающего буфера СТАВ:
- в мерную колбу внести 1 г СТАВ, 0,5 г NaCl, добавить 100 мл деионизированной воды, довести раствором 30%-ной натрия гидроокиси рН раствора до 8,0, довести объем деионизированной водой до 200 мл;
- хранить при 4°C не более 6 месяцев.
3.9. Приготовление 1,2 М NaCl:
- растворить 7,0 г NaCl в 100 мл деионизированной воды, перемешать;
- хранить в колбе с притертой пробкой при комнатной температуре до 1 года.
3.10. Приготовление 10%-ного раствора SDS:
- растворить 10 г SDS в 90 мл дистиллированной воды;
- хранить при комнатной температуре не более 1 года.
IV. Выделение ДНК
4.1. Метод выделения ДНК с помощью СТАВ:
- навеску исследуемого гомогенизированного продукта массой 100 мг поместить в микроцентрифужную пробирку типа Эппендорф на 1,5 мл;
- добавить 300 мкл деионизированной воды, перемешать шпателем;
- добавить 500 мкл лизирующего СТАВ-буфера с меркаптоэтанолом, тщательно перемешать шпателем;
- инкубировать при 65°С 90 минут;
- центрифугировать 10 минут при 13000 об/мин;
- перести 500 мкл супернатанта в чистую пробирку типа Эппендорф вместимостью 1,5 мл;
- добавить 500 мкл хлороформа, перемешать на вортекс 30 секунд;
- центрифугировать 10 минут при 13000 об/мин;
- перенести 500 мкл верхней фракции в чистую пробирку, добавить 500 мкл хлороформа, перемешать;
- центрифугировать 5 минут при 13000 об/мин;
- перенести верхнюю фракцию в чистую пробирку типа Эппендорф вместимостью 1,5 мл, не захватывая слой хлороформа;
- добавить 2 объема СТАВ-осаждающего буфера, перемешать пипетированием;
- инкубировать 60 минут при комнатной температуре;
- центрифугировать 5 минут при 13000 об/мин;
- удалить супернатант;
- растворить осадок в 350 мкл NaCl (1,2 М);
- добавить 350 мкл хлороформа, перемешать на вортекс 30 секунд;
- центрифугировать 10 минут при 13000 об/мин;
- перенести верхнюю фракцию в чистую пробирку типа Эппендорф вместимостью 1,5 мл;
- добавить 0,6 объема изопропилового спирта, перемешать;
- центрифугировать 10 минут при 13000 об/мин;
- удалить супернатант;
- добавить 500 мкл 70%-ного раствора этилового спирта и перемешать на вортекс;
- центрифугировать 10 минут при 13000 об/мин;
- удалить супернатант;
- подсушить осадок не более 5 минут при 65°C для удаления капель спирта;
- растворить осадок в 100 мкл деионизированной воды, осторожно встряхивая, полученный раствор ДНК готов для проведения полимеразной цепной реакции (ПЦР);
- хранить при минус 20°С.
4.2. Сорбционный метод выделения ДНК:
- в центрифужные пробирки типа Эппендорф на 1,5 мл внести 300 мг бисера и 70-80 мг анализируемого материала, добавить 0,5 мл 5 мМ Na - cоль ЭДТА и термостатировать 30-60 минут при 65°С;
- cоль ЭДТА и термостатировать 30-60 минут при 65°С;
- к содержимому пробирки добавить 400 мкл лизирующего реагента, перемешать на вортекс до максимально однородного состояния, термостатировать при 65°C 60-120 минут;
- перемешать на вортекс, добавить 500 мкл бидистиллированной воды, перемешать на вортекс;
- центрифугировать 1 минуту при 12000 об/мин, прозрачный супернатант перенести в чистую пробирку;
- добавить 20 мкл сорбента, пробирку поместить на ротатор или перемешивать на вортекс 10 минут при 10-20 об/мин;
- центрифугировать 10 секунд при 12000 об/мин;
- удалить супернатант, к осадку добавить 200 мкл лизирующего реагента, перемешать на вортекс до однородного состояния, центрифугировать 10 секунд при 12000 об/мин;
- удалить супернатант, к осадку добавить 1 мл рабочего раствора солевого буфера, перемешать содержимое пробирки переворачиванием 5-10 раз, центрифугировать 10 секунд при 12000 об/мин;
- удалить супернатант, не задевая осадка;
- к осадку добавить 1 мл рабочего раствора солевого буфера, перемешать на вортекс, центрифугировать 10 секунд при 12000 об/мин, удалить супернатант;
- повторить предыдущий пункт еще раз;
- подсушить осадок при 65°С в течение 4-5 минут;
- к осадку добавить 50 мкл экстракционного раствора, отбор раствора из исходного флакона проводить при постоянном помешивании, не допуская выпадения в осадок гранул ионообменной смолы;
- суспендировать содержимое пробирки на вортекс 5-10 секунд до гомогенного состояния, затем термостатировать 10 минут при 65°С;
- повторно суспендировать пробу на вортекс, центрифугировать 1 минуту при 12000 об/мин;
- раствор ДНК перенести в чистую пробирку, хранить при минус 20°C.
V. ПЦР с электрофоретической детекцией
5.1. Идентификация видоспецифичной растительной ДНК.
5.1.1. Идентификация ДНК сои, ген лектина:
- праймеры:
1) 5' GCC CTC TAC TCC ACC CCC ATC C 3',
2) 5' GCC CAT CTG CAA GCC TTT TTG TG 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl |
25,00 |
|
Смесь нуклеотидов (4 млM) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/95°C, |
|
Амплификация |
30 сек/95°C, 30 сек/60°C, 40 сек/72°C, |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 118 пар нуклеотидов, приложение 2.1.
5.1.2. Идентификация ДНК кукурузы, ген зеина:
- праймеры:
1) 5' TGC TTG CAT TGT TCG CTC TCC TAG 3',
2) 5' GTC GCA GTG ACA TTG TGG CAT 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl |
25,00 |
|
Смесь нуклеотидов (4 мM) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/95°C |
|
Амплификация |
1 мин/94°C, 1 мин/60°C, 1 мин/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
7 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 329 пар нуклеотидов, приложение 2.2.
5.1.3. Идентификация ДНК картофеля, ген фосфоенолпируват карбоксилазы:
- праймеры:
1) 5' GTC TCC TTG GCT TGT CAT TTT ATG C 3',
2) 5' CAA GTT AGC TGC CAT CAT TCT GGC C 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
188,70 |
|
Буфер для ПЦР с MgCl |
25,00 |
|
Смесь нуклеотидов (4 млM) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
- реакционную смесь перемешать на вортекс и центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/95°C |
|
Амплификация |
1 мин/94°C, 1 мин/60°C, 1 мин/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
7 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 1149 пар нуклеотидов, приложение 2.3.
5.2. Скриниговый анализ.
5.2.1. Метод идентификации промотора 35 S:
- праймеры:
1) 5' GCT CCT ACA AAT GCC ATC A 3',
2) 5' GAT AGT GGG ATT GTG CGT CA 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/94°C |
|
Амплификация |
20 сек/94°C, 40 сек/54°C, 60 сек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
1 мин/4°C |
|
Скорость нагрева |
0,77°C/сек |
|
Скорость остывания |
3,15°C/сек |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 195 пар нуклеотидов, приложение 2.4.
5.2.2. Метод идентификации терминатора NOS:
- праймеры:
1) 5' GAA TCC TGT TGC CGG TCT TG 3',
2) 5' TTA TCC TAG TTT GCG CGC TA 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/94°C |
|
Амплификация |
20 сек/94°C, 40 сек/54°C, 60 сек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
1 мин/4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 180 пар нуклеотидов, приложение 2.5.
5.2.3. Метод идентификации маркерного гена npt II:
- праймеры:
1) 5' GGA TCT CCT GCT ATC T 3',
2) 5' GAT CAT CCT GAT CGA C 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
16,53 |
|
Буфер для ПЦР с MgCl |
3,30 |
|
Раствор БСА (20 мкг/мл) |
3,30 |
|
Смесь нуклеотидов (4 млM) |
0,62 |
|
Праймер 1 (32 пикомоль/мкл) |
0,40 |
|
Праймер 2 (59 пикомоль/мкл) |
0,20 |
|
Taq-полимераза (5 единиц/мкл) |
0,15 |
- реакционную смесь перемешать на вортекс и центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94°C |
|
Амплификация |
30 cек/95°C, 50 cек/50°C, 40 cек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 173 пары нуклеотидов, приложение 2.6.
5.3. Идентификация линий ГМО.
5.3.1. Метод идентификации сои линии 40-3-2:
- 1-й раунд, внешние праймеры:
1) 5'CCA CTG ACG TAA GGG ATG ACG 3',
2) 5'CAT GAA GGA CCG GTG GGA GAT 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
188,70 |
|
Буфер для ПЦР с MgCl |
25,00 |
|
Смесь нуклеотидов (4 млM) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95°C |
|
Амплификация |
30 сек/95°C, 30 сек/60°C, 40 сек/72°C |
|
Количество циклов амплификации |
25 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы поместить на холод, хранение не более одного часа в холодильнике до проведения 2-го раунда;
- 2-й раунд, внутренние праймеры:
3) 5' ATC CCA CTA TCC TTC GCA AGA 3',
4) 5' TGG GGT TTA TGG AAA TTG GAA 3'.
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl |
25,00 |
|
Смесь нуклеотидов (4 млM) |
12,50 |
|
Праймер 3 (20 мкМ) |
6,25 |
|
Праймер 4 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, добавить 0,5 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95°C |
|
Амплификация |
30 сек/95°C, 30 сек/60°C, 40 сек/72°C |
|
Количество циклов амплификации |
35 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза, продукт амплификации 169 пар нуклеотидов, приложение 2.7.
5.3.2. Метод идентификации сои линии А2704-12:
- праймеры:
1) 5' GGC GTT CGT AGT GAC TGA GG 3',
2) 5' GTT TTA CAA CGT CGT GAC TGG 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94°C |
|
Амплификация |
20 cек/94°C, 40 cек/54°C, 60 cек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 185 пар нуклеотидов, приложение 2.8.
5.3.3. Метод идентификации сои линии А5547-127.
- праймеры:
1) 5' TGT GGT TAT GGC GGT GCC ATC 3',
2) 5' TGC TAC AGG CAT CGT GGT GTC 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94°C |
|
Амплификация |
20 cек/94°C, 40 cек/54°C, 60 cек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 150 пар нуклеотидов, приложение 2.9.
5.3.4. Метод идентификации кукурузы линии Bt 176:
- 1-й раунд, внешние праймеры:
1) 5' CGG CCC CGA GTT CAC CTT 3',
2) 5' CTG CTG GGG ATG ATG TTG TTG 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
188,70 |
|
Буфер для ПЦР с MgCl |
25,00 |
|
Смесь нуклеотидов (4 млM) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
- реакционную смесь перемешать на вортекс и центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95°C |
|
Амплификация |
40 сек/95°C, 40 сек/60°C, 40 сек/72°C |
|
Количество циклов амплификации |
25 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы поместить на холод, хранение не более одного часа в холодильнике до проведения 2-го раунда;
- 2-й раунд, внутренние праймеры:
3) 5' CCG CAC CCT GAG CAG CAC 3',
4) 5' GGT GGC ACG TTG TTG TTC TGA 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl |
25,00 |
|
Смесь нуклеотидов (4 млM) |
12,50 |
|
Праймер 3 (20 мкМ) |
6,25 |
|
Праймер 4 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, добавить 0,5 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95°C |
|
Амплификация |
40 сек/95°C, 40 сек/60°C, 40 сек/72°C |
|
Количество циклов амплификации |
35 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 189 пар нуклеотидов, приложение 2.10.
5.3.5. Метод идентификации линии MON 810:
- 1-й раунд, внешние праймеры:
1) 5' TAT CTC CAC TGA CGT AAG GGA TGA C 3',
2) 5' TGC CCT ATA ACA CCA ACA TGT GCT T 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
188,70 |
|
Буфер для ПЦР с MgCl |
25,00 |
|
Смесь нуклеотидов (4 млM) |
12,50 |
|
Праймер 1 (20 мкМ) |
6,25 |
|
Праймер 2 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/95°C |
|
Амплификация |
45 сек/95°C, 50 сек/60°C, 50 сек/72°C |
|
Количество циклов амплификации |
35 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- 2-й раунд, внутренние праймеры:
3) 5' ACT ATC CTT CGC AAG ACC CTT CCTC 3',
4) 5' GCA TTC AGA GAA ACG TGG CAG TAA C 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
193,70 |
|
Буфер для ПЦР с MgCl |
25,00 |
|
Смесь нуклеотидов (4 млM) |
12,50 |
|
Праймер 3 (20 мкМ) |
6,25 |
|
Праймер 4 (20 мкМ) |
6,25 |
|
Taq-полимераза (5 единиц/мкл) |
1,30 |
- реакционную смесь перемешать на вортекс и центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, добавить 0,5 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать (30 секунд при 3000 об/мин), при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 95°C |
|
Амплификация |
45 сек/95°C, 50 сек/60°C, 50 сек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 149 пар нуклеотидов, приложение 2.11.
5.3.6. Метод идентификации кукурузы линии MON 863:
- праймеры:
1) 5' GTA GGA TCG GAA AGC TTG GTA C 3',
2) 5' TGT TAC GGC CTA AAT GCT GAA CT 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс и центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94°C |
|
Амплификация |
20 сек/94°C, 40 сек/54°C, 60 сек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
1 мин. - 4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 84 пары нуклеотидов, приложение 2.12.
5.3.7. Метод идентификации кукурузы линии NK 603:
- праймеры:
1) 5' AGT AAT GAC CTC GAG TAA GCT TGT TAA 3',
2) 5' AAG AGA TAA CGA GAT CCA CTC AAA CAC T 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94°C |
|
Амплификация |
20 сек/94°C, 40 сек/54°C, 60 сек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
1 мин. - 4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 108 пар нуклеотидов, приложение 2.13.
5.3.8. Метод идентификации кукурузы линии Bt 11:
- праймеры:
1) 5' ССA TTT TTC AGC TAG GAA GTT C 3',
2) 5' TCG TTG ATG TTK GGG TTG TTG TCC 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
10 мин/ 95°C |
|
Амплификация |
30 сек/95°C, 60 сек/63°C, 60 сек/72°C |
|
Количество циклов амплификации |
10 |
|
Амплификация |
30 сек/95°C, 30 сек/60°C, 30 сек/95°C |
|
Количество циклов амплификации |
30 |
|
Конечное удлинение |
7 мин/72°C |
|
Фаза остывания |
1 мин. - 4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 110 пар нуклеотидов, приложение 2.14.
5.3.9. Метод идентификации кукурузы Т 25:
- праймеры:
1) 5' GCC AGT TAG GCC AGT TAC CCA 3',
2) 5' TGA GCG AAA CCC TAT AAG AAC CCT 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
10 мин/ 95°C |
|
Амплификация |
30 сек/95°C, 60 сек/63°C, 60 сек/72°C |
|
Количество циклов амплификации |
10 |
|
Амплификация |
30 сек/95°C, 30 сек/60°C, 30 сек/95°C |
|
Количество циклов амплификации |
30 |
|
Конечное удлинение |
7 мин/72°C |
|
Фаза остывания |
1 мин. - 4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 149 пар нуклеотидов, приложение 2.15.
5.3.10. Метод идентификации кукурузы линии GA 21:
- праймеры:
1) 5' ACG GTG GAA GAG TTC AAT GTA TG 3',
2) 5' TCT CCT TGA TGG GCT GCA 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс и центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94°C |
|
Амплификация |
20 сек/94°C, 40 сек/54°C, 60 сек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
1 мин. - 4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 270 пар нуклеотидов, приложение 2.16.
5.3.11. Метод идентификации кукурузы линии MIR 604:
- праймеры:
1) 5' GGT ACC CAT TTG GCG CCG AT 3',
2) 5' CAG CGT TGC GGT TCT GTC AG 3';
- реакционная смесь для проведения ПЦР:
|
Реактивы |
Объем, мкл |
|
Раствор ДНК |
0,5 |
|
Праймер 1 (20 мкМ) |
1,0 |
|
Праймер 2 (20 мкМ) |
1,0 |
|
Буферная смесь |
2,5 |
|
Taq-полимераза |
0,2 |
|
Деионизированная вода |
19,8 |
- состав буферной смеси:
|
Реактивы |
Объем, мкл |
|
1 М KCL |
500 |
|
100 мМ dATP |
20 |
|
100 мМ dCTP |
20 |
|
100 мМ dTTP |
20 |
|
100 мМ dGTP |
20 |
|
100 мМ MgC |
150 |
|
Деионизированная вода |
170 |
|
1 М Tris-HCl-pH 8,3 |
100 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
4 мин /94°C |
|
Амплификация |
30 сек/95°C, 30 сек/55°C, 2 мин/72°C |
|
Количество циклов амплификации |
34 |
|
Конечное удлинение |
5 мин/72°C |
|
Фаза остывания |
до конца/ 4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 895 пар нуклеотидов, приложение 2.17.
5.3.12. Метод идентификации кукурузы линии MON 88017:
- праймеры:
1) 5' GAG CAG GAC CTG CAG AAG CT 3',
2) 5' TCC GGA GTT GAC CAT CCA 3';
- реакционная смесь для проведения ПЦР:
|
Реактивы |
Объем, мкл |
|
Раствор ДНК |
0,5 |
|
Праймер 1 (20 мкМ) |
1,0 |
|
Праймер 2 (20 мкМ) |
1,0 |
|
Буферная смесь |
2,5 |
|
Taq-полимераза |
0,2 |
|
Деионизированная вода |
19,8 |
- состав буферной смеси:
|
Реактивы |
Объем, мкл |
|
1 М KCL |
500 |
|
100 мМ dATP |
20 |
|
100 мМ dCTP |
20 |
|
100 мМ dTTP |
20 |
|
100 мМ dGTP |
20 |
|
100 мМ MgC |
150 |
|
Деионизированная вода |
170 |
|
1 М Tris-HCl-pH 8,3 |
100 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
4 мин/94°C |
|
Амплификация |
30 сек/95°C, 30 сек/55°C, 2 мин/72°C |
|
Количество циклов амплификации |
34 |
|
Конечное удлинение |
5 мин/72°C |
|
Фаза остывания |
до конца/4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации - 94 пары нуклеотидов, приложение 2.18.
5.3.13. Метод идентификации сахарной свеклы линии Н7-1:
- праймеры:
1) 5' TGG GAT CTG GGT GGC TCT AAC T 3',
2) 5' AAT GCT GCT AAA TCC TGA G 3';
- реакционная смесь для проведения ПЦР рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94°C |
|
Амплификация |
20 сек/94°C, 40 сек/54°C, 60 сек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
1 мин. /4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации 110 пар нуклеотидов, приложение 2.19.
5.3.14. Метод идентификации риса LL 62:
- праймеры:
1) 5' AGC TGG CGT AAT AGC GAA GAG G 3',
2) 5' TGC TAA CGG GTG CAT CGT CTA 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
169,0 |
|
Буфер для ПЦР с MgCl |
29,0 |
|
Раствор БСА (20 мкг/мл) |
29,0 |
|
Смесь нуклеотидов (4 млM) |
14,0 |
|
Праймер 1 (20 мкМ) |
7,0 |
|
Праймер 2 (20 мкМ) |
7,0 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
3 мин/ 94°C |
|
Амплификация |
20 сек/94°C, 40 сек/54°C, 60 сек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
1 мин. /4°C |
- после проведения амплификации пробы готовы для проведения электрофореза в агарозном геле, продукт амплификации 88 пар нуклеотидов, приложение 2.20.
5.3.15. Метод идентификации картофеля, устойчивого к колорадскому жуку сортов Рассет Бурбанк Ньюлив, Супериор Ньюлив, Елизавета 2904/1 kgs, Луговской 1210 amk:
- 1-й раунд, внешние праймеры:
1) 5' CTA CCA CTA AGG ATG TTA TCC 3',
2) 5' ATG CAC TCA CGT AGT CCT CC 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
161,3 |
|
Буфер для ПЦР с MgCl |
33,0 |
|
Раствор БСА (20 мкг/мл) |
33,0 |
|
Смесь нуклеотидов (10 млM) |
6,2 |
|
Праймер 1 (20 мкМ) |
2,5 |
|
Праймер 2 (20 мкМ) |
2,5 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, добавить 1,0 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
2 мин/ 98°C |
|
Амплификация |
30 сек/95°C, 30 сек/60°C, 40 сек/72°C |
|
Количество циклов амплификации |
20 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- хранение не более одного часа в холодильнике до проведения 2-го раунда;
- 2-й раунд, внутренние праймеры:
3) 5' CTA CCA CTA AGG ATG TTA TCC 3',
4) 5' TTG TAT AGA AGC TCA CGA GG 3';
- реакционная смесь для проведения ПЦР, рассчитанная на 10 проб:
|
Реактивы |
Объем, мкл |
|
Деионизированная вода |
164,8 |
|
Буфер для ПЦР с MgCl |
33,0 |
|
Раствор БСА (20 мкг/мл) |
33,0 |
|
Смесь нуклеотидов (10 млM) |
6,2 |
|
Праймер 3 (20 мкМ) |
2,5 |
|
Праймер 4 (20 мкМ) |
2,5 |
|
Taq-полимераза (5 единиц/мкл) |
1,5 |
- реакционную смесь перемешать на вортекс, центрифугировать 30 секунд при 3000 об/мин, разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, добавить 0,5 мкл раствора ДНК в каждую пробирку, перемешать, центрифугировать 30 секунд при 3000 об/мин, при использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация |
2 мин/ 98°C |
|
Амплификация |
30 сек/95°C, 30 сек/60°C, 40 сек/72°C |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72°C |
|
Фаза остывания |
4°C |
- после проведения амплификации пробы готовы для проведения электрофореза, продукт амплификации - 102 пары нуклеотидов, приложение 2.21.
VI. Проведение электрофореза в агарозном геле
6.1. Приготовление 2%-ного агарозного геля:
- к 1 г агарозы добавить 50 мл 1х буфера ТВЕ, тщательно перемешать;
- полученный раствор поместить в микроволновую печь на 2-5 мин или прокипятить на водяной бане 15 мин до полного расплавления агарозы;
- расплавленную агарозу охладить до 56°C, добавить 5 мкл бромистого этидия, тщательно перемешать, разлить в подготовленную форму, толщина геля 0,5-0,7 см, через 30-40 минут удалить гребенку;
- готовый гель использовать сразу или хранить в 1х ТВЕ буфере в холодильнике при +4°C.
6.2. Проведение электрофореза:
- 10 мкл реакционной смеси после аплификации внести в лунку геля, в одну из лунок внести маркер молекулярной массы;
- поместить заполненный гель в камеру для электрофореза с буфером 1х ТБЕ, толщина слоя буфера над поверхностью геля ~ 2-3 мм;
- провести электрофорез в режиме постоянного напряжения 100V 70-90 минут;
- гель (без формы) поместить на экран трансиллюминатора;
- документировать результат фореза при помощи гель-документирующей системы, фотокопию геля приложить к отчету по идентификации.
VII. ПЦР с детекцией результатов методом ферментного
анализа на биологическом микрочипе
7.1. Используются следующие праймеры:
- на 35S-промотор вируса мозаики цветной капусты:
5 CGG CTA CTC CAA GAA TAT CAA AGA TAC AGT TTC AGA AGA (39 н.о.),
5' CCA TTT TCC TTT TTT ATT GTC CTT TCG ATG AAG TGA CAG A (40 н.о.);
- на маркерный ген gus из бактерии Escherichia coli:
5' ACC GTA CCT CGC ATT ACC CTT ACG CTG AAG AGA (33 н.о.),
5' TGC CCG CTT CGA AAC CAA TGC CTA AAG AGA (30 н.о.);
- на терминатор nos из агробактерии Agrobacterium tumefaciens:
5' GGA CAA GCC GTT TTA CGT TTG GAA CTG ACA GA (32 н.о.),
5' GCC TGA CGT ATG TGC TTA GCT CAT TAA ACT CCA GA (35 н.о.);
- на маркерный ген nptII из транспазона Tn5 бактериального происхождения:
5' GTG ACC CAT GGC GAT GCC TGC TTG C (25 н.о.),
5' ACC CAG CCG GCC ACA GTC GAT GAA TCC AGA (30 н.о.);
- на промотор ocs из агробактерии Agrobacterium tumefaciens:
5' AAA AAG TGG CAG AAC CGG TCA AAC CTA AAA GA (32 н.о.),
5' CGT TAT TAG TTC GCC GCT CGG TGT GTC GTA GA (32 н.о.).
7.2. Набор реактивов для ассиметричной мультиплексной ПЦР (амПЦР) включает:
- сухие смеси, включающие Taq ДНК полимеразу, дезоксинуклеозидтрифосфаты, хлорид магния с конечными концентрациями, соответственно, 1 ед, 200 мкМ и 2,5 млМ, оптимизированную буферную систему для проведения одной стандартной ПЦР:
- растворитель;
- минеральное масло;
- "+" контроль амплификации - 1 пробирка, 0,5 мл.
7.3. Проведение реакции:
- необходимое количество микропробирок с сухими реактивами промаркировать соответствующим образом: "-" контроль", "исследуемые пробы", "+" контроль";
- добавить во все пробирки по 5 мкл праймеров, 10 мкл растворителя;
- в пробирку, которая служит отрицательным контролем, добавить 5 мкл деионизированной воды, в опытные пробирки - по 5 мкл раствора исследуемой ДНК, в пробирку с положительным контролем - 5 мкл раствора контрольной ДНК;
- добавить во все пробирки по 20 мкл минерального масла;
- пробы готовы для проведения амплификации;
- запустить программу амплификации:
|
Шаг |
Температура °C |
Время инкубации, |
Количество циклов |
|
1) |
94 |
180 |
1 |
|
2) |
94 |
30 |
42 |
|
3) |
62,5 |
30 |
|
|
4) |
72 |
180 |
1 |
- после проведения амплификации пробы готовы для осуществления гибридизации.
7.4. Гибридизация ДНК, ферментный анализ на биологическом микрочипе и сканирование результатов:
- набор реактивов для ДНК гибридизации и ферментного анализа содержит 20x SSC - 50 мл, диаминобензидин (ДАБ) - 100 таблеток, конъюгат пероксидазы хрена со стрептавидином - 0,1 мл с концентрацией 1 мг/ мл, 1 пробирка;
- приготовить рабочие разведения раствора 20 х SSC (3M NaCl, 0,3 М цитрат натрия, рН 7,4): 2 х SSC, 0,1% SDS; 0,1x SSC; 0,1x SSC, 0,1% SDS; 0,01 x SSC;
- схема приготовления 100 мл раствора:
|
Раствор: |
20 х SSC, мл |
10%-ный SDS, мл |
Н |
|
2 х SSC, 0,1% SDS |
10,00 |
1 |
89,00 |
|
0,1 х SSC |
0,50 |
- |
99,50 |
|
0,1 х SSC, 0,1% SDS |
0,50 |
1 |
98,50 |
|
0,01 х SSC |
0,05 |
- |
99,95 |
- микропробирки с продуктами амплификации ДНК центрифугировать 1-2 секунды для сбора пробы на дне пробирки, добавить в каждую микропробирку 5 мкл 20 х SSC и 0,2 мкл 10% SDS, перемешать, центрифугировать 1-2 секунды при 3000 об/мин, распределить полученную смесь по поверхности микрочипа, содержащей зоны иммобилизованных олигонуклеотидов;
- поместить микрочип во влажную камеру, поставить на 1 час в воздушный термостат с температурой 42°C;
- по окончании реакции капли смыть буфером 2 х SSC, 0,1% SDS, тщательно промыть чип растворами 2 х SSC, 0,1% SDS - 1 раз 5 минут, 0,1 х SSC, 0,1% SDS - 2 раза по 5 минут, 0,1 х SSC - 5 раз по 1 минуте, - 0,01 х SSC в течение 10 секунд.
7.5. Проведение ферментного анализа:
- исходный стрептавидин-пероксидазный конъюгат разбавить в 200 раз буфером 1 х SSC, содержащим 1% БСА (бычий сывороточный альбумин), из расчета 25 мкл на микрочип;
- нанести 25-30 мкл разведенного конъюгата на рабочую зону микрочипа и поместить его на 30 минут во влажную камеру при комнатной температуре;
- смыть конъюгат раствором 1 х SSC;
- залить микрочип раствором 2 х SSC, промыть 5 минут;
- промыть микрочип раствором 1 х SSC;
- непосредственно перед применением приготовить раствор субстрата - диаминобензидина (ДАБ), для этого растворить таблетку ДАБ в 1 см буфера 0,1 х SSC, добавить 30 мм
буфера 0,1 х SSC, добавить 30 мм 3%-ного раствора пероксида водорода и перемешать, раствор использовать немедленно;
3%-ного раствора пероксида водорода и перемешать, раствор использовать немедленно;
- залить рабочую зону микрочипа раствором субстрата, выдержать от 2 до 10 минут при комнатной температуре;
- в случае положительной реакции появляются коричневые пятна окисленного субстрата;
- промыть микрочип дистиллированной водой, встряхнуть капли воды и поместить в термостат 42°C на 5-10 минут, после сушки микрочип с окрашенными зонами хранить в темном месте.
7.6. Сканирование биологических микрочипов:
- осуществлять с применением аппаратно-программного комплекса для анализа биологических микрочипов типа "ДЕГМИГЕН-001" и компьютерной программы для анализа изображений;
- в соответствии с руководством по эксплуатации, поставляемым в комплекте с аппаратно-программным комплексом подготовить сканер микрочипов к работе;
- поместить микрочип в рамку для сканирования, зафиксировать его и закрыть рамку;
- запустить программу сканирования, функционирующую в диалоговом режиме, дождаться появления на мониторе приглашения к сканированию и только после этого вставить рамку с микрочипом в приемное окно детектора;
- после завершения сканирования микрочипа сохранить изображение, присвоив файлу соответствующее имя.
7.7. Анализ изображений биочипов:
- запустить программу обработки изображения микрочипа, ввести оцифрованное изображение в программу, для этого выбрать опцию "Файл", открыть изображение, в появившемся диалоговом окне выбрать формат, в котором представлены изображения, и выбрать в списке нужный файл, изображение появится в основном окне программы;
- провести операцию разметки матрицы, чтобы совместить центры измерительных зондов с центрами пятен решетки в изображении, для этого выбрать опцию "Анализ", "Разметка матрицы";
- разметка начинается с рисования прямоугольника, боковые стороны которого проходят через центры узлов крайних столбцов, для этого нужно щелкнуть левой кнопкой мыши в центре левого верхнего пятна/ячейки, затем, держа кнопку нажатой, переместить правую нижнюю вершину появившегося прямоугольника в центр нижнего правого узла;
- в результате предварительной разметки на экране появится четырехугольник с внутренними линиями, расположенными равномерно, в соответствии с заданным числом столбцов матрицы, чтобы завершить разметку и закрыть диалоговое окно, нужно нажать клавишу "Принять";
- после завершения базовой разметки провести автоматическую коррекцию положения зондов, для этого в меню выбрать опцию "Настройки / Автоматическая подстройка";
- для анализа результатов нужно выбрать опцию меню "Анализ" - "Показать результаты", по окончании измерений программа предоставляет возможность подготовки и распечатки протокола испытаний, для этого нужно выбрать опцию меню "Файл", и затем "Заполнить протокол", после этого появится окно с формой для заполнения, после того как она будет заполнена, нажать кнопку "Выход".
7.8. Интерпретация результатов:
- появление регистрируемого компьютерной программой оптического сигнала в одной, нескольких или во всех пяти зонах гибридизации, содержащих иммобилизованные олигонуклеотиды, указывает на присутствие рекомбинантной ДНК, свидетельствующей о наличии ГМО растительного происхождения в анализируемом образце;
- отсутствие регистрируемого оптического сигнала во всех пяти гибридизационных зонах, содержащих иммобилизованные олигонуклеотиды, указывает на отсутствие рекомбинантной ДНК, что свидетельствует о том, что анализируемый образец не имеет ГМО растительного происхождения;
- появление оптического сигнала в зоне гибридизации при использовании отрицательного контроля амплификации, свидетельствует о получении ложноположительного результата, причиной может быть загрязнение реактивов и/или оборудования, в этом случае необходимо обработать поверхности лабораторных столов и оборудования раствором 1Н соляной кислоты, заменить реактивы на свежеприготовленные и повторить анализ;
- отсутствие оптического сигнала при использовании положительного контроля амплификации, свидетельствует о получении ложноотрицательного результата, причиной могут быть потеря активности одного из компонентов реакционной смеси для амПЦР и/или гибридизации с применением ферментного анализа на биологическом микрочипе, в этом случае необходимо заменить реактивы на свежеприготовленные и повторить анализ.
VIII. Количественный анализ методом ПЦР в реальном времени
8.1. Метод количественного определения генетически модифицированной сои:
- метод позволяет количественно определить рекомбинантную ДНК, характерную для генетически модифицированных линий сои в пищевых продуктах методом ПЦР в реальном времени;
- анализ проводится по гену лектина, который присутствует в геноме всех линий сои, и универсальной последовательности 35 S промотора вируса мозаики цветной капусты, который присутствует в геноме всех генетически модифицированных линий сои;
- праймеры на ген лектина:
1) 5' TCC ACC CCC ATC CAC ATT T 3',
2) 5' GGC ATA GAA GGT GAA GTT GAA GGA 3',
3) 5'-FAM-AAC CGG TAG CGT TGC CAG CTT CG-TAMRA-3',
длина ампликона 81 пара нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' GCC TCT GCC GAC AGT GGT 3',
5) 5' AAG ACG TGG TTG GAA CGT CTT C 3',
6) 5'-FAM-CAA AGA TGG ACC CCC ACC CAC G-TAMRA-3',
длина ампликона 82 пары нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК сои:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
10,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР без MgCl |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5 ммоль/л |
|
Праймеры 1,2 |
900 нмоль/л каждого |
|
dUTP |
400 ммоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP (2,5 ммоль/л каждого) |
200 ммоль/л каждого |
|
Праймер 3 |
100 нмоль/л |
|
Деионизированная вода |
Довести до 50,00 мкл |
- реакционная смесь для проведения ПЦР количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
10,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР без MgCl |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5 ммоль/л |
|
Праймеры 4,5 |
900 нмоль/л каждого |
|
dUTP |
400 ммоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 ммоль/л каждого |
|
Праймер 6 |
100 нмоль/л |
|
Деионизированная вода |
Довести до 50,00 мкл |
- при проведении исследования использовали стандартные образцы состава генетически модифицированной сои;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/50°C |
|
Денатурация |
10 мин/ 95°C |
|
Амплификация |
15 сек/95°C, |
|
Количество циклов амплификации |
45 |
- результаты исследования, приложение 2.22.
8.2. Метод количественного определения генетически модифицированной кукурузы:
- метод позволяет количественно определить рекомбинантную ДНК, характерную для генетически модифицированных линий кукурузы, в пищевых продуктах методом ПЦР в реальном времени;
- анализ проводится по гену инвертазы кукурузы, который присутствует в геноме всех линий кукурузы, и универсальной последовательности 35 S промотора вируса мозаики цветной капусты, который присутствует в геноме всех генетически модифицированных линий за исключением GA 21.
- праймеры на ген инвертазы кукурузы:
1) 5' CAC TCC ATC GTG GAG AGC TT 3',
2) 5' GGC GTT GTT GAA GAG GAA GA 3',
3) 5'-FAM-TAC CCC ACA CGA GCC ATC TAC GAC T-TAMRA-3',
длина ампликона 111 пар нуклеотидов;
- праймеры, на целевую последовательность ГМО:
4) 5' CGT CTT CAA AGC AAG TGG ATT G 3',
5) 5' TCT TGC GAA GGA TAG TGG GAT T 3',
6) 5'-FAM-TCT CCA CTG ACG TAA GGG ATG ACG CA-TAMRA-3',
длина ампликона 79 пар нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
10,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР без MgCl |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5 ммоль/л |
|
Праймеры 1,2 |
900 нмоль/л каждого |
|
dUTP |
400 ммоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP (2,5 ммоль/л каждого) |
200 ммоль/л каждого |
|
Праймер 3 |
100 нмоль/л |
|
Деионизированная вода |
Довести до 50,00 мкл |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
10,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР без MgCl |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5 ммоль/л |
|
Праймеры 4,5 |
900 нмоль/л каждого |
|
dUTP |
400 ммоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 ммоль/л каждого |
|
Праймер 6 |
100 нмоль/л |
|
Деионизированная вода |
Довести до 50,00 мкл |
- при проведении исследования использовали стандартные образцы состава генетически модифицированной кукурузы;
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация |
10 мин/ 95°C |
|
Амплификация |
15 сек/95°C, |
|
Количество циклов амплификации |
50 |
- результат исследований, приложение 2.23.
8.3. Метрологические характеристики метода:
- границы интервала, в котором погрешность определения находится с доверительной вероятностью Р = 0,95, составляют от 0,1% до 5%, нижнюю и верхнюю границы погрешности определяют с использованием сертифицированных стандартных образцов состава и свойств, стандартные отклонения повторяемости результатов ( ) составляет от 0,067 (для стандарта 0,1%) до 0,540 (для стандарта 5%), что соответствует погрешности сертифицированных стандартных образцов состава ГМО растительного происхождения;
) составляет от 0,067 (для стандарта 0,1%) до 0,540 (для стандарта 5%), что соответствует погрешности сертифицированных стандартных образцов состава ГМО растительного происхождения;
- результаты анализа образцов принимают, если коэффициент корреляции калибровочной прямой, построенной по сертифицированным стандартным образцам состава ГМО растительного происхождения, по методу наименьших квадратов (R ) > 0,97.
) > 0,97.
8.4. Метод количественного определения сои линии 40-3-2:
- основан на ПЦР в реальном времени с определением гена лектина и генетической конструкции, характерной для сои линии 40-3-2;
- используются зонды, специфичные к трансгену и гену лектина, меченые красителями FAM и VIC соответственно;
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной сои:- 5,0%, 2,0%, 1,0%, 0,5% и 0,00%.
- праймеры на ген лектина сои:
1) 5' TCC ACC CCC ATC CAC ATT T3',
2) 5' GGC ATA GAA GGT GAA GTT GAA GGA 3',
3) 5'-VIC-AAC CGG TAG CGT TGC CAG CTT CG-TAMRA-3';
- на целевую последовательность ГМО:
4) 5' GCC ATG TTG TTA ATT TGT GCC AT 3'
5) 5' GAA GTT CAT TTC ATT TGG AGA GGA C 3'
6) 5'-FAM-CTT GAA AGA TCT GCT AGA GTC AGC TTG TCA GCG-TAMRA-3'
- реакционная смесь для проведения ПЦР:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50-200 нг) |
5,00 |
|
Деионизированная вода |
18,30 |
|
Праймеры 1,2 (20 мкМ) |
0,10 каждого |
|
Праймеры 4,5 (20 мкМ) |
0,25 каждого |
|
Праймеры 3,6 (10 мкМ) |
0,50 каждого |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10 Х |
10,60 |
|
MgCl |
4,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,40 |
|
Итого: |
50,00 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
8.5. Метод количественного определения сои линии А2704-12:
- основан на ПЦР в реальном времени, с определением гена лектина и области ДНК, специфичной трансформационному событию А2704-12;
- используются зонды, меченые красителем FAM;
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной сои А2704-12 : 0,1%, 0,4%, 0,9%, 2,0%; 3,3%;
- праймеры на ген лектина сои:
1) 5' CAC CTT TCT CGC ACC AAT TGA CA3',
2) 5' TCA AAC TCA ACA GCG ACG AC 3',
3) 5' FAM-CCA CAA ACA CAT GCA GGT TAT CTT GG-TAMRA-3',
длина ампликона 105 пар нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' GCA AAA AAG CGG TTA GCT CCT3',
5) 5' ATT CAG GCT GCG CAA CTG TT 3',
6) 5'-FAM-CGG TCC TCC GAT CGC CCT TCC-TAMRA-3',
длина ампликона 64 пары нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК сои:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50-200 нг) |
5,0 |
|
Деионизированная вода |
18,0 |
|
Праймеры 1,2 (20 мкМ) |
0,5 каждого |
|
Праймер 3 (10 мкМ) |
1,0 |
|
Смесь нуклеотидов (4 млМ) |
10,0 |
|
Буфер для ПЦР 10 Х |
10,6 |
|
MgCl |
4,0 |
|
Taq-полимераза (5 единиц/мкл) |
0,4 |
|
Итого: |
50,0 |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50-200 нг) |
5,0 |
|
Деионизированная вода |
17,0 |
|
Праймеры 4,5 (20 мкМ) |
1,0 каждого |
|
Праймер 6 (10 мкМ) |
1,0 |
|
Смесь нуклеотидов (4 млМ) |
10,0 |
|
Буфер для ПЦР 10 Х |
10,6 |
|
MgCl |
4,0 |
|
Taq-полимераза (5 единиц/мкл) |
0,4 |
|
Итого: |
50,0 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
8.6. Метод количественного определения кукурузы линии MON 810:
- основан на ПЦР в реальном времени с определением гена, кодирующего синтез группы белков, присущих для всех линий кукурузы (hmg) и области ДНК, специфичной трансформационному событию MON 810, на границе генома кукурузы и элемента генетической конструкции промотора 35 S из вируса мозаики цветной капусты;
- используются зонды, меченые красителем FAM;
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы - < 0,02%, 0,1%, 0,5%, 1,0%, 2,0%, 5,0%;
- праймеры на ген hmg:
1) 5' TTG GAC TAG AAA TCT CGT GCC CA 3',
2) 5' GCT ACA TAG GGA GCC TTG TCC T 3',
3) 5'-FAM-CAA TCC ACA CAA ACG CAC GCG TA-TAMRA-3',
длина ампликона 79 пар нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' TCG AAG GAC GAA GGA CTC TAA CGT 3',
5) 5' GCC ACC TTC CTT TTC CAC TAT CTT 3',
6) 5'-FAM -AAC ATC CTT TGC CAT TGC CCA GC -TAMRA-3',
длина ампликона 92 пары нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50-200 нг) |
5,0 |
|
Деионизированная вода |
19,3 |
|
Праймеры 1,2 (20 мкМ) |
0,1 каждого |
|
Праймер 3 (10 мкМ) |
0,5 |
|
Смесь нуклеотидов (4 млМ) |
10,0 |
|
Буфер для ПЦР 10 Х |
10,6 |
|
MgCl |
4,0 |
|
Taq-полимераза (5 единиц/мкл) |
0,4 |
|
Итого: |
50,0 |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 50-200 нг) |
5,0 |
|
Деионизированная вода |
19,0 |
|
Праймеры 4,5 (20 мкМ) |
0,25 каждого |
|
Праймер 6 (10 мкМ) |
0,5 |
|
Смесь нуклеотидов (4 млМ) |
10,0 |
|
Буфер для ПЦР 10 Х |
10,6 |
|
MgCl |
4,0 |
|
Taq-полимераза (5 единиц/мкл) |
0,4 |
|
Итого: |
50,0 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
8.7. Метод количественного определения кукурузы линии MON 863:
- основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы и области ДНК, специфичной трансформационному событию MON 863, на границе генома кукурузы и элемента генетической конструкции;
- используются зонды, меченые красителем FAM;
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: 0,01%, 1,0%, 5,0%, 10,0%;
- праймеры на ген adhl 1:
1) 5' CCA GCC TCA TGG CCA AAG 3',
2) 5' CCT TCT TGG CGG CTT ATC TG 3',
3) 5'-FAM-CTT AGG GGC AGA CTC CCG TGT TCC CT-3,'
длина ампликона 84 пары нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' GTA GGA TCG GAA AGC TTG GTA C 3',
5) 5' TGT TAC GGC CTA AAT GCT GAA CT 3',
6) 5'-FAM-TGA ACA CCC ATC CGA ACA AGT AGG GTC A-TAMRA-3',
длина ампликона 70 пар нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
4,00 |
|
Деионизированная вода |
19,00 |
|
Праймеры 1,2 (10 мкМ) |
0,75 каждого |
|
Праймер 3 (5 мкМ) |
0,50 |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10 Х |
10,60 |
|
MgCl |
4,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,40 |
|
Итого: |
50,00 |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
4,00 |
|
Деионизированная вода |
19,00 |
|
Праймеры 4,5 (10 мкМ) |
0,75 каждого |
|
Праймер 6 (5 мкМ) |
0,50 |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10 Х |
10,60 |
|
MgCl |
4,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,40 |
|
Итого: |
50,00 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
8.8. Метод количественного определения кукурузы линии NK 603:
- основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы и области ДНК, специфичной трансформационному событию NK 603, на границе генома кукурузы и элемента генетической конструкции;
- используются зонды, меченые красителем FAM;
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: 0,1%, 0,49%, 0,98%, 1,96%, 4,91%;
- праймеры на ген adhl 1:
1) 5' CCA GCC TCA TGG CCA AAG 3',
2) 5' CCT TCT TGG CGG CTT ATC TG 3',
3) 5'-FAM-CTT AGG GGC AGA CTC CCG TGT TCC CT-3',
длина ампликона 70 пар нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' ATG AAT GAC CTC GAG TAA GCT TGT TAA 3',
5) 5' AAG AGA TAA CAG GAT CCA CTC AAA CAC T 3',
6) 5'-FAM-TGG TAC CAC GCG ACA CAC TTC CAC TC-TAMRA-3',
длина ампликона 108 пар нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
4,00 |
|
Деионизированная вода |
19,00 |
|
Праймеры 1,2 (10 мкМ) |
0,75 каждого |
|
Праймер 3 (5 мкМ) |
0,50 |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10 Х |
10,60 |
|
MgCl |
4,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,40 |
|
Итого: |
50,00 |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
4,00 |
|
Деионизированная вода |
19,00 |
|
Праймеры 4,5 (10 мкМ) |
0,75 каждого |
|
Праймер 6 (5 мкМ) |
0,50 |
|
Смесь нуклеотидов (4 млМ) |
10,00 |
|
Буфер для ПЦР 10 Х |
10,60 |
|
MgCl |
4,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,40 |
|
Итого: |
50,00 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
8.9. Метод количественного определения кукурузы линии Bt 11:
- основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы и области ДНК, специфичной трансформационному событию Bt 11, на границе генома кукурузы и элемента генетической конструкции;
- используются зонды, меченые красителем FAM;
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы:0,1%, 0,3%, 0,7%, 1,0%, 1,3%, 2,0%;
- праймеры на ген adhl 1:
1) 5' СGT CGT TTC CCA TCT CTT CCT CC 3',
2) 5' CCA CTC CGA GAC CCT CAG TC 3',
3) 5'-FAM-AAT CAG GGC TCA TTT TCT CGC TCC TCA -TAMRA-3';
- праймеры на целевую последовательность ГМО:
4) 5' GCG GAA CCC CTA TTT GTT TA 3',
5) 5' TCC AAG AAT CCC TCC ATG AG 3',
6) 5'-FAM-AAA TAC ATT CAA ATA TGT ATC CGC TCA-TAMRA-3';
- реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 250 нг) |
6,000 |
|
Деионизированная вода |
9,000 |
|
Праймеры 1,2 (20 мкМ) |
0,375 каждого |
|
Праймер 3 (10 мкМ) |
0,500 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10млМ) |
0,500 каждого |
|
dUTP (20 млМ) |
0,500 |
|
Буфер для ПЦР 10 Х |
2,500 |
|
MgCl |
4,000 |
|
Taq-полимераза (5 единиц/мкл) |
0,250 |
|
Итого: |
25,000 |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
6,0000 |
|
Деионизированная вода |
7,7500 |
|
Праймеры 4,5 (20 мкМ) |
0,9375 каждого |
|
Праймер 6 (10 мкМ) |
0,6250 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,5000 каждого |
|
dUTP (20 млМ) |
0,5000 |
|
Буфер для ПЦР 10 Х |
2,5000 |
|
MgCl |
4,0000 |
|
Taq-полимераза (5 единиц/мкл) |
0,2500 |
|
Итого: |
25,0000 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
8.10. Метод количественного определения кукурузы линии T 25:
- основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы и области ДНК, специфичной трансформационному событию Т 25, на границе генома кукурузы и элемента генетической конструкции;
- используются зонды, меченые красителем FAM;
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: 0,15%, 0,40%, 0,90%, 2,00%, 3,30%;
- праймеры на ген adhl 1:
1) 5' CGT CGT TTC CCA TCT CTT CCT CCT 3',
2) 5' CCA CTC CGA GAC CCT CAG TC 3',
3) 5'-FAM-AAT CAG GGC TCA TTT TCT CGC TCC TCA-TAMRA-3',
длина ампликона 136 пар нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' ACA AGC GTG TCG TGC TCC AC 3',
5) 5' GAC ATG ATA CTC CTT CCA CCG 3',
6) 5'-FAM-TCA TTG AGT CGT TCC GCC ATT GTC G-TAMRA-3',
длина ампликона 102 пары нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Деионизированная вода |
9,75 |
|
Праймеры 1,2 (10 мкМ) |
0,50 каждого |
|
Праймер 3 (10 мкМ) |
0,50 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,50 каждого |
|
dUTP (20 млМ) |
0,50 |
|
Буфер для ПЦР 10 Х |
2,50 |
|
MgCl |
4,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Итого: |
25,00 |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Деионизированная вода |
8,75 |
|
Праймеры 4,5 (10 мкМ) |
1,00 каждого |
|
Праймер 6 (10 мкМ) |
0,50 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,50 каждого |
|
dUTP (20 млМ) |
0,50 |
|
Буфер для ПЦР 10 Х |
2,50 |
|
MgCl |
4,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Итого: |
25,00 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
8.11. Метод количественного определения кукурузы линии GA 21:
- основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы и области ДНК, специфичной трансформационному событию GA21, на границе генома кукурузы и элемента генетической конструкции;
- используются зонды, меченые красителем FAM;
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной кукурузы: 0,1%, 0,49%, 0,98%, 1,3%, 1,71%, 4,26% ;
- праймеры на ген adhl 1:
1) 5' ССA GCC TCA TGG CCA AAG 3',
2) 5' CCT TCT TGG CGG CTT ATC TG 3',
3) 5'-FAM-CTT AGG GGC AGA CTC CCG TGT TCC CT-TAMRA-3',
длина ампликона 70 пар нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' CTT ATC GTT ATG CTA TTT GCA ACT TTA GA 3',
5) 5' TGG CTC GCG ATC CTC CT 3',
6) 5'-FAM-CAT ATA CTA ACT CAT ATC TCT TTC TCA ACA GCA GGT GGG T-TAMRA-3',
длина ампликона 112 пар нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 300 нг) |
5,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР 10 Х |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5,00 ммоль/л |
|
Праймеры 1,2 |
150,00 нмоль/л каждого |
|
dUTP |
400,00 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200,00 мкмоль/л каждого |
|
Праймер 3 |
50,00 нмоль/л |
|
Деионизированная вода |
довести до 50,00 мкл |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 300 нг) |
5,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР 10 Х |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5,00 ммоль/л |
|
Праймеры 4,5 |
150,00 нмоль/л каждого |
|
dUTP |
400,00 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200,00 мкмоль/л каждого |
|
Праймер 6 |
50,00 нмоль/л |
|
Деионизированная вода |
довести до 50,00 мкл |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
8.12. Метод количественного определения кукурузы линии MIR 604:
- основан на ПЦР в реальном времени с определением гена, кодирующего синтез алкогольдегидрогеназы 1 (adhl 1), присущей для всех линий кукурузы и области ДНК, специфичной трансформационному событию MIR 604, на границе генома кукурузы и элемента генетической конструкции;
- используются зонды, меченые красителем FAM и VIC;
- для построения калибровочной прямой используются стандартные образцы состава и свойств генетически модифицированной кукурузы: менее 0,09%, 0,1%, 0,98%, 9,85%;
- праймеры на ген adhl 1:
1) 5' CGT CGT TTC CCA TCT CTT CCT CC 3',
2) 5' CCA CTC CGA GAC CCT CAG TC 3',
3) 5'-VIC-AAT CAG GGC TCA TTT TCT CGC TCC TCA-TAMRA-3',
длина ампликона 136 пар нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' GCG CAC GCA ATT CAA CAG 3',
5) 5' GGT CAT AAC GTG ACT CCC TTA ATT CT 3',
6) 5'-FAM -AGG CGG GAA ACG ACA ATC TGA TCA TG-TAMRA-3',
длина ампликона 76 пар нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК кукурузы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 250 нг) |
5,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР 10 Х |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5,00 ммоль/л |
|
Праймеры 1,2 |
300 нмоль/л каждого |
|
dUTP |
400 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 мкмоль/л каждого |
|
Праймер 3 |
200 нмоль/л |
|
Деионизированная вода |
довести до 25,00 мкл |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР 10 Х |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5 ммоль/л |
|
Праймер 4 |
600 нмоль/л |
|
Праймер 5 |
300 нмоль/л |
|
dUTP |
400 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 мкмоль/л каждого |
|
Праймер 6 |
200 нмоль/л |
|
Деионизированная вода |
довести до 25,00 мкл |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
40 |
8.13. Метод количественного определения риса линии LL 62:
- основан на ПЦР в реальном времени с определением гена, кодирующего синтез фосфолипазы Д (PLD), присущей для всех линий риса, и области ДНК, специфичной трансформационному событию LL 62, на границе генома риса и элемента генетической конструкции;
- используются зонды, меченые красителем FAM;
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированного риса: менее 0,09%, 0,45%, 0,9%, 1,8%, 3,6%;
- праймеры на ген PLD:
1) 5' TGG TGA GCG TTT TGC AGT CT 3',
2) 5' CTG ATC CAC TAG CAG GAG GTC C 3',
3) 5'-FAM-TGT TGT GCT GCC AAT GTG GCC TG -TAMRA-3',
длина ампликона 64 пары нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' AGC TGG CGT AAT AGC GAA GAG G 3',
5) 5' TGC TAA CGG GTG CAT CGT CTA 3',
6) 5'-FAM -CGC ACC GAT TAT TTA TAC TTT TAG TCC ACC-TAMRA-3',
длина ампликона 88 пар нуклеотидов;
- реакционная смесь для проведения ПЦР, количественное определение ДНК риса:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР 10 Х |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5 ммоль/л |
|
Праймеры 1,2 (10 мкМ) |
200 нмоль/л каждого |
|
dUTP |
400 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 мкмоль/л каждого |
|
Праймер 3 (10 мкМ) |
200 нмоль/л |
|
Деионизированная вода |
довести до 25,00 мкл |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 200 нг) |
5,00 |
|
Taq-полимераза (5 единиц/мкл) |
0,25 |
|
Буфер для ПЦР 10 Х |
5,00 |
|
Концентрация в реакционной смеси | |
|
MgCl |
5 ммоль/л |
|
Праймер 4,5 (10 мкМ) |
400 нмоль/л |
|
dUTP |
400 мкмоль/л |
|
Смесь нуклеотидов dATP, dCTP, dGTP |
200 мкмоль/л каждого |
|
Праймер 6 (10 мкМ) |
200 нмоль/л |
|
Деионизированная вода |
довести до 25,00 мкл |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Доамплификационный период |
2 мин/ 50°C |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
8.14. Метод количественного определения сахарной свеклы линии H7-1:
- основан на ПЦР в реальном времени с определением гена, кодирующего синтез глютамин синтетазы (GS), присущей для всех линий сахарной свеклы и области ДНК, специфичной трансформационному событию Н7-1, на границе генома сахарной свеклы и элемента генетической конструкции;
- используются зонды, меченые красителем FAM:
- для построения калибровочной прямой используются стандартные образцы состава генетически модифицированной сахарной свеклы: менее 0,1%, 0,5%, 0,9%, 2,0%, 5,0%;
- праймеры на ген GS :
1) 5' GAC CTC CAT ATT ACT GAA AGG AAG 3',
2) 5' GAG TAA TTG CTC CAT CCT GTT CA 3',
3) 5'-FAM-CTA CGA AGT TTA AAG TAT GTG CCG CTC-TAMRA-3',
длина ампликона 121 пара нуклеотидов;
- праймеры на целевую последовательность ГМО:
4) 5' TGG GAT CTG GGT GGC TCT AAC T 3',
5) 5' AAT GCT GCT AAA TCC TGA G 3',
6) 5'-FAM-AAG GCG GGA AAC GAC AAT CT-TAMRA-3',
длина ампликона 110 пар нуклеотидов:
- реакционная смесь для проведения ПЦР, количественное определение ДНК сахарной свеклы:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 125 нг) |
5,0000 |
|
Деионизированная вода |
9,2000 |
|
Праймеры 1,2 (100 мкМ) |
0,0375 каждого |
|
Праймер 3 (100 мкМ) |
0,0250 |
|
dUTP (20 млМ) |
0,5000 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,5000 каждого |
|
Буфер для ПЦР 10 Х |
2,5000 |
|
MgCl |
5,0000 |
|
Taq-полимераза (5 единиц/мкл) |
0,2000 |
|
Краситель ROX (25 мкМ) |
1,0000 |
|
Итого |
25,0000 |
- реакционная смесь для проведения ПЦР, количественное определение рекомбинантной ДНК:
|
Реактивы |
Объем, мкл |
|
Раствор целевой ДНК (максимальное количество ДНК 125 нг) |
5,0000 |
|
Деионизированная вода |
7,0750 |
|
Праймеры 4,5 (100 мкМ) |
0,1000 каждого |
|
Праймер 6 (100 мкМ) |
0,0250 |
|
dUTP (20 млМ) |
0,5000 |
|
Смесь нуклеотидов dATP, dCTP, dGTP (10 млМ) |
0,5000 каждого |
|
Буфер для ПЦР 10 Х |
2,5000 |
|
MgCl |
7,0000 |
|
Taq-полимераза (5 единиц/мкл) |
0,2000 |
|
Краситель ROX (25 мкМ) |
1,0000 |
|
Итого: |
25,0000 |
- условия амплификации:
|
Стадия |
Программа амплификации |
|
Денатурация первичная |
10 мин/ 95°C |
|
Амплификация |
|
|
Денатурация |
15 сек/95°C |
|
Отжиг |
60 сек/60°C измерение |
|
Количество циклов амплификации |
45 |
IX. Методы идентификации и количественного определения ГМО
с использованием тест-систем
9.1. Метод количественного определения генно-инженерно-модифицированной сои и кукурузы с использованием наборов "TaqMan GMO Soy Detection Kit" и "TaqMan GMO Maize Detection Kit":
- наборы реактивов предназначены для количественного определения в пищевых продуктах генно-инженерно-модифицированной кукурузы или сои;
- метод основан на ПЦР в реальном времени;
- амплифицируется участок эндогенной ДНК, характерной для всех линий кукурузы или сои, и участок рекомбинантной ДНК в ходе двух независимых реакций с использованием соответствующих праймеров и зондов, меченых флуоресцентным красителем;
- регистрация флуоресценции красителей осуществляется приборами типа ABI-PRISM 7000, Rotor Gene 3000 и анализируется с использованием программного обеспечения приборов;
- относительное содержание ГМО в пищевом продукте рассчитывается с использованием стандартных образцов состава, путем сравнения результатов измерения флуоресценции красителя FAM, специфичного для ГМО, с результатами измерения флуоресценции красителя VIC, специфичного для всех линий сои или кукурузы;
- выделение ДНК из стандартных образцов состава и из исследуемых образцов осуществляется одновременно одним методом с помощью СТАВ или набора реактивов "ДНК-сорб-С".
9.2. Метод идентификации и количественного определения ГМО с использованием наборов "Ампликвант ГМ соя", "Ампликвант ГМ кукуруза", "АмплиСенс ГМ соя FTR", "АмплиСенс ГМ кукуруза FTR", разработанных ФГУН Центральный НИИ эпидемиологии Роспотребнадзора.
9.2.1. Набор реактивов "Ампликвант ГМ соя":
- предназначен для количественного определения генно-инженерно-модифицированной сои;
- метод основан на ПЦР в реальном времени;
- амплифицируется участок эндогенной ДНК, характерной для всех линий сои, и участок рекомбинантной ДНК, промотора 35 S из вируса мозаики цветной капусты, в ходе двух независимых реакций с использованием соответствующих праймеров и зондов, меченых флуоресцентным красителем;
- регистрация флуоресценции красителей осуществляется приборами типа ABI-PRISM 7000, Rotor Gene 3000 и анализируется с использованием программного обеспечения приборов;
- относительное содержание ГМО в пищевом продукте рассчитывается с использованием стандартных образцов состава, путем сравнения результатов измерения флуоресценции красителя FAM, специфичного для ГМО, с результатами измерения флуоресценции красителя VIC, специфичного для всех линий сои;
- выделение ДНК из стандартных образцов состава и из исследуемых образцов осуществляется одновременно одним методом с помощью СТАВ или набора реактивов "ДНК-сорб-С".
9.2.2. Набор реактивов "Ампликвант ГМ кукуруза":
- предназначен для количественного определения генно-инженерно-модифицированной кукурузы;
- метод основан на ПЦР в реальном времени;
- амплифицируется участок эндогенной ДНК, характерной для всех линий кукурузы, и участок рекомбинантной ДНК, промотора 35 S из вируса мозаики цветной капусты, в ходе двух независимых реакций с использованием соответствующих праймеров и зондов, меченых флуоресцентным красителем;
- регистрация флуоресценции красителей осуществляется приборами типа ABI-PRISM 7000, Rotor Gene 3000 и анализируется с использованием программного обеспечения приборов;
- относительное содержание ГМО в пищевом продукте рассчитывается с использованием стандартных образцов состава путем сравнения результатов измерения флуоресценции красителя FAM, специфичного для ГМО, с результатами измерения флуоресценции красителя VIC, специфичного для всех линий кукурузы;
- выделение ДНК из стандартных образцов состава из исследуемых образцов осуществляется одновременно одним методом с помощью СТАВ (или набора реактивов "ДНК-сорб-С".
9.2.3. Набор реактивов "АмплиСенс ГМ соя FRT":
- предназначен для идентификации генно-инженерно-модифицированной сои в пищевых продуктах и растительном сырье методом ПЦР в реальном времени;
- анализ представляет собой проведение трех ПЦР в одной пробирке, для каждой из которых используются специфичные праймеры и меченый флуоресцентными красителями зонд;
- в двух реакциях выявляются последовательности ДНК, специфичные для промотора 35S из вируса мозаики цветной капусты и терминатора NOS из Agrobactetium tumefaciens, третья предназначена для амплификации эндогенной ДНК, специфичной для всех линий сои.
- выделение ДНК осуществляется с помощью СТАВ или набора реактивов "ДНК-сорб-С";
9.2.4. Набор реактивов "АмплиСенс ГМ кукуруза FRT":
- предназначен для идентификации генно-инженерно-модифицированной кукурузы в пищевых продуктах и растительном сырье методом ПЦР в реальном времени;
- анализ представляет собой проведение трех ПЦР в одной пробирке, для каждой из которых используются специфичные праймеры и меченый флуоресцентными красителями зонд;
- в двух реакциях выявляются последовательности ДНК, специфичные для промотора 35S из вируса мозаики цветной капусты и терминатора NOS из Agrobactetium tumefaciens, третья предназначена для амплификации эндогенной ДНК, специфичной для всех линий кукурузы.
- выделение ДНК осуществляется с помощью СТАВ или набора реактивов "ДНК-сорб-С";
9.2.5. Выделение ДНК с использованием набора реактивов "ДНК-сорб-С":
- буфер для лизирующего реагента и раствор для отмывки 1 прогреть при 64°C до полного растворения кристаллов;
- в каждую пробирку внести по 400 мкл буфера для лизирующего реагента и по 17 мкл лизирующего реагента, тщательно перемешать;
- инкубировать при 64°C 1 час, периодически встряхивая на вортекс ;
- центрифугировать 5 минут при 12000-14000 об/мин;
- отобрать и перенести надосадочную жидкость в объеме 200-350 мкл в чистые пробирки;
- центрифугировать 5 секунд при 5000 об/мин;
- тщательно ресуспендировать сорбент на вортекс, в каждую пробирку добавить по 25 мкл ресуспендированного сорбента, перемешать на вортекс, оставить в штативе на 10-15 минут, перемешивая каждые 2 минуты;
- центрифугировать 1 минуту при 5000 об/мин, удалить супернатант;
- добавить по 300 мкл раствора для отмывки 1, перемешать на вортекс до полного ресуспендирования сорбента, центрифугировать 1 минуту 5000 об/мин;
- удалить супернатант;
- добавить по 500 мкл раствора для отмывки 2, перемешать на вортекс до полного ресуспендирования сорбента, центрифугировать 1 минуту при 10000-12000 об/мин, отобрать супернатант;
- повторить процедуру отмывки, отобрать супернатант полностью, поместить пробирки в термостат 64°C на 5-10 минут для подсушивания сорбента, при этом крышки пробирок должны быть открыты;
- добавить по 50 мкл ТЕ-буфера для элюции ДНК, перемешать на вортекс;
- поместить в термостат 64°C на 5-8 минут, периодически встряхивая на вортекс;
- центрифугировать 1 минуту при 12000-14000 об/мин;
- раствор ДНК хранить в течение 1 недели при температуре от 2 до 8С и в течение 1 года - при температуре минус 20С.
9.3. Методы количественного определения сои линии 40-3-2, кукурузы линии GA 21, кукурузы линии NK 603, кукурузы линии MON 863, разработанные Центром "Биоинженерия" РАН.
9.3.1. Наборы реактивов для количественного определения сои линии 40-3-2, кукурузы линии GA 21, кукурузы линии NK 603, кукурузы линии MON 863 методом ПЦР в реальном времени:
- в состав каждого набора входят 2 пробирки матричной реакционной смеси, 1 пробирка с термостабильной полимеразой, 8 пробирок со стандартными разведениями рекомбинантной ДНК;
- реакционная смесь на одну пробу содержит 9,25 мкл матричной реакционной смеси, 0,75 мкл термостабильной полимеразы, 32,0 мкл деионизированной воды, конечный объем каждой пробы - 50 мкл;
- реакционную смесь разлить в пробирки по 42 мкл на пробу;
- добавить 8 мкл раствора ДНК в следующем порядке - контроль без ДНК, ДНК 0%, ГМО 0,5%, ГМО 100%, исследуемые образцы;
- центрифугировать;
- условия амплификации: 94?C - 9 мин - 1 цикл, (94°C - 30 сек) + (62°C - 30 сек) + (72°C - 1 мин) - 40 циклов;
- наборы реактивов оптимизированы для работы на амплификаторах типа ABI Prism 7000/7700.
9.3.2. Метод выделения ДНК с применением технологии Wizard, Promega:
- навеску исследуемого продукта массой 100 мг поместить в микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл;
- добавить 300 мкл - буфера I (50 мМ Трис НСl, рН - 8,0; 10 мМ ЭДТА; 50 мкг/мл панкреатической РНКазы свободной от ДНКаз, 3 М гуанидин тиоцианата) при комнатной температуре;
- растереть пробу в пробирке пестиком до гомогенного состояния;
- добавить 400 мкл буфера II (2% додецилсульфат натрия, 0.2 М NaOH) и перемешать на вортекс;
- инкубировать при 65°C 30 минут, перемешать на вортекс, охладить до комнатной температуры;
- добавить 400 мкл буфера III (5М ацетат калия, рН 4,5), перемешать на вортекс 2 минуты;
- центрифугировать 10 минут при 13000 об/мин;
- надосадок отобрать и перенести в чистую пробирку типа Эппендорф вместимостью 1,5 мл, добавить смолу Wizard MaxiPreps из расчета 100 мкл смолы на 200 мкл надосадочной жидкости и перемешать на вортекс;
- при помощи стерильного шприца емкостью 2 мл прокачать смесь через микроцентрифужную колонку;
- стерильным шприцом емкостью 2 мл прокачать через микроцентрифужную колонку 2 мл промывочного буфера (0.2 М NaCl, 20 мМ Трис HCl, pH-8.0, 5 мМ ЭДТА смешать в соотношении 5:7 с 96% этанолом);
- поместить микроколонку в микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл;
- центрифугировать 1 минуту при 13000 об/мин;
- поместить микроколонку в чистую микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл;
- добавить в колонку 100 мкл деионизованной воды, нагретой до 65?С, центрифугировать 15 секунд при 13000 об/мин;
- измерить концентрацию раствора ДНК и довести ее до 10 нг/мкл;
- раствор ДНК хранить при минус 20°C.
9.4. Количественное определение сои линии 40-3-2, кукурузы линий GA 21, MON 810, T-25, Bt-176, Bt-11 с использованием наборов реагентов GeneScan Analytics GmbH.
9.4.1. Наборы реактивов для определения сои линии 40-3-2 (GMOQuant Roundup Ready Soy), кукурузы линии Bt-176, (GMOQuant Maximizer
Soy), кукурузы линии Bt-176, (GMOQuant Maximizer Bt 176 corn), кукурузы линии Bt-11 (GMOQuant Bt-11 Corn), кукурузы линии MON 810 (GMOQuant YieldCard
Bt 176 corn), кукурузы линии Bt-11 (GMOQuant Bt-11 Corn), кукурузы линии MON 810 (GMOQuant YieldCard MON 810), кукурузы линии Т-25 (GMOQuant LibertyLink
MON 810), кукурузы линии Т-25 (GMOQuant LibertyLink T25 Corn), кукурузы линии GA 21, (GMOQuant Roundup Ready
T25 Corn), кукурузы линии GA 21, (GMOQuant Roundup Ready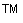 GA 21 Corn):
GA 21 Corn):
- используется реакционная смесь, позволяющая амплифицировать участок эндогенной ДНК, характерной для кукурузы или сои и реакционная смесь, позволяющая амплифицировать участок рекомбинантной ДНК;
- каждая реакционная смесь содержит соответствующие праймеры и зонд, меченый флуоресцентным красителем FAM, специфичный для ГМО и VIC, специфичный для сои или кукурузы;
- интенсивность флуоресценции измеряют с помощью приборов типа ABI-PRISM 7000, iCycler iQ и анализируют с применением программного обеспечения приборов.
9.4.2. Метод выделения ДНК с помощью набора реагентов "GENESpin":
- набор "GENESpin" предназначен для выделения геномной ДНК из пищевых продуктов;
- исследуемый образец пищевого продукта гомогенизировать, добавить лизирующий буфер, содержащий денатурирующие агенты и детергенты;
- лизат центрифугировать;
- добавить связывающий буфер и этанол для создания оптимальных условий осаждения ДНК на фильтре со специально подобранным силикагелем;
- промыть буфером для удаления потенциальных ингибиторов ДНК-полимеразы;
- ДНК элюировать водой или буфером, хранить при минус 20°C.
9.5. Методы количественного определения сои линии 40-3-2, кукурузы линии MON 810, разработанные ГУ ВНИИ сельскохозяйственной биотехнологии РАСХН:
9.5.1. Принцип методов:
- для количественного определения ГМО одновременно проводятся две независимые реакции в одной пробирке, одна реакция позволяет обнаруживать ДНК сои или кукурузы, другая - последовательность, специфичную для сои линии 40-3-2 или кукурузы линии MON 810;
- для обнаружения ДНК сои или кукурузы используется зонд, меченый красителем R6G, для обнаружения генетической конструкции - красителем FAM или ROX в зависимости от типа прибора;
- интенсивность флуоресценции измеряют с помощью приборов типа АНК-32, ABI-PRISM 7000, iCycler iQ и анализируют с применением программного обеспечения приборов;
- определение процентного содержания ГМО осуществляется с использованием калибровочных образцов (КО), которые представляют собой смеси ДНК растения дикого типа (0%) и ДНК ГМО (100%) в определенном процентном соотношении, разность значений пороговых циклов двух реакций для калибровочных образцов используется для построения калибровочной прямой. С помощью калибровочной прямой рассчитывается процентное содержание ДНК ГМО в анализируемых пробах;
9.5.2. Метод выделения ДНК "Сорб-ГМО":
- измельченные навески образцов перенести в одноразовые микроцентрифужные пробирки объемом 1,5 мл или 2,0 мл;
- внести в каждую пробирку по 600 мкл лизирующего буфера и 10 мкл лизирующего реагента, тщательно перемешать;
- инкубировать 50-60 минут при 65°С, периодически перемешивая на вортекс;
- внести в каждую пробирку по 500 мкл хлороформа, интенсивно перемешать, центрифугировать 10 минут при 12000-14000 об/мин;
- верхнюю водную фазу в объеме 300 мкл аккуратно, не захватывая хлороформ и межфазный слой, перенести в пробирку с сорбентом, интенсивно перемешать на вортекс до полного ресуспензирования сорбента, инкубировать при комнатной температуре 10 минут, периодически встряхивая;
- центрифугировать суспензию при 10000 об/мин 1 минуту, удалить супернатант;
- добавить к осадку 500 мкл промывочного раствора А, перемешать на вортекс до максимального ресуспензирования сорбента, инкубировать при комнатной температуре 2-3 минуты, периодически встряхивая;
- центрифугировать при 7000 об/мин 30 секунд, удалить супернатант;
- добавить к осадку 500 мкл промывочного раствора Б., перемешать на вортекс до максимального ресуспензирования сорбента;
- центрифугировать суспензию при 7000 об/мин 30 секунд, удалить супернатант;
- добавить к осадку 500 мкл промывочного раствора В, перемешать на вортекс до максимального ресуспензирования сорбента;
- центрифугировать при 7000 об/мин 30 секунд удалить супернатант;
- поместить пробирки с открытыми крышками в термостат при температуре 65°С на 5 минут для испарения жидкости;
- к сухому осадку добавить 100 мкл ТЕ буфера, перемешать на вортекс, инкубировать 10 минут при температуре 65°С, перемешивая каждые 2 минуты;
- центрифугировать при 12000-14000 об/мин 2 минуты.
- чистую надосадочную жидкость перенести в чистую пробирку объемом 0,5-1,5 мл, не захватывая сорбент.
9.5.3. Порядок проведения исследований:
- взять необходимое количество пробирок с реакционной смесью из тест-системы из расчета N + 8, где N - количество анализируемых образцов;
- после размораживания реакционной смеси, центрифугировать пробирки 30-60 секунд при более 4000 об/мин;
- внести в пробирки по 2 мкл исследуемых образцов и в последнюю очередь калибровочных образцов сои или кукурузы в двух повторах, перемешать многократным пипетированием, поместить пробирки в амплификатор;
- программа амплификации для сои: 10 мин/95°С, 20 сек/95°С, 50 сек/62°С съемка 50 циклов, 25°С - хранение;
- программа амплификации для кукурузы: 10 мин/95°С, 20 сек/95°С, 50 сек/60°С съемка 50 циклов, 25°С - хранение.
9.6. Для определения ГМО растительного происхождения допустимо использование тест-систем с техническими характеристиками, аналогичными указанным выше и разрешенными для использования в установленном порядке.
Приложение 2.1
ПРИМЕР
представления данных электрофореза по результатам
идентификации ДНК сои (ген лектин)
Продукт ПЦР - 118 пар нуклеотидов
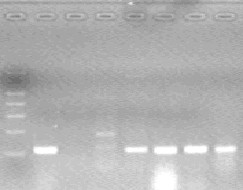
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2. Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенной сои.
3. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
4-7. Продукты ПЦР, полученные на препаратах ДНК из продуктов переработки сои.
Приложение 2.2
ПРИМЕР
представления данных электрофореза по результатам
идентификации ДНК кукурузы (ген зеин)
Продукт ПЦР - 329 пар нуклеотидов
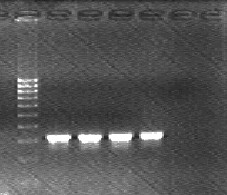
|
1 |
2 |
3 |
4 |
5 |
6 |
1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2-5. Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенной кукурузы.
6. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
Приложение 2.3
ПРИМЕР
представления данных электрофореза по результатам идентификации
ДНК картофеля (ген фосфоенолпируваткарбоксилазы)
Продукт ПЦР - 1149 пар нуклеотидов.
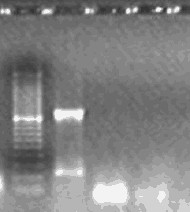
|
1 |
2 |
3 |
1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2. Продукт ПЦР, полученный на препаратах ДНК из клубней нетрансгенного картофеля.
3. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
Приложение 2.4
ПРИМЕР
представления данных электрофореза по результатам
идентификации рекомбинантной ДНК (мишень - промотор 35S)
Продукт ПЦР - 195 пар нуклеотидов.

|
1 |
2 |
3 |
4 |
5 |
6 |
1-3. Продукты ПЦР, полученные на препаратах ДНК из семян сои линии 40-3-2.
4. Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои.
5. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
6. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
Приложение 2.5
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК (мишень - терминатор NOS)
Продукт ПЦР - 180 пар нуклеотидов.
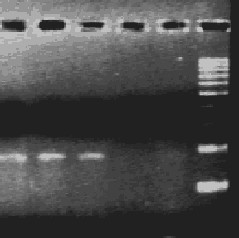
|
1 |
2 |
3 |
4 |
5 |
6 |
1-3. Продукты ПЦР, полученные на препаратах ДНК из семян сои линии 40-3-2.
4. Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои.
5. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
6. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
Приложение 2.6
ПРИМЕР
представления данных электрофореза по результатам
идентификации рекомбинантной ДНК (маркерный ген nptII)
Продукт ПЦР - 173 пары нуклеотидов

|
1 |
2 |
3 |
1. Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК.
2. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
3. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 863.
Приложение 2.7
ПРИМЕР
представления данных электрофореза по результатам
идентификации рекомбинантной ДНК, характерной
для генетической конструкции сои линии 40-3-2
Продукт ПЦР - 169 пар нуклеотидов.
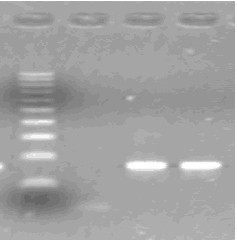
|
1 |
2 |
3 |
4 |
1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2. Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои.
3-4. Продукты ПЦР, полученные на препаратах ДНК из семян сои линии 40-3-2.
Приложение 2.8
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для генетической конструкции
сои линии А2704-12
Продукт ПЦР - 185 пар нуклеотидов
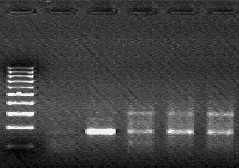
|
1 |
2 |
3 |
4 |
5 |
6 |
1. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
2. Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенной сои.
3-6. Продукты ПЦР, полученные на препаратах ДНК из семян сои линии А 2704-12.
Приложение 2.9
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для генетической конструкции
сои линии А5547-127
Продукт ПЦР - 150 пар нуклеотидов.
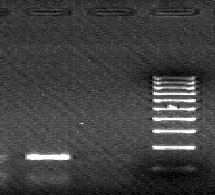
|
1 |
2 |
3 |
Продукт ПЦР, полученный на препаратах ДНК из семян сои линии А5547-127.
Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенной сои.
3. Маркер молекулярной массы (100 п.н., Лаборатория Био-Рад).
Приложение 2.10
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для генетической конструкции
кукурузы линии Bt-176
Продукт ПЦР - 189 пар нуклеотидов.
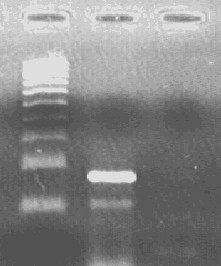
|
1 |
2 |
3 |
1. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
2. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии Bt-176.
3. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
Приложение 2.11
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для генетической конструкции
кукурузы линии MON 810
Продукт ПЦР - 149 пар нуклеотидов.

|
1 |
2 |
3 |
4 |
1. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 810.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
4. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 810.
Приложение 2.12
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для кукурузы линии MON 863
Продукт ПЦР - 84 пары нуклеотидов.

|
1 |
2 |
3 |
1. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 863.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение 2.13
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для кукурузы линии NK 603
Продукт ПЦР - 108 пар нуклеотидов.
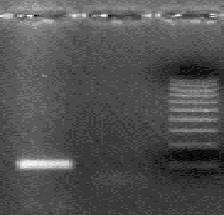
|
1 |
2 |
3 |
1. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии NK 603.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад);
Приложение 2.14
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для кукурузы линии Bt 11
Продукт ПЦР - 110 пар нуклеотидов.
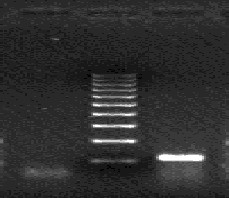
|
1 |
2 |
3 |
1. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
3. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии Bt 11.
Приложение 2.15
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для кукурузы линии T 25
Продукт ПЦР - 149 пар нуклеотидов.

|
1 |
2 |
3 |
1. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии T 25.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение 2.16
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для кукурузы линии GA 21
Продукт ПЦР - 270 пар нуклеотидов.

|
1 |
2 |
3 |
1. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
3. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии GA 21.
Приложение 2.17
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для кукурузы линии MIR 604
Продукт ПЦР - 894 пары нуклеотидов.
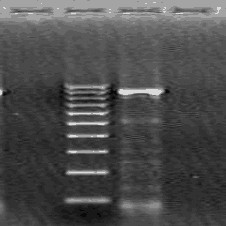
|
1 |
2 |
3 |
4 |
1. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
3. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MIR 604.
4. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
Приложение 2.18
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для кукурузы линии MON 88017
Продукт ПЦР - 94 пары нуклеотидов.
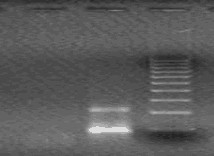
|
1 |
2 |
3 |
1. Продукт ПЦР, полученный на препаратах ДНК из зерна нетрансгенной кукурузы.
2. Продукт ПЦР, полученный на препаратах ДНК из зерна кукурузы линии MON 88017.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение 2.19
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для сахарной свеклы линии Н7-1
Продукт ПЦР - 110 пар нуклеотидов.

|
1 |
2 |
3 |
4 |
1. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад);
2-3. Продукты ПЦР, полученные на препаратах ДНК из корнеплодов сахарной свеклы линии Н7-1;
4. Продукт ПЦР, полученный на препаратах ДНК из корнеплодов нетрансгенной сахарной свеклы.
Приложение 2.20
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для риса, устойчивого к глюфосинату
аммония, линии LL 62
Продукт ПЦР - 88 пар нуклеотидов.

|
1 |
2 |
3 |
1. Продукт ПЦР, полученный на препаратах ДНК из семян риса линии LL 62.
2. Продукт ПЦР, полученный на препаратах ДНК из семян нетрансгенного риса.
3. Маркер молекулярной массы (100 п.н., лаборатория Био-Рад).
Приложение 2.21
(обязательное)
ПРИМЕР
представления данных электрофореза по результатам идентификации
рекомбинантной ДНК, характерной для сортов картофеля, устойчивых
к колорадскому жуку: Рассет Бурбанк Ньюлив, Супериор Ньюлив,
Елизавета 2904/kgs, Луговской 1210 amk
Продукт ПЦР - 102 пар нуклеотидов.
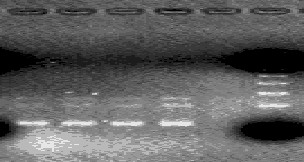
|
1 |
2 |
3 |
4 |
5 |
6 |
1. Продукт ПЦР, полученный на препаратах ДНК из клубней картофеля сорта Рассет Бурбанк Ньюлив.
2. Продукт ПЦР, полученный на препаратах ДНК из клубней картофеля сорта Супериор Ньюлив.
3. Продукт ПЦР, полученный на препаратах ДНК из клубней картофеля сорта Елизавета 2904/kgs.
4. Продукт ПЦР, полученный на препаратах ДНК из клубней картофеля сорта Луговской 1210 amk.
5. Продукт ПЦР, полученный на препаратах ДНК из клубней нетрансгенного картофеля.
6. Маркер молекулярной массы (100 п.н. лаборатория Био-Рад).
Приложение 2.22
(обязательное)
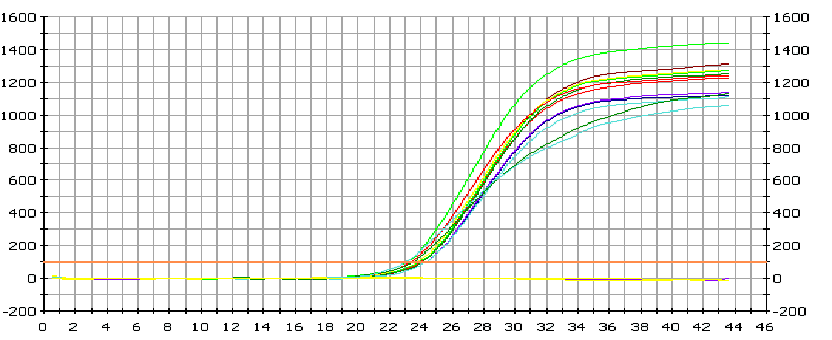
|
Количество циклов |
Зависимость величины сигнала флуоресценции (Rn) от количества циклов ПЦР для гена лектина.
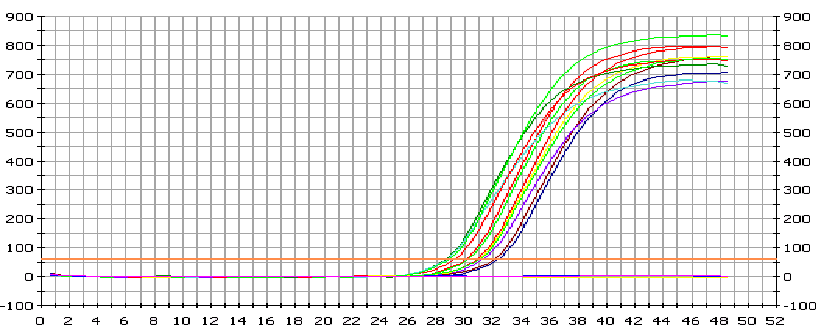
|
Количество циклов |
Зависимость величины сигнала флуоресценции (Rn) от количества циклов ПЦР для рекомбинантной ДНК.
Расчет количества рекомбинантной ДНК.
По кривой амплификации определяется пороговый цикл для каждой ПЦР (Ct). Рассчитывается разность между Ct специфичным для 35 S промотора и Ct специфичным для гена лектина. Относительное количество рекомбинантной ДНК в пробе определяется по формуле:
w = 2 х c ref
х c ref
Где:
ДCt sam - разность между значениями Ct для 35 S промотора и гена лектина в исследуемом образце.
ДCt ref - разность между значениями Ct для 35 S промотора и гена лектина в стандартном образце.
c ref - концентрация стандартного образца.
Приложение 2.23
|
Rn |
|
Количество циклов |
Зависимость величины сигнала флуоресценции (Rn) от количества циклов ПЦР для гена зеина.
|
Rn |
|
Количество циклов |
Зависимость величины сигнала флуоресценции (Rn) от количества циклов ПЦР для рекомбинантной ДНК.
Расчет количества рекомбинантной ДНК.
По кривой амплификации определяется пороговый цикл для каждой ПЦР (Ct). Рассчитывается разность между Ct специфичным для 35 S промотора и Ct специфичным для гена зеина. Относительное количество рекомбинантной ДНК в пробе определяется по формуле:
w = 2 х c ref
х c ref
Где:
ДCt sam - разность между значениями Ct для 35 S промотора и гена лектина в исследуемом образце.
ДCt ref - разность между значениями Ct для 35 S промотора и гена лектина в стандартном образце.
c ref - концентрация стандартного образца.
Приложение 3
УТВЕРЖДЕНО
постановлением
Главного государственного
санитарного врача
Российской Федерации
от 30 ноября 2007 года N 80
4.2. Методы контроля.
Биологические и микробиологические факторы.
Пищевые продукты и пищевые добавки
Определение генно-инженерно-модифицированных микроорганизмов
и микроорганизмов, имеющих генно-инженерно-модифицированные аналоги,
в пищевых продуктах методами полимеразной цепной реакции (ПЦР)
в реальном времени и ПЦР с электрофоретической детекцией
Методические указания
МУК 4.2.2305-07
I. Область применения
1.1. Настоящие методические указания устанавливают методы определения генно-инженерно-модифицированных микроорганизмов (ГММ) в пищевой продукции, полученной из/или с использованием генно-инженерно-модифицированных микроорганизмов и микроорганизмов, имеющих генно-инженерно-модифицированные аналоги (МГМА), посредством полимеразной цепной реакции (ПЦР) в реальном времени или ПЦР с детекцией результатов методом электрофореза.
1.2. Методические указания предназначены для применения в лабораториях учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также в других испытательных лабораториях, аккредитованных в установленном порядке на право проведения исследований пищевых продуктов и продовольственного сырья.
1.3. Методические указания разработаны с целью обеспечения единого методического подхода для определения ГММ в пищевых продуктах, продовольственном сырье, пищевых и биологически активных добавках к пище.
II. Общие положения
2.1. Методические указания содержат описание молекулярно-генетических методов идентификации ДНК (дезоксирибонуклеиновых кислот) генно-инженерно-модифицированных микроорганизмов в пищевых продуктах, полученных из/или с использованием генно-инженерно-модифицированных микроорганизмов и микроорганизмов, имеющих генно-инженерно-модифицированные аналоги. Методы являются скрининговыми и обеспечивают выявление наиболее типичных маркерных и селективных генов, используемых в генетических конструкциях по технологии рекомбинантных ДНК в различных группах микроорганизмов (бактерии, дрожжи, плесневые грибы), используемых в пищевой промышленности. Идентификация этих генов методом ПЦР позволяет проводить качественный анализ пищевой продукции на наличие ГММ.
2.2. Методические указания предусматривают также количественный анализ содержания ДНК ГММ посредством использования специальных стандартов ДНК с известной концентрацией в формате ПЦР в реальном времени.
2.3. При обнаружении генетических модификаций методом ПЦР проводят дополнительные исследования с целью идентификации разрешенных (в том числе путем подтверждения их принадлежности к конкретной генетической конструкции) или для выявления не разрешенных для реализации населению и использованию в пищевой промышленности в Российской Федерации ГММ и пищевых продуктов на основе ГММ. Исследования проводят в соответствии с методическими указаниями, официально утвержденными в установленном порядке.
2.4. Идентификация ГММ, разрешенных для реализации населению и использования в пищевой промышленности в Российской Федерации, в образцах продукции и/или используемых культурах штаммов ГММ, проводится на основании сведений, представляемых изготовителем (разработчиком) в Роспотребнадзор, с полно информацией о:
- генной вставке (описание источника и нуклеотидной последовательности целевого гена и его регуляторных элементов; описание средств доставки целевого гена в клетки реципиента - физическая карта вектора, наличие полилинкеров и селективных маркеров);
- о методах идентификации и количественного определения ДНК ГММ;
2.5. Представленные в методических указаниях методы выделения ДНК из образцов пищевой продукции, проведения амплификации с детекцией продуктов ПЦР путем электрофореза или в режиме реального времени с использованием специального оборудования, документирования и анализа получаемых результатов являются обязательными при проведении как качественных, так и количественных исследований ГММ и МГМА.
III. Молекулярно-генетический анализ пищевой продукции, полученной
с использованием генно-инженерно-модифицированных
микроорганизмов и микроорганизмов, имеющих генно-инженерно-
модифицированные аналоги, методом ПЦР с детекцией результатов
методом электрофореза
3.1. Необходимость проведения лабораторных исследований для конкретных видов пищевой продукции, полученной с использованием ГММ и МГМА, определяется экспертом с учетом анализа представленной заявителем документации, перечня микроорганизмов, используемых в пищевой промышленности и имеющих генно-инженерно-модифицированные аналоги. Экспертные исследования включают подтверждение данных, предоставленных заявителем, а при необходимости - проверку на наличие возможных не декларированных генетических модификаций.
3.2. Для обнаружения ГММ проводят исследования на наличие трансгенов (чужеродных генов), регуляторных или маркерных векторных последовательностей. Наличие таких последовательностей свидетельствует о произведенных генетических модификациях. Обнаружение последовательностей таких генов производят с помощью специфичного и высокочувствительного метода полимеразной цепной реакции (ПЦР).
3.3. Рекомендуемые стратегии международных организаций (ФАО/ВОЗ) для выявления генетических модификаций предусматривают определение наиболее часто употребляемых последовательностей векторов - плазмид, с помощью которых генетическая информация вводится в клетку. В качестве маркеров используют гены, по которым проводят селекцию модифицированных клеток (гены антибиотикорезистентности, бактериоцинов), последовательности регуляторных векторных генов (полилинкеры, промоторы или терминаторы), а также последовательности мигрирующих элементов. Обнаружение таких последовательностей свидетельствует о возможных не документированных генетических модификациях, и требует проведения дополнительных исследований штаммов и/или продуктов.
3.4. Проведение дополнительных исследований осуществляют с использованием методов гибридизационного и рестрикционного анализа, секвенирования, анализа функционирования целевой вставки (изучение РНК и белка, продуцируемых чужеродной ДНК) в соответствии официально утвержденными методами анализа.
3.5. Для качественного определения ДНК генно-инженерно-модифицированных микроорганизмов в пищевых продуктах и биологически активных добавках к пище (БАД) методом ПЦР используют тест-системы, включающие многокомпонентные наборы реагентов и праймеров (искусственно синтезированных олигонуклеотидов, комплементарных соответствующим участкам ДНК-мишени), предназначенные для выявления селективных маркерных генов, наиболее часто употребляемых при конструировании ГММ. Обнаружение маркерных генов у штаммов микроорганизмов, используемых при производстве пищевых продуктов, свидетельствует о произведенных генетических модификациях.
В тест-системы входят праймеры, фланкирующие следующие последовательности:
1) гена ermC, кодирующего устойчивость к эритромицину, плазмиды pE194 Staphylococcus aureus (размер фрагмента 349 п.н.);
2) гена tetO, кодирующего устойчивость к тетрациклину хромосомы Streptococcus pneumoniae (размер фрагмента 242 п.н.);
3) гена amp, кодирующего устойчивость к ампициллину, плазмиды pBR322 Esherichia coli, (размер фрагмента 321 п.н.);
4) гена lacZ, кодирующего фермент  -галактозидазу, хромосомы Esherichia coli (размер фрагмента 158 п.н.);
-галактозидазу, хромосомы Esherichia coli (размер фрагмента 158 п.н.);
5) гена ori, кодирующего ориджин репликации, плазмиды p15A Esherichia coli (размер фрагмента 382 н.п.);
6) гена hph, кодирующего устойчивость к гигромицину, хромосомы Streptomyces hygroscopicus, (размер фрагмента 288 н.п);
7) гена Sh ble, кодирующего устойчивость к блеомицину, хромосомы Streptomyces verticillus (размер фрагмента 301 н.п.);
3.6. Выбранный в соответствии с правилами молекулярного дизайна и международных баз данных (с применением программ "Oligo 4.0", "Blast" и их аналогов) набор праймеров обеспечивает проведение многофакторного анализа выбранных последовательностей.
3.7. Для каждой конкретной пары праймеров ПЦР проводят с использованием оптимального соотношения компонентов реакционной смеси, структуры программы амплификации (временных и температурных характеристик каждого этапа амплификации) и адекватного метода детекции результатов, для исключения перекрестных реакций с неспецифическими ДНК и обеспечения необходимого уровня чувствительности и специфичности реакции.
3.8. Специфичность и чувствительность наборов праймеров и реагентов (положительные результаты ПЦР в пробах с контролями ДНК селективных маркеров при концентрации не менее 5х10 ГЭ/мл, отсутствие перекрестных реакций с неспецифическими ДНК при концентрации не менее 1х10
ГЭ/мл, отсутствие перекрестных реакций с неспецифическими ДНК при концентрации не менее 1х10 ГЭ/мл) подтверждают на препаратах ДНК, выделенных из штаммов микроорганизмов, указанных в таблице 1.
ГЭ/мл) подтверждают на препаратах ДНК, выделенных из штаммов микроорганизмов, указанных в таблице 1.
|
Таблица 1 |
|
NN |
Микроорганизм |
номер штамма |
|
1 |
Escherichia coli |
M-17 |
|
2 |
Lactobacillus acidophilus |
Шт. Биобактон |
|
3 |
Lactobacillus acidophilus |
Шт. 1К В-2991 |
|
4 |
Bifidobacterium |
Вb-12 |
|
5 |
Bifidobacterium bifidum |
Шт. N 1 |
|
6 |
Lactobacillus acidophilus |
Е.Р.317/402 |
|
7 |
Lactobacillus casei |
Шт. 163 |
|
8 |
Lactobacillus acidophilus |
К/А |
|
9 |
Sacсharomyces cerevisiae |
Шт. АлкоИст |
|
10 |
Композиция бифидобактерий |
B.bifidum, N ВКПМ Ас 1248(8-3); В.longum, N Ас 1531 (ДВА -13), B.bifidum 791 БАГ |
|
12 |
Lactobacillus paracasei, subsp. paracasei |
Шт. Dalton |
|
14* |
Композиция Lactobacillus plantarum + Lactobacillus fermentum |
Шт. 8P-A3 La + шт. 90TC-4 |
|
_______________ | ||
|
15 |
Lactobacillus casei |
Шт.-01 |
|
16 |
Lactococcus cremoris |
Шт. 322 |
|
17 |
Streptococcus thermophilus |
Шт. КТс 3 Е.А. |
3.9. Для выявления ДНК генно-инженерно-модифицированных микроорганизмов в пробах с различными уровнями содержания микробной ДНК и ДНК пищевого субстрата используют два вида тест-систем:
- комплект N 1А для выделения ДНК из ферментных препаратов, стартерных и заквасочных культур, БАД;
- комплект N 1Б для выделения ДНК из пищевых продуктов.
3.10. Выделение ДНК из бактериальных культур с помощью Комплекта N 1А включает лизис бактериальных клеток с последующим осаждением ДНК на двуокиси кремния. Выделение ДНК из образцов пищевых продуктов с помощью Комплекта N 1Б включает предварительную обработку пробы гомогенизированных образцов протеиназой К, лизис, дополнительную обработку депротеинизирующим раствором и осаждение ДНК на двуокиси кремния.
3.11. Для выявления ГММ и МГМА в пищевых продуктах используют следующие материалы, оборудование, реактивы:
1) программируемый термостат (ДНК-амплификатор) типа "Терцик МС2" или иные типы амплификаторов, зарегистрированные в Российской Федерации в установленном порядке;
2) термостат, поддерживающий температуру +45°С, для пробирок объемом 1,5 мл;
3) центрифуга со скоростью вращения ротора до 12000 об/мин для пробирок вместимостью 1,5 и 0,5 мл типа "эппендорф";
4) встряхиватель вибрационный типа "вортекс" со скоростью вращения до 3000 об/мин;
5) прибор для горизонтального электрофореза;
6) источник постоянного тока;
7) водяная баня с подогревом до +95°С или СВЧ-печь;
8) ультрафиолетовый трансиллюминатор;
9) очки / маска защитные;
10) холодильник бытовой электрический;
11) морозильная камера, обеспечивающая температуру (- 20)(0)С или ниже;
12) гомогенизатор типа "SilentCrusher" или других моделей;
13) ступка фарфоровая с пестиком;
14) пинцет медицинский;
15) ножницы медицинские;
16) скальпель медицинский;
17) весы лабораторные общего назначения 2-го класса точности;
18) дистиллятор;
19) анализатор потенциометрический;
20) облучатель бактерицидный настенный;
21) дозаторы с переменным объемом дозирования 0,2-2,0 мм с шагом 0,01 мм
с шагом 0,01 мм , 0,5-10,0 мм
, 0,5-10,0 мм с шагом 0,01 мм
с шагом 0,01 мм , 2-20 мм
, 2-20 мм с шагом 0,01 мм
с шагом 0,01 мм , 20-200 мм
, 20-200 мм с шагом 0,1 мм
с шагом 0,1 мм , 100-1000 мм
, 100-1000 мм с шагом 1 мм
с шагом 1 мм , 2-10 см
, 2-10 см с шагом 0,1 см
с шагом 0,1 см ;
;
22) пробирки типа "эппендорф" вместимостью 1,5 мл;
23) пробирки типа "эппендорф" для ПЦР вместимостью 0,5 мл;
24) наконечники полимерные объемом 1-200 мкл;
25) наконечники полимерные объемом 200-1000 мкл;
26) перчатки резиновые;
27) колбы плоскодонные конические разной вместимости;
28) цилиндры стеклянные мерные лабораторные вместимостью 25, 100, 1000 см ;
;
29) воронки стеклянные;
30) штативы для пробирок объемом 1,5 и 0,5 мл;
31) комплект N 1А для выделения ДНК из ферментных препаратов, стартерных и заквасочных культур, БАД к пище;
32) комплект N 1Б для выделения ДНК из пищевых продуктов;
33) комплект N 2 "Набора реагентов для выявления селективных маркеров генетически модифицированных микроорганизмов";
34) комплект N 3 "Набора реагентов для выявления селективных маркеров генетически модифицированных микроорганизмов";
35) реактивы:
- тритон Х-100,
- гуанидина гидрохлорид,
- ЭДТА (этилендиаминтетрауксусная кислота),
- додецилсульфат натрия,
- суспензия двуокиси кремния,
- фенол водонасыщенный,
- хлороформ водонасыщенный,
- спирт этиловый ректификованный,
- ацетат аммония,
- протеиназа К,
- магния хлорид,
- калия хлорид,
- водный раствор дезоксинуклетидтрифосфатов (0,1М),
- креозоловый красный,
- термостабильная ДНК-полимераза,
- масло вазелиновое,
- трис-ацетат,
- ледяная уксусная кислота,
- агароза для электрофореза,
- бромистый этидий,
- вода деионизированная.
3.12. Допускаются к использованию тест-системы, комплекты (наборы) реагентов и материалы аналогичного назначения других типов, разрешенные к применению в установленном порядке и с характеристиками, обеспечивающими проведение исследований в соответствии с настоящими Методическими указаниями.
3.13. Отобранные согласно установленному порядку и нормам отбора проб (в соответствии с официально утвержденными нормативными и техническими документами) образцы подготавливают к процедуре выделения ДНК ГММ и МГМА двумя способами, в зависимости от их принадлежности к группам пищевой продукции:
- из образцов проб ферментных препаратов, заквасочных и стартерных культур, БАД готовят растворы 30%-й концентрации в стерильной деионизированной воде. Для этого вносят 300 мг (мкл) порошка или суспензии исходного образца в 700 мкл стерильной деионизированной воды и перемешивают на вихревом смесителе в течение 3-5 с. При необходимости образец предварительно измельчают до гомогенного состояния в ступке или с помощью гомогенизатора;
- из образцов других пищевых продуктов готовят растворы 50%-й концентрации, для чего к 500 мг (мкл) пробы добавляют 500 мкл стерильной деионизированной воды и перемешивают на вихревом смесителе в течение 3-5 с. Твердый образец предварительно измельчают до гомогенного состояния в ступке или с помощью гомогенизатора.
Подготовленные образцы используют для анализа в тот же день. Допускается хранение образцов при температуре минус 20 (0)С не более 2 недель.
3.14. Выделение ДНК ГММ и МГМА из образцов исследуемой пищевой продукции проводят с использованием комплектов (наборов) реагентов для выявления селективных маркеров генно-инженерно-модифицированных микроорганизмов. Допускается применение фенол-хлороформного или другого адекватного метода экстракции ДНК.
3.15. Выделение ДНК из заквасочных и стартерных культур, БАД к пище, ферментных препаратов проводят с использованием Комплекта N 1А "Набора реагентов для выявления селективных маркеров генетически модифицированных микроорганизмов".
Комплект N 1А для выделения ДНК включает:
- лизирующий раствор, содержащий гуанидинтиоцианат (Раствор 1) - 1 фл. (30 мл);
- раствор для отмывки, содержащий гуанидинтиоцианат (Раствор 2) - 1 фл. (15 мл);
- раствор для отмывки (Раствор 3) - 2 фл. (по 70 мл);
- суспензия двуокиси кремния - 1 пробирки (0,5 мл).
3.15*. Выделение ДНК комплектом N 1А включает следующие этапы
_______________
* Нумерация соответствует оригиналу. - Примечание изготовителя базы данных.
- исследуемый материал в объеме 700 мкл центрифугируют в течение 10 минут при комнатной температуре (+18-250°С) при 12000 об/мин.;
- удаляют 600 мкл надосадочной жидкости; оставшийся материал (100-110 мкл) тщательно перемешивают в пробирке на вортексе и добавляют к суспензии 300 мкл раствора 1 и 5 мкл суспензии двуокиси кремния;
- пробы инкубируют в течение 15 минут при комнатной температуре, периодически перемешивая на вортексе;
- пробы центрифугируют в течение 30 сек, при комнатной температуре при 12000 об/мин, супернатант удаляют;
- к осадку добавляют 150 мкл раствора 2, встряхивают его на вортексе и центрифугируют в течение 30 сек при комнатной температуре при 12000 об/мин, супернатант удаляют;
- к осадку добавляют 700 мкл раствора 3, встряхивают его на вортексе и центрифугируют в течение 30 сек при комнатной температуре при 12000 об/мин, супернатант удаляют; проводят повторную процедуру отмывки;
- дополнительным центрифугированием с последующим удалением супернатанта убирают остатки раствора 3, пробы подсушивают в течение 5 мин при температуре +45°С, оставляя пробирки открытыми;
- добавляют в каждую пробирку 50 мкл деионизированной воды, перемешивают на вортексе и инкубируют в течение 5 мин при температуре +45°С;
- пробы центрифугируют при комнатной температуре в течение 30 сек при 12000 об/мин, водную фазу отбирают в другую пробирку и используют в качестве исследуемого образца ДНК для постановки реакции амплификации, либо хранят при температуре -20°С не более двух недель.
3.16. Выделение ДНК ГММ и МГМА из пищевых продуктов проводят с использованием Комплекта N 1Б "Набора реагентов для выявления селективных маркеров генетически модифицированных микроорганизмов". При повышенном содержании жиров проводится дополнительная экстракция суспензией неполярных растворителей с водой для перевода содержащейся в пищевом продукте ДНК в водную фазу, в которой и производится дальнейшая очистка.
Комплект N 1Б для выделения ДНК из пищевых продуктов включает:
раствор 1 (лизирующий буфер, pH 8,0) - 1 фл. (15 мл);
раствор 2 (смесь фенола с хлороформом, 1:1) - 1 фл. (20 мл);
раствор 3 (хлороформ) - 1 фл. (20 мл);
раствор 4 (ацетат аммония 5М) - 1 фл. (5,0 мл);
раствор 5 (спирт этиловый 96%) - 4 фл. (по 20 мл);
раствор 6 (спирт этиловый 75%) - 1 фл. (12 мл);
раствор 7 (ТЕ-буфер, pH 8,0) - 1 фл. (6,0 мл);
протеиназу К - 1 пробирки (3,0 мг).
3.17. Выделение ДНК комплектом N 1Б включает следующие этапы:
- раствор 1 прогревают при температуре +25?С до полного растворения осадка, непосредственно перед применением к раствору 1 добавляют протеиназу К до концентрации 200 мкг/мл (0,001 г на 5,0 мл);
- в полипропиленовую пробирку вместимостью 1,5 мл вносят 100 мкл гомогенизированного образца, добавляют 100 мкл раствора 1, перемешивают на вихревом смесителе в течение 3-5 сек;
- пробирки инкубируют при температуре +55°С в течение 40 мин;
- добавляют 200 мкл (равный объем) раствора 2, перемешивают на вихревом смесителе в течение 10 сек и центрифугируют при комнатной температуре (+18-25?С) в течение 5 мин при 10000-12000 об/мин (10000-13000 g);
- отбирают верхнюю (водную) фазу и вносят ее в полипропиленовую пробирку вместимостью 1,5 мл, в эту пробирку добавляют 200 мкл (равный объем) раствора 3;
- перемешивают на вихревом смесителе в течение 3-5 сек и центрифугируют при комнатной температуре 2 мин при 10000-12000 об/мин (10000-13000 g);
Отбирают водную фазу (200 мкл) и вносят ее в полипропиленовую пробирку вместимостью 1,5 мл, в эту пробирку добавляют 40 мкл раствора 4 и 720 мкл (3 объема) раствора; перемешивают на вихревом смесителе в течение 3-5 сек;
- инкубируют при комнатной температуре в течение 40 мин;
- центрифугируют при комнатной температуре (+18-25єС) в течение 15 мин при 12000 об/мин (13000 g); супернатант удаляют;
- в пробирку вносят 100 мкл раствора 6;
- центрифугируют в течение 1 мин при комнатной температуре при 12000 об/мин (13000 g); супернатант удаляют; осадок сушат на воздухе в течение 10 мин;
- растворяют осадок в 50 мкл раствора 7; полученные образцы ДНК используют для дальнейшего анализа.
3.18. Проведение ПЦР осуществляют с использованием Комплекта N 2 реагентов для амплификации ДНК "Набора реагентов для выявления селективных маркеров генетически модифицированных микроорганизмов".
Комплект N 2 реагентов для амплификации ДНК включает:
- ПЦР-смесь 1 (реакционный буфер, смесь олигонуклеотидных праймеров и дезоксинуклеозидтрифосфатов) - 8 пробирок по 1300 мкл;
- ПЦР-смесь 2 (термостабильная ДНК-полимераза) - 4 пробирки (200 мкл);
- масло минеральное - 8 пробирок по 1300 мкл;
- положительные контрольные образцы ДНК (плазмидная ДНК с клонированным специфическим фрагментом соответствующих маркерных генов) - 4 пробирки по 30 мкл;
- отрицательные контрольные образцы (плазмидная ДНК pET-9) - 4 пробирки по 30 мкл.
3.19. Проведение ПЦР с использованием Комплекта N 2 включает следующие этапы:
- перед началом работы вынимают из морозильной камеры комплект реагентов для амплификации (кроме ПЦР-смеси 2), размораживают содержимое пробирок при комнатной температуре, тщательно перемешивают на вихревом смесителе в течение 10 сек и помещают все пробирки в холодильник;
- амплификационные пробирки вместимостью 0,2 (или 0,5) мл маркируют в соответствии с маркировкой анализируемых образцов, пробирки для положительного контрольного образец ДНК маркируют как ПК, для отрицательного контрольного образца - ОК;
- рабочий раствор для проведения реакции амплификации готовят в количестве, достаточном для анализа всех проб (при анализе N образцов рабочий раствор готовится в количестве, необходимом для анализа N+1 образцов); для этого в пробирку вместимостью 1,5 мл вносят из расчета на одну пробу по 25 мкл ПЦР-смеси 1 и по 2,0 мкл ПЦР-смеси 2; тщательно перемешивают;
- в каждую пробирку с анализируемыми образцами и в пробирки ПК и ОК вносят по 27 мкл рабочего раствора;
- в каждую пробирку добавляют по 1 капле (или 20 мкл) минерального масла;
- в каждую пробирку с анализируемыми образцами вносят под масло по 3,0 мкл исследуемой ДНК (используют наконечники с аэрозольным барьером) и закрывают их;
В пробирку, маркированную ОК, внести под масло 3,0 мкл отрицательного контрольного образца и закрыть ее;
- в пробирку, маркированную ПК, вносят под масло 3,0 мкл положительного контрольного образца ДНК и закрывают ее;
- содержимое пробирок осторожно перемешивают пипетированием и центрифугируют при комнатной температуре в течение 5 сек при 10000 об/мин (11000 g);
- все пробирки устанавливают в блок амплификатора и проводят амплификацию с учетом объема реакционной смеси, равного 30 мкл; программа амплификации представлена в таблице 2
|
N |
Температура |
Время |
Количество |
|
1 |
+37°С |
10 мин |
1 раз |
|
2 |
+95°С |
10 мин |
1 раз |
|
+94°С |
30 сек |
||
|
3 |
+60°С |
30 сек |
30 раз |
|
+72°С |
30 сек |
||
|
4 |
+72°С |
5 мин |
1 раз |
|
5 |
+10°С |
Хранение |
3.20. Результаты ПЦР регистрируют методом электрофореза в 1,2% агарозном геле, приготовленном на 1-кратном трис-ацетатном (ТАЕ) буфере с использованием Комплекта N 3 "Набора реагентов для выявления селективных маркеров генетически модифицированных микроорганизмов".
3.21. Детекция результатов ПЦР методом электрофореза включает следующие этапы:
- приготовление ТАЕ буфера: 20 мл 50-кратного концентрированного ТАЕ буфера вносят в мерную колбу вместимостью 1000 мл, доводят до метки дистиллированной водой и тщательно перемешивают;
- приготовление 1,2% агарозного геля: 0,6 г агарозы растворяют в 50 мл 1 х ТАЕ буфера нагреванием в кипящей водяной бане до полного и равномерного растворения, полученный раствор охлаждают до температуры +60°С, добавляют 6 мкл 1% раствора бромистого этидия и перемешивают (примечание: бромистый этидий является сильным мутагеном, поэтому все манипуляции с ним и с агарозным гелем выполняют в перчатках;
- проведение электрофореза: полученный раствор агарозы заливают в кювету для геля согласно инструкции к прибору для горизонтального электрофореза;
- для создания стартовых лунок в кювету помещают гребенку с зубцами, полимеризация агарозы происходит при температуре ниже +42°С в течение 10-20 мин;
- после застывания агарозы осторожно вынимают гребенку и переносят гель в камеру для проведения электрофореза, в камеру заливают 1хТАЕ буфер так, чтобы толщина слоя жидкости над гелем составляла приблизительно 5 мм;
- вносят в лунки агарозного геля по 12,5 мкл амплифицированных образцов, подключают к камере источник постоянного тока и проводят электрофорез при напряжении 120 В в течение примерно 20 мин, помещая стартовые лунки ближе к катоду;
- вынимают гель из камеры, переносят его на стекло трансиллюминатора, включают трансиллюминатор и просматривают гель с последующей видео- или фотодетекцией результатов. Фотоотпечатки или оттиски, выполненные на лазерном принтере с разрешением не менее 600 точек на дюйм, прикладывают к протоколу проведения испытаний.
3.21*. Интерпретацию результатов ПЦР проводят следующим образом:
_______________
* Нумерация соответствует оригиналу. - Примечание изготовителя базы данных.
- в положительном контрольном образце ДНК должна выявляться полоса красно-оранжевого цвета, соответствующая по размеру специфическим фрагментам селективных маркеров ГММ;
- в отрицательном контрольном образце полоса красно-оранжевого цвета должна отсутствовать;
- наличие в анализируемом материале полосы красно-оранжевого цвета, располагающейся строго на уровне полосы положительного контрольного образца ДНК, свидетельствует о наличии в исследуемом образце соответствующего селективного маркерного гена ГММ. При отсутствии такой полосы результат считают отрицательным;
- наличие полосы красно-оранжевого цвета в отрицательном контрольном образце, располагающейся на уровне полосы положительного контрольного образца ДНК, считают результатом контаминации.
IV. Молекулярно-генетический анализ пищевой продукции, полученной
с использованием генно-инженерно-модифицированных микроорганизмов
и микроорганизмов, имеющих генно-инженерно-модифицированные
аналоги методом полимеразной цепной реакции (ПЦР) в реальном времени
4.1. Для выявления ГММ и МГМА в пищевых продуктах методом ПЦР в реальном времени используют следующие материалы, оборудование, реактивы:
1) амплификатор с оптической приставкой типа Rotor Gene - 3000, ABI Prism 7000, iCycler IQ или отечественные аналоги;
2) компьютер, совместимый с программным обеспечением амплификаторов с оптической приставкой;
3) оптические 96-луночные планшеты типа MicroAmp;
4) оптические крышки типа MicroAmp;
5) оптически прозрачные адгезивные пленки;
6) термостат, поддерживающий температуру +45°С, для пробирок объемом 1,5 мл;
7) центрифуга со скоростью вращения ротора до 12000 об/мин для пробирок вместимостью 1,5 и 0,5 мл типа "эппендорф";
8) встряхиватель вибрационный типа "вортекс" со скоростью вращения до 3000 об/ мин;
9) очки / маска защитные;
10) холодильник бытовой электрический;
11) морозильная камера, обеспечивающая температуру (- 20)(0)С или ниже;
12) гомогенизатор типа "SilentCrusher" или других моделей;
13) ступка фарфоровая с пестиком;
14) пинцет медицинский;
15) ножницы медицинские;
16) скальпель медицинский;
17) весы лабораторные общего назначения 2-го класса точности;
18) дистиллятор;
19) анализатор потенциометрический;
20) облучатель бактерицидный настенный;
21) дозаторы с переменным объемом дозирования;
0,2-2,0 мм с шагом 0,01 мм
с шагом 0,01 мм , 0,5-10,0 мм
, 0,5-10,0 мм с шагом 0,01 мм
с шагом 0,01 мм , 2-20 мм
, 2-20 мм с шагом 0,01 мм
с шагом 0,01 мм , 20-200 мм
, 20-200 мм с шагом 0,1 мм
с шагом 0,1 мм ,( )100-1000 мм
,( )100-1000 мм с шагом 1 мм
с шагом 1 мм , 2-10 см
, 2-10 см с шагом 0,1 см
с шагом 0,1 см ;
;
22) пробирки типа "эппендорф" вместимостью 1,5 мл;
23) пробирки типа "эппендорф" для ПЦР вместимостью 0,5 мл;
24) наконечники полимерные объемом 1-200 мкл;
25) наконечники полимерные объемом 200-1000 мкл;
26) перчатки резиновые;
27) колбы плоскодонные конические разной вместимости;
28) цилиндры стеклянные мерные лабораторные вместимостью 25, 100, 1000 см ;
;
29) воронки стеклянные;
30) штативы для пробирок объемом 1,5 и 0,5 мл;
31) комплект N 2 (модифицированный) реагентов для амплификации ДНК "Набора для выделения ДНК из ферментных препаратов, стартерных и заквасочных культур, БАД к пище";
32) реактивы:
- тритон Х-100,
- гуанидина гидрохлорид,
- ЭДТА (этилендиаминтетрауксусная кислота),
- додецилсульфат натрия,
- суспензия двуокиси кремния,
- фенол водонасыщенный,
- хлороформ водонасыщенный,
- спирт этиловый ректификованный,
- ацетат аммония,
- протеиназа К,
- магния хлорид,
- калия хлорид,
- водный раствор дезоксинуклетидтрифосфатов (0,1М),
- креозоловый красный,
- термостабильная ДНК-полимераза,
- масло вазелиновое,
- трис-ацетат,
- ледяная уксусная кислота,
- агароза для электрофореза,
- бромистый этидий,
- вода деионизованная.
4.2. Допускаются к использованию оборудование, инструменты и материалы аналогичного назначения других типов, разрешенные к применению в установленном порядке и с характеристиками, обеспечивающими проведение исследований в соответствии с данным документом.
4.3. Выделение ДНК ГММ и МГМА из заквасочных и стартерных культур, БАД, ферментных препаратов и пищевых продуктов осуществляют в соответствии с п.п.3.13-3.17 настоящих Методических указаний.
4.4. ПЦР в реальном времени осуществляют с использованием модифицированного Комплекта N 2 реагентов для амплификации ДНК "Набора реагентов для выявления селективных маркеров генетически модифицированных микроорганизмов". Модификация предусматривает использование в реакционной смеси не только праймеров, но и флуоресцентно-меченых зондов, а также использование контрольной ДНК ГММ с известной концентрацией в нескольких десятикратных разведениях.
4.5. Флуоресцентно-меченые зонды представляют собой олигонуклеотиды, комплементарные амплифицируемой последовательности-мишени, содержащие на 5'-конце флуорофор - донор флуоресцентного излучения, а на 3'- конце - его акцептор (гаситель).
Нарастание флуоресцентного свечения наблюдают после физического разобщения флуорофора и гасителя; разобщение флуорофора и гасителя происходит при гибридизации с амплифицируемым фрагментом ДНК за счет 5'-экзонуклеазной активности Taq-полимеразы, разрушающей зонд после его гибридизации с амплифицируемой последовательностью. Рост регистрируемого флуоресцентного свечения происходит пропорционально нарастанию числа ампликонов. Это позволяет регистрировать накопление продуктов амплификации в реальном времени, а сравнение кинетики флуоресценции ДНК-стандартов и исследуемого образца - определять относительную концентрацию ДНК в образце.
4.6. Зонды синтезируют на автоматическом олигонуклеотидном синтезаторе типа ASM102U фосфитамидным методом в режиме DMT-on, используя фосфорамидиты и полимерный носитель типа Glen Reseach. Для введения на 3'-конец зонда метки диметиламинофенилазобензойной кислоты (DABCYL) в качестве гасителя флуоресценции используют фазу 3'-Dabcyl CPG (типа Glen Reseach) в стандартном режиме синтеза. Введение на 5'-конец зонда флуорофора - донора флуоресценции - осуществляют автоматическим синтезом, при использовании 6-карбоксифлуоресцеин-амидита (FAM-фосфорамидит). Первичную очистку зондов осуществляют на колонках типа Poly-Pac, с последующей дополнительной очисткой в полиакриламидном геле.
4.7. Для ПЦР в реальном времени используют ферменты Taq-полимеразу TermoStar, или Taq-полимеразу HotRescue, инактивированные антителами, или полимеразу AmpliTaq Gold, обладающие выраженной 5'-экзонуклеазной активностью.
4.8. Для проведения ПЦР в реальном времени используют систему, состоящую из термоциклера (амплификатора) и флуоресцентного детектора продуктов ПЦР в реальном времени.
4.9. Концентрацию ДНК ГММ в образце определяют путем сравнения кинетики флуоресценции ДНК-стандартов в диапазоне разведений контрольных препаратов (10-кратных разведений контрольной ДНК известной концентрации) и исследуемого образца.
4.10. Амплификацию проводят по двухступенчатой программе, объединяющей стадии отжига и элонгации в один этап; конечная концентрация зондов в реакционной смеси - до 200 нМ.
Реакцию проводят в реакционной смеси объемом 50 мкл, включающей в себя: десятикратный реакционный буфер, адаптированный к используемому типу полимеразы; 250 мкМ каждого из 4 дезоксирибонуклеотидтрифосфатов; 300 нМ каждого из праймеров; 200 нМ флуоресцентно-меченого зонда; 5 ед. Taq-полимеразы.
Амплификацию проводят по программе:
1) 1 цикл - 10 мин. - 95°С;
2) 50 циклов: 20 с - 95°С, 1 мин - 65°С.
4.11. Для постановки ПЦР в реальном времени в используемом приборе для амплификации создают специальный протокол в соответствии с инструкциями по пользованию; после завершения создания протокола проверяют наличие в списке режима компенсации базовой линии ПЦР и отмечают используемые флуоресцентные красители. Контрольную ДНК используют в известных разведениях определенной концентрации (стандартах); количество повторов стандартов определяют в соответствии с руководством по эксплуатации прибора.
4.12. Детекцию результатов ПЦР в реальном времени производят автоматически в рамках созданного протокола в графическом и цифровом виде. Автоматический анализ данных происходит следующим образом: последние 95% данных, собранных на каждом шаге, фильтруются средневзвешенным методом. Для экспериментов по амплификации выбирают циклы базовой линии для каждой кривой (образцы) индивидуально с учетом общего оптимального значения порога. По значениям стандартов вычисляют стандартную кривую, на основе которой определяют концентрации ДНК ГММ в исследуемых пробах.

 PO
PO
 , 20
, 20 
 - 08
- 08  «Сейчас просто идёт уже борьба характеров!» Олимпийские...
«Сейчас просто идёт уже борьба характеров!» Олимпийские...  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов