- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
МУ 3.3.2.1886-04
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
3.3.2. МЕДИЦИНСКИЕ ИММУНОБИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ
ВАЛИДАЦИЯ МЕТОДОВ КОНТРОЛЯ ХИМИЧЕСКИХ И ФИЗИКО-ХИМИЧЕСКИХ
ПОКАЗАТЕЛЕЙ КАЧЕСТВА МИБП: ОРГАНИЗАЦИЯ, ПОРЯДОК ПРОВЕДЕНИЯ
И ПРЕДСТАВЛЕНИЕ РЕЗУЛЬТАТОВ
Дата введения: с момента утверждения
УТВЕРЖДЕНЫ Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 4 марта 2004 г.
1. Область применения
1.1. Настоящие методические указания устанавливают порядок валидации химических и физико-химических методов контроля качества (далее - методов) медицинских иммунобиологических препаратов (далее - МИБП).
1.2. Методические указания предназначены для организаций, производящих МИБП, и органов и учреждений, осуществляющих контроль и надзор за МИБП.
1.3. Необходимость валидации методов контроля МИБП определена требованиями, изложенными в СП 3.3.2.1288-03 "Надлежащая практика производства медицинских иммунобиологических препаратов" и ОСТ 42-510-98, а также рекомендациями Всемирной организации здравоохранения (ВОЗ).
2. Общие положения
2.1. Целью валидации химических и физико-химических методов контроля МИБП (далее - валидация методов) является:
- установление пригодности метода для оценки качества конкретного МИБП в соответствии с требованиями нормативных документов (далее - НД);
- обеспечение единства оценки химических и физико-химических показателей качества в организациях, производящих МИБП, и в национальном органе контроля МИБП (НОК) - Государственном НИИ стандартизации и контроля медицинских биологических препаратов им. Л.А.Тарасевича (далее - ГИСК им. Л.А.Тарасевича) и других испытательных организациях.
2.2. Задача валидации - определение характеристики (свойств) метода и показателей его точности при использовании в конкретной организации.
2.3. Валидации подлежат:
2.3.1. Действующие методы контроля по Государственной фармакопее (далее - ГФ) XI и не вошедшие в очередное издание ГФ (например, общая фармакопейная статья (далее - ОФС) "Физико-химические, химические, физические и иммунохимические методы контроля медицинских иммунобиологических препаратов" 42-3874-99 или методические указания по методам контроля (далее - МУК) "Методы контроля медицинских иммунобиологических препаратов, вводимых людям" МУК 4.1/4.2.588-96, а также методы контроля по фармакопейной статье (далее - ФС) и фармакопейной статье предприятия (далее - ФСП) на МИБП.
2.3.2. Ранее валидированные методы контроля после внесения изменений, касающихся области их применения, условий проведения, замены применяемых в них средств измерений, материалов реактивов.
2.3.3. Методы контроля, результаты которых используют для мониторинга технологического процесса.
2.3.4. Новые методы, результаты которых будут использовать для контроля качества сырья, продуктов на стадиях технологического процесса и готовой продукции.
2.4. Валидацию методов проводят по мере представления НД на МИБП или на методы контроля на рассмотрение или пересмотр.
2.5. Валидацию проводят с применением оборудования и средств измерения, аттестованных и внесенных в реестр Госстандартом РФ или Минздравом РФ, или имеющих сертификат калибровки, выданный Госстандартом РФ. На средства измерения должны быть документы, подтверждающие их поверку или калибровку.
2.6. При валидации новых методов определяют характеристики (свойства) метода и показатели его точности.
К характеристике метода относят:
- специфичность;
- линейность;
- диапазон определяемых величин;
- предел обнаружения или предел количественного определения;
- чувствительность.
Выбор характеристики (свойства) зависит от области применения метода, например, оценку предела обнаружения или предела количественного определения необходимо проводить, прежде всего, для методов контроля примесей или остаточных количеств вещества. Характеристики (свойства) нового метода, как правило, определяют на стадии его разработки.
Показателями точности являются:
- прецизионность (т.е. повторяемость и воспроизводимость);
- правильность.
Показатели точности определяют после освоения метода исполнителями.
2.7. При валидации уже использующихся методов контроля определяют показатели точности - прецизионность (повторяемость, воспроизводимость) и правильность. При определении этих показателей подтверждают характеристики метода: линейность, диапазон определяемых величин, пределы обнаружения или количественного определения.
2.7.1. Прецизионность метода определяют для всех методов контроля независимо от их назначения и области применения.
2.7.2. Правильность устанавливают для методов, предназначенных:
- для расширения области применения действующего метода контроля по п.2.3.1.;
- для замены действующего метода контроля по п.2.3.1.;
- для применения наряду с действующим методом контроля по п.2.3.1.
3. Организация и порядок проведения валидации методов
3.1. Валидацию методов контроля, разрабатываемых или используемых на уровне или в рамках национальных или отраслевых стандартов, т.е. предназначенных для контроля готовой продукции (ОФС, ФС, ФСП, МУК) проводят в два этапа.
3.1.1. Первый этап валидации проводит организация, разработавшая или использующая метод контроля. Валидацию проводит подразделение, ответственное за валидацию, - отдел биолого-технологического контроля (далее - ОБТК) или отдел обеспечения качества (далее - ООК). На первом этапе определяют (для нового метода) или подтверждают (при ревалидации) характеристики (свойства) метода и показатели его точности (повторяемость, внутрилабораторная воспроизводимость, при необходимости - правильность) в соответствии с прилож.3 и 4.
3.1.2. Второй этап валидации проводит ГИСК им. Л.А.Тарасевича с участием организаций, использующих метод контроля. На втором этапе валидации определяют правильность и воспроизводимость метода в разных организациях.
3.2. Валидацию методов контроля, использующихся для мониторинга технологического процесса или в соответствии с регламентом производства препарата, проводят ОБТК, ООК или лаборатория, ответственная за валидацию методов контроля. При валидации данных методов проводят только первый этап валидации.
3.3. Валидацию методов контроля допускается совмещать с проведением приемочных испытаний оборудования, предназначенного для обеспечения этих методов и регламентированного в НД на метод. Программу приемочных испытаний оборудования согласовывают с ГИСК им. Л.А.Тарасевича.
3.4. Работу по валидации метода контроля проводят в соответствии с планом организации по валидации. Руководитель организации назначает руководителя соответствующего этапа валидации, а также рабочую группу для проведения валидации.
3.5. Подразделение, проводящее валидацию метода, составляет программу проведения его валидации.
3.6. Для составления программы валидации разработчик метода представляет следующие документы:
3.6.1. Для первого этапа валидации:
- проект метода, оформленный в соответствии с требованиями прилож.2 (за исключением показателей точности, согласовывающих и утверждающих подписей);
- отчет о разработке метода и изучении его характеристик (свойств) с включением всех экспериментальных данных, в т.ч. протоколы проведения анализов;
- сведения о поверке или калибровке использованных средств измерения;
- при необходимости, по требованию лаборатории, проводящей валидацию, должны быть представлены другие дополнительные сведения.
3.6.2. Для второго этапа:
- метод контроля, оформленный в соответствии с требованиями прилож.2, с включением показателей точности, установленных для одной лаборатории (организации);
- отчет о первом этапе валидации, в т.ч. протоколы валидации;
- сведения о поверке или калибровке использованных средств измерения;
- при необходимости по требованию ГИСК им. Л.А.Тарасевича должны быть представлены другие дополнительные сведения.
3.7. Программу работ по валидации согласовывает главный метролог или лицо, ответственное за метрологическую службу организации, и утверждает руководитель организации, проводящей валидацию (или лицо, которому переданы эти полномочия, например, руководитель по качеству организации).
3.8. В программе валидации должно быть указано:
- задачи валидации;
- руководитель этапа и рабочая группа;
- метод, изложенный в виде стандартной операционной процедуры (в дальнейшем - СОП);
- порядок проведения валидации;
- сроки проведения валидации на соответствующем этапе;
- перечень организаций, лабораторий, сотрудников, принимающих участие в валидации;
- форма протокола валидации;
- при определении точности метода указывают порядок обеспечения участников валидации пробами образцов, включая сроки предоставления проб участникам валидации.
3.9. В состав документов, предоставляемых участникам валидации при определении точности, входят:
- метод, оформленный в виде СОП или проект общей ФС аттестуемого метода контроля (без показателей точности);
- программа проведения валидации, а именно часть, включающая:
- задачи валидации;
- инструкцию по хранению проб и по обращению с ними;
- последовательность испытаний отдельных проб в каждой лаборатории, определенную в случайном порядке;
- сроки и порядок представления результатов испытаний;
- форму протокола валидации в части сбора первичных данных (прилож.5), в котором должно быть предусмотрено указание:
- N НД, производитель, N серии (партии), дата выпуска, срок годности основных реактивов;
- типа и марки оборудования, включая мерную посуду (пипетки, бюретки и т.д.);
- для измерительного оборудования - дату последней поверки (калибровки) и проверки.
3.10. Выполнение программы валидации, оформление протоколов и составление отчета обеспечивают руководители этапов валидации.
3.11. Составление программы валидации и обработку результатов проводят с привлечением специалистов в области метрологии и математической статистики.
4. Обработка и оформление результатов валидации
4.1. Результаты по первому и второму этапам валидации оформляют соответствующими отчетами с приложением всех исходных данных, расчетов показателей точности, протоколов валидации по всем лабораториям, сводных данных по результатам валидации, а также анализом данных и заключения о результатах валидации. Отчеты оформляют не менее чем в двух экземплярах.
4.2. Отчет по первому этапу валидации подписывают исполнитель, руководитель первого этапа работ, руководитель ОБТК или ООК или руководитель по качеству организации, проводящей валидацию, представитель организации-разработчика оборудования (в случае совмещения работ по проведению валидации метода контроля и приемочных испытаний оборудования) и утверждает руководитель организации.
4.3. Отчет по второму этапу работ подписывают руководитель второго этапа работ, ответственный исполнитель и руководитель по качеству ГИСК им. Л.А.Тарасевича, руководитель организации, участвовавшей в валидации, руководитель ОБТК или ООК этой организации. Отчеты согласовывает главный метролог ГИСК им. Л.А.Тарасевича и утверждает руководитель ГИСК им. Л.А.Тарасевича.
4.4. Материалы по первому этапу валидации (отчет о первом этапе валидации с включением экспериментальных данных и расчетов показателей точности) проходят экспертизу в составе проектов НД (ФСП, регламента производства).
4.5. При положительных результатах валидации на метод, прошедший первый этап валидации, оформляют свидетельство о проведении первого этапа валидации (прилож.6), в СОП включают пределы определяемых величин и численные значения показателей точности для одной лаборатории (организации), а также процедуру и периодичность контроля показателей точности. Результаты валидации, полученные в данной организации, не могут быть использованы при внедрении метода в другой организации.
На метод контроля, прошедший второй этап валидации, оформляют свидетельство о валидации (прилож.7). В НД на метод включают показатели точности, а также указывают процедуру и периодичность контроля точности.
4.6. При отрицательных результатах валидации в отчете указывают, что следует провести дополнительное исследование и анализ полученных результатов с целью уточнений положений метода и в срок (указать срок, согласованный с разработчиком метода или рабочей группой) и представить метод на повторную валидацию.
Отрицательным результат валидации признают в следующих случаях:
- если выявлено отсутствие специфичности и линейности;
- если выявлено несоответствие предела обнаружения или предела количественного определения требованиям к допустимому содержанию примеси в НД на препарат;
- если выявлено несоответствие показателей точности требованиям к допустимому диапазону показателя, установленному в НД на препарат.
Приложение 1
Термины, определения, сокращения
|
Метод (методика) контроля - (далее - метод /методика/) |
документированная процедура определения химических и физико-химических показателей качества МИБП на этапах производства и готовой продукции | |
|
Новый метод (новая методика) |
Метод (методика), разработанный или использующийся впервые для определения химических и физико-химических показателей МИБП на этапах производства и готовой продукции, т.е. метод, не включенный в ГФ, общую ФС 42-3874-99, МУК 4.1/4.2.588-96 или в ФС и ФСП на МИБП | |
|
НД на метод |
Нормативные документы на метод (ГФ, ФС, МУК или СОП на метод, ФС или ФСП на препарат) | |
|
Валидация метода |
документированное подтверждение пригодности метода для применения при производстве и контроле качества МИБП в соответствии с требованиями НД | |
|
Оборудование |
технические средства, которые используют для воспроизведения стандартизованных условий метода (например, термостат, центрифуга, холодильник, газовые горелки, нагревательные приборы и т.д.) | |
|
Средств измерения |
Контрольно-измерительные приборы (КИП) (например, рН-метр, спектрофотометр, аналитические весы, термометр и т.д.) | |
|
Проба |
представительная часть продукта, отобранная в соответствии с НД или правилами, установленными в программе валидации | |
|
Независимые определения (результаты) |
определения (результаты) в условиях повторяемости или воспроизводимости (т.е. осуществляют все процедуры, предусмотренные в НД на метод, включая калибровочный график) | |
|
Аналитическая серия |
одномоментное определение одного и того же показателя в нескольких пробах (идентичных или различных), т.е. с использованием одного калибровочного графика или стандартного образца | |
|
Параллельные определения |
одномоментное определение одного и того же показателя в двух или более идентичных пробах или идентичных частях одной и той же пробы, т.е. с использованием одного калибровочного графика или стандартного образца | |
|
Аналитический сигнал |
показания измерительного прибора, использующиеся для расчета результата (например, величина оптической плотности, рН, масса, объем и т.д.) | |
|
Результат |
окончательное значение аналитического показателя, получаемое при выполнении метода. В зависимости от указаний в соответствующем разделе метода результат может быть получен из одного определения, или как среднее арифметическое значение двух или нескольких параллельных определений, или иным способом | |
|
Выпадающее значение (выброс) |
результат, статистически значимо отклоняющийся от других результатов и не признаваемый поэтому элементом серии результатов | |
|
*Принятое опорное значение |
значение, которое служит в качестве согласованного для сравнения и получено как: | |
|
|
а) теоретическое или установленное значение, базирующееся на научных принципах; | |
|
|
б) приписанное или аттестованное значение, базирующееся на экспериментальных работах какой-либо национальной или международной организации; | |
|
|
в) согласованное или аттестованное значение, базирующееся на экспериментальных работах под руководством научной или инженерной группы; | |
|
|
г) математическое ожидание измеряемой характеристики, т.е. среднее значение заданной совокупности результатов измерений - лишь в случаях, когда а), б) и в) недоступны | |
|
Характеристика (свойства) метода |
включает: специфичность, линейность, диапазон определяемых величин, предел обнаружения или количественного определения (для примесей или остаточных количеств вещества), чувствительность | |
|
Специфичность |
способность метода определять исключительно анализируемое соединение | |
|
Линейность |
способность метода в пределах заданного диапазона давать результаты, пропорциональные количеству анализируемого вещества в образце | |
|
Диапазон определяемых величин |
интервал между верхним и нижним значениями количества анализируемого вещества, для которого установлена пригодность метода с точки зрения линейности, прецизионности и правильности | |
|
Предел обнаружения |
минимальное количество анализируемого вещества, которое может быть обнаружено данным методом | |
|
Предел количественного определения |
минимальное количество анализируемого вещества, которое может быть количественно определено с определенной точностью данным методом | |
|
Чувствительность |
способность метода регистрировать минимальные изменения концентрации | |
|
*Точность |
степень близости результата измерений к принятому опорному значению; показатели точности правильность и прецизионность | |
|
*Правильность |
степень близости среднего значения, полученного на основании серии результатов, к принятому опорному значению | |
|
*Прецизионность |
степень близости друг к другу независимых результатов, полученных в конкретных регламентированных условиях. Количественная форма представления прецизионности включает два показателя: повторяемость и воспроизводимость | |
|
*Повторяемость |
степень близости друг к другу независимых результатов, полученных в условиях повторяемости, а именно: | |
|
|
- одним и тем же методом | |
|
|
- на идентичных объектах испытаний (идентичных частях пробы) | |
|
|
- в одной и той же лаборатории | |
|
|
- одним и тем же оператором | |
|
|
- с использованием одного и того же комплекта (экземпляра) оборудования и средств измерения, предусмотренных в НД на метод | |
|
|
- в пределах короткого промежутка времени | |
|
Мерой рассеяния результатов в условиях повторяемости является стандартное (среднеквадратическое) отклонение повторяемости - | ||
|
*Короткий промежуток времени |
промежуток времени, в который не проводится перекалибровка оборудования (если это не предусмотрено методом) и сохраняются параметры окружающей среды | |
|
*Доверительный интервал разности двух результатов в условиях повторяемости |
Значение | |
|
*Воспроизводимость |
степень близости друг к другу независимых результатов, полученных в условиях воспроизводимости, а именно: | |
|
|
- одним и тем же методом | |
|
|
- на идентичных объектах испытаний | |
|
|
- в разных лабораториях | |
|
|
- разными операторами | |
|
|
- с использованием различных комплектов (экземпляров) оборудования и средств измерения, предусмотренных в НД на метод. | |
|
|
Мерой рассеяния результатов в условиях воспроизводимости является стандартное (среднеквадратическое) отклонение воспроизводимости - | |
|
*Внутрилабораторная воспроизводимость |
степень близости друг к другу независимых результатов, полученных в одной лаборатории: | |
|
- одним и тем же методом | ||
|
- на идентичных объектах испытаний | ||
|
|
- разными операторами | |
|
|
- с использованием различных комплектов (экземпляров) оборудования и средств измерения, предусмотренных в НД на метод. | |
|
*Доверительный интервал разности двух результатов в условиях воспризводимости |
Значение |
________________
* Термины и определения, использованные в соответствии с ГОСТ Р ИСО 5725-1-02.
ГФ - Государственная фармакопея.
НД - нормативные документы.
МИБП - медицинские иммунобиологические препараты.
МУК - методические указания по методам контроля.
НОК - национальный орган контроля.
ОБТК - отдел биологического и технологического контроля.
ООК - отдел обеспечения качества.
ОСО - отраслевой стандартный образец.
ОФС - общая фармакопейная статья.
РП - регламент производства.
СОП - стандартная операционная процедура.
ФС - фармакопейная статья.
ФСП - фармакопейная статья предприятия.
![]() - стандартное (среднеквадратическое) отклонение повторяемости.
- стандартное (среднеквадратическое) отклонение повторяемости.
![]() - стандартное (среднеквадратическое) отклонение воспроизводимости.
- стандартное (среднеквадратическое) отклонение воспроизводимости.
![]() - доверительный интервал разности двух результатов в условиях повторяемости.
- доверительный интервал разности двух результатов в условиях повторяемости.
Приложение 2
Требование к составлению стандартных
операционных процедур на методы контроля химических
и физико-химических показателей качества МИБП
Общие положения
При составлении стандартных операционных процедур (далее - СОП) необходимо руководствоваться следующими правилами:
- текст СОП должен быть ясным и четким, не допускать двоякого толкования, обеспечивать возможность воспроизведения процедуры обученным лицом;
- в тексте не должно допускаться научного и лабораторного жаргона;
- при описании процедуры целесообразно нумеровать этапы процедуры по принципу "один пункт - одно действие", чтобы в дальнейшем давать ссылку на необходимый номер;
- оформление СОП (первой и последующих страниц) должно быть регламентировано и производиться по установленному образцу; целесообразно предусмотреть централизованное форматирование документа;
- при использовании физических величин их размерность должна быть указана в системе СИ, за исключением тех случаев, когда допускается использование других общепризнанных систем;
- целесообразно использовать определенные шрифт, размер и интервал при написании СОП (например, шрифт Times New Roman, размер 12, интервал 1,5);
- порядок действий с электронной версией СОП должен быть регламентирован;
- должна быть обеспечена безопасность компьютерной базы данных для исключения несанкционированного доступа.
Общие требования к составлению, рассмотрению и введению в действие СОП изложены в методических рекомендациях "Составление, рассмотрение и введение в действие стандартных операционных процедур". МР N 11-3/11-09-03. Далее изложены требования к оформлению СОП на методы контроля химических и физико-химических показателей качества МИБП (далее - СОП на методы контроля).
Составление СОП на методы контроля
СОП на методы контроля должна содержать следующие разделы:
- наименование метода;
- введение, цель;
- область применения;
- пересмотр;
- термины и обозначения;
- техника безопасности и охрана труда;
- образцы;
- персонал (ответственность);
- материалы и оборудование;
- процедура;
- учет и представление результатов (продуктов), включая действия в случае отклонения или несоответствия требуемым параметрам;
- приложения;
- ссылки.
В зависимости от области применения разделы могут быть объединены или исключены.
Изложение разделов СОП
В разделе "Введение, цель" могут быть указаны общие положения по усмотрению разработчика, должна быть указана цель проведения процедуры.
В разделе "Область применения" должно быть указано, где и с какой целью используется СОП, диапазон измеряемых величин.
В разделе "Пересмотр" должно быть указанно "Разработана впервые", если разработана впервые или "Взамен СОП N...", если это пересмотренная СОП, в этом случае должна быть дана краткая история поправки. Этот раздел может быть включен в текст 1 страницы.
В разделе "Термины и обозначения" должны быть расшифрованы обозначения, сокращения, а также введенные термины.
В разделе "Техника безопасности и охрана труда" должны быть изложены все необходимые общие указания по технике безопасности и охране труда, производственной санитарии и охране окружающей среды. Кроме того, если это необходимо, они должны быть выделены в тексте жирным шрифтом и заглавными буквами. Должна быть сделана ссылка на соответствующие документы, если они имеются.
В разделе "Образцы" должно быть указано: порядок отбора образцов, их количество для процедуры, каким образом и в течение какого времени их следует хранить до осуществления процедуры.
В разделе "Персонал" должно быть указано, кто по должности отвечает за процедуру и кто ее исполняет, а также кто осуществляет контроль за правильностью ее проведения. Должен быть указан уровень квалификации соответствующих лиц.
В разделе "Материалы и оборудование" должно быть указано все необходимое для проведения процедуры. В СОП, касающихся методик контроля, в этом разделе указывают:
- реактивы с указанием нормативного документа и квалификации;
- стандартные образцы (где хранятся /указать номер комнаты и номер холодильника/), другие контрольные материалы и рабочие стандартные образцы;
- буферные и другие растворы (как готовить, где, как хранить);
- формы отчетности, использующиеся с СОП;
- контрольно-измерительные приборы и другие технические средства, необходимые для выполнения метода, с указанием государственных (отраслевых) стандартов или технических условий, а также типов, марок или моделей. Для контрольно-измерительных приборов (мерная посуда, пипетки, рН-метры, весы и т.д.) указывают класс точности, пределы допускаемых погрешностей, пределы измерений, а также условия поверки, проверки и калибровки;
- стеклянную посуду, пластиковые принадлежности, иглы, и т.д.
В разделе "Процедура" необходимо максимально подробно изложить все этапы работы:
- предварительные работы (подготовка помещения, оборудования, рабочего места, реактивов, подготовка пробы, калибровочный график, при этом допускается ссылка на соответствующие СОП);
- опасные места в процессе производства, условия безопасной работы, санитарно-гигиенические требования;
- описание процедуры включает перечень, объем, последовательность операций, периодичность и число измерений, требования к представлению промежуточных и конечных результатов (число значащих цифр и др.), указания о проведении контрольного опыта, использовании контрольных материалов, описание операций по устранению влияющих факторов, критерии для принятия решений (например, для высокоэффективной жидкостной хроматографии - критерии для оценки технического состояния оборудования и пригодности колонок).
В разделе "Учет и представление результатов" необходимо указать:
- используемые формы отчетности (например, протоколы, акты, журналы и т.д.);
- формы представления результатов (формы отчетности) с указанием вида носителя полученной измерительной информации (документ, лента самопишущего прибора и т.п.). Формы отчетности даются в приложении или приводится ссылка на другой документ, где эта форма указана;
- кому должны быть представлены полученные результаты;
- где должны храниться полученные результаты;
- действия, если результаты выходят за рамки спецификации;
- любые произошедшие отклонения от процедуры, которые должны быть зафиксированы и доведены до сведения лица, ответственного за процедуру, указать способ доведения до сведения. Ответственное лицо должно принять решение о допустимости данного отклонения;
- любые требуемые вычисления (при необходимости привести пример расчета). Указывают необходимость регистрации результатов промежуточных измерений и значений влияющих величин, а также формы их регистрации;
- оценку достоверности результата или критерий того, что метод проведен правильно;
- нормативы, процедуры и периодичность контроля показателей точности (повторяемость, воспроизводимость и др.).
В разделе "Приложения" указывается перечень всех материалов: табличные материалы, формы отчетности, заполняемые формы и т.д., необходимые для осуществления данной процедуры (если они используются только в данной СОП). Каждое приложение должно иметь ссылку на СОП, к которой оно относится.
В разделе "Ссылки" указывают перечень СОП и других документов, которые должны учитываться при работе с данной СОП. В этом же разделе, при необходимости, может быть дана ссылка на литературные источники.
Приложение 3
Валидация методов определения химических и физико-химических
показателей при производстве и контроле МИБП
Определение характеристики (свойств) метода
При валидации методов, использующихся при производстве и контроле МИБП для определения химических и физико-химических показателей (далее - валидации методов), оценивают в зависимости от назначения метода следующие характеристики (свойства):
- специфичность;
- линейность;
- диапазон определяемых величин;
- предел обнаружения или предел количественного определения (для примеси и остаточных количеств веществ);
- чувствительность.
Кроме того, должна быть проведена оценка устойчивости метода, которая включает изучение продолжительности и условий хранения рабочих растворов реактивов и стандартных образцов, а также изучение влияния параметров окружающей среды на результаты анализа.
Характеристики (свойства) метода, как правило, должны быть установлены в процессе его разработки.
Для валидации метод должен быть изложен в виде стандартной операционной процедуры в соответствии с требованиями прилож.2 (за исключением показателей точности, согласовывающих и утверждающих подписей).
Специфичность
Специфичность - это способность метода определять исключительно анализируемое вещество.
Специфический метод дает возможность определять анализируемое вещество в присутствии других веществ и/или примесей других веществ.
При оценке специфичности устанавливают факторы, мешающие или влияющие на определение. При наличии таких факторов они должны быть указаны в НД на метод.
Для оценки специфичности может быть использован метод добавок и стандартные образцы. При использовании метода добавок процент выявления не должен превышать +/-10% от добавленного количества анализируемого вещества.
Линейность
Линейность метода определяют, проводя анализ проб с различной концентрацией (при разработке метода - не менее 5 концентраций, при ревалидации достаточно трех концентраций) анализируемого вещества или образцов плацебо с внесенным веществом в диапазоне, предусмотренном методом контроля. По результатам анализа строят график вручную или с помощью машинной обработки, для построения графика отмечают на оси OX - ожидаемое количество анализируемого соединения; на оси ОУ - величину аналитического сигнала.
Стандартное отклонение и доверительный интервал точки пересечения графика с осью ОУ (интерсепт, коэффициент сдвига) и наклона линии регрессии могут быть вычислены, например, методом наименьших квадратов или с помощью машинной обработки с пакетом статистических программ для регрессионного анализа, например Microsoft Excel.
Вывод о линейности может быть сделан в следующих случаях:
при визуальной оценке:
- измеренные значения должны лежать на линии регрессии или быть равномерно распределены по обе стороны от нее (отклонение не должно превышать 10%);
при машинной обработке:
- если коэффициент корреляции превышает 0,9;
- если начало координат находится внутри доверительного интервала точки пересечения графика с осью ОУ (если график должен проходить через 0, например, при оценке примесей).
Если метод является линейным лишь в определенном диапазоне, должна быть указана область линейности.
Должны быть регламентированы требования к построению калибровочного графика. При последующей валидации должен быть установлен доверительный интервал для линии регрессии.
Чувствительность
Чувствительность - это способность метода регистрировать минимальные изменения концентрации. Мерой чувствительности является наклон линии регрессии при определении линейности.
Диапазон определяемых величин
Диапазон определяемых величин - это интервал между верхним и нижним значениями концентрации анализируемого вещества (включая эти значения), для которого продемонстрирована пригодность данной методики с точки зрения линейности, повторяемости, воспроизводимости и правильности в одной лаборатории.
Предел обнаружения
Предел обнаружения характеризует минимальное количество вещества, которое может выявлять метод. Данная характеристика необходима для методов, предназначенных для испытания на чистоту или выявления остаточных количеств веществ, которые были использованы при получении препарата.
Предел обнаружения может быть установлен с использованием визуальной или инструментальной оценки. При использовании инструментальной оценки предел обнаружения устанавливают расчетным путем - по соотношению аналитического сигнала анализируемой пробы и контрольного раствора (это соотношение должно быть не менее 3:1).
Предел количественного определения
Предел количественного определения характеризует минимальное количество вещества, которое может быть количественно определено. Данная характеристика необходима для методов определения примесей, например, примесей в субстанции или лекарственных формах.
Установление предела количественного определения может проводиться расчетным путем на основании величины стандартного отклонения и угла наклона графика при определении линейности.
Приложение 4
Валидация методов определения химических и физико-химических
показателей при производстве и контроле МИБП
Определение показателей точности метода в одной лаборатории
(в одной организации)
При валидации методов, использующихся при производстве и контроле МИБП для определения химических и физико-химических показателей, оценивают следующие показатели точности:
- прецизионность;
- повторяемость;
- воспроизводимость;
- правильность.
1. Общие положения
1.1. Оценку показателей точности методов контроля получают на основе результатов внутрилабораторных или межлабораторных испытаний, проведенных в одной организации.
1.2. Показатель точности метода контроля, полученный в одной организации, не может быть использован при внедрении метода контроля в другой организации. При внедрении метода контроля в другой организации необходимо проведение валидации в полном объеме в соответствии с данными методическими указаниями.
1.3. Описание метода контроля, подлежащего валидации, должно быть сделано в соответствии с требованиями прилож.2, должен быть указан способ представления и округления результатов испытаний. В методе контроля должны быть оговорены все условия, которые могут влиять на результат определения.
1.4. В проведении валидации должны принимать участие исполнители, освоившие метод контроля. Пробы, полученные для проведения валидации, не должны использоваться для освоения метода контроля.
1.5. Порядок проведения валидации определяется программой, составленной в соответствии с разделом 3 настоящих методических указаний. Составление программы валидации и обработка результатов должна проводиться с участием специалиста в области метрологии и математической статистики.
1.6. Желательно проведение валидации при участии нескольких исполнителей.
1.7. Концентрации определяемого вещества в препаратах МИБП, использующихся при валидации, должны быть по возможности равномерно распределены в пределах, установленных для определяемого показателя, и охватить нижний предел плюс 20%, среднее значение +/-10% и верхний предел минус 20% диапазоны ожидаемых пределов. Желательно, чтобы количество препаратов в каждом диапазоне было не менее 2, соответственно в трех диапазонах - не менее 6.
1.8. Пробы МИБП предоставляются исполнителям, принимающим участие в валидации, в закодированном виде. Кодирование проб производится путем присвоения каждой пробе отдельного неповторяющегося номера.
1.9. На случай утери или порчи отдельных проб, руководитель этапа валидации должен иметь в резерве некоторое количество каждой пробы с тем, чтобы обеспечить им исполнителей, нуждающихся в проведении повторного определения.
1.10. В программе валидации должны быть оговорены условия хранения МИБП (температура помещения, освещенность и т.п.) в соответствии с требованиями ФСП на препарат.
1.11. Для получения достаточно надежных оценок повторяемости метода необходимо, чтобы эти оценки были получены как минимум при 30 степенях свободы для каждого диапазона концентраций. Только в этом случае полученная оценка повторяемости метода характеризует предел расхождения между двумя единичными результатами испытаний в условиях повторяемости и является средней оценкой указанных расхождений для изучаемого диапазона концентраций.
1.12. Первоначальные пробы (препараты МИБП или другие материалы), предназначенные для проведения валидации, разделяют на части. Количество частей равно количеству аналитических серий, которое будет проведено всеми участниками валидации.
1.13. В аналитической серии исполнитель использует одну часть каждой первоначальной пробы. Количество аналитических серий и количество проб в каждой аналитической серии у каждого исполнителя должно быть одинаковым.
1.14. Каждую последующую аналитическую серию проводят после окончания работы с предыдущей аналитической серией.
1.15. Последовательность проб в каждой аналитической серии устанавливают в случайном порядке и указывают в программе валидации.
1.16. Исполнитель обязан вносить в протокол валидации каждый полученный результат. В протокол вносятся все замечания по валидации.
1.17. Все результаты вносят в сводную таблицу результатов валидации. К сводной таблице прилагают протоколы валидации.
2. Отбор, распределение и хранение проб
2.1. Соблюдение установленных правил отбора, распределения и хранения проб МИБП имеет важное значение для получения достоверных результатов валидации.
2.2. Для обеспечения идентичности всех частей проб, предоставляемых исполнителям, вначале отбирают первоначальную пробу (1 серия готовой продукции, полуфабриката, субстанции или другой материал), а затем делят ее на ![]() частей, где:
частей, где:
![]() - общее количество аналитических серий для каждого исполнителя;
- общее количество аналитических серий для каждого исполнителя;
![]() - количество исполнителей;
- количество исполнителей;
![]() - количество частей пробы, оставляемых руководителем в качестве резерва.
- количество частей пробы, оставляемых руководителем в качестве резерва.
Если для валидации используют субстанцию или неразлитый полуфабрикат, при разделении первоначальной пробы на необходимое количество частей должны соблюдаться меры, обеспечивающие однородность всех частей пробы.
Размер одной части пробы, передаваемой исполнителю, должен обеспечивать получение одного результата. Если в методе контроля имеется указание о том, что результат получается как среднее из двух или большего количества определений, то размер каждой пробы должен обеспечивать проведение всех определений, входящих в результат.
Количество первоначальных проб выбирают в соответствии с п.1.7. настоящего приложения.
2.3. Отбор проб МИБП для проведения валидации проводят в соответствии с СОП на отбор проб при контроле МИБП.
2.4. Подготовка проб должна быть отражена в протоколе валидации.
2.5. Пробы МИБП должны храниться в условиях, обеспечивающих сохранность всех свойств пробы. Условия хранения проб указываются в программе проведения валидации.
3. Правила округления результатов
3.1. Значение результата определения округляют до одной десятой известной (или предполагаемой) величины повторяемости.
3.2. Способ округления должен быть указан в программе валидации.
3.3. Шаг округления результатов указывается в СОП на метод контроля.
Примечание.
Способы округления
1) Шаг округления выбирают из ряда 5; 2; 1; 0,5; 0,2; 0,1 и т.д. Если в этом ряду не будет чисел, равных точно одной десятой повторяемости ![]() метода испытаний, то в качестве шага округления берут ближайшее меньшее число. Например, если повторяемость метода равна 5,0, то результат испытания округляют с шагом 0,5. Если повторяемость метода равна 4,0, то результат испытания округляют с шагом не 0,4, а с шагом, равным ближайшему меньшему значению шага округления, т.е. 0,2.
метода испытаний, то в качестве шага округления берут ближайшее меньшее число. Например, если повторяемость метода равна 5,0, то результат испытания округляют с шагом 0,5. Если повторяемость метода равна 4,0, то результат испытания округляют с шагом не 0,4, а с шагом, равным ближайшему меньшему значению шага округления, т.е. 0,2.
2) При округлении результат испытания округляют до ближайшего числа, кратного шагу округления. Если результат испытания лежит посередине между ближайшими округленными числами, то его округляют в сторону числа, четного по отношению к шагу округления. Например, при принятом шаге округления 0,1 число 23,55 округляют до 23,6, а число 23,45 округляют до 23,4. При принятом шаге округления 0,02 число 5,03 округляют до 5,04, а число 5,01 до 5,00 и т.д.
3) В некоторых случаях процедура округления результатов испытаний определяется спецификой метода и задается на основе иных правил. Например, для грубой оценки допускается округление в соответствии с правилами приближенного вычисления, т.е., если число больше или равно 5, то цифру увеличивают на 1 единицу разряда, если число меньше 5, то сохраняют цифру предшествующего разряда без изменений.
4. Порядок кодирования проб и процедура определения очередности испытаний проб
4.1. Исполнители получают кодированные (зашифрованные) пробы. Кодирование проб - присвоение каждой пробе отдельного неповторяющегося номера. Другой информации для идентификации пробы исполнитель не получает.
4.2. Принцип кодирования указывают в программе валидации (например, пробы кодируют четырехзначными номерами, в которых первые две цифры (01, 02, 03 и т.д.) обозначают номер микросерии и номер аналитической серии, а последние цифры - номер пробы).
4.3. Код пробы указывается на контейнерах или емкостях, в которых проба хранится и транспортируется.
4.4. Очередность использования проб во всех аналитических сериях устанавливает руководитель этапа валидации. Для определения очередности испытаний проб может быть использован, например, метод случайных чисел. Способ определения очередности указывают в программе валидации.
4.5. Руководитель этапа валидации составляет таблицу кодов всех проб, которая прилагается к отчету.
5. Определение повторяемости
Повторяемость характеризуется стандартным отклонением повторяемости ![]() . Стандартное отклонение определяют при многократном определении нескольких образцов.
. Стандартное отклонение определяют при многократном определении нескольких образцов.
Многократное определение проводят при максимально одинаковых условиях, а именно в условиях повторяемости (получают независимые результаты), т.е. проводят несколько серий определений один за другим в одной лаборатории, с применением одного метода, на идентичных частях одной и той же пробы, одним и тем же оператором, на одном и том же комплекте (экземпляре) испытательного оборудования и средств измерения.
Для оценки повторяемости проводят определение показателя в образцах, выбранных и приготовленных в соответствии с п.п.1.7. и 2.2. настоящего приложения. Число образцов в каждом диапазоне должно быть одинаковым. Для получения достаточно надежных оценок повторяемости метода необходимо, чтобы эти оценки были получены как минимум при 30 степенях свободы для каждого диапазона концентраций. Если статистический план, на основании которого проводилось исследование, не обеспечивает 30 степеней свободы, то оценку параметров эмпирического распределения нельзя считать представительной.
Рассчитывают стандартное отклонение повторяемости и доверительный интервал разности двух результатов, полученных в условиях повторяемости.
Конкретный алгоритм расчета зависит от метода анализа и плана эксперимента, предусмотренного в программе валидации.
Пример плана эксперимента для оценки повторяемости метода определения белкового азота, позволяющий максимально упростить расчеты, приведен в прилож.8.
6. Определение внутрилабораторной воспроизводимости
(в одной лаборатории или в одной организации)
Для определения внутрилабораторной воспроизводимости проводят определение показателя в образцах, выбранных и приготовленных в соответствии с п.п.1.7. и 2.2. настоящего приложения, в одной организации одним и тем же методом на идентичных частях одной и той же пробы в одной или нескольких лабораториях, меняя следующие факторы:
- разные операторы;
- различные комплекты (экземпляры) испытательного оборудования и средств измерения, предусмотренные в НД на метод.
Воспроизводимость характеризуется стандартным отклонением вопроизводимости ![]() .
.
Конкретный алгоритм расчета зависит от метода анализа и плана эксперимента, предусмотренного в программе валидации.
Для получения достаточно надежных оценок внутрилабораторной воспроизводимости метода необходимо, чтобы эти оценки были получены как минимум при 30 степенях свободы для каждого диапазона концентраций. Если статистический план, на основании которого проводилось исследование, не обеспечивает 30 степеней свободы, то оценку параметров эмпирического распределения нельзя считать представительной.
7. Определение правильности
Для нового метода с целью определения правильности применяют два основных подхода:
1. Предлагаемый метод сравнивается со вторым методом, точность которого установлена. Метод сравнения может быть методом, приведенным в ГФ или в общей фармакопейной статье ФС 42-3874-99.
2. Используется метод добавок. Анализируемое вещество и образцы плацебо с внесенным в них веществом, охватывающие заданный диапазон концентраций, исследуются в соответствии с методом. По результатам анализа строят график, для построения которого отмечается на оси ОХ - ожидаемое количество анализируемого соединения; на оси ОУ - измеренное количество анализируемого соединения.
При отсутствии систематической ошибки измеренные значения должны лежать на прямой линии, проходящей через начало координат и имеющей наклон 1.
Рассчитывают стандартное отклонение и доверительный интервал точки пересечения графика с осью ОУ и угол наклона графика. Для построения графика используют, как правило, метод наименьших квадратов, для расчета коэффициентов - регрессионный анализ. Конкретный алгоритм расчета зависит от метода анализа и плана эксперимента по валидации, предусмотренного в программе валидации.
Правильность считают удовлетворительной при соблюдении следующих условий:
1. Значения, полученные по обеим методикам анализа, не должны различаться на значительную величину (не должны превышать доверительный интервал среднего значения).
2. а) Среднее выявление должно, как правило, находиться в диапазоне от 98 до 102% от добавленной величины.
б) Доверительный интервал (![]() 95%) точки пересечения графика с осью ОУ должен включать начало координат и не превышать +/-10% от измеряемой величины. Доверительный интервал (
95%) точки пересечения графика с осью ОУ должен включать начало координат и не превышать +/-10% от измеряемой величины. Доверительный интервал (![]() 95%) наклона линии регрессии должен включать 1 и быть в пределах 0,9-1,1.
95%) наклона линии регрессии должен включать 1 и быть в пределах 0,9-1,1.
Для определения правильности проводят определение показателя в образцах, содержащих анализируемое вещество в необходимом диапазоне (низкая, средняя, высокая концентрация). Анализ проводят не менее 5-6 раз.
Приложение 5
Форма
составления протокола валидации (первичные данные)
Наименование организации
ПРОТОКОЛ ВАЛИДАЦИИ
1 этап валидации
|
1. Лаборатория N | ||||
|
2. Наименование лаборатории | ||||
|
3. Зав. лаборатории | ||||
|
4. Исполнитель | ||||
|
5. Наименование метода и N СОП | ||||
|
6. Условия проведения испытаний: | ||||
|
6.1. Оборудование (тип, марка, заводской номер, важные для метода характеристики, для КИП - дата последней поверки или калибровки). | ||||
|
6.2. Реактивы для построения калибровочного графика (дата приготовления основного и рабочего стандартных растворов). | ||||
|
6.3. Реактивы (N НД, квалификацию или фирму и N по каталогу, N серии, дату выпуска, срок годности). | ||||
|
При использовании растворов (буферных, солевых и т.д.) указать дату приготовления. | ||||
|
7. Результаты определения. | ||||
|
NN |
Код пробы |
Дата начала определения |
Дата окончания определения |
Использо- |
Результат измерения, например, оптическая плотность, объем, время и т.д. |
Формула расчета результата определения |
Результат |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8. Замечания о ходе выполнения программы.
|
Дата |
Руководитель лаборатории: |
Пример составления формы протокола валидации (сбор первичных данных) на первом этапе валидации (определение повторяемости) метода определения белкового азота приведен в прилож.9.
Приложение 6
Форма
Составления свидетельства о проведении
первого этапа валидации метода контроля
|
СОГЛАСОВАНО |
УТВЕРЖДАЮ | ||||
|
(фамилия, дата) |
(фамилия, дата) |
||||
Свидетельство N
о проведении первого этапа валидации
|
На метод | ||||||||||||||
|
(наименование метода контроля) | ||||||||||||||
|
1. Назначение и область применения | ||||||||||||||
|
2. Оборудование, реактивы и материалы - по СОП N | ||||||||||||||
|
3. Стандартный образец (СО) | ||||||||||||||
|
4. Подготовка и выполнение метода контроля - по СОП N | ||||||||||||||
|
5. Характеристики (свойства) метода | ||||||||||||||
|
Линейность | ||||||||||||||
|
Диапазон определяемых величин | ||||||||||||||
|
Предел обнаружения или Предел количественного определения | ||||||||||||||
|
Влияющие факторы | ||||||||||||||
|
6. Показатели точности метода в одной лаборатории (организации): | ||||||||||||||
|
повторяемость | ||||||||||||||
|
внутрилабораторная воспроизводимость | ||||||||||||||
|
правильность (для нового метода) | ||||||||||||||
|
Руководитель ОБТК или ООК организации, проводившей валидацию | ||||||||||||||
|
(фамилии, имя, отчество) | ||||||||||||||
|
Руководитель лаборатории | ||||||||||||||
|
(фамилия, имя, отчество) | ||||||||||||||
|
Руководитель первого этапа валидации | ||||||||||||||
|
(фамилия, имя, отчество) | ||||||||||||||
Приложение 7
Форма
Составления свидетельства о проведении
первого этапа валидации метода контроля
|
УТВЕРЖДАЮ | ||
|
(фамилия, дата) |
||
Свидетельство о валидации N
|
Метод | ||||||||
|
(наименование метода контроля и НД в котором метод регламентирован) | ||||||||
|
валидирован в соответствии с МУ N 3.3.2.1886-04 "Валидация методов контроля химических и физико-химических показателей качества МИБП: организация, порядок проведения и представление результатов". | ||||||||
|
Область применения метода | ||||||||
|
В результате валидации установлены следующие показатели точности метода: | ||||||||
|
Диапазон определяемых величин | ||||||||
|
Повторяемость | ||||||||
|
Воспроизводимость | ||||||||
|
Правильность (для нового метода) | ||||||||
|
Руководитель по качеству ГИСК им. Л.А.Тарасевича | ||||||||
|
(фамилия, имя, отчество) | ||||||||
|
Главный метролог ГИСК им. Л.А.Тарасевича | ||||||||
|
(фамилия, имя, отчество) | ||||||||
|
Руководитель проведения валидации | ||||||||
|
(фамилия, имя, отчество) | ||||||||
Приложение 8
Пример схемы оценки повторяемости
Для упрощения расчетов целесообразно использовать план эксперимента, изложенный далее. В одной аналитической серии проводят определение показателя, например в 9 образцах: по 3 образца для каждого диапазона концентраций (3 образца с несколько отличающейся концентрацией в диапазоне нижний предел плюс 20%, 3 образца с несколько отличающейся концентрацией в диапазоне средняя концентрация +/-10% и 3 образца с несколько отличающейся концентрацией в диапазоне верхний предел минус 20%). Такую аналитическую серию следует повторить несколько раз (например, 3 раза) - назовем такое повторение аналитической серии микросерией определений (или блок определений). Если микросерия состоит из 3 аналитических серий, то для обеспечения 30 степеней свободы необходимо провести 5 таких микросерий. В каждой микросерии должны строго выдерживаться условия повторяемости, в различных микросериях допускается менять исполнителей, комплекты или экземпляры оборудования, серии стандартных образцов, что должно быть отражено в протоколе валидации.
Таким образом, в нашем примере отбирают 9 образцов (серий) МИБП одного наименования (9 первоначальных проб - по 3 первоначальные пробы в каждом диапазоне концентрации), делят каждую пробу на 20 частей {15 (количество определений)+5 (резерв)}. Руководитель этапа валидации кодирует пробы, устанавливает очередность их определения в каждой серии определений (например, методом случайных чисел) и шифрует пробы четырехзначным номером. Шифр включает номер микросерии, номер аналитической серии в микросерии и очередность пробы в аналитической серии, например, шифр 3109 означает, что проба используется в третьей микросерии, в первой аналитической серии этой микросерии девятой по порядку. Исполнитель получает пробы с номером, последние две цифры которого означают очередность их анализа. Исполнители после проведения определений возвращают протоколы валидации руководителю этапа валидации, который расшифровывает пробы, организует статистическую обработку результатов для установления показателей повторяемости - ![]() и
и ![]() . При условии нормального распределения полученных результатов стандартное отклонение повторяемости
. При условии нормального распределения полученных результатов стандартное отклонение повторяемости ![]() рассчитывают для каждого диапазона концентраций по формуле:
рассчитывают для каждого диапазона концентраций по формуле:
![]() ,
,
где ![]() - средневзвешенная дисперсия для диапазона концентраций по всем микросериям.
- средневзвешенная дисперсия для диапазона концентраций по всем микросериям.
(Такой алгоритм расчета может быть использован только в случае одинакового числа степеней свободы для каждой концентрации).
Для расчета ![]() проводят следующие вычисления:
проводят следующие вычисления:
- рассчитывают среднее арифметическое значение показателя ![]() по формуле:
по формуле:
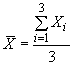 ,
,
где ![]() - значение показателя в аналитических сериях в данной микросерии для каждой концентрации;
- значение показателя в аналитических сериях в данной микросерии для каждой концентрации;
расчитывают для каждой концентрации в микросерии дисперсию ![]() по формуле:
по формуле:
![]() ,
,
где ![]() - значение показателя в аналитических сериях в данной микросерии для каждой концентрации;
- значение показателя в аналитических сериях в данной микросерии для каждой концентрации;
![]() - среднее арифметическое значение показателя в аналитических сериях:
- среднее арифметическое значение показателя в аналитических сериях:
- рассчитывают сумму дисперсий для каждого диапазона концентраций в микросерии;
- рассчитывают сумму полученных сумм для каждого диапазона концентраций по всем микросериям.
В нашем примере рассчитывают среднее арифметическое из 3 определений в микросерии для каждой из 3 концентраций в диапазоне концентраций (три средних арифметических), соответствующую дисперсию (три дисперсии) и сумму полученных дисперсий для диапазона концентрации в каждой микросерии (5 сумм), затем рассчитывают сумму полученных сумм дисперсий (сумм 5 сумм дисперсий).
Рассчитывают средневзвешенную дисперсию ![]() для каждого диапазона концентраций по формуле:
для каждого диапазона концентраций по формуле:
![]() ,
,
где ![]() - сумма дисперсий для каждого диапазона концентраций в микросерии определений;
- сумма дисперсий для каждого диапазона концентраций в микросерии определений;
![]() - сумма сумм дисперсий по всем микросериям для каждого диапазона концентраций;
- сумма сумм дисперсий по всем микросериям для каждого диапазона концентраций;
![]() - количество аналитических серий в микросерии;
- количество аналитических серий в микросерии;
![]() - количество микросерий.
- количество микросерий.
Зная ![]() можно рассчитать доверительный интервал разности двух результатов определения в условиях повторяемости
можно рассчитать доверительный интервал разности двух результатов определения в условиях повторяемости ![]() для каждого диапазона концентраций по формуле:
для каждого диапазона концентраций по формуле:
![]() ,
,
где ![]() - стандартное отклонение повторяемости;
- стандартное отклонение повторяемости;
![]() - коэффициент Стьюдента, получают из таблицы критерия Стьюдента (прилож.10);
- коэффициент Стьюдента, получают из таблицы критерия Стьюдента (прилож.10);
![]() - доверительный уровень (обычно 95%);
- доверительный уровень (обычно 95%);
![]() - число степеней свободы, рассчитывают по формуле:
- число степеней свободы, рассчитывают по формуле:
![]() ,
,
где ![]() - число первоначальных проб в диапазоне концентраций;
- число первоначальных проб в диапазоне концентраций;
![]() - число аналитических серий в микросерии;
- число аналитических серий в микросерии;
![]() - число микросерий.
- число микросерий.
Все результаты вносят в сводный протокол:
|
N микросерии |
N образца |
|
|
|
| ||
|
1 |
2 |
3 |
|||||
|
1 |
1-(н1) |
|
|
|
|
|
|
|
2-(н2) |
|
|
|
|
|
||
|
3-(н3) |
|
|
|
|
|
||
|
4-(с1) |
|
|
|
|
|
| |
|
5-(с2) |
|
|
|
|
|
||
|
6-(с3) |
|
|
|
|
|
||
|
7-(в1) |
|
|
|
|
|
| |
|
8-(в2) |
|
|
|
|
|
||
|
9-(в3) |
|
|
|
|
|
||
|
┘ |
|
|
|
|
|
|
|
|
5 |
46-(н1) |
|
|
|
|
|
|
|
47-(н2) |
|
|
|
|
|
||
|
48-(н3) |
|
|
|
|
|
||
|
49-(с1) |
|
|
|
|
|
| |
|
50-(с2) |
|
|
|
|
|
||
|
51-(с3) |
|
|
|
|
|
||
|
52-(в1) |
|
|
|
|
|
| |
|
53-(в2) |
|
|
|
|
|
||
|
54-(в3) |
|
|
|
|
|
||
Составляют таблицу для каждого диапазона концентраций:
Для низких концентраций
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для средних концентраций
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для высоких концентраций
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приложение 9
Пример протокола 1 этапа валидации
(сбор первичных материалов при определении повторямости)
Определение повторяемости
Микросерия N 1
|
1. Наименование организации | |||||||||||||||||||||||||
|
2. Наименование лаборатории | |||||||||||||||||||||||||
|
3. Зав. лаборатории | |||||||||||||||||||||||||
|
4. Исполнитель | |||||||||||||||||||||||||
|
5. Наименование метода N СОП "Определение белкового азота с реактивом Несслера". СОП N | |||||||||||||||||||||||||
|
6. Условия проведения испытаний: | |||||||||||||||||||||||||
|
6.1. Оборудование | |||||||||||||||||||||||||
|
- центрифуга (охлаждаемая) марка, страна, год выпуска | |||||||||||||||||||||||||
|
- температура при центрифугировании | |||||||||||||||||||||||||
|
- число оборотов |
максимально возможное | ||||||||||||||||||||||||
|
- радиус ротора, см | |||||||||||||||||||||||||
|
- холодильник марка, страна | |||||||||||||||||||||||||
|
- температура при хранении | |||||||||||||||||||||||||
|
- температура при анализе | |||||||||||||||||||||||||
|
- вибрационная мешалка марка, страна, автоматическая или операция выполняется вручную | |||||||||||||||||||||||||
|
- мерная посуда объем, ГОСТ | |||||||||||||||||||||||||
|
- пипетки автоматическая, фирма, объем | |||||||||||||||||||||||||
|
или стеклянная по ГОСТ | |||||||||||||||||||||||||
|
Для мерной посуды и пипеток - дата последней проверки емкости. | |||||||||||||||||||||||||
|
- песочная баня марка, страна, с каким обогревом - газовым или электрическим | |||||||||||||||||||||||||
|
- фотоколориметр тип, заводской N, год выпуска, дата последней проверки | |||||||||||||||||||||||||
|
6.2. Реактивы для построения калибровочного графика N НД, квалификация, N серии (партии), дата выпуска, срок годности | |||||||||||||||||||||||||
|
- аммония сульфат | |||||||||||||||||||||||||
|
- аммония хлорид (фиксанал) | |||||||||||||||||||||||||
|
Реактив, который не используется, вычеркнуть | |||||||||||||||||||||||||
|
Дата приготовления основного раствора | |||||||||||||||||||||||||
|
Дата приготовления рабочего раствора | |||||||||||||||||||||||||
|
6.3. Реактивы | |||||||||||||||||||||||||
|
- реактив Несслера | |||||||||||||||||||||||||
|
- ТУ N |
|||||||||||||||||||||||||
|
- N серии |
|||||||||||||||||||||||||
|
- дата выпуска | |||||||||||||||||||||||||
|
или приготовленный | |||||||||||||||||||||||||
|
Реактив, который не используется, вычеркнуть. | |||||||||||||||||||||||||
|
- кислота трихлоруксусная (N НД, квалификация, N серии, дата выпуска, срок годности) | |||||||||||||||||||||||||
|
Дата приготовления и проверки титра 80%-ного раствора ТХУ | |||||||||||||||||||||||||
|
Дата приготовления 20%-ного раствора ТХУ | |||||||||||||||||||||||||
|
- кислота серная, концентрированная (N НД, квалификация, N серии, дата выпуска, срок годности) | |||||||||||||||||||||||||
|
- натрия гидроксид (N НД, квалификация, N серии, дата выпуска, срок годности) | |||||||||||||||||||||||||
|
- пергидроль (N НД, квалификация, N серии, дата выпуска, срок годности) | |||||||||||||||||||||||||
Микросерия N 1 серия определений (аналитическая серия) N 1
Таблица 1.1.1
Калибровочный график
|
Содержание азота в аликвоте раствора, мкг |
5 |
10 |
15 |
20 |
25 |
|
Взятая аликвота, мл |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
|
Результат измерения оптической плотности |
|
|
|
|
|
Таблица 1.1.2.
Результаты определения
|
NN |
Код пробы |
Дата начала определения |
Дата окончания определения |
Объем минерали- |
Результат измерения оптической плотности |
Формула расчета результата определения |
Результат определения белкового азота, мг/мл |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
Микросерия N 1 Серия определений (аналитическая серия) N 2
Таблица 1.2.3
Калибровочный график
|
Содержание азота в аликвоте раствора, мкг |
5 |
10 |
15 |
20 |
25 |
|
Взятая аликвота, мл |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
|
Результат измерения оптической плотности |
|
|
|
|
|
Таблица 1.2.4
Результаты определения
|
NN |
Код пробы |
Дата начала определения |
Дата окончания определения |
Объем минерали- |
Результат измерения оптической плотности |
Формула расчета результата определения |
Результат определения белкового азота, мг/мл |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
Микросерия N 1 Серия определений (аналитическая серия) N 3
Таблица 1.3.5
Калибровочный график
|
Содержание азота в аликвоте раствора, мкг |
5 |
10 |
15 |
20 |
25 |
|
Взятая аликвота, мл |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
|
Результат измерения оптической плотности |
|
|
|
|
|
Таблица 1.3.6
Результаты определения
|
NN |
Код пробы |
Дата начала определения |
Дата окончания определения |
Объем минерали- |
Результат измерения оптической плотности |
Формула расчета результата определения |
Результат определения белкового азота, мг/мл |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
7. Замечания о ходе выполнения программы.
Руководитель лаборатории:
Ответственный исполнитель:
Исполнитель:
Аналогично составляется протокол сбора первичных данных для других микросерий.
Приложение 10
Значения ![]() -критерия Стьюдента
-критерия Стьюдента
(при доверительной вероятности 0,95)
|
Число степеней свободы |
|
|
1 |
12,71 |
|
2 |
4,30 |
|
3 |
3,18 |
|
4 |
2,78 |
|
5 |
2,57 |
|
6 |
2,45 |
|
7 |
2,36 |
|
8 |
2,31 |
|
9 |
2,26 |
|
10 |
2,23 |
|
11 |
2,20 |
|
12 |
2,18 |
|
13 |
2,16 |
|
14 |
2,14 |
|
15 |
2,13 |
|
16 |
2,12 |
|
17 |
2,11 |
|
18 |
2,10 |
|
19 |
2,09 |
|
20 |
2,09 |
|
21 |
2,08 |
|
22 |
2,07 |
|
23 |
2,07 |
|
24 |
2,06 |
|
25 |
2,06 |
|
26 |
2,06 |
|
27 |
2,05 |
|
28 |
2,05 |
|
29 |
2,05 |
|
30 |
2,04 |
|
40 |
2,02 |
|
50 |
2,01 |
|
60 |
2,00 |
|
70 |
1,99 |
|
80 |
1,99 |
|
90 |
1,99 |
|
100 |
1,98 |
|
110 |
1,98 |
|
120 |
1,98 |
|
130 |
1,97 |
|
|
1,96 |

 Светлана Бессараб: все социальные обязательства государства будут выполнены
Светлана Бессараб: все социальные обязательства государства будут выполнены  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов