МУК 4.2.1903-04
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Продукты пищевые. Метод идентификации генетически модифицированных
источников (ГМИ) растительного происхождения
с применением биологического микрочипа
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: Институтом физиологии растений им. К.А.Тимирязева РАН и Институтом молекулярной биологии им. В.А.Энгельгардта РАН.
2. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 06.03.04.
3. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
Настоящие методические указания распространяются на пищевое сырье (в т.ч. посевной и посадочный материал), пищевые продукты, цветы (далее - продукт) и устанавливает метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с использованием биологического микрочипа.
Метод основан на асимметричной мультиплексной полимеразной цепной реакции (далее - амПЦР) с последующей гибридизацией продуктов этой амПЦР на биологическом микрочипе. Метод одновременно устанавливает наличие или отсутствие в анализируемой пробе не менее пяти различных трансгенных последовательностей ДНК. Чувствительность метода - не менее 10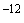 г (1 пг) ДНК.
г (1 пг) ДНК.
Методические указания предназначены для применения в лабораториях учреждений санитарно-эпидемиологической службы Российской Федерации, осуществляющей контроль за качеством продовольственного сырья и пищевых продуктов, в т.ч. импортируемых в Российскую Федерацию, гигиеническую оценку и выдачу санитарно-эпидемиологических заключений в лабораториях других организаций, аккредитованных в установленном порядке на право проведения контроля безопасности пищевой продукции и продовольственного сырья.
2. Нормативные ссылки
В настоящих методических указаниях использованы ссылки на следующие стандарты.
ГОСТ 12.1.004-91. Система стандартов безопасности труда. Пожарная безопасность. Общие требования.
ГОСТ 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности.
ГОСТ 12.1.019-79. Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты.
ГОСТ 12.4.009-83. Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание.
ГОСТ 12.4.021-75. Система стандартов безопасности труда. Системы вентиляционные. Общие требования.
ГОСТ 1770-74. Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия.
ГОСТ 3118-77. Кислота соляная. Технические условия.
ГОСТ 3164-78. Масло вазелиновое медицинское. Технические условия.
ГОСТ 4233-77. Натрий хлористый. Технические условия.
ГОСТ 4328-77. Натрия гидроокись. Технические условия.
ГОСТ 6709-72. Вода дистиллированная. Технические условия.
ГОСТ 9284-75. Стекла предметные для микропрепаратов. Технические условия.
ГОСТ 9805-84. Спирт изопропиловый. Технические условия.
ГОСТ 12026-76. Бумага фильтровальная лабораторная. Технические условия.
ГОСТ 12738-77. Колбы стеклянные с градуированной горловиной. Технические условия.
ГОСТ 13646-68. Термометры стеклянные ртутные для точных измерений. Технические условия.
ГОСТ 21400-75. Стекло химико-лабораторное. Технические требования. Методы испытаний.
ГОСТ 24104-01. Весы лабораторные. Общие технические требования.
ГОСТ 25336-82. Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры.
ГОСТ 26678-85. Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия.
ГОСТ 29227-91 (ИСО 835-1-81). Посуда лабораторная стеклянная. Пипетки градуированные. Ч.1. Общие требования.
ГОСТ Р 51652-00. Спирт этиловый ректификованный из пищевого сырья. Технические условия.
3. Определения
В настоящих методических указаниях применяют следующие термины с соответствующими определениями.
3.1. Биологическая безопасность - в соответствии с прилож.А.
3.2. Генетически модифицированные источники - сырье и пищевые продукты (компоненты), используемые человеком в натуральном или переработанном виде, полученные из генетически модифицированных организмов или содержащие их в своем составе.
3.3. Генетически модифицированный организм - организм, генетический материал которого изменен с применением методов генной инженерии.
3.4. Генная инженерия - совокупность приемов, методов и технологий, в т.ч. технологий получения рекомбинантных нуклеиновых кислот, по выделению генов из организма, осуществлению манипуляций с генами и введению их в другие организмы.
3.5. Биологический микрочип - микроматрица с ячейками, в которых иммобилизован набор олигонуклеотидов.
3.6. Праймер - последовательность однотяжевой ДНК длиной до 25 нуклеотидов, применяемая для проведения асимметричной мультиплексной полимеразной цепной реакции.
3.7. Асимметричная мультиплексная полимеразная цепная реакция - полимеразная цепная реакция, где в одной пробирке с участием нескольких пар праймеров одновременно амплифицируются разные последовательности анализируемой ДНК, причем количество одного из праймеров каждой пары в несколько раз превышает количество другого праймера.
4. Аппаратура, материалы и реактивы
4.1. Компьютерная программа "Imageware" для анализа изображений, полученных с помощью "Чипдетектора-03" [1].
4.2. Комплекс аппаратно-программный для анализа флуоресценции биологических микрочипов типа "Чипдетектор-03" [2].
4.3. Амплификатор ДНК типа "Терцик" под микроцентрифужные пробирки вместимостью 0,2, 0,5 см со скоростью нагрева/охлаждения активного элемента не менее 1,5 °С/с [3].
со скоростью нагрева/охлаждения активного элемента не менее 1,5 °С/с [3].
4.4. Термостат суховоздушный типа ТВЗ-25 с рабочей температурой 37 °С, рабочий диапазон от 20 до 60 °С, точность поддержания температуры ±1 °С [4].
4.5. Весы лабораторные общего назначения по ГОСТ 24104 высокого класса точности (условное обозначение II) с пределом допустимой абсолютной погрешности однократного взвешивания не более ±0,0001 г.
4.6. Камера морозильная по ГОСТ 26678, обеспечивающая температуру минус 20 °С.
4.7. Холодильник бытовой электрический по ГОСТ 26678.
4.8. Микроцентрифуга настольная типа 5415С с частотой вращения не менее 13000 мин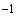 [5].
[5].
4.9. Мешалка магнитная с подогревом [6].
4.10. Аппарат для встряхивания типа CV-1500 с частотой вращения не менее 1500 мин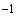 [7].
[7].
4.11. рН-метр с набором электродов, с погрешностью измерений ±0,1 рН.
4.12. Микродозаторы с переменным объемом дозирования: 0,5-10,0 мм (шаг - 0,1 мм
(шаг - 0,1 мм , точность ±2,5-10,0%, воспроизводимость 3-7%); 5,0-50,0 мм
, точность ±2,5-10,0%, воспроизводимость 3-7%); 5,0-50,0 мм (шаг - 0,5 мм
(шаг - 0,5 мм , точность ±2,0-5,0%, воспроизводимость 2,5-5%); 20,0-200,0 мм
, точность ±2,0-5,0%, воспроизводимость 2,5-5%); 20,0-200,0 мм (шаг - 1,0 мм
(шаг - 1,0 мм , точность ±1,5-2,0%, воспроизводимость 2-3%); 100-1000 мм
, точность ±1,5-2,0%, воспроизводимость 2-3%); 100-1000 мм (шаг - 5 мм
(шаг - 5 мм , точность ±1,0-1,5%, воспроизводимость 1-2%).
, точность ±1,0-1,5%, воспроизводимость 1-2%).
4.13. Штативы под микроцентрифужные пробирки типа RP-30 и RP-80 на 30 и 80 шт. [8].
4.14. Наконечники с фильтром для микродозаторов (микропипеток) с переменным объемом дозирования жидкостей до 10; 20; 200; 1000 мм [9].
[9].
4.15. Пробирки микроцентрифужные типа Эппендорф вместимостью 0,2; 0,5 и 1,5 см стерильные.
стерильные.
4.16. Пестик или палочка стеклянные по ГОСТ 21400 для микроцентрифужных пробирок вместимостью 1,5 см .
.
4.17. Цилиндры стеклянные мерные лабораторные по ГОСТ 1770 на 25, 100, 250 и 1000 см .
.
4.18. Колбы стеклянные мерные плоскодонные конические по ГОСТ 25336 вместимостью 50-1000 см .
.
4.19. Пипетки стеклянные градуированные по ГОСТ 29227.
4.20. Бумага фильтровальная лабораторная по ГОСТ 12026.
4.21. Натрия гидроокись по ГОСТ 4328.
4.22. Кислота соляная концентрированная по ГОСТ 3118, хч.
4.23. Натрий хлористый по ГОСТ 4233, хч.
4.24. Этилендиаминтетрауксусной кислоты динатриевая соль дигидрат (ЭДТА) [10].
4.25. Трис(оксиметил)аминометан [11].
4.26. Спирт этиловый ректификованный по ГОСТ Р 51652, хч.
4.27. Спирт изопропиловый по ГОСТ 9805, хч.
4.28. Додецилсульфат натрия (SDS) [12].
4.29. Вода дистиллированная по ГОСТ 6709.
4.30. Вода особо чистая стерильная, не содержащая ДНК, РНК и дезоксирибонуклеаз.
4.31. Фермент термостабильный Taq-полимераза, оптимум активности при 70-72 °С [13].
4.32. ПЦР буфер десятикратный (10х; 12,1 г в 1 дм Трис-HCl, рН 8,8; 37,28 г в 1 дм
Трис-HCl, рН 8,8; 37,28 г в 1 дм КСl, 5% Твин-20, 50% формамид; 142,83 мг в 1 дм
КСl, 5% Твин-20, 50% формамид; 142,83 мг в 1 дм MgCl
MgCl ).
).
4.33. Гуанидин тиоцианат [14].
4.34. N-[2-оксиэтил]пиперазин-N'-[2-этансульфоновая кислота] (HEPES) [15].
4.35. Масло вазелиновое медицинское по ГОСТ 3164.
4.36. Раствор водный дезоксирибонуклеозидтрифосфатов: дАТФ, дГТФ, дТТФ, дЦТФ с концентрацией 2 мМ каждого [16].
4.37. Раствор заведомо трансгенной ДНК (около 100 нг/мм или 10
или 10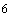 копий/мм
копий/мм ) [17].
) [17].
4.38. Раствор заведомо нетрансгенной ДНК (около 100 нг/мм или 10
или 10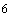 копий/мм
копий/мм ) [18].
) [18].
4.39. Баня водяная [19].
4.40. Раствор водный праймеров "ПР-1" для амплификации соответствующих участков генома, включающий следующие пары праймеров.
Праймеры на промотор 35S вируса мозаики цветной капусты:
35S_п 5' ССТ ССТ CGG АТТ ССА TTG CCC AG (23 н.о.);
35S_оф 5' GTC CAT CTT TGG GAC CAC TGT CGG (24 н.о.).
Праймеры на маркерный ген gus из бактерии Escherichia coli:
gus_п 5' AAG CCG GGC AAT TGC TGT GCC A (22 н.о);
gus_oф 5' GAC CGC АТС GAA ACG CAG CAC G (22 н.о.).
Праймеры на промотор nos из агробактерии Agrobacterium tumefaciens:
nos_п 5' CGA TGA CGC GGG АСА AGC CGT (21 н.о.);
nos _оф 5' GAC CTT AGG CGA CTT TTG AAC GCG С (25 н.о.).
Праймеры на маркерный ген npt II из транспазона Tn5 бактериального происхождения:
npt_п 5' GTG TTC CGG CTG TCA GCG CAG G (22 н.о.);
nрt_оф 5' CGC AAG GAA CGC CCG TCG TGG (21 н.о.).
Праймеры на терминатор ocs из агробактерии Agrobacterium tumefaciens:
ocs_п 5' GCG AGA CGC СТА TGA TCG CAT GAT (24 н.о.);
ocs_оф 5' GAA ACC GGC GGT AAG GAT CTG AGC (24 н.о.).
Примечание. В обозначениях праймеров индекс "_п" означает "прямой", индекс "_оф" означает "обратный флуоресцентно-меченый"; н.о - нуклеотидные остатки [20].
4.41. Биологический микрочип с иммобилизованными олигонуклеотидами, приведенными в табл.1 [21].
Таблица 1
Олигонуклеотиды, иммобилизованные на биологическом микрочипе
|
Наименование олигонуклеотида |
Детектируемая мишень |
Последовательность олигонуклеотида |
|
35S_и |
промотор 35S |
5' GCC АТС АТТ GCG АТА AAG G |
|
gus_и |
ген gus |
5' CTG GTA TCA GCG CGA A |
|
nos_и |
промотор nos |
5' GCT AAG CAC АТА CGT CAG AA |
|
npt_и |
ген nptII |
5' GGC AGC GCG GCT АТС |
|
ocs_и |
терминатор ocs |
5' TTC TGT TGT GCA CGT TGT A |
|
Примечание. Индекс "_и" означает "иммобилизованный". | ||
Биологический микрочип представляет собой стандартное предметное стекло по ГОСТ 9284 для световой микроскопии, на поверхности которого в определенном порядке расположены 10 микроскопических ячеек (рис.1), заполненных полиакриламидным гелем. Каждая из пяти верхних ячеек содержит индивидуальный ковалентно иммобилизованный олигонуклеотид (35S, gus nos, npt или ocs). Три ячейки с индексом "НК" не содержат ранее перечисленных индивидуальных ковалентно иммобилизованных олигонуклеотидов и выполняют роль отрицательного контроля гибридизации. Две ячейки с индексом "М" содержат ковалентно связанный флуоресцентный краситель и предназначены для однозначной ориентации биологического микрочипа. Поверхность биологического микрочипа с ячейками должна быть закрыта пластиковой крышкой с отверстиями, которая вместе с предметным стеклом образует замкнутое пространство, предназначенное для проведения гибридизации анализируемой пробы.
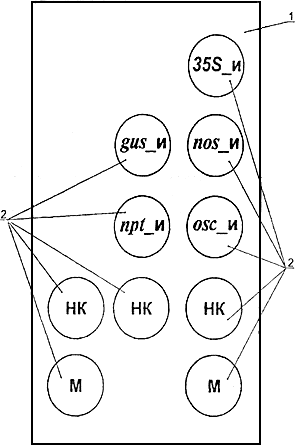
Рис.1. Схема биологического микрочипа для идентификации генетически
модифицированных источников растительного происхождения
1 - предметное стекло; 2 - гелевые ячейки
Допускается применение других средств измерений с метрологическими характеристиками, а также оборудования и реактивов с техническими характеристиками не хуже указанных выше.
5. Отбор проб
Отбор проб проводят по межгосударственным и национальным стандартам, устанавливающим порядок отбора проб для однородных групп растительного сырья (в т.ч. посевного материала, цветов) и пищевых продуктов.
6. Подготовка к проведению анализа
6.1. Приготовление растворов
6.1.1. Приготовление раствора NaOH концентрации 40 г/дм .
.
В стеклянную плоскодонную колбу по ГОСТ 1770 вместимостью 100 см помещают 4,0 г сухой гидроокиси натрия по ГОСТ 4328 и растворяют в 100 см
помещают 4,0 г сухой гидроокиси натрия по ГОСТ 4328 и растворяют в 100 см особо чистой стерильной воды по п.4.30. После охлаждения раствора до комнатной температуры его переливают в специальную щелочеустойчивую пластиковую плотно закрывающуюся емкость. Срок хранения при комнатной температуре - не более одного года.
особо чистой стерильной воды по п.4.30. После охлаждения раствора до комнатной температуры его переливают в специальную щелочеустойчивую пластиковую плотно закрывающуюся емкость. Срок хранения при комнатной температуре - не более одного года.
6.1.2. Приготовление раствора ЭДТА концентрации 186,12 г/дм .
.
В стеклянную плоскодонную колбу вместимостью 100 см помещают 18,61 г ЭДТА по п.4.24, растворяют в 80 см
помещают 18,61 г ЭДТА по п.4.24, растворяют в 80 см особо чистой стерильной воды при интенсивном перемешивании на магнитной мешалке [6]. Затем раствором гидроокиси натрия по п.6.1.1 доводят рН раствора до 8,0. Полученный раствор переливают в мерную колбу по ГОСТ 12738 вместимостью 100 см
особо чистой стерильной воды при интенсивном перемешивании на магнитной мешалке [6]. Затем раствором гидроокиси натрия по п.6.1.1 доводят рН раствора до 8,0. Полученный раствор переливают в мерную колбу по ГОСТ 12738 вместимостью 100 см и особо чистой стерильной водой доводят объем этого раствора до метки. Срок хранения в холодильнике по ГОСТ 26678 при температуре 4-5 °С - не более 6 мес.
и особо чистой стерильной водой доводят объем этого раствора до метки. Срок хранения в холодильнике по ГОСТ 26678 при температуре 4-5 °С - не более 6 мес.
6.1.3. Приготовление 70%-ного раствора этилового спирта.
В мерную колбу вместимостью 200 см по ГОСТ 12738 вносят 140 см
по ГОСТ 12738 вносят 140 см 96%-ного этилового спирта высокой степени очистки по ГОСТ Р 51652, добавляют 52 см
96%-ного этилового спирта высокой степени очистки по ГОСТ Р 51652, добавляют 52 см особо чистой стерильной воды и перемешивают. Срок хранения при температуре 4-5 °С - не более 6 мес.
особо чистой стерильной воды и перемешивают. Срок хранения при температуре 4-5 °С - не более 6 мес.
6.1.4. Приготовление гибридизационного буфера.
В стеклянный стакан или плоскодонную колбу вместимостью 300-500 см помещают точно отмеренные количества: 44,33 (±0,01) г гуанидин тиоцианата - по п.4.33 [14], 4,88 (±0,01) г N-[2-гидроксиэтил]пиперазин N'-[2-этансульфоновой кислоты] натриевой соли (HEPES) по п.4.34 [15]. Затем стеклянной пипеткой по ГОСТ 29227 вместимостью 5 см
помещают точно отмеренные количества: 44,33 (±0,01) г гуанидин тиоцианата - по п.4.33 [14], 4,88 (±0,01) г N-[2-гидроксиэтил]пиперазин N'-[2-этансульфоновой кислоты] натриевой соли (HEPES) по п.4.34 [15]. Затем стеклянной пипеткой по ГОСТ 29227 вместимостью 5 см приливают 3,75 (±0,05) см
приливают 3,75 (±0,05) см раствора ЭДТА, приготовленного по п.6.1.2, и цилиндром вместимостью 250 см
раствора ЭДТА, приготовленного по п.6.1.2, и цилиндром вместимостью 250 см добавляют 200 см
добавляют 200 см особо чистой стерильной воды. Стакан с раствором помещают на магнитную мешалку по п.4.9 [6] и перемешивают до полного растворения компонентов. Доводят значение рН буфера до 7,5 (±0,1) добавлением раствора гидроокиси натрия, приготовленного по п.6.1.1. Полученный раствор из стакана переносят в мерную колбу вместимостью 250 см
особо чистой стерильной воды. Стакан с раствором помещают на магнитную мешалку по п.4.9 [6] и перемешивают до полного растворения компонентов. Доводят значение рН буфера до 7,5 (±0,1) добавлением раствора гидроокиси натрия, приготовленного по п.6.1.1. Полученный раствор из стакана переносят в мерную колбу вместимостью 250 см , доводят объем до метки особо чистой стерильной водой и разливают по 50 см
, доводят объем до метки особо чистой стерильной водой и разливают по 50 см в плоскодонные колбы с притертыми пробками. Срок хранения при температуре 2-8 °С - не более 12 мес.
в плоскодонные колбы с притертыми пробками. Срок хранения при температуре 2-8 °С - не более 12 мес.
6.1.5. Приготовление раствора Трис-HCl концентрации 242,2 г/дм .
.
В колбу вместимостью 100 см помещают 24,22 г Трис (оксиметил) аминометана по п.4.25 [11] и растворяют приблизительно в 80 см
помещают 24,22 г Трис (оксиметил) аминометана по п.4.25 [11] и растворяют приблизительно в 80 см особо чистой стерильной воды. Концентрированной соляной кислотой по ГОСТ 3118 доводят рН раствора до 7,5, а объем - до 100 см
особо чистой стерильной воды. Концентрированной соляной кислотой по ГОСТ 3118 доводят рН раствора до 7,5, а объем - до 100 см особо чистой стерильной водой. Срок хранения при комнатной температуре - не более 6 мес.
особо чистой стерильной водой. Срок хранения при комнатной температуре - не более 6 мес.
6.1.6. Приготовление раствора NaCI концентрации 146,2 г/дм .
.
В плоскодонную колбу вместимостью 100 см помещают 14,62 г хлористого натрия по ГОСТ 4233, растворяют в 70-80 см
помещают 14,62 г хлористого натрия по ГОСТ 4233, растворяют в 70-80 см особо чистой стерильной воды, затем полученный раствор переносят в мерную колбу вместимостью 100 см
особо чистой стерильной воды, затем полученный раствор переносят в мерную колбу вместимостью 100 см и особо чистой стерильной водой доводят до метки. Срок хранения при комнатной температуре - не более одного года.
и особо чистой стерильной водой доводят до метки. Срок хранения при комнатной температуре - не более одного года.
6.1.7. Приготовление раствора 20%-ного додецилсульфата натрия (SDS) [12].
В стеклянную колбу вместимостью 100 см помещают 20 г сухого додецилсульфата натрия по п.4.28 и добавляют 80 см
помещают 20 г сухого додецилсульфата натрия по п.4.28 и добавляют 80 см особо чистой стерильной воды. Растворяют при плавном перемешивании на магнитной мешалке и одновременном нагревании до температуры 40-50 °С до полного растворения. Срок хранения при комнатной температуре - не более одного года.
особо чистой стерильной воды. Растворяют при плавном перемешивании на магнитной мешалке и одновременном нагревании до температуры 40-50 °С до полного растворения. Срок хранения при комнатной температуре - не более одного года.
6.1.8. Приготовление буфера экстракции.
В мерной колбе вместимостью 50 см смешивают 5 см
смешивают 5 см раствора Трис-HCl, приготовленного по п.6.1.5, 5 см
раствора Трис-HCl, приготовленного по п.6.1.5, 5 см раствора NaCI, приготовленного по п.6.1.6, 1,25 см
раствора NaCI, приготовленного по п.6.1.6, 1,25 см раствора 20%-ного SDS, приготовленного по п.6.1.7, и 2,5 см
раствора 20%-ного SDS, приготовленного по п.6.1.7, и 2,5 см раствора ЭДТА, приготовленного по п.6.1.2; каждый раствор отбирают отдельной стеклянной пипеткой. Объем раствора доводят до 50 см
раствора ЭДТА, приготовленного по п.6.1.2; каждый раствор отбирают отдельной стеклянной пипеткой. Объем раствора доводят до 50 см особо чистой стерильной водой. Срок хранения при температуре 4-5 °С - не более двух недель, в морозильной камере по ГОСТ 26678 при температуре минус 20 °С - не более одного года.
особо чистой стерильной водой. Срок хранения при температуре 4-5 °С - не более двух недель, в морозильной камере по ГОСТ 26678 при температуре минус 20 °С - не более одного года.
6.1.9. Раствор Taq-полимеразы по п.4.31 хранят при температуре минус 20 °С не более одного года. Не допускается хранение раствора Taq-полимеразы ниже температуры минус 23 °С.
6.2. Приготовление пробы для анализа (выделение ДНК)
6.2.1. Две навески каждого анализируемого продукта массой 60-80 мг помещают в две чистые стерильные микроцентрифужные пробирки по п.4.15 вместимостью 1,5 см , в течение 15-20 с доводят до состояния однородной смеси пестиком по ГОСТ 21400 при комнатной температуре и сразу микродозатором добавляют по 400 мм
, в течение 15-20 с доводят до состояния однородной смеси пестиком по ГОСТ 21400 при комнатной температуре и сразу микродозатором добавляют по 400 мм буфера экстракции, приготовленного по п.6.1.8.
буфера экстракции, приготовленного по п.6.1.8.
6.2.2. Микроцентрифужные пробирки со смесью, приготовленной по п.6.2.1, интенсивно встряхивают в течение 5 с на аппарате для встряхивания по п.4.10 [7], быстро нагревают на водяной бане [19] до температуры 65 °С и выдерживают при этой температуре 15-20 мин, периодически осторожно перемешивая содержимое.
6.2.3. Микроцентрифужные пробирки со смесью, приготовленной по п.6.2.2, центрифугируют при комнатной температуре в настольной центрифуге по п.4.8 [5] при частоте вращения 13000 мин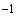 в течение 5 мин.
в течение 5 мин.
6.2.4. Надосадочную жидкость, полученную по п.6.2.3, отбирают по 300 мм и переносят в чистые микроцентрифужные пробирки, содержащие по 300 мм
и переносят в чистые микроцентрифужные пробирки, содержащие по 300 мм изопропилового спирта по ГОСТ 9805. Содержимое перемешивают, выдерживают 5 мин при комнатной температуре и центрифугируют 5 мин при частоте вращения 13000 мин
изопропилового спирта по ГОСТ 9805. Содержимое перемешивают, выдерживают 5 мин при комнатной температуре и центрифугируют 5 мин при частоте вращения 13000 мин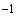 .
.
6.2.5. Надосадочную жидкость по п.6.2.4 тщательно удаляют микродозатором, а осадок ДНК, полученный по п.6.2.4, промывают 1 см 70%-ного этилового спирта, приготовленного по п.6.1.3 и охлажденного до температуры 0-4 °С, центрифугируют аналогично п.6.2.4. Полученную надосадочную жидкость вновь тщательно удаляют, а осадок ДНК подсушивают при комнатной температуре до полного удаления этилового спирта, но не более 30 мин.
70%-ного этилового спирта, приготовленного по п.6.1.3 и охлажденного до температуры 0-4 °С, центрифугируют аналогично п.6.2.4. Полученную надосадочную жидкость вновь тщательно удаляют, а осадок ДНК подсушивают при комнатной температуре до полного удаления этилового спирта, но не более 30 мин.
6.2.6. Осадок ДНК, полученный по п.6.2.5, перерастворяют в 40-50 мм особо чистой стерильной воды. Полученный раствор ДНК используют для проведения амПЦР. Срок хранения раствора ДНК при температуре минус 20 °С - не более одного года.
особо чистой стерильной воды. Полученный раствор ДНК используют для проведения амПЦР. Срок хранения раствора ДНК при температуре минус 20 °С - не более одного года.
6.3. Подготовка асимметричной мультиплексной ПЦР.
6.3.1. Приготовление реакционной смеси для амПЦР*.
________________
* Реакционную смесь для амПЦР готовят непосредственно перед анализом при температуре не выше 20 °С.
6.3.1.1. В микроцентрифужную пробирку вместимостью 1,5 см микродозатором вносят (из расчета на каждую анализируемую пробу): 3 мм
микродозатором вносят (из расчета на каждую анализируемую пробу): 3 мм 10
10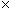 буфера реакционного для ПЦР по п.4.32; 3 мм
буфера реакционного для ПЦР по п.4.32; 3 мм смеси дезоксирибонуклеозидтрифосфатов по п.4.36 [16], 2,5 мм
смеси дезоксирибонуклеозидтрифосфатов по п.4.36 [16], 2,5 мм фермента Taq-полимеразы по п.4.31 [13] (концентрацией 5 ед. акт/мм
фермента Taq-полимеразы по п.4.31 [13] (концентрацией 5 ед. акт/мм )*, а также водный раствор праймеров по п.4.40 [20] в следующих концентрациях (нг/дм
)*, а также водный раствор праймеров по п.4.40 [20] в следующих концентрациях (нг/дм ):
):
35S_п/35S_оф - 15,32/81,02;
gus_п/gus_oф - 3,75/37,59;
nos_п/nos_oф - 3,61/84,74;
npt_п/npt_oф - 7,51/36,01;
ocs_п/ocs_oф - 8,18/41,41.
________________
* Срок хранения Taq-полимеразы после разведения при температуре от 2 до 8 °С - не более 2 ч.
Смесь разбавляют особо чистой стерильной водой до объема 27 мм (из расчета на одну анализируемую пробу) и осторожно перемешивают в течение 3-5 с на аппарате для встряхивания, не допуская образования пены. Общий объем реакционной смеси для амПЦР готовят с учетом числа анализируемых проб и двух контрольных проб: положительный контроль (заведомо трансгенная ДНК по п.4.37) и отрицательный контроль (заведомо нетрансгенная ДНК по п.4.38).
(из расчета на одну анализируемую пробу) и осторожно перемешивают в течение 3-5 с на аппарате для встряхивания, не допуская образования пены. Общий объем реакционной смеси для амПЦР готовят с учетом числа анализируемых проб и двух контрольных проб: положительный контроль (заведомо трансгенная ДНК по п.4.37) и отрицательный контроль (заведомо нетрансгенная ДНК по п.4.38).
6.3.1.2. Реакционную смесь для амПЦР, полученную по п.6.3.1.1, осаждают кратковременным (10-15 с) центрифугированием на настольной центрифуге при частоте вращения 1500-3000 мин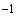 и сразу же используют для проведения анализа.
и сразу же используют для проведения анализа.
6.3.2. Все этапы амПЦР должен проводить квалифицированный, специально обученный персонал в соответствии с требованиями [22]. Для проведения амПЦР допускается использовать только стерильную лабораторную посуду и новые стерильные микроцентрифужные пробирки. При проведении амПЦР каждую микроцентрифужную пробирку открывают только перед отбором или внесением анализируемой пробы, а по окончании манипуляции сразу же закрывают. Запрещается открывать одновременно несколько микроцентрифужных пробирок с анализируемыми пробами и оставлять их открытыми длительное время. Каждую анализируемую пробу отбирают микродозатором с новым стерильным наконечником с фильтром.
7.1. Проведение асимметричной мультиплексной ПЦР
7.1.1. Реакционную смесь для амПЦР, полученную по п.6.3.1.2, микродозатором вносят в чистые микроцентрифужные пробирки вместимостью 0,2 или 0,5 см , по 27 мм
, по 27 мм в каждую.
в каждую.
7.1.2. Анализируемую ДНК, выделенную по п.6.2, вносят микродозатором по 3 мм в микроцентрифужные пробирки с реакционной смесью для амПЦР, по п.7.1.1. При использовании амплификатора ДНК по п.4.3 [3] без подогрева крышки в каждую микроцентрифужную пробирку с реакционной смесью вносят по 30 мм
в микроцентрифужные пробирки с реакционной смесью для амПЦР, по п.7.1.1. При использовании амплификатора ДНК по п.4.3 [3] без подогрева крышки в каждую микроцентрифужную пробирку с реакционной смесью вносят по 30 мм вазелинового масла по ГОСТ 3164 для предохранения реакционной смеси от испарения водной фазы при амПЦР. В этом случае анализируемую ДНК вносят под слой масла, в результате чего образуются водная и масляная фазы.
вазелинового масла по ГОСТ 3164 для предохранения реакционной смеси от испарения водной фазы при амПЦР. В этом случае анализируемую ДНК вносят под слой масла, в результате чего образуются водная и масляная фазы.
7.1.3. В две другие микроцентрифужные пробирки микродозатором вносят по 3 мм раствора заведомо трансгенной ДНК (положительный контроль) и раствора заведомо нетрансгенной ДНК (отрицательный контроль).
раствора заведомо трансгенной ДНК (положительный контроль) и раствора заведомо нетрансгенной ДНК (отрицательный контроль).
7.1.4. Все микроцентрифужные пробирки со смесями, полученными по п.7.1.2, и растворами, подготовленными по п.7.1.3, помещают в амплификатор ДНК и проводят амПЦР по программе, указанной в табл.2.
Таблица 2
Программа проведения амПЦР
|
Шаг программы |
Температура, °С |
Время инкубации |
Число циклов |
|
1 |
95 |
5 мин |
1 |
|
|
95 |
30 с |
|
|
2 |
62 |
30 с |
37 |
|
|
72 |
30 с |
|
|
3 |
72 |
5 мин |
1 |
7.2. Гибридизация на биологическом микрочипе
7.2.1. В необходимое количество микроцентрифужных пробирок микродозатором вносят по 24 мм гибридизационного буфера, приготовленного по п.6.1.4. Затем к гибридизационному буферу добавляют по 12 мм
гибридизационного буфера, приготовленного по п.6.1.4. Затем к гибридизационному буферу добавляют по 12 мм водной фазы ПЦР-смеси, полученной в результате проведения амПЦР по п.7.1.4 и перемешивают в течение 20-30 с на аппарате для встряхивания по п.4.10 с частотой вращения не менее 1500 мин
водной фазы ПЦР-смеси, полученной в результате проведения амПЦР по п.7.1.4 и перемешивают в течение 20-30 с на аппарате для встряхивания по п.4.10 с частотой вращения не менее 1500 мин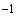 для получения гибридизационной смеси.
для получения гибридизационной смеси.
7.2.2. Из каждой микроцентрифужной пробирки микродозатором отбирают по 28 мм гибридизационной смеси (для каждого биологического микрочипа), полученной по п.7.2.1, и помещают на поверхность биологического микрочипа, через отверстие в пластиковой крышке. Гибридизацию проводят в термостате [4] при температуре 37 °С в течение 18 ч.
гибридизационной смеси (для каждого биологического микрочипа), полученной по п.7.2.1, и помещают на поверхность биологического микрочипа, через отверстие в пластиковой крышке. Гибридизацию проводят в термостате [4] при температуре 37 °С в течение 18 ч.
7.2.3. После окончания гибридизации пластиковые крышки снимают, каждый биологический микрочип трижды промывают дистиллированной водой по ГОСТ 6709 при температуре 25 °С и высушивают при комнатной температуре.
Схема метода идентификации генетически модифицированных источников (ГМИ) растительного происхождения приведена в прилож.Б.
8. Обработка результатов анализа
8.1. Визуализацию гибридизационной картины на биологическом микрочипе для анализируемой пробы осуществляют с помощью аппаратно-программного комплекса для анализа флуоресценции биологических микрочипов "Чипдетектор-03" [2] и компьютерной программы Imageware [1].
8.2. Полученную на экране компьютера гибридизационную картину для анализируемой пробы сравнивают с гибридизационной картиной для положительного контроля (заведомо трансгенной ДНК) и гибридизационной картиной для отрицательного контроля (заведомо нетрансгенной ДНК). Пример гибридизационной картины флуоресцентных продуктов амПЦР в гелевых ячейках биологического микрочипа приведен в прилож.В. Наличие высокого уровня специфического флуоресцентного сигнала в гелевых ячейках биологического микрочипа, содержащих иммобилизованные олигонуклеотиды (для промоторов 35S и nos, терминатора ocs, генов gus или nptII), свидетельствует о присутствии конкретных чужеродных последовательностей ДНК в анализируемой пробе, т.е. о трансгенности анализируемой ДНК. Низкий уровень флуоресцентных сигналов в гелевых ячейках биологического микрочипа после гибридизации, сравнимый с уровнем фоновой флуоресценции отрицательного контроля, но не выше установленного порога чувствительности в программе Imageware, указывает на отсутствие конкретных чужеродных последовательностей ДНК в анализируемой пробе, т.е. о нетрансгенности анализируемой ДНК.
8.3. Интерпретация результатов.
8.3.1. Высокий уровень флуоресценции одной, нескольких или всех пяти гелевых ячеек биологического микрочипа, содержащих иммобилизованные олигонуклеотиды, превышающий заданный в программе Imageware [1] порог чувствительности, свидетельствует о наличии генетически модифицированных источников (ГМИ) в анализируемом продукте.
8.3.2. Низкий уровень флуоресценции всех пяти гелевых ячеек биологического микрочипа, содержащих иммобилизованные олигонуклеотиды, близкий к фоновой флуоресценции отрицательных контролей и не достигающий заданного в программе Imageware порога чувствительности, свидетельствует об отсутствии генетически модифицированных источников (ГМИ) в анализируемом продукте.
8.3.3. Высокий уровень флуоресценции гелевых ячеек при использовании заведомо нетрансгенной ДНК свидетельствует о получении ложноположительного результата. Причиной может быть загрязнение ГМИ реактивов и/или оборудования. В этом случае необходимо обработать поверхности лабораторных столов и оборудования раствором соляной кислоты (1 моль/дм ), заменить реактивы на свежеприготовленные и повторить анализ. Полученный при повторном анализе низкий уровень флуоресценции гелевых ячеек при использовании заведомо нетрансгенной ДНК свидетельствует о достоверном результате, который является окончательным.
), заменить реактивы на свежеприготовленные и повторить анализ. Полученный при повторном анализе низкий уровень флуоресценции гелевых ячеек при использовании заведомо нетрансгенной ДНК свидетельствует о достоверном результате, который является окончательным.
8.3.4. Низкий уровень (отсутствие) флуоресцентного сигнала при использовании заведомо трансгенной ДНК свидетельствует о получении ложноотрицательного результата. Причиной могут быть потеря активности одного из компонентов реакционной смеси для амПЦР или несоблюдение условий проведения амПЦР и/или гибридизации на биологическом микрочипе. В этом случае необходимо заменить реактивы на свежеприготовленные и повторить анализ. Полученный при повторном анализе высокий уровень флуоресценции гелевых ячеек при использовании заведомо трансгенной ДНК свидетельствует о достоверном результате, который является окончательным.
9. Требования безопасности
9.1. При выполнении всех работ необходимо соблюдать требования техники безопасности при работе с химическими реактивами в соответствии с ГОСТ 12.1.007.
9.2. Помещение, в котором проводятся работы, должно быть оборудовано общей приточно-вытяжной вентиляцией по ГОСТ 12.4.021. Содержание вредных веществ в воздухе рабочей зоны не должно превышать гигиенические нормативы, установленные Минздравом России [23, 24].
9.3. При работе с электроустановками электробезопасность должна соответствовать требованиям ГОСТ 12.1.019. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и быть оснащено средствами пожаротушения по ГОСТ 12.4.009.
9.4. Исследования по идентификации ГМИ растительного происхождения могут проводиться на базе лабораторий, проводящих исследования методом ПЦР с патогенными биологическими агентами. В таком случае должно быть предусмотрено лишь разграничение проведения исследований во времени. При организации исследований по идентификации ГМИ необходимо предусмотреть наличие вспомогательных помещений (комнаты ведения учетной документации; раздевалки для сотрудников; комнаты приема пищи; туалета; подсобных помещений), которые могут быть общими с другими подразделениями учреждения. Проведение исследований методом ПЦР сопряжено с необходимостью обеспечения соблюдения правил биологической безопасности и требований к организации и проведению анализа с целью предотвращения ложноположительных и ложноотрицательных результатов [22].
Приложение А
(справочное)
Биологическая безопасность - защищенность человека, общества и окружающей среды от негативного воздействия токсических, аллергенных, канцерогенных, мутагенных биологических веществ и соединений, содержащихся в природных или генно-инженерно-модифицированных биологических объектах и полученных из них продуктах.
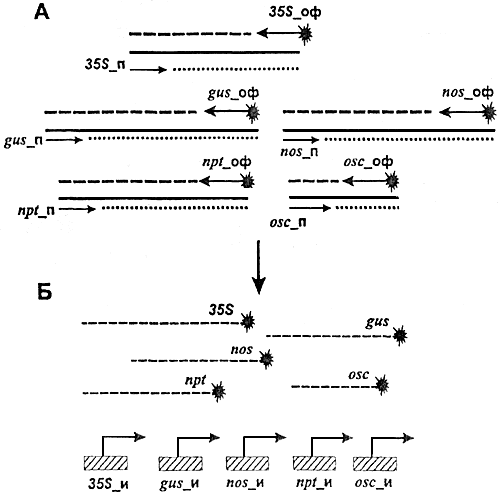
Рис.Б1. Схема метода идентификации генетически модифицированных источников растительного происхождения.
А - асимметричная мультиплексная ПЦР с использованием флуоресцентно-меченных праймеров (индекс "_оф");
Б - гибридизация ПЦР продуктов со специфическими олигонуклеотидами, иммобилизованными на биологическом микрочипе (индекс "_и").
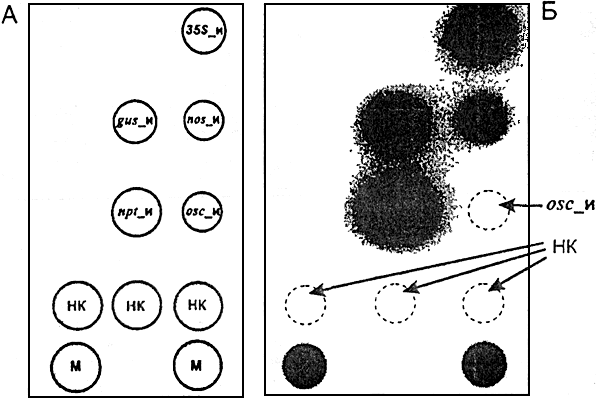
Рис.В1. Пример гибридизационной картины на биологическом микрочипе флуоресцентных продуктов амПЦР
(гибридизационная картина на экране компьютера, полученная в результате анализа генетически
модифицированного картофеля, содержащего промотор 35S, гены gus и nptll и промотор nos).
А - схема биологического микрочипа для идентификации генетически модифицированного источника растительного происхождения;
Б - гибридизационная картина на биологическом микрочипе флуоресцентных продуктов амПЦР анализируемой ДНК, содержащей промотор 35S, гены gus и nptll, a также промотор nos. Пунктиром обозначены гелевые ячейки биологического микрочипа с уровнем флуоресценции, близким к фоновой, не достигающим заданного в программе Imageware порога чувствительности.
Приложение Г
(справочное)
Библиография
|
[1] |
Центр биологических микрочипов РАН ИМБ |
Компьютерная программа "Imageware" для анализа изображений, полученных с помощью "Чипдетектора-03" | |
|
[2] |
ТУ 9443-001-02699501-03 |
Комплекс аппаратно-программный для анализа флуоресценции биологических микрочипов "Чипдетектор-03" | |
|
[3] |
ТУ 9642-001-4648062-98 |
Амплификатор "Терцик МС-2" | |
|
[4] |
ТУ 42-619-61 |
Термостат суховоздушный ТВЗ-25 | |
|
[5] |
Корпорация "Эппендорф", |
Микроцентрифуга настольная 5415С 13000 мин | |
|
[6] |
Корпорация "Хеликон", кат. N MSH-300 |
Мешалка магнитная с подогревом | |
|
[7] |
Корпорация "Хеликон", N СV-1500 |
Аппарат для встряхивания кат. (центрифуга-вортекс) | |
|
[8] |
Корпорация "Хеликон", кат. N RP-30 и RP-80 |
Штативы под микроцентрифужные пробирки | |
|
[9] |
Корпорация "Хеликон", кат. N FА 104; FА 108; |
Наконечники с фильтром для микропипеток | |
|
[10] |
ТУ 6-09-11-1721-83 |
Этилендиаминтетрауксусной кислоты натриевая соль дигидрат | |
|
[11] |
ТУ 6-09-4292-76 |
Трис(оксиметил)аминометан[NН | |
|
[12] |
Корпорация "Сигма Алдрич" ("Sigma"), |
Додецилсульфат натрия (SDS) | |
|
[13] |
Корпорация "Сигма Алдрич" ("Sigma"), |
Фермент Taq-полимераза 5 ед. акт./мм | |
|
[14] |
Корпорация "Хеликон", кат. N Am-038-0.5 |
Гуанидин тиоцианат [СН | |
|
[15] |
Корпорация "Хеликон", кат. N Am-0485-Ol |
N-[2-оксиэтил]пиперазин-N'-[2-этансульфоновая кислота] (HEPES) [C | |
|
[16] |
Корпорация "Хеликон", кат. N Н-4044-0.4 |
Раствор смеси дАТФ, дГТФ, дТТФ, дЦТФ, по 25 мл каждого | |
|
[17] |
ИФР РАН |
Раствор заведомо трансгенной ДНК около 100 нг/мм | |
|
[18] |
ИФР РАН |
Раствор заведомо нетрансгенной ДНК около 100 нг/мм | |
|
[19] |
ТУ 46-22-603-75 |
Баня водяная с электрическим или огневым подогревом | |
|
[20] |
Центр биологических микрочипов ИМБ РАН |
Раствор водный праймеров "ПР-1" | |
|
[21] |
Центр биологических микрочипов ИМБ РАН |
Микрочипы гелевые с иммобилизованными олигонуклеотидами | |
|
[22] |
Методические рекомендации по проведению работ в диагностических лабораториях, использующих метод полимеразной цепной реакции. Основные положения |
Государственный комитет санэпиднадзора Российской Федерации; N 06-19/52-17 от 02.06.95 | |
|
[23] |
Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны. ГН 2.2.5.1313-03 |
Минздрав России. М., 2003 | |
|
[24] |
Минздрав России. М., 2003 |
Текст документа сверен по:
официальное издание
Бюллетень нормативных и методических
документов Госсанэпиднадзора, вып.2 (июнь), 2005
 ]
] H
H N
N SNa]
SNa]