МУК 4.1.2158-07
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств антибиотиков тетрациклиновой группы
и сульфаниламидных препаратов в продуктах животного происхождения
методом иммуноферментного анализа
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ ГУ НИИ питания РАМН: Тутельян В.А. (руководитель), Хотимченко С.А., Шевелева С.А., Ефимочкина Н.Р., Барбер Н.В., Григорьев А.М.; ФГУЗ "Центр государственного санитарно-эпидемиологического надзора в г.Москве" (Иванова Л.И., Кругликова Т.А.)
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Комиссией по государственному санитарно-эпидемиологическому нормированию Российской Федерации
3. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ 18 января 2007 г. Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко
4. ВВЕДЕНЫ ВПЕРВЫЕ
1. Область применения
1.1. Настоящие методические указания устанавливают методы определения остаточных количеств антибиотиков тетрациклиновой группы и сульфаниламидных препаратов в пищевом сырье и пищевых продуктах животного происхождения (в мясе и мясопродуктах; в птице и птицепродуктах; в молоке и молочных продуктах) на основе твердофазного иммуноферментного анализа.
1.2. Методические указания предназначены для органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов, а также могут быть использованы для проведения производственного контроля другими испытательными лабораториями, аккредитованных в порядке, установленном Правительством Российской Федерации. Методические указания не могут быть применены для арбитражных исследований.
2. Общие положения
2.1. Среди контаминантов продовольственного сырья и пищевых продуктов важное место занимают остатки антимикробных ветеринарных препаратов, используемых для лечения и профилактики инфекционных заболеваний животных и птицы, в том числе антибиотики тетрациклиновой группы и сульфаниламидные препараты. При их поступлении в организм человека могут возникать аллергические реакции, дисбиотические изменения микрофлоры кишечника, а также происходит формирование антибиотикоустойчивых форм микроорганизмов.
Для определения остаточных количеств антибиотиков в пищевых продуктах в настоящее время в основном применяют микробиологические методы, которые являются сравнительно простыми и дешевыми, однако, отличаются недостаточной специфичностью результатов.
2.2. Для скрининга пищевых продуктов на загрязненность антибактериальными препаратами, в том числе сульфаниламидами, целесообразно использовать методы иммунохимического анализа, обеспечивающие высокую специфичность и точность, при этом предпочтительнее применять методы твердофазного иммуноферментного анализа (далее - ИФА), которые являются высокочувствительными.
2.3. При определении методом ИФА в соответствии с настоящими Методическими указаниями антибиотиков тетрациклиновой группы предел обнаружения их составляет от 0,0015 мг/кг до 0,15 мг/кг в зависимости от вида продукта; для сульфаниламидных препаратов - от 0,002 мг/кг до 0,02 мг/кг в зависимости от вида продукта.
3. Отбор и подготовка проб
3.1. Отбор пищевых образцов для исследования осуществляется в соответствии с требованиями ГОСТ 7269-79 "Мясо", ГОСТ 7202.0-74 "Мясо птицы", ГОСТ 3622-68 "Молоко и молочные продукты".
3.2. Отобранные образцы продуктов герметично упаковывают в полиэтиленовые мешки, стеклянные банки с притертыми крышками, маркируют и нумеруют. Образцы доставляют в лабораторию для анализа сразу же после отбора проб. В случае необходимости допускается хранить при температуре 4±2 °С в течение времени не более срока годности пищевых продуктов или замораживать до температуры минус 10-12 °С и хранить не более 2 недель.
3.3. К исследованию скоропортящихся образцов следует приступать в день их доставки в лабораторию.
4. Определение антибиотиков тетрациклиновой группы
4.1. Принцип метода ИФА
Базовым принципом для количественного определения антибиотиков тетрациклиновой группы в пищевых продуктах является твердофазный конкурентный иммуноферментный анализ на полистироловых планшетах. Метод основан на конкуренции свободного антибиотика из исследуемых образцов и антибиотика, предварительно адсорбированного на твердой фазе (лунке планшета) в составе белкового конъюгата, за центры связывания специфичных к тетрациклинам антител во вносимом растворе. После отделения не связавшихся реагентов количество антител, прореагировавших с иммобилизованным антигеном, определяют с помощью вторичных антивидовых антител, меченных пероксидазой хрена*. Количество связавшегося с антителами конъюгата вторичных антител определяют с помощью субстрат - хромогенной смеси. При этом количество определяемого антибиотика, содержащегося в исследуемом образце, обратно пропорционально регистрируемой оптической плотности продукта ферментативной реакции.
________________
* Текст соответствует оригиналу. - Примечание изготовителя базы данных.
4.2. Аппаратура, материалы, реактивы
|
Перечень и характеристики оборудования и материалов |
Нормативные документы, примечания |
|
1 |
2 |
|
Фотометр планшетный вертикального сканирования, с фильтрами, соответствующими длине волны 450 нм |
"Униплан", "Мультискан" или иного типа с теми же характеристиками |
|
Дозаторы пипеточные автоматические с переменным объемом 0,02-0,2 см |
"Ленпипет", "Термолабсистемс" или иные тех же объемов |
|
Дозаторы пипеточные автоматические восьмиканальные с переменным объемом 0,05-0,3 см |
|
|
Наконечники для автоматических пипеток объемом до 0,30 см |
По спецификации изготовителя |
|
Анализатор потенциометрический, погрешность измерений рН ±0,01 или рН-м |
ГОСТ 19881-74 или другие марки с аналогичными характеристиками |
|
Весы аналитические 120 г / 0,001 мг |
ГОСТ 24104-88Е*** |
|
Весы лабораторные общего назначения, 2 класса точности, до 200 г / 0,1 г |
ГОСТ 24104-88Е*** |
|
Гомогенизатор лабораторный |
Типа "Ультратюрракс", "Диакс" или аналогичные |
|
Аквадистиллятор |
В соответствии с ГОСТ 6709-72 |
|
Холодильник бытовой электрический |
ГОСТ 16317-87 |
|
Стаканы химические и колбы мерные вместимостью 25, 50, 200 и 500 см |
|
|
Пипетки градуированные, 2 класса точности 1, 2, 5, 10 см |
ГОСТ 20292-74**** или аналогичные |
|
Часы механические сигнальные |
ГОСТ 3145-84 |
|
Центрифуга настольная с эффективностью не менее 4000 g |
По ТУ 5.375-4261 или иного типа |
|
Колонка для твердофазной экстракции RIDA |
По спецификации изготовителя |
|
Цилиндры мерные вместимостью 25 см |
По спецификации изготовителя |
|
Шейкер лабораторный для пробирок |
Типа "Вортекс" |
|
Микроиспаритель лабораторный одноканальный |
Моделей ПЭ-2300, "Мини-Вап" или других аналогичного назначения |
|
Насос (компрессор) мембранный |
РКадет, РКадмирал или иных моделей аналогичного назначения |
|
Устройство для твердофазной экстракции |
"Доркус", "Вакэлют" или иных моделей аналогичного назначения |
|
Аппарат универсальный для встряхивания |
ТУ 64-1-2451-78 |
|
Шкаф (стол) лабораторный с вытяжным устройством |
|
|
Набор реагентов для количественного определения тетрациклина типа "Ридаскрин Тетрациклин" |
По спецификации изготовителя |
|
Дигидрофосфат натрия водный |
хч** |
|
Гидрофосфат натрия |
хч |
|
Гидрофосфат натрия двухводный |
хч |
|
Хлорид натрия |
хч |
|
Гидрооксид натрия |
хч |
|
Моногидрат лимонной кислоты |
хч |
|
Щавелевая кислота |
хч |
|
ЭДТА-натриевая соль |
хч |
|
Твин 20 |
По спецификации изготовителя |
|
Метанол* или этанол 95,0% |
хч |
|
Этилацетат |
хч |
|
н-гексан |
хч |
|
Ацетонитрил |
хч |
|
Дистиллированная вода |
|
|
метанол* - ядовитое вещество, требует мер безопасности при работе;
| |
________________
*** На территории Российской Федерации действует ГОСТ 24104-2001;
**** Действуют ГОСТ 29169-91, ГОСТ 29227-91-ГОСТ 29229-91, ГОСТ 29251-91-ГОСТ 29253-91, здесь и далее. - Примечание изготовителя базы данных.
5. Характеристика наборов для иммуноферментного определения тетрациклина
Для иммуноферментного определения тетрациклина могут быть использованы промышленно изготовленные наборы, метрологические характеристики которых не ниже указанных в настоящем документе после процедуры стандартизации их относительно данного метода.
5.1. Состав набора "Ридаскрин Тетрациклин"
|
Микротитровальный планшет на 96 лунок (12 стрипов по 8 лунок), сенсибилизированных препаратом тетрациклина - 1 шт. |
|
Комплект стандартных растворов тетрациклина со следующими концентрациями: 0 нг/см |
|
Раствор антител - 6,0 см |
|
Конъюгат вторичных антител с пероксидазой - 10,0 см |
|
Субстрат, содержащий пероксид карбамида (мочевины) - 7,0 см |
|
Хромоген, содержащий тетраметилбензидин - 7,0 см |
|
Стоп-реагент, содержащий 1 N серную кислоту - 14,0 см |
|
Буфер 1, для разбавления стандартных растворов тетрациклина и растворов образцов - 50,0 см |
|
Буфер 2, для разбавления стандартных образцов при анализе молока - 10,0 см |
Примечание. Набор рассчитан на проведение анализа в 2 повторностях: 42 исследуемых образца и 6 калибровочных проб (всего 96 определений на один планшет).
5.2. Аналитические характеристики набора
5.2.1. Специфичность метода
Метод анализа при использовании набора "Ридаскрин Тетрациклин" характеризуется показателем специфичности*, составляющим для:
Тетрациклина - 100%
Хлортетрациклина - 100%
Окситетрациклина - 10%
Миноциклина - 125%
Ролитетрациклина - 110%
Демеклоциклина - 35%
Доксициклина - 5%
_________________
* - гарантируется изготовителем
5.2.2. Чувствительность метода
Предел обнаружения тетрациклина и хлортетрациклина в молоке - 0,0015 мг/кг, мясе - 0,006 мг/кг, окситетрациклина в молоке - 0,015 мг/кг, в мясе - 0,06 мг/кг.
Показатель извлекаемости составляет более 70%, в т.ч. в молоке - 75±5%, в мясе и мясопродуктах - 85±15%.
При искусственном загрязнении проб молока 5 мкг/л тетрациклина или 100 мкг/л окситетрациклина степень извлечения составляет 90±10%.
5.3. Рекомендации по использованию наборов "Ридаскрин Тетрациклин"
5.3.1. При проведении испытаний следует использовать реагенты и компоненты, входящие в один и тот же набор. Разбавление или замена реагентов, использование реагентов из набора с другим номером партии может привести к потере чувствительности или ошибке определения.
5.3.2. Хранить наборы следует при температуре в пределах от 2 до 8 °С. Категорически не допускается хранение при минусовой температуре и замораживание реагентов набора. Для хранения неиспользованных стрипов (лунок) их упаковывают в оригинальный фольгированный пакет вместе с имеющимся осушителем в плотно закрытом виде.
5.3.3. Следует избегать попадания прямых солнечных лучей на флакон с раствором хромогена из-за его светочувствительности.
5.3.4. В случае окрашивания раствора хромогена его применение для анализа не рекомендуется, поскольку окрашивание раствора хромогена является признаком порчи.
6. Требования техники безопасности при проведении испытаний
Стоп-реагент содержит в своем составе серную кислоту, поэтому следует избегать контакта стоп-реагента с кожей.
7. Проведение испытаний с применением набора "Ридаскрин Тетрациклин"
7.1. Подготовка проб для анализа
Отбор образцов для анализа ведется в соответствии с п.3 данного документа. Образцы, предназначенные для анализа, должны храниться в холодильнике, в темном месте.
7.1.1. Подготовка проб молока
Молоко объемом 5 см![]() охладить до температуры 6±2 °С, перенести в центрифужную пробирку, центрифугировать при температуре 4-10 °С в течение 15 мин при эффективности центрифугирования 4000 g*. Удалить верхний слой жира и перенести аликвоту обезжиренного молока в новую чистую пробирку. Смешать обезжиренное молоко с буфером N 1 в соотношении 1:10. Для анализа использовать 0,05 см
охладить до температуры 6±2 °С, перенести в центрифужную пробирку, центрифугировать при температуре 4-10 °С в течение 15 мин при эффективности центрифугирования 4000 g*. Удалить верхний слой жира и перенести аликвоту обезжиренного молока в новую чистую пробирку. Смешать обезжиренное молоко с буфером N 1 в соотношении 1:10. Для анализа использовать 0,05 см![]() разведения обезжиренного молока с буфером на 1 лунку планшета. Коэффициент разбавления - 10.
разведения обезжиренного молока с буфером на 1 лунку планшета. Коэффициент разбавления - 10.
________________
* Эффективность центрифугирования измеряется в g и зависит от скорости и радиуса вращения (см. технический паспорт имеющейся центрифуги). Например, при использовании центрифуги ОПН-8 с угловым ротором эффективности 4000 g соответствует скорость вращения ротора около 7000 об/мин.
7.1.2. Подготовка проб мяса
7.1.2.1. Приготовление реагентов для пробоподготовки
При исследовании образцов мяса для пробоподготовки необходимо приготовить следующие реагенты:
![]() метанол (допускается использование спирта этилового 95,0%);
метанол (допускается использование спирта этилового 95,0%);
![]() буфер Макллвейна: 12,9 г лимонной кислоты моногидрата; 10,9 г Na
буфер Макллвейна: 12,9 г лимонной кислоты моногидрата; 10,9 г Na![]() HPO
HPO![]() ; 37,2 г ЭДТА-натриевой соли растворить в дистиллированной воде и довести до объема 1000 см
; 37,2 г ЭДТА-натриевой соли растворить в дистиллированной воде и довести до объема 1000 см![]() ; установить рН 3,8;
; установить рН 3,8;
![]() раствор 20 мМ щавелевой кислоты в метаноле (этаноле) (1,8 г/л).
раствор 20 мМ щавелевой кислоты в метаноле (этаноле) (1,8 г/л).
7.1.2.2. Приготовление проб
Пробу мяса измельчить с использованием лабораторного гомогенизатора. Далее 5 г гомогенизированной пробы поместить в чистую центрифужную пробирку, смешать с 25 см![]() буфера Макллвейна и встряхивать в шейкере в течение 30 мин. Полученную суспензию охладить до температуры 15 °С и центрифугировать в течение 10 мин при эффективности центрифугирования 4000 g. Отобрать пипеткой верхний слой в чистую пробирку и повторить с оставшейся пробой экстракцию с 25 см
буфера Макллвейна и встряхивать в шейкере в течение 30 мин. Полученную суспензию охладить до температуры 15 °С и центрифугировать в течение 10 мин при эффективности центрифугирования 4000 g. Отобрать пипеткой верхний слой в чистую пробирку и повторить с оставшейся пробой экстракцию с 25 см![]() буфера Макллвейна. После этого объединить супернатанты (50 см
буфера Макллвейна. После этого объединить супернатанты (50 см![]() ) и профильтровать раствор через гофрированный фильтр.
) и профильтровать раствор через гофрированный фильтр.
7.1.2.3. Очистка раствора методом твердофазной экстракции
Из полученного по п.7.1.2.2 фильтрата отобрать 5 см![]() и очистить раствор методом твердофазной экстракции на колонке RIDA
и очистить раствор методом твердофазной экстракции на колонке RIDA![]() С18 следующим образом:
С18 следующим образом:
![]() предварительно колонку промывают 3 см
предварительно колонку промывают 3 см![]() метанола (этанола) со скоростью 1 капля в секунду: при отсутствии устройства для твердофазной экстракции можно использовать разовый пластиковый шприц на 5 см
метанола (этанола) со скоростью 1 капля в секунду: при отсутствии устройства для твердофазной экстракции можно использовать разовый пластиковый шприц на 5 см![]() ;
;
![]() промыть колонку 2 см
промыть колонку 2 см![]() дистиллированной воды со скоростью 1 капля в секунду;
дистиллированной воды со скоростью 1 капля в секунду;
![]() пропустить через колонку 5 см
пропустить через колонку 5 см![]() подготовленного раствора исследуемой пробы со скоростью 15 капель в минуту;
подготовленного раствора исследуемой пробы со скоростью 15 капель в минуту;
![]() промыть колонку 3 см
промыть колонку 3 см![]() дистиллированной воды со скоростью 1 капля в секунду;
дистиллированной воды со скоростью 1 капля в секунду;
![]() удалить из колонки остатки жидкости и сушить колонку в токе воздуха или азота 2 мин;
удалить из колонки остатки жидкости и сушить колонку в токе воздуха или азота 2 мин;
![]() адсорбированные на колонке вещества осторожно, со скоростью 15 капель в минуту, элюировать 2 см
адсорбированные на колонке вещества осторожно, со скоростью 15 капель в минуту, элюировать 2 см![]() 20 мМ раствора щавелевой кислоты в метаноле (этаноле) в чистую пробирку;
20 мМ раствора щавелевой кислоты в метаноле (этаноле) в чистую пробирку;
![]() элюат разбавить буфером N 1 в 10 раз (1:9), например, смешав 0,05 см
элюат разбавить буфером N 1 в 10 раз (1:9), например, смешав 0,05 см![]() элюата и 0,45 см
элюата и 0,45 см![]() буфера N 1. Раствор готов к испытанию в ИФА. Для анализа используют 0,05 см
буфера N 1. Раствор готов к испытанию в ИФА. Для анализа используют 0,05 см![]() раствора.
раствора.
7.2. Приготовление реагентов для анализа
Перед использованием набора довести температуру всех реагентов до комнатной температуры в пределах 20-25 °С, а после использования охладить все оставшиеся реагенты до температуры 4±2 °С.
В процессе выполнения анализа нельзя допускать высыхания лунок планшета. На всех стадиях инкубации следует избегать воздействия прямого солнечного света. При инкубации планшета рекомендуется закрыть его непрозрачным экраном.
Все разведения реагентов и расчеты представлены для проведения анализа на одном планшете. Построение калибровочной кривой необходимо проводить для каждой серии определений.
7.2.1. Приготовление стандартных растворов
Подготовку стандартных растворов проводят только в стеклянной посуде, не допускается использование пластиковой посуды.
Для подготовки к использованию стандартных растворов тетрациклина концентраты растворов, входящие в состав набора, разбавляют буфером N 1 или буфером N 2 в нижеприведенных пропорциях. После разбавления необходимо тщательно перемешать готовые растворы:
|
Стандарт 1 (С1). Для приготовления стандарта 1 с концентрацией 0 мкг/л тетрациклина 0,05 см |
|
Стандарт 2 (С2). Для приготовления стандарта 2 с концентрацией 0,05 мкг/л тетрациклина 0,05 см |
|
Стандарт 3 (С3). Для приготовления стандарта 3 с концентрацией 0,15 мкг/л тетрациклина 0,05 см |
|
Стандарт 4 (С4). Для приготовления стандарта 4 с концентрацией 0,45 мкг/л тетрациклина 0,05 см |
|
Стандарт 5 (С5). Для приготовления стандарта 5 с концентрацией 1,35 мкг/л тетрациклина 0,05 см |
|
Стандарт 6 (С6). Для приготовления стандарта 6 с концентрацией 4,05 мкг/л тетрациклина 0,05 см |
Буферный раствор N 1 используется для разведения стандартных растворов при исследовании проб мяса и мясопродуктов, птицы и птицепродуктов.
Буферный раствор N 2 используется для разведения стандартных растворов при исследовании проб молока.
Перед использованием буферного раствора N 2, использующегося при исследовании проб молока, следует энергично перемешать раствор с помощью встряхивателя типа "вортекс".
Для каждой серии исследований следует готовить свежие стандартные растворы.
7.2.2. Подготовка моющего буферного раствора
Для приготовления моющего фосфатного буферного раствора с твином навески 0,55 г NaH![]() PO
PO![]() ·Н
·Н![]() О, 2,85 г Na
О, 2,85 г Na![]() HPO
HPO![]() ·2H
·2H![]() O и 9 г NaCl растворить в дистиллированной воде, добавить 1 мл твина 20 и довести до объема 1000 мл; рН моющего фосфатного буфера должен быть 7,3±0,1.
O и 9 г NaCl растворить в дистиллированной воде, добавить 1 мл твина 20 и довести до объема 1000 мл; рН моющего фосфатного буфера должен быть 7,3±0,1.
7.2.3. Подготовка раствора антител
Раствор антител к тетрациклину (флакон с черной крышкой), входящий в состав набора "Ридаскрин", поставляется в готовом к употреблению виде. Перед употреблением достаточно вскрыть флакон.
7.2.4. Подготовка раствора конъюгата
Раствор конъюгата с ферментом (флакон с красной крышкой) также готов для использования. Перед употреблением достаточно открыть флакон.
7.2.5. Подготовка микротитровального планшета
Перед выполнением анализа из планшета следует извлечь необходимое количество стрипов. Остальные стрипы следует тщательно упаковать в фольгированный пакет вместе с осушителем, закрыть застежку пакета и поместить на хранение при температуре (4±2) °С.
7.3. Процедура анализа
Вставить в рамку планшета стрипы (лунки) в количестве, необходимом для выполнения всех запланированных определений в двух повторностях. Записать координаты лунок, предназначенных для стандартных растворов и подготовленных исследуемых растворов. Пример формы записи показан на рис.1.
|
С1 |
С1 |
П3 |
П3 |
П11 |
П11 |
П19 |
П19 |
П27 |
П27 |
П35 |
П35 |
|
С2 |
С2 |
П4 |
П4 |
П12 |
П12 |
П20 |
П20 |
П28 |
П28 |
П36 |
П36 |
|
С3 |
С3 |
П5 |
П5 |
П13 |
П13 |
П21 |
П21 |
П29 |
П29 |
П37 |
П37 |
|
С4 |
С4 |
П6 |
П6 |
П14 |
П14 |
П22 |
П22 |
П30 |
П30 |
П38 |
П38 |
|
С5 |
С5 |
П7 |
П7 |
П15 |
П15 |
П23 |
П23 |
П31 |
П31 |
П39 |
П39 |
|
С6 |
С6 |
П8 |
П8 |
П16 |
П16 |
П24 |
П24 |
П32 |
П32 |
П40 |
П40 |
|
П1 |
П1 |
П9 |
П9 |
П17 |
П17 |
П25 |
П25 |
П33 |
П33 |
П41 |
П41 |
|
П2 |
П2 |
П10 |
П10 |
П18 |
П18 |
П26 |
П26 |
П34 |
П34 |
П42 |
П42 |
Рис.1. Пример формы записи координат лунок перед выполнением анализа
("С" - стандартные растворы, "П" - исследуемые пробы)
7.3.1. Добавить по 0,05 см![]() стандартных растворов и подготовленных растворов исследуемых образцов в соответствующие пары лунок.
стандартных растворов и подготовленных растворов исследуемых образцов в соответствующие пары лунок.
7.3.2. Добавить по 0,05 см![]() раствора антител в каждую лунку, перемешать вручную, легкими круговыми движениями рамки планшета по поверхности стола, избегая попадания смеси в соседние лунки, и оставить на инкубацию в течение 1 часа при комнатной температуре в пределах 20-25 °С.
раствора антител в каждую лунку, перемешать вручную, легкими круговыми движениями рамки планшета по поверхности стола, избегая попадания смеси в соседние лунки, и оставить на инкубацию в течение 1 часа при комнатной температуре в пределах 20-25 °С.
7.3.3. Вылить жидкость из лунок, перевернув рамку планшета и выбить капли жидкости, оставшиеся в лунках, путем энергичного троекратного постукивания рамки с лунками по столу, накрытому фильтровальной бумагой. Наполнить лунки 0,25 см![]() раствора фосфатного моющего буфера и снова удалить раствор из лунок. Выбить капли жидкости, как описано выше. Повторить процедуру промывки лунок раствором фосфатного буфера еще два раза.
раствора фосфатного моющего буфера и снова удалить раствор из лунок. Выбить капли жидкости, как описано выше. Повторить процедуру промывки лунок раствором фосфатного буфера еще два раза.
7.3.4. Добавить в каждую лунку по 0,1 см![]() раствора конъюгата. Тщательно перемешать вручную и оставить на инкубацию в течение 15 мин при комнатной температуре в пределах 20-25 °С.
раствора конъюгата. Тщательно перемешать вручную и оставить на инкубацию в течение 15 мин при комнатной температуре в пределах 20-25 °С.
7.3.5. Вылить жидкость из лунок, перевернув рамку и тщательно выбить капли жидкости, оставшиеся в лунках, путем троекратного постукивания рамки с лунками по столу, накрытому фильтровальной бумагой. Наполнить лунки 0,25 см![]() раствора фосфатного буфера и снова опорожнить лунки. Выбить капли жидкости, как описано выше. Повторить процедуру промывки лунок раствором фосфатного буфера еще два раза.
раствора фосфатного буфера и снова опорожнить лунки. Выбить капли жидкости, как описано выше. Повторить процедуру промывки лунок раствором фосфатного буфера еще два раза.
7.3.6. Добавить по 0,05 см![]() субстрата и по 0,05 см
субстрата и по 0,05 см![]() хромогена в каждую лунку. Тщательно перемешать и инкубировать при комнатной температуре в пределах 20-25 °С в течение 15 мин в темноте.
хромогена в каждую лунку. Тщательно перемешать и инкубировать при комнатной температуре в пределах 20-25 °С в течение 15 мин в темноте.
7.3.7. Добавить в каждую лунку по 0,1 см![]() стоп-реагента и перемешать вручную. В течение 60 мин, не более, после добавления стоп-реагента измерить оптическую плотность в каждой лунке при 450 нм (бланк или нулевое считывание по воздуху), используя фотометр планшетный.
стоп-реагента и перемешать вручную. В течение 60 мин, не более, после добавления стоп-реагента измерить оптическую плотность в каждой лунке при 450 нм (бланк или нулевое считывание по воздуху), используя фотометр планшетный.
8. Определение количества антибиотиков
тетрациклиновой группы в исследованных пробах
Средние из 2 значений оптической плотности, измеренной в лунках со стандартными и исследуемыми растворами, делятся на среднее значение оптической плотности, измеренной в лунках с первым (нулевым) стандартом, результат умножается на 100. Результат измерения оптической плотности измеряемой пробы выражается в процентах от оптической плотности лунки с нулевым стандартом (% поглощения, или относительное поглощение) по формуле:
![]() ,
,
где ![]() - среднее значение оптической плотности в лунках со стандартной пробой или с пробами исследуемого образца;
- среднее значение оптической плотности в лунках со стандартной пробой или с пробами исследуемого образца;
![]() - среднее значение оптической плотности лунки с нулевым стандартом (С1).
- среднее значение оптической плотности лунки с нулевым стандартом (С1).
Примечание. Если величина оптической плотности, измеренной в лунке с нулевым стандартом, составляет значение ниже 0,6 - это может быть признаком порчи реагентов. В таком случае следует заменить реагенты и повторить процедуру.
По величинам относительного поглощения, вычисленным для стандартных растворов, и соответствующим известным значениям концентрации тетрациклина в мкг/кг (мкг/л) строится калибровочная кривая в полулогарифмической системе координат. При правильно проведенном определении калибровочная кривая должна быть почти линейна в диапазоне 0,15-1,35 мкг/кг (рис.2).
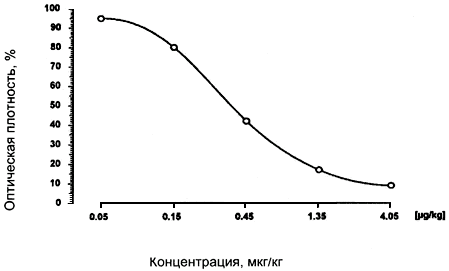
Рис.2. Образец калибровочной кривой для набора реагентов "Ридаскрин Тетрациклин"
Концентрация тетрациклина в растворах исследуемых образцов в мкг/кг (или мкг/л) определяется по калибровочной кривой соответственно относительному поглощению, измеренному и вычисленному для этих растворов.
Для того, чтобы вычислить концентрацию тетрациклина в исследуемой исходной пробе, величину концентрации тетрациклина, полученную по калибровочной кривой, следует умножить на соответствующий коэффициент разбавления. При выполнении пробоподготовки и анализа в полном соответствии с приведенной методикой коэффициент разбавления имеет следующие значения:
Молоко - 10;
Мясо - 40.
Окончательный результат исследования выражают в мг/кг или мг/л, для чего величины, полученные в мкг/кг или мкг/л, делят на 1000.
9. Обработка результатов
9.1. За окончательный результат измерения принимают среднее арифметическое результатов двух параллельных определений. Окончательный результат округляют до второго десятичного знака.
9.2. Метрологические характеристики иммуноферментного метода определения антибиотиков тетрациклиновой группы в продуктах питания животного происхождения (молоке, мясе) - табл.1.
Таблица 1
|
Статистический параметр |
Соединение - тетрациклин | |
|
мясо |
молоко | |
|
1 |
2 |
3 |
|
Нижний предел определения, мг/кг |
0,006 |
0,0015 |
|
Интервал надежного определения, мг/кг |
0,01-0,1 |
0,005-0,05 |
|
Среднее значение открываемости (показатель правильности), % |
80-115 | |
|
Допустимое расхождение между результатами двух параллельных определений тетрациклина, полученными в одной лаборатории в одной серии измерений (сходимость), при |
9,0 | |
|
Допустимое расхождение между результатами двух параллельных определений тетрациклина, выполненных в двух разных лабораториях (воспроизводимость), при |
10,0 | |
9.3. Если расхождение результатов двух параллельных определений (сходимость и воспроизводимость) превышает требования по п.9.2, то повторно проводят два новых параллельных определения.
10. Определение сульфаниламидных препаратов в продуктах
животного происхождения методом иммуноферментного анализа
10.1. Принцип метода
Сущность метода и принципиальная схема определения сульфаметазина с помощью иммуноферментного анализа в основном соответствует описанию, приведенному в п.4 для антибиотиков тетрациклиновой группы. Отличие состоит в использовании первичных антител захвата, адсорбированных на поверхности планшета, неконъюгированных вторичных антивидовых антител и сульфаметазина, конъюгированного с пероксидазой. Дополнительно предусмотрена процедура качественного определения сульфаниламидных препаратов в мясных и молочных продуктах, а также метод экспрессного определения количества сульфаниламидов в молоке с использованием тест-системы "Ридаскрин Фаст Сульфаметазин".
10.2. Аппаратура, материалы, реактивы
|
Перечень и характеристики оборудования и материалов |
Нормативные документы, примечания |
|
1 |
2 |
|
Фотометр планшетный вертикального сканирования, с фильтрами, соответствующими длине волны 450 нм |
"Униплан", "Мультискан" или иного типа с теми же характеристиками |
|
Дозаторы пипеточные автоматические с переменным объемом 0,02-0,2 см |
"Ленпипет", "Термолабсистемс" или иные тех же объемов |
|
Дозаторы пипеточные автоматические 8-ми канальные с переменным объемом 0,05-0,3 см |
|
|
Наконечники для автоматических пипеток объемом до 0,30 см |
|
|
Анализатор потенциометрический, погрешность измерений рН ±0,01 или рН-метр |
ГОСТ 19881-74 или другие марки с аналогичными характеристиками |
|
Весы аналитические 120 г / 0,001 мг |
ГОСТ 24104-88Е |
|
Весы лабораторные общего назначения, 2 класса точности, до 200 г / 0,1 г |
ГОСТ 24104-88Е |
|
Гомогенизатор лабораторный |
Типа "Ультратюрракс", "Диакс" или аналогичные |
|
Аквадистиллятор |
В соответствии с ГОСТ 6709-72 |
|
Холодильник бытовой электрический |
ГОСТ 16317-87 |
|
Стаканы химические и колбы мерные вместимостью 25, 50, 200 и 500 см |
|
|
Пипетки градуированные, 2 класса точности на 1, 2, 5, 10 см |
ГОСТ 20292-74 или аналогичные |
|
Часы механические сигнальные |
ГОСТ 3145-84 |
|
Центрифуга настольная с эффективностью центрифугирования не менее 4000 g |
По ТУ 5.375-4261 или иного типа |
|
Цилиндры мерные вместимостью 25 см |
|
|
Шейкер лабораторный для пробирок |
Типа "Вортекс" |
|
Микроиспаритель лабораторный одноканальный |
Моделей ПЭ-2300, "МиниВап" или других аналогичного назначения |
|
Насос (компрессор) мембранный |
РКадет, РКадмирал или иных моделей аналогичного назначения |
|
Аппарат универсальный для встряхивания |
ТУ 64-1-2451-78 |
|
Шкаф (стол) с вытяжным устройством |
По спецификации изготовителя |
|
Набор реагентов для количественного определения тетрациклина типа "Ридаскрин Сульфаметазин" |
По спецификации изготовителя |
|
Набор реагентов для количественного определения сульфаметазина типа "Ридаскрин Фаст Сульфаметазин" |
По спецификации изготовителя |
|
Этилацетат |
хч* |
|
н-гексан |
хч |
|
Ацетонитрил |
хч |
|
Дистиллированная вода |
|
|
хч* - химически чистые вещества | |
10.3. Состав набора "Ридаскрин Сульфаметазин"
|
Микротитровальный планшет (12х8), 96 лунок, сенсибилизированных специфическими антителами |
1 шт. | |
|
Комплект концентрированных стандартных растворов сульфаметазина в буфере с концентрациями: 0 мкг/л, 10 мкг/л, 30 мкг/л, 90 мкг/л, 270 мкг/л, 810 мкг/л, по 1300 мкл каждого, всего 6 растворов |
1 шт. | |
|
Антитела к сульфаметазину, концентрат (черная крышка) |
1 шт. | |
|
Конъюгат сульфаметазина с пероксидазой, концентрат (красная крышка) |
1 шт. | |
|
Субстрат, содержащий пероксид карбамида, 7 мл (зеленая крышка) |
1 шт. | |
|
Хромоген, содержащий тетраметилбензидин, 7 мл (голубая крышка) |
1 шт. | |
|
Стоп-реагент, содержит 1 N серную кислоту, 14 мл (желтая крышка) |
1 шт. | |
|
Буфер 1, для разбавления буфера 2, препаратов конъюгата и антител, стандартных растворов и растворов образцов, 60 мл |
1 шт. | |
|
Буфер 2, концентрированный, для разбавления стандартных растворов (для молока) |
1 шт. |
В состав набора входят материалы и реагенты в количестве, достаточном для выполнения 96 определений (включая калибровку по стандартным растворам).
10.4. Состав набора "Ридаскрин Фаст Сульфаметазин"
|
Микротитровальный планшет (6х8), 48 лунок, сенсибилизированных специфическими антителами |
1 шт. | |
|
Комплект концентрированных стандартных растворов сульфаметазина в буфере с концентрациями: 0 мкг/л, 50 мкг/л, 150 мкг/л, 450 мкг/л, 1350 мкг/л по 1,3 мл каждого, всего 5 растворов |
1 шт. | |
|
Антитела к сульфаметазину (черная крышка), 3 мл |
1 шт. | |
|
Конъюгат сульфаметазина с пероксидазой, (красная крышка), 3 мл |
1 шт. | |
|
Субстрат/хромоген (белая крышка), 6 мл |
1 шт. | |
|
Стоп-реагент, содержит 1 N серную кислоту (желтая крышка), 6 мл |
1 шт. | |
|
Буфер 1, концентрированный (х20) для разбавления стандартных растворов и растворов образцов, 60 мл |
1 шт. | |
|
Буфер 2, готовый к использованию, для разбавления стандартных растворов (для молока), 10 мл |
1 шт. |
В состав набора входят материалы и реагенты в количестве, достаточном для выполнения 48 определений (включая калибровку по стандартным растворам).
10.5. Аналитические характеристики наборов для определения сульфаниламидных препаратов
Наборы "Ридаскрин Сульфаметазин" и "Ридаскрин Фаст Сульфаметазин".
Специфичность
Перекрестная чувствительность наборов реагентов наборов "Ридаскрин Сульфаметазин" и "Ридаскрин Фаст Сульфаметазин" составляет:
|
Сульфаметазин (сульфадимезин, сульфадимидин) |
100% |
|
Сульфамеразин |
56,1% |
|
Сульфамоксол |
2,2% |
|
Сульфадиазин |
0,9% |
Чувствительность
Предел обнаружения сульфаметазина с помощью набора "Ридаскрин Сульфаметазин" составляет 0,001 мг/кг (мг/л). С учетом коэффициента разбавления предел обнаружения составляет 0,01 мг/л в молоке, 0,002 мг/кг в мясе и субпродуктах.
Предел обнаружения сульфаметазина с помощью набора "Ридаскрин Фаст Сульфаметазин" составляет 0,005 мг/кг (мг/л). С учетом коэффициента разбавления предел обнаружения сульфаметазина в молоке с помощью набора "Ридаскрин Фаст Сульфаметазин" составляет 0,01 мг/кг (мг/л).
Извлекаемость
Для проб молока степень извлечения сульфаметазина составляет 99% (при коэффициенте вариации 4,7%).
Для проб мяса степень извлечения сульфаметазина составляет 95% (при коэффициенте вариации 4,9%).
10.6. Рекомендации по использованию наборов "Ридаскрин Сульфаметазин"
и "Ридаскрин Фаст Сульфаметазин"
Все рекомендации, приведенные в п.5.3. для тест-наборов "Ридаскрин Тетрациклин" аналогичны для наборов "Ридаскрин Сульфаметазин" и "Ридаскрин Фаст Сульфаметазин".
11. Проведение испытаний с применением набора "Ридаскрин Сульфаметазин"
11.1. Подготовка необходимых реагентов
11.1.1. Приготовление буфера N 1
Буфер N 1 входит в набор в виде концентрата (20х).
Перед выполнением исследования необходимо разбавить буфер N 1 дистиллированной водой в 20 раз, например, смешать 50 мл буфера и 950 мл дистиллированной воды. Рекомендуется разбавлять буфер в 1 этап.
Срок хранения разбавленного буфера нанесен на этикетку флакона с концентрированным буфером при условии хранения при температуре 4±2 °С.
11.1.2. Приготовление буфера N 2
Буфер N 2 используется для приготовления стандартных растворов сульфаметазина при анализе проб молока. Для приготовления буферного раствора N 2, к 1 мл концентрата буфера N 2 (флакон с белой крышкой) следует добавить 9 мл разбавленного буферного раствора N 1 (по п.11.1.1) и тщательно перемешать (например, при помощи шейкера типа "Вортекс"). Мутность раствора не влияет на результат определения, однако осадок на дне флакона после перемешивания должен быть распределен в объеме раствора.
11.2. Подготовка проб для анализа
Отбор проб для анализа ведется в соответствии с разделом 3. Образцы, предназначенные для анализа, должны храниться в холодильнике, в темном месте. Перед анализом пробы должны быть тщательно перемешаны.
11.3. Подготовка проб молока к исследованию
11.3.1. Обезжиренное молоко
Пробу обезжиренного молока смешать с буфером N 1, приготовленным в соответствии с п.11.1.1. в соотношении 1:9. Например, смешать 0,05 см![]() молока и 0,45 см
молока и 0,45 см![]() буфера N 1.
буфера N 1.
Для анализа использовать 0,05 см![]() раствора на 1 лунку планшета.
раствора на 1 лунку планшета.
11.3.2. Молоко с содержанием жира 1% и более
Пробу молока объемом 5 см![]() охладить до +8 °С, перенести в стеклянную центрифужную пробирку, центрифугировать при температуре в пределах 8-12 °С в течение 10 мин при 3000 g (см. примечание к п.7.1.1). При отсутствии центрифуги с охлаждением, допускается охлаждение пробы перед центрифугированием до температуры 4 °С.
охладить до +8 °С, перенести в стеклянную центрифужную пробирку, центрифугировать при температуре в пределах 8-12 °С в течение 10 мин при 3000 g (см. примечание к п.7.1.1). При отсутствии центрифуги с охлаждением, допускается охлаждение пробы перед центрифугированием до температуры 4 °С.
Удалить верхний слой жира и перенести аликвоту обезжиренного молока в новую чистую пробирку и смешать с буфером N 1 в отношении 1:9, например, смешать 0,05 см![]() молока и 0,45 см
молока и 0,45 см![]() буфера N 1. Для анализа использовать 0,05 см
буфера N 1. Для анализа использовать 0,05 см![]() раствора на 1 лунку планшета.
раствора на 1 лунку планшета.
11.4. Подготовка проб мяса к исследованию
11.4.1. Приготовление реагентов для пробоподготовки
При исследовании образцов мяса для пробоподготовки необходимо подготовить следующие реагенты:
1. Этилацетат
2. н-гексан
3. Ацетонитрил
4. Дистиллированная вода
11.4.2. Пробоподготовка для качественного определения сульфаметазина
Исследуемую пробу мяса освободить от жировой ткани, взвесить 1 г мяса и добавить 10 см![]() буфера N 1, гомогенизировать пробу с использованием миксера или лабораторного гомогенизатора. Полученную пробу гомогенизированного мяса при комнатной температуре центрифугировать в течение 10-ти минут при 4000 g (см. примечание к п.7.1.1). Отобрать супернатант с помощью пипетки Пастера (избегая попадания жира в пипетку). Для анализа использовать 0,05 см
буфера N 1, гомогенизировать пробу с использованием миксера или лабораторного гомогенизатора. Полученную пробу гомогенизированного мяса при комнатной температуре центрифугировать в течение 10-ти минут при 4000 g (см. примечание к п.7.1.1). Отобрать супернатант с помощью пипетки Пастера (избегая попадания жира в пипетку). Для анализа использовать 0,05 см![]() супернатанта на лунку планшета.
супернатанта на лунку планшета.
11.4.3. Пробоподготовка для количественного определения сульфаметазина
Исследуемую пробу мяса освободить от жировой ткани и гомогенизировать пробу мяса с использованием лабораторного гомогенизатора. Далее 5 г гомогената поместить в чистую центрифужную пробирку, смешать с 20 см![]() 84%-го раствора ацетонитрила в воде и встряхивать на шейкере в течение 10 мин. Полученную суспензию центрифугировать при температуре 15 °С в течение 10 мин при 3000 g. Разбавить 3 см
84%-го раствора ацетонитрила в воде и встряхивать на шейкере в течение 10 мин. Полученную суспензию центрифугировать при температуре 15 °С в течение 10 мин при 3000 g. Разбавить 3 см![]() супернатанта с 3 см
супернатанта с 3 см![]() дистиллированной воды. Добавить к раствору 4,5 см
дистиллированной воды. Добавить к раствору 4,5 см![]() этилацетата и встряхивать на шейкере в течение 10 мин. Центрифугировать раствор при температуре 15 °С в течение 10 минут при 3000 g. Этилацетатный слой перенести в другую пробирку и испарить экстракт досуха с помощью микроиспарителя.
этилацетата и встряхивать на шейкере в течение 10 мин. Центрифугировать раствор при температуре 15 °С в течение 10 минут при 3000 g. Этилацетатный слой перенести в другую пробирку и испарить экстракт досуха с помощью микроиспарителя.
Растворить сухой остаток в 1,5 см![]() разбавленного буфера N 1. Для обезжиривания раствора добавить в пробирку 1,5 см
разбавленного буфера N 1. Для обезжиривания раствора добавить в пробирку 1,5 см![]() гексана и встряхивать на шейкере в течение 5 мин. Центрифугировать раствор, как описано выше. С помощью пипетки Пастера удалить полностью гексановый слой. Для анализа использовать 0,05 см
гексана и встряхивать на шейкере в течение 5 мин. Центрифугировать раствор, как описано выше. С помощью пипетки Пастера удалить полностью гексановый слой. Для анализа использовать 0,05 см![]() оставшейся в пробирке водной фазы на лунку планшета.
оставшейся в пробирке водной фазы на лунку планшета.
11.5. Приготовление реагентов для анализа
Построение калибровочной кривой необходимо проводить для каждой серии определений при использовании стрипов (лунок) одного тест-набора.
11.5.1. Приготовление стандартных растворов
Для приготовления стандартных растворов сульфаметазина концентраты растворов, входящие в состав набора, следует разбавить готовым буфером N 1 или готовым буфером N 2 в нижеприведенных пропорциях. После разбавления необходимо тщательно перемешать готовые растворы. Для разбавления нельзя использовать пластиковую посуду, необходимо использовать только стеклянную посуду.
Для каждой серии исследований следует готовить свежие стандартные растворы.
11.5.1.1. Приготовление стандартных растворов при количественном определении сульфаметазина.
|
Стандарт 1 (С1). Для приготовления стандарта 1 с концентрацией 0 мкг/л сульфаметазина 0,05 см |
|
Стандарт 2 (С2). Для приготовления стандарта 2 с концентрацией 1 мкг/л сульфаметазина 0,05 см |
|
Стандарт 3 (С3). Для приготовления стандарта 3 с концентрацией 3 мкг/л сульфаметазина 0,05 см |
|
Стандарт 4 (С4). Для приготовления стандарта 4 с концентрацией 9 мкг/л сульфаметазина 0,05 см |
|
Стандарт 5 (С5). Для приготовления стандарта 5 с концентрацией 27 мкг/л сульфаметазина 0,05 см |
|
Стандарт 6 (С6). Для приготовления стандарта 6 с концентрацией 81 мкг/л сульфаметазина 0,05 см |
Буферный раствор N 1, приготовленный по п.11.1.1, используется для разведения стандартных растворов при исследовании проб мяса и мясопродуктов, птицы и птицепродуктов.
Буферный раствор N 2, приготовленный по п.11.1.2, используется только для разведения стандартных растворов при исследовании проб молока. Перед использованием буфера N 2 следует энергично перемешать раствор с помощью встряхивателя типа "вортекс".
11.5.1.2. Приготовление стандартных растворов при качественном определении сульфаметазина.
При проведении качественного определения сульфаметазина используют только два стандартных раствора:
Стандарт 1: 0,05 см![]() концентрата N 1 смешивают с 0,45 см
концентрата N 1 смешивают с 0,45 см![]() буферного раствора - концентрация сульфаметазина - 0 мг/кг (отрицательный контроль).
буферного раствора - концентрация сульфаметазина - 0 мг/кг (отрицательный контроль).
Стандарт 4: 0,05 см![]() концентрата N 4, содержащего 9 мкг/л сульфаметазина, смешивают с 0,45 см
концентрата N 4, содержащего 9 мкг/л сульфаметазина, смешивают с 0,45 см![]() буферного раствора (положительный контроль).
буферного раствора (положительный контроль).
11.5.2. Приготовление раствора конъюгата
Конъюгат сульфаметазина с ферментом (флакон с красной крышкой) поставляется в концентрированном виде. Поскольку разбавленный раствор конъюгата имеет ограниченную стабильность, следует готовить раствор непосредственно перед проведением анализа. Перед разбавлением концентрированного раствора конъюгата следует осторожно встряхнуть содержимое флакона.
Для приготовления готового к использованию раствора конъюгата следует разбавить концентрат конъюгата готовым буферным раствором N 1 в отношении 1:11; например, смешать 200 мкл концентрата конъюгата с 2 мл готового буфера N 1 - данного количества раствора конъюгата достаточно для 4 стрипов (32 лунки).
11.5.3. Приготовление раствора антител
Антитела к сульфаметазину (флакон с черной крышкой) поставляются в концентрированном виде. Поскольку разбавленный раствор антител имеет ограниченную стабильность, следует готовить раствор по потребности. Перед разбавлением концентрата антител необходимо осторожно встряхнуть содержимое флакона.
Для приготовления готового раствора антител следует разбавить концентрат готовым буферным раствором N 1 в отношении 1:11; например, смешать 200 мкл концентрата антител с 2 мл готового буфера N 1 - данного разведения достаточно для 4 стрипов (32 лунки).
12. Процедура анализа
Вставить в рамку планшета стрипы (лунки) в количестве, необходимом для выполнения всех запланированных определений. Записать координаты лунок, предназначенных для стандартных растворов и подготовленных исследуемых растворов. Пример формы записи приведен на рис.3-4.
|
C1 |
П7 |
П15 |
П23 |
П31 |
П39 |
П47 |
П55 |
П63 |
П71 |
П79 |
П87 |
|
С2 |
П8 |
П16 |
П24 |
П32 |
П40 |
П48 |
П56 |
П64 |
П72 |
П80 |
П88 |
|
П1 |
П9 |
П17 |
П25 |
П33 |
П41 |
П49 |
П57 |
П65 |
П73 |
П81 |
П89 |
|
П2 |
П10 |
П18 |
П26 |
П34 |
П42 |
П50 |
П58 |
П66 |
П74 |
П82 |
П90 |
|
П3 |
П11 |
П19 |
П27 |
П35 |
П43 |
П51 |
П59 |
П67 |
П75 |
П83 |
П91 |
|
П4 |
П12 |
П20 |
П28 |
П36 |
П44 |
П52 |
П60 |
П68 |
П76 |
П84 |
П92 |
|
П5 |
П13 |
П21 |
П29 |
П37 |
П45 |
П53 |
П61 |
П69 |
П77 |
П85 |
П93 |
|
П6 |
П14 |
П22 |
П30 |
П38 |
П46 |
П54 |
П62 |
П70 |
П78 |
П86 |
П94 |
Рис.3. Пример формы записи координат лунок перед выполнением качественного анализа
на наличие сульфаниламидных препаратов ("С" - стандартные растворы, "П" - исследуемые пробы)
|
C1 |
C1 |
П3 |
П3 |
П11 |
П11 |
П19 |
П19 |
П27 |
П27 |
П35 |
П35 |
|
C2 |
C2 |
П4 |
П4 |
П12 |
П12 |
П20 |
П20 |
П28 |
П28 |
П36 |
П36 |
|
C3 |
C3 |
П5 |
П5 |
П13 |
П13 |
П21 |
П21 |
П29 |
П29 |
П37 |
П37 |
|
C4 |
C4 |
П6 |
П6 |
П14 |
П14 |
П22 |
П22 |
П30 |
П30 |
П38 |
П38 |
|
C5 |
C5 |
П7 |
П7 |
П15 |
П15 |
П23 |
П23 |
П31 |
П31 |
П39 |
П39 |
|
C6 |
C6 |
П8 |
П8 |
П16 |
П16 |
П24 |
П24 |
П32 |
П32 |
П40 |
П40 |
|
П1 |
П1 |
П9 |
П9 |
П17 |
П17 |
П25 |
П25 |
П33 |
П33 |
П41 |
П41 |
|
П2 |
П2 |
П10 |
П10 |
П18 |
П18 |
П26 |
П26 |
П34 |
П34 |
П42 |
П42 |
Рис.4. Пример формы записи координат лунок перед выполнением количественного анализа
на наличие сульфаниламидных препаратов ("С" - стандартные растворы, "П" - исследуемые пробы)
12.1. Добавить по 0,05 см![]() стандартных растворов и подготовленных растворов исследуемых образцов в соответствующие лунки.
стандартных растворов и подготовленных растворов исследуемых образцов в соответствующие лунки.
12.2. Добавить по 0,05 см![]() разбавленного раствора конъюгата в каждую лунку.
разбавленного раствора конъюгата в каждую лунку.
12.3. Добавить по 0,05 см![]() раствора антител в каждую лунку, перемешать вручную, легкими круговыми движениями по поверхности стола, избегая попадания смеси в соседние лунки, и оставить на инкубацию в течение 2-х часов при комнатной температуре в пределах 20-25 °С.
раствора антител в каждую лунку, перемешать вручную, легкими круговыми движениями по поверхности стола, избегая попадания смеси в соседние лунки, и оставить на инкубацию в течение 2-х часов при комнатной температуре в пределах 20-25 °С.
12.4. Вылить жидкость из лунок, перевернуть рамку планшета и выбить капли жидкости, оставшиеся в лунках, путем энергичного троекратного постукивания рамки с лунками по столу, накрытому фильтровальной бумагой. Наполнить лунки 0,25 см![]() дистиллированной воды и снова опорожнить лунки. Выбейте капельки жидкости как описано выше. Повторите процедуру промывки лунок дистиллированной водой еще два раза.
дистиллированной воды и снова опорожнить лунки. Выбейте капельки жидкости как описано выше. Повторите процедуру промывки лунок дистиллированной водой еще два раза.
12.5. Добавить в каждую лунку по 0,05 см![]() субстрата и по 0,05 см
субстрата и по 0,05 см![]() хромогена. Осторожно перемешать и инкубировать при комнатной температуре в пределах 20-25 °С в течение 30 мин в темноте.
хромогена. Осторожно перемешать и инкубировать при комнатной температуре в пределах 20-25 °С в течение 30 мин в темноте.
12.6. Добавить в каждую лунку по 2 капли (0,1 см![]() ) стоп-реагента и перемешать вручную. В течение 60 мин после добавления стоп-реагента измерить оптическую плотность в каждой лунке при 450 нм ("бланк" или нулевое считывание по воздуху), используя фотометр планшетный.
) стоп-реагента и перемешать вручную. В течение 60 мин после добавления стоп-реагента измерить оптическую плотность в каждой лунке при 450 нм ("бланк" или нулевое считывание по воздуху), используя фотометр планшетный.
Примечание. При качественном анализе допускается использовать по одной лунке на каждую исследуемую пробу продукта и стандартного раствора.
13. Определение количества сульфаметазина в исследованных пробах
Определение количества сульфаметазина в исследованных пробах проводится аналогично описанному в п.8 определению количества антибиотиков тетрациклиновой группы.
Калибровочная кривая также строится в полулогарифмической системе координат и должна быть почти линейна в диапазоне концентраций сульфаметазина 1- 27 мкг/кг (пример - рис.5).
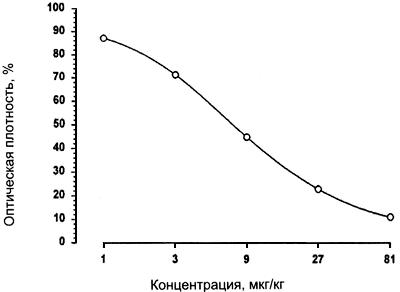
Рис.5. Образец калибровочной кривой для набора реагентов Ридаскрин Сульфаметазин
Для того чтобы вычислить концентрацию сульфаметазина в исследуемой исходной пробе, величину концентрации сульфаметазина, полученную по калибровочной кривой, следует умножить на соответствующий коэффициент разбавления. При выполнении пробоподготовки и анализа в полном соответствии с приведенной методикой коэффициент разбавления имеет следующие значения:
Молоко - 10;
Мясо - 2.
13.1. Обработка результатов
За окончательный результат измерения принимают среднее арифметическое результатов двух параллельных определений. Окончательный результат округляют до второго десятичного знака.
13.2. Учет результатов при качественном определении сульфаметазина в исследованных пробах
При качественном определении сульфаметазина результат определяется как положительный или отрицательный. Результат интерпретируется как отрицательный (концентрация сульфаметазина в исследуемом образце меньше 0,01 мг/кг), если оптическая плотность, измеренная в лунке с пробой, больше, чем порог интерпретации.
Порог интерпретации результата определяется как произведение оптической плотности лунки со стандартом N 4 на коэффициент, равный 1,2 (коэффициент 1,2 отражает потери сульфаметазина при упрощении пробоподготовки).
Результат интерпретируется как положительный (концентрация сульфаметазина в исследуемом образце больше 0,01 мг/кг) если оптическая плотность, измеренная в лунке с пробой, меньше, чем порог интерпретации.
14. Проведение испытаний с применением набора
"Ридаскрин Фаст Сульфаметазин"
14.1. Подготовка необходимых реагентов
14.1.1. Приготовление буфера N 1
Рекомендации по приготовлению буфера N 1 аналогичны приведенным в п.11.1.1.
14.2. Подготовка проб для анализа
Отбор проб для анализа ведется в соответствии с п.3. Образцы, предназначенные для анализа, должны храниться в холодильнике, в темном месте. Перед анализом пробы должны быть тщательно перемешаны.
14.3. Подготовка проб молока к исследованию
14.3.1. Обезжиренное молоко
Пробу обезжиренного молока смешать с буфером N 1, приготовленным в соответствии с п.11.1.1. в соотношении 1:1. Например, смешать 0,5 см![]() молока и 0,5 см
молока и 0,5 см![]() буфера N 1. Для анализа использовать 0,05 см
буфера N 1. Для анализа использовать 0,05 см![]() раствора на 1 лунку планшета.
раствора на 1 лунку планшета.
14.3.2. Молоко с содержанием жира 1% и более
Пробу молока объемом 5 см![]() охладить до температуры 8 °С, перенести в стеклянную центрифужную пробирку, центрифугировать при температуре 8-12 °С в течение 10 мин при 3000 g (см. примечание к п.7.1.1). При отсутствии центрифуги с охлаждением допускается предварительное охлаждение пробы перед центрифугированием до температуры 4 °С.
охладить до температуры 8 °С, перенести в стеклянную центрифужную пробирку, центрифугировать при температуре 8-12 °С в течение 10 мин при 3000 g (см. примечание к п.7.1.1). При отсутствии центрифуги с охлаждением допускается предварительное охлаждение пробы перед центрифугированием до температуры 4 °С.
Удалить верхний слой жира и перенести аликвоту обезжиренного молока в новую чистую пробирку и смешать с буфером N 1 в соотношении 1:1. Например, смешать 0,5 см![]() молока и 0,5 см
молока и 0,5 см![]() буфера N 1. Для анализа использовать 0,05 см
буфера N 1. Для анализа использовать 0,05 см![]() раствора на 1 лунку планшета.
раствора на 1 лунку планшета.
14.3.3. Молоко сырое
Пробу молока объемом 5 см![]() охладить, центрифугировать и удалить верхний слой жира согласно п.11.3.2, после чего перенести аликвоту обезжиренного молока в новую чистую пробирку и смешать с буфером N 1 в соотношении 1:3. Например, смешать 0,1 см
охладить, центрифугировать и удалить верхний слой жира согласно п.11.3.2, после чего перенести аликвоту обезжиренного молока в новую чистую пробирку и смешать с буфером N 1 в соотношении 1:3. Например, смешать 0,1 см![]() молока и 0,3 см
молока и 0,3 см![]() буфера N 1. Для анализа использовать 0,05 см
буфера N 1. Для анализа использовать 0,05 см![]() раствора на 1 лунку планшета.
раствора на 1 лунку планшета.
14.4. Приготовление реагентов для анализа
Построение калибровочной кривой необходимо проводить для каждой серии измерений в отдельности.
14.4.1. Приготовление стандартных растворов при количественном определении
сульфаметазина с использованием набора "Ридаскрин Фаст сульфаметазин"
Для приготовления стандартных растворов сульфаметазина концентраты растворов, входящие в состав набора, следует разбавить буферным раствором N 2 в нижеприведенных пропорциях. После разбавления необходимо тщательно перемешать готовые растворы. Для разбавления необходимо использовать только стеклянную посуду, нельзя использовать пластиковую посуду.
Для каждой серии исследований следует готовить свежие стандартные растворы:
|
Стандарт 1 (С1). Для приготовления стандарта 1 с концентрацией 0 мкг/л сульфаметазина 0,05 см |
|
Стандарт 2 (С2). Для приготовления стандарта 2 с концентрацией 5 мкг/л сульфаметазина 0,05 см |
|
Стандарт 3 (С3). Для приготовления стандарта 3 с концентрацией 15 мкг/л сульфаметазина 0,05 см |
|
Стандарт 4 (С4). Для приготовления стандарта 4 с концентрацией 45 мкг/л сульфаметазина 0,05 см |
|
Стандарт 5 (С5). Для приготовления стандарта 5 с концентрацией 135 мкг/л сульфаметазина 0,05 см |
14.3. Процедура анализа
Вставить в рамку планшета стрипы (лунки) в количестве, необходимом для выполнения всех запланированных определений. Записать координаты лунок, предназначенных для стандартных растворов и подготовленных исследуемых растворов. Пример формы записи приведен на рис.6.
|
С1 |
П4 |
П12 |
П20 |
П28 |
П36 |
|
С2 |
П5 |
П13 |
П21 |
П29 |
П37 |
|
С3 |
П6 |
П14 |
П22 |
П30 |
П38 |
|
С4 |
П7 |
П15 |
П23 |
П31 |
П39 |
|
С5 |
П8 |
П16 |
П24 |
П32 |
П40 |
|
П1 |
П9 |
П17 |
П25 |
П33 |
П41 |
|
П2 |
П10 |
П18 |
П26 |
П34 |
П42 |
|
П3 |
П11 |
П19 |
П27 |
П35 |
П43 |
Рис.6. Пример формы записи координат лунок перед выполнением анализа
("С" - стандартные растворы, "П" - исследуемые пробы)
14.3.1. Добавить по 0,05 см![]() стандартных растворов и подготовленных растворов исследуемых образцов в соответствующие лунки планшета.
стандартных растворов и подготовленных растворов исследуемых образцов в соответствующие лунки планшета.
14.3.2. Добавить по 0,05 см![]() раствора конъюгата в каждую лунку.
раствора конъюгата в каждую лунку.
14.3.3. Осторожно, избегая образования пены, перемешать раствор антител, встряхнув несколько раз флакон, после чего добавить по 0,05 см![]() раствора антител в каждую лунку, перемешать вручную, легкими круговыми движениями по поверхности стола, избегая попадания смеси в соседние лунки, и оставить на инкубацию в течение 10 мин (±1 мин) при комнатной температуре в пределах 20-25 °С.
раствора антител в каждую лунку, перемешать вручную, легкими круговыми движениями по поверхности стола, избегая попадания смеси в соседние лунки, и оставить на инкубацию в течение 10 мин (±1 мин) при комнатной температуре в пределах 20-25 °С.
14.3.4. Вылить жидкость из лунок, перевернуть рамку планшета и выбить капли жидкости, оставшиеся в лунках, путем энергичного троекратного постукивания рамки с лунками по столу, накрытому фильтровальной бумагой. Наполнить лунки 0,25 см![]() готового буфера N 1 и снова опорожнить лунки. Выбить капли жидкости, как описано выше. Повторить процедуру промывки буфером N 1 еще два раза.
готового буфера N 1 и снова опорожнить лунки. Выбить капли жидкости, как описано выше. Повторить процедуру промывки буфером N 1 еще два раза.
14.3.5. Добавить в каждую лунку по 2 капли (0,1 см![]() ) раствора хромогена/субстрата. Осторожно перемешать, как описано в п.14.3.3 и инкубировать при комнатной температуре в пределах 20-25 °С в течение 5 мин (±0,5 мин) в темноте. Не встряхивать планшет во время инкубации.
) раствора хромогена/субстрата. Осторожно перемешать, как описано в п.14.3.3 и инкубировать при комнатной температуре в пределах 20-25 °С в течение 5 мин (±0,5 мин) в темноте. Не встряхивать планшет во время инкубации.
14.3.6. Добавить в каждую лунку по 2 капли (0,1 см![]() ) стоп-реагента и перемешать вручную. В течение 10 мин после добавления стоп-реагента измерить оптическую плотность в каждой лунке при длине волны 450 нм ("бланк" или нулевое считывание по воздуху), используя фотометр планшетный.
) стоп-реагента и перемешать вручную. В течение 10 мин после добавления стоп-реагента измерить оптическую плотность в каждой лунке при длине волны 450 нм ("бланк" или нулевое считывание по воздуху), используя фотометр планшетный.
14.4. Определение количества сульфаметазина в исследованных пробах
Определение количества сульфаметазина в исследованных пробах проводится аналогично описанному в п.8 определению тетрациклина.
Калибровочная кривая также строится в полулогарифмической системе координат и должна быть почти линейна в диапазоне концентраций сульфаметазина 0,005-0,045 мг/кг (пример - рис.7).
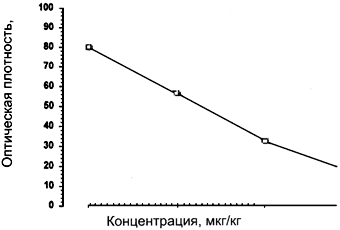
Рис.7. Образец калибровочной кривой для набора реагентов "Ридаскрин Фаст Сульфаметазин"
Для того, чтобы определить количество сульфаметазина в исследуемой исходной пробе, величину концентрации сульфаметазина, полученную по калибровочной кривой, следует умножить на соответствующий коэффициент разбавления. При выполнении пробоподготовки и анализа в соответствии с приведенной методикой коэффициент разбавления имеет следующие значения:
|
Обезжиренное молоко |
- 2 |
|||
|
Молоко с массовой долей жира 1% и более |
- 2 |
|||
|
Сырое молоко |
- 4 |
|||
15. Обработка результатов
15.1. За окончательный результат измерения принимают среднее арифметическое число результатов двух параллельных определений. Окончательный результат округляют до второго десятичного знака.
15.2. Метрологические характеристики иммуноферментного метода определения сульфаниламидных препаратов в продуктах питания животного происхождения (молоке, мясе) изложены в табл.2.
Таблица 2
|
Статистический параметр |
Соединение - сульфаметазин |
|
Нижний предел определения, мг/кг |
Мясо - 0,002 |
|
молоко - 0,01 | |
|
Интервал надежного определения, мг/кг |
0,01-0,1 |
|
Среднее значение открываемости (показатель правильности), % |
90±17 |
|
Допустимое расхождение между результатами двух параллельных определений сульфаметазина, полученными в одной лаборатории в одной серии измерений (сходимость), при |
8,0 |
|
Допустимое расхождение между результатами двух параллельных определений сульфаметазина, выполненных в двух разных лабораториях (воспроизводимость), при |
12,0 |