- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
САЛЬМОНЕЛЛЕЗОВ ЧЕЛОВЕКА И ЖИВОТНЫХ,ОБНАРУЖЕНИЕ САЛЬМОНЕЛЛ
В КОРМАХ, ПРОДУКТАХ ПИТАНИЯ И ОБЪЕКТАХ ВНЕШНЕЙ СРЕДЫ
(МЕТОДИЧЕСКИЕ УКАЗАНИЯ)
Методические указания разработаны Б.Л.Черкасским, С.Ш.Рожновой, Ю.Я.Тендетником (Всесоюзный центр по сальмонеллам Центрального научно-исследовательского института эпидемиологии Минздрава СССР); Б.И.Антоновым, В.В.Поповцевым (Центральная ветеринарная лаборатория Главного управления ветеринарии при Государственной комиссии Совета Министров СССР по продовольствию и закупкам); Б.Ю.Шустером (Всесоюзный государственный научно-контрольный институт ветеринарных препаратов); Ф.С.Киржаевым (Всесоюзный научно-исследовательский ветеринарный институт птицеводства).
Предназначены для специалистов лабораторий, занимающихся диагностикой сальмонеллезов и обнаружением сальмонелл в пищевых продуктах, кормах для животных и других объектах внешней среды.
Ответственные за выпуск: С.Ш.Рожнова и В.В.Поповцев.
Местным органам здравоохранения и ветеринарии разрешается размножить данные указания в необходимом количестве экземпляров.
1. ОБЩИЕ ПОЛОЖЕНИЯ
1.1. Сальмонеллезы - инфекционные заболевания человека, животных и птиц, вызываемые возбудителем рода Salmonella семейства Enterobacteriaceae. Этот род включает один вид, который подразделяют на семь подвидов. Патогенностью для теплокровных обладают в основном Сальмонеллы I и II подвидов, реже - остальных подвидов.
Несмотря на выраженную полипатогенность, в большинстве случаев у человека заболевание вызывает S. typhi, S. paratyphi A, S. paratyphi С; у крупного рогатого скота - S. dublin; у мелкого рогатого скота - S. abortusovis; у лошадей - S. abortusequi; у свиней - S. choleraesuis, S. typhisuis; у кур - S. gallinarum-pullorum и т.д. Некоторые виды сальмонелл без каких-либо клинических проявлений болезни могут в течение некоторого времени находиться в организме животного, способствуя обсеменению окружающей среды и продуктов животного происхождения. Чаще такое явление отмечают у птиц.
1.2. Сальмонеллы - грамотрицательные палочки, подвижные (кроме S. gallinarum-pullorum), при ферментации глюкозы выделяют газ (кроме S. typhi, S. typhisuis и некоторых штаммов других сероваров). Идентификацию сальмонелл внутри семейства энтеробактерий проводят с помощью биохимических тестов (приложение 1).
1.3. Сальмонеллы внутри рода идентифицируют по антигенной структуре, выявляемой в реакции агглютинации на стекле с монорецепторными О- и Н-агглютинирующими сыворотками.
У сальмонелл различают два основных антигенных комплекса: О-антиген - соматический и Н-антиген - жгутиковый (отсутствует у неподвижных штаммов). Последний имеет две фазы. Некоторые сальмонеллы обладают еще vi-антигеном.
В настоящее время известно более 2200 серологических вариантов сальмонелл, каждый из которых характеризуется определенной комбинацией О- и Н-антигенов, что позволяет определить серовар возбудителя.
1.4. Сальмонеллы достаточно устойчивы во внешней среде (рН 4-9, температурный режим 7-45 °С), способны длительно сохраняться в почве, навозе, воде и пищевых продуктах; хорошо растут на обычных питательных средах (оптимальная температура 37 °С, рН - 7,0-7,4). Кипячение убивает сальмонелл мгновенно, при 80 °С они сохраняют жизнеспособность до 15 мин.
1.5. Болезнь проявляется у человека в виде гастроинтестинальной и генерализованной форм. Кроме того, человек может быть носителем острого, транзиторного или хронического сальмонеллеза. У животных и птиц наблюдаются первичные и вторичные сальмонеллезы, а также сальмонеллоносительство.
2. ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ
Исследование на сальмонеллез проводят с целью диагностики заболеваний людей и животных, выявления сальмонеллоносительства, обсемененности объектов внешней среды, а также при расследовании вспышек заболеваний и анализе эпидемической и эпизоотической ситуации.
3. ВЗЯТИЕ И ПЕРЕСЫЛКА МАТЕРИАЛОВ ДЛЯ ИССЛЕДОВАНИЯ
3.1. Для исследования на наличие сальмонелл у человека отбирают испражнения, рвотные массы и промывные воды желудка, кровь, мочу, а при наличии специальных показаний - желчь, дуоденальное содержимое, спинномозговую жидкость и секционный материал.
3.2. Для бактериологического исследования от трупов животных отбирают паренхиматозные органы или части их (печень с желчным пузырем и лимфатическими узлами, селезенку, почку, мезентериальные лимфатические узлы, трубчатую кость, сердце, перевязанное лигатурой у основания аорты). Погибшие в 12-18-дневном возрасте эмбрионы птиц (до 30 шт.) и павшую птицу (до 10 гол.), абортированные плоды с плодовыми оболочками и околоплодной жидкостью, а также свежие трупы мелких животных направляют в лабораторию целиком. При подозрении на хроническую форму кроме перечисленных органов от телят берут измененные участки легких, от кур - измененные фолликулы яичника.
Для установления сальмонеллоносительства исследуют печень, селезенку, фолликулы.
Материалом для прижизненной диагностики служат фекалии больных животных.
3.3. Объектами исследования являются и остатки пищи, употребляемой заболевшими, а также исходные продукты и полуфабрикаты, которые использовали при ее приготовлении; суточные пробы готовой пищи, корма животного и растительного происхождения, смывы с различного оборудования и других предметов, подозреваемых в качестве источника или фактора передачи возбудителя.
3.4. Патологический материал следует доставлять в лабораторию в возможно короткий срок, но не позднее 12 ч после отбора, испражнения (фекалии) - не позднее 3-4 ч; кровь высевают у постели больного.
В случае невозможности доставки в установленные сроки материал посылают в консервированном виде (приложение 3). Консервированный материал до исследования хранят при 4-6 °С не более 24 ч. Патологический материал от животных допускается направлять в замороженном виде - в термосе со льдом.
При отборе проб необходимо исключить возможность контаминации их за счет смежных областей кожи, других органов, внешней среды и т.п.
3.4.1. Испражнения (фекалии) собирают сразу после дефекации (у животных - из последней порции) с помощью стерильной стеклянной палочки или деревянного шпателя. При наличии патологических примесей (слизь, кровь, гной и т.п.) их включают в отбираемую пробу. В случае невозможности получения испражнений после дефекации материал берут непосредственно из прямой кишки с помощью ректального тампона, вводя его в кишку на 8-10 см.
При профилактических обследованиях здоровых лиц на сальмонеллоносительство накануне взятия испражнений для исследования можно применить солевое слабительное (25-30 г магнезии сульфата - MgSО ), растворенное в теплой воде. Не принимается для исследования на сальмонеллоносительство материал, взятый на дому в отсутствие медицинского работника.
), растворенное в теплой воде. Не принимается для исследования на сальмонеллоносительство материал, взятый на дому в отсутствие медицинского работника.
3.4.2. Кровь для исследования берут в начале заболевания, а также повторно в период лихорадки или в разгар рецидивов стерильным шприцем из локтевой вены в объеме 2-10 мл (в зависимости от возраста); в более поздние сроки или при слабовыраженной клинической картине - 15-20 мл. Взятую кровь высевают у постели больного.
У детей до одного года кровь берут в доступных количествах из пальца, пятки или мочки уха.
3.4.3. Рвотные массы и промывные воды желудка отбирают при заболевании, сопровождающемся соответствующей симптоматикой, в объеме до 100 мл. Для исследования используют первые порции промывных вод, полученные без применения дезинфицирующих средств.
В случае кислой реакции рвотных масс их перед посевом нейтрализуют 10%-ным раствором бикарбоната натрия, промывные воды центрифугируют 15 мин при 3000 об/мин и в дальнейшем используют осадок. В случае невозможности центрифугирования допускается высев нативного материала.
3.4.4. Желчь (дуоденальное содержимое) собирают в стерильные пробирки. При этом отдельно собирают дуоденальное содержимое, пузырную желчь и желчь из желчных протоков (порции А, В и С соответственно).
Кислая реакция, белесоватый оттенок, наличие хлопьев свидетельствуют о примеси желудочного сока и делают материал непригодным для бактериологического исследования.
3.4.5. Мочу для исследования собирают после тщательного туалета. Первую порцию мочи не берут для анализа, остальную в количестве 20-30 мл собирают в стерильную посуду и доставляют в лабораторию. Мочу центрифугируют 15 мин при 3000 об/мин. Для исследования используют осадок. Допускается высев нативного материала.
3.4.6. Спинномозговая жидкость подлежит исследованию при наличии менингеального или менингоэнцефалитического синдромов.
Пробу (3-5 мл) помещают в стерильную пробирку и доставляют в лабораторию, предохраняя материал от замораживания (можно использовать термос).
3.4.7. Операционный и секционный материал для исследования отбирают в случае необходимости при оперативных вмешательствах или на месте вскрытия. Масса пробы должна быть не менее 20 г.
3.4.8. Остатки консервов направляют в лабораторию непосредственно в той банке, из которой их использовали в пищу. При отсутствии остатков консервов исследованию подлежит содержимое 2-5 невскрытых банок с аналогичной маркировкой.
3.4.9. Мелкую рыбу отбирают в количестве 2-3 шт., у крупной вырезают 3-4 куска из спинки, ближе к голове, и из участков около анального отверстия общей массой не менее 200 г.
3.4.10. Солонину и соленые продукты, находящиеся в бочечной таре, берут сверху, из середины и со дна бочки. Общая масса пробы должна быть не менее 200 г. В отдельную посуду набирают 100-200 мл рассола.
3.4.11. Пробы жидких и полужидких продуктов и кормов (супы, соусы, заменитель цельного молока - ЗЦМ) отбирают после тщательного перемешивания в количестве около 200 г.
Молочные продукты заводского приготовления доставляют в лабораторию в оригинальной упаковке, прочие - в объеме до 200 мл.
3.4.12. Суточные пробы направляют для исследования непосредственно в той посуде, в которой они хранились в холодильнике. Остатки фактически употребленной пищи отбирают в той посуде, в которой их обнаружили.
Допускается доставка этих проб в стерильных банках, куда их перекладывают с соблюдением асептики.
3.4.13. Пробы мяса животных для исследования отбирают по ГОСТ 21237-75 "Мясо. Методы бактериологического анализа", мяса птицы - по ГОСТ 7702.2-74 "Мясо птицы. Методы бактериологического анализа".
3.4.14. Яйца отбирают по 5 шт. из шести разных мест обследуемой партии; в первую очередь берут яйца, хранившиеся более 7 дней.
3.4.15. При отборе проб яичного порошка руководствуются ГОСТ 2858-82 "Яичный порошок", меланжа - ОСТ 49197-83 "Продукты яичные мороженые".
3.4.16. Отбор проб комбикормов и сырья, используемого при его производстве (кроме зерна), проводят по ГОСТ 13496.0-80 "Комбикорма, сырье. Методы отбора проб", зерна - по ГОСТ 13586.3-83 "Зерно. Правила приемки и методы отбора проб", мясокостной муки - по ГОСТ 25311-82 "Мука кормовая животного происхождения. Методы бактериологического анализа".
3.4.17. Для исследования сухого ЗЦМ отбирают из пяти мешков одной партии по 80-100 г продукта, который тщательно перемешивают и помещают в стерильную банку. Всего отбирают 4-5 сборных проб ЗМЦ.
3.4.18. Отбор проб смывов осуществляют стерильными ватными или ватно-марлевыми тампонами. Тампоны монтируют на деревянной палочке или проволоке, пропущенной через пробку, помещают в пробирку и стерилизуют 30 мин при температуре 120 °С. Затем в каждую пробирку наливают 2 мл предварительной среды обогащения - забуференной пептонной воды рН 7,0 (приложение 3). Непосредственно перед взятием смыва тампон увлажняют, наклоняя пробирку, излишек влаги отжимают о стенку пробирки.
Смывы берут с площади не менее 100 см , если нет специальных указаний для данного объекта.
, если нет специальных указаний для данного объекта.
При взятии смывов с яичной скорлупы один тампон используют для исследования 10 яиц.
3.4.19. При отборе стоков животноводческих объектов смывы делают со стенок и дна навозного желоба у приямка, как указано в п.3.4.18.
При наличии гидросмыва тампон, не увлажняя предварительной средой обогащения, погружают в жидкую навозную массу на 2-3 мин, после чего помещают в пробирку с 2 мл предварительной среды обогащения.
3.4.20. Порядок отбора смывов, перечень объектов, с которых их отбирают, и материал, подлежащий исследованию, на предприятиях, производящих, перерабатывающих, хранящих и реализующих животноводческую продукцию, приведен в приложении 9.
3.5. Материал, подлежащий исследованию, помещают в стерильную посуду (банки, пробирки, флаконы), новые полиэтиленовые пакеты, стерильную пергаментную бумагу, тщательно укупоривают и упаковывают.
Пробы можно брать в стаканы или банки, прокипяченные 15 мин. Обработка посуды дезинфицирующими средствами не допускается.
Каждую пробу снабжают этикеткой с наименованием материала и источника его получения (фамилия обследуемого, хозяйство, ферма и т.д.).
В сопроводительном документе необходимо указать, какое учреждение направляет материал, фамилию, имя, отчество и возраст обследуемого, место работы (для детей - название детского учреждения или школы), дату заболевания, предполагаемый диагноз или показания к обследованию, дату и час взятия пробы материала, фамилию и должность лица, посылающего материал. При направлении проб продуктов и объектов внешней среды дополнительно указывают, какой из продуктов подозревается в качестве причины заболевания.
Сопроводительные документы к материалу о животных составляют в соответствии с действующими "Правилами взятия патологического материала, крови, кормов и пересылки их для лабораторного исследования".
4. МИКРОБИОЛОГИЧЕСКИЙ МЕТОД ИССЛЕДОВАНИЯ
4.1. Подготовка материалов к исследованию
Доставленные в лабораторию пробы высевают в пробирки (колбы) со средой обогащения и на чашки Петри с дифференциально-диагностическими средами.
Исследуемый материал, высеваемый на чашки Петри, растирают шпателем по всей поверхности среды.
Засеянные пробирки и чашки помещают в термостат при 37 °С на 16-20 ч.
4.1.1. Операционный и секционный материал массой не менее 20 г растирают в ступках и высевают в одну из сред обогащения (предпочтительнее селенитовую или магниевую) в отношении 1:5. Допускается одновременный высев суспензии материала в среду обогащения и на дифференциально-диагностические среды.
4.1.2. При диагностике сальмонеллезов животных исследуемый материал - паренхиматозные органы (кроме печени), кровь, желчь, костный мозг, содержимое фолликулов яичников кур, околоплодную жидкость абортированного плода, хориоаллантоисную жидкость и содержимое желточного мешка замерших эмбрионов - высевают пастеровской пипеткой непосредственно на чашки Петри с одной из дифференциально-диагностических сред (приложение 3).
Печень (целиком или не менее 20 г) растирают в ступке с небольшим количеством физиологического раствора; 0,1 г полученной суспензии высевают на дифференциально-диагностические среды и одновременно на МПА и в МПБ.
В связи с тем что S. abortusovis плохо растет на обычных питательных средах, высевы из абортированных плодов овец необходимо делать также и на сывороточно-глюкозные среды.
При исследовании на сальмонеллоносительство животных и реагирующей по кровекапельной реакции непрямой гемагглютинации (ККРНГА) птицы, выявленной в порядке эпизоотологического надзора, суспензию материалов и органов высевают в одну из сред обогащения (п.4.1.1).
Одновременно проводят микроскопическое исследование методом световой микроскопии. Мазки-отпечатки делают из тех же органов и окрашивают по Граму.
4.1.3. Клинический материал высеивают на две-три дифференциально-диагностические среды (комбинируя высоко- и низкоселективные среды) и в пробирки со средой обогащения одновременно.
Испражнения, доставленные в фосфатно-буферном растворе, высевают в среду обогащения двойной концентрации в соотношении 1:1. Фекалии, доставленные в глицериновом консерванте, высевают на обычную среду обогащения в соотношении 1:5. Испражнения, доставленные без консерванта, суспендируют в среде обогащения в соотношении 1:5. Из суспензии делают высев на дифференциально-диагностические среды, оставшуюся часть инкубируют в термостате.
Кровь, взятую из вены, высевают в среду Рапопорт или 10-20%-ный желчный бульон в соотношении 1:10. После 16-20 ч инкубирования делают высев на одну из селективных сред. При отрицательном результате делают повторные посевы на 3-и, 4-, 6- и 10-е сутки.
Рвотные массы, осадки промывных вод желудка и мочи после центрифугирования высевают в среды обогащения. В случае исследования материала без центрифугирования посев проводят в среду обогащения двойной концентрации в соотношении 1:1 и после 16-20 ч инкубирования делают высев на дифференциально-диагностические среды.
Каждую фракцию желчи (дуоденального содержимого) высевают во флаконы со слабощелочным бульоном в соотношении 1:10 и на дифференциально-диагностические среды. Через 16-20 ч из флаконов осуществляют высев на дифференциально-диагностические среды. В случае получения отрицательных результатов высев повторяют на 3-и, 5-, 7-е сутки, используя среды слабой селективности. Спинномозговую жидкость высевают в желчный бульон для обогащения и на слабоселективные среды.
4.1.4. При исследовании проб продуктов и кормов делают навеску массой 25 г.
Пищевые продукты, бактериологическое исследование которых проводят в соответствии с требованиями "Микробиологических нормативов и методов анализа продуктов детского, лечебного и диетического питания и их компонентов" (М., 1988), "Нормативов и методов микробиологического контроля продуктов детского питания, изготовленных на молочных кухнях системы здравоохранения" (М., 1988), "Медико-биологических требований к качеству продовольственного сырья и пищевых продуктов" (М., 1989), берут для исследования в количестве, предусмотренном в указанных документах.
Пробы пищевых продуктов высевают в предварительную среду обогащения в соотношении 1:5, кормов - 1:5-1:10 в зависимости от способности к набуханию.
Продукты плотной консистенции гомогенизируют с небольшим количеством предварительной среды обогащения, которую затем добавляют в количестве, обеспечивающем соотношение 1:5.
Крем, сливочное масло, мороженое и т.п. перед посевом расплавляют в водяной бане.
Жидкие объекты, имеющие кислую реакцию, перед посевом нейтрализуют 10%-ным стерильным раствором бикарбоната натрия до слабощелочной реакции.
При исследовании яиц скорлупу обрабатывают спиртом и обжигают, после чего яйца разбивают и отделяют желток в стерильную посуду, объединяя пять желтков одной пробы. Желтки гомогенизируют и используют для посева.
Пробы мяса животных и птиц, яичного порошка, меланжа и консервы в закрытых банках исследуют согласно действующим ГОСТам.
Пробы кормов в предварительной среде обогащения инкубируют 5 ч в термостате, после чего взбалтывают, отстаивают. Надосадочную жидкость пересевают в соотношении 1:5 во вторую среду обогащения (любая среда из приведенных в приложении 3) и помещают в термостат. Разбухшие корма растительного происхождения заливают второй средой обогащения так, чтобы она покрыла поверхность пробы.
4.1.5. Смывы, помещенные в предварительную среду обогащения, инкубируют в термостате.
4.2. Операционный и секционный материал из среды обогащения после инкубирования в термостате пересевают на дифференциально-диагностические среды.
Посевы проб продуктов и смывов в предварительной среде обогащения после инкубирования в термостате пересевают во вторую среду обогащения: 10 мл среды, засеянной пробой продукта, вносят в колбу с 90 мл второй среды обогащения, а в пробирку с посевом смыва добавляют 10 мл этой среды.
Для исследования молока лучше использовать среду Мюллера.
При расследовании вспышек болезни целесообразно проводить параллельный высев исследуемого материала на две среды обогащения.
Через сутки инкубирования в термостате делают высев из второй среды обогащения на дифференциально-диагностические среды.
4.3. Посевы на дифференциально-диагностических средах инкубируют в термостате 18-20 ч при температуре 37 °С, после чего просматривают невооруженным глазом или с помощью лупы в проходящем дневном или искусственном свете (посевы на чашках Петри с висмут-сульфитным агаром просматривают в падающем свете) и отмечают колонии, по морфологическим свойствам похожие на сальмонеллезные.
При этом имеют в виду, что сальмонеллы на средах Эндо и Плоскирева растут в виде прозрачных колоний, на среде Левина - голубоватых, на висмут-сульфитном агаре - черных колоний с характерным металлическим блеском, при этом наблюдается прокрашивание в черный цвет участка среды под колонией. Исключение составляют S. paratyhi A, S. choleraesuis, S. abortusovis, S. gallinarum-pullorum и некоторые другие, которые при работе на висмут-сульфитном агаре образуют нежные светло-зеленые колонии.
Подозрительные колонии (не менее трех) пересеивают в пробирки со скошенным МПА или одной из комбинированных сред - Олькеницкого, Клиглера, Ресселя (приложение 3).
В случаях чрезвычайной эпидемической ситуации при наличии подозрительных колоний в посевах из продуктов и смывов параллельно с пересевом на комбинированную среду проводят высев на МПА для последующей постановки реакции агглютинации. Результаты этой реакции ориентировочны и требуют подтверждения на этапе завершения биохимической идентификации.
Одновременно изучают морфологию и тинкториальные свойства бактерий, готовя мазки и окрашивая их по Граму.
При отсутствии подозрительных колоний чашки Петри с висмут-сульфитным агаром оставляют в термостате еще на 24 ч, после чего просматривают и при обнаружении подозрительных колоний продолжают исследование.
В противном случае работу с посевами прекращают.
4.4. Посевы на комбинированной среде инкубируют 16-20 ч при температуре 37 °С. Затем изучают изменение среды.
Для дальнейшей работы отбирают колонии уреазонегативных бактерий, ферментирующих глюкозу, неферментирующих сахарозу и образующих сероводород. Такие культуры пересевают со среды Олькеницкого в среду Гисса с маннитом, 1%-ную пептонную воду для определения образования индола и в полужидкий агар для определения подвижности.
При высеве подозрительных колоний на МПА делают пересев в среды Гисса с глюкозой, лактозой, сахарозой и маннитом, с сернокислым железом, с мочевиной, в 1%-ную пептонную воду, полужидкий агар.
При высеве на среду Ресселя исключают пересев на среды Гисса с глюкозой и лактозой, при высеве на среду Клиглера, кроме того, на среду с сернокисльм железом.
Дополнительно делают высев на МПА для постановки реакции агглютинации.
При обнаружении изменений комбинированной среды, позволяющих заподозрить наличие сальмонелл, дальнейшее исследование материалов от человека проводят согласно таблице (приложение 4).
4.5. При выделении культур, имеющих ферментативные свойства, характерные для представителей рода сальмонелл (приложение 1), изучают их антигенную структуру в реакции агглютинации на стекле с О- и Н-агглютинирующими диагностическими сальмонеллезными сыворотками (приложение 5, 6), а также биовары (приложение 10).
По результатам реакции агглютинации дают ответ, исследование прекращают.
4.6. Ход работы при исследовании различных материалов дан в схемах (рис.1-6).
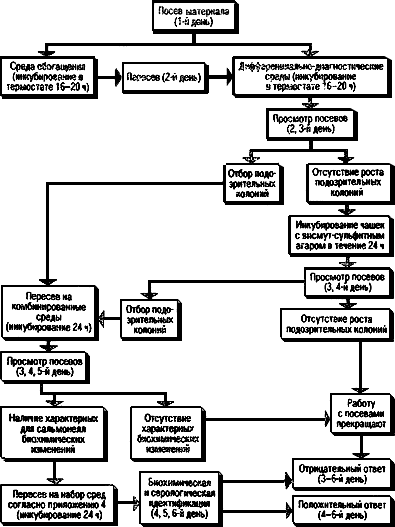
Рис.1. Схема исследования операционного и секционного материала, рвотных масс, мочи,
спинно-мозговой жидкости и органов от животных на сальмонеллоносительство
5. СЕРОЛОГИЧЕСКИЙ МЕТОД ИССЛЕДОВАНИЯ
5.1. Исследование крови человека на сальмонеллез проводят с целью диагностики, а также выявления и дифференциации различных форм бактерионосительства в реакции пассивной гемаглютинации с цистеиновой пробой (приложение 8).
5.2. Для обнаружения у кур антител к возбудителю пуллороза-тифа и другим сальмонеллам группы D используют эритроцитарный антиген в соответствии с наставлением по его применению в кровекапельной реакции непрямой геммагглютинации (приложение 7).
6. ЛАБОРАТОРНЫЙ НАДЗОР ЗА СИТУАЦИЕЙ ПО САЛЬМОНЕЛЛЕЗАМ
В целях эпидемиологического и эпизоотологического надзора за сальмонеллезами человека и животных проводят плановые исследования объектов с учетом особенностей и специфики каждого объекта, эпидемиологической ситуации, результатов лабораторных исследований пищевых продуктов и объектов внешней среды.
Перечень объектов, исследуемых материалов и кратность исследования приведены в приложении 9.
7. ОРГАНИЗАЦИЯ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ ПРИ ВЫЯСНЕНИИ
ВОЗНИКНОВЕНИЯ ГРУППОВЫХ ЗАБОЛЕВАНИЙ САЛЬМОНЕЛЛЕЗАМИ
7.1. При возникновении подозрения на групповое заболевание сальмонеллезом (большое число заболевших, повышение заболеваемости в ограниченный период времени, установление в анамнезе общего источника инфекции, выделение от пострадавших определенного серовара сальмонелл и т.п.) осуществляют эпидемиологическое расследование, которое включает углубленный эпидемиологический анализ и обследование (включая лабораторные исследования) возможных источников инфекции.
Если в ходе эпидемиологического расследования возникло подозрение, что возможным источником инфекции могут являться сельскохозяйственные животные или птицы, работники санитарно-эпидемиологических станций информируют о создавшейся ситуации представителей государственной ветеринарной службы района, откуда поступили продукты животного происхождения. Дальнейшее расследование проводят совместно обе службы.
В спорных случаях отбор проб продуктов животноводства и на животноводческих объектах, подозреваемых в качестве источника или фактора передачи сальмонелл, ведут совместно специалисты санитарно-эпидемиологической и ветеринарной служб. Исследование таких материалов, идентификация возбудителя и выдача заключения по результатам исследования также ведется совместно на базе бактериологической лаборатории санитарно-эпидемиологической станции или ветеринарной лаборатории в соответствии с требованиями настоящих методических указаний.
Результаты эпидемиологического, эпизоотологического расследования и лабораторных исследований обобщают и делают заключение о роли определенных источников и факторов передачи инфекции в возникновении вспышки сальмонеллеза.
Разрабатывают комплекс противоэпидемических и противоэпизоотических мероприятий, направленный на ликвидацию заболевания.
ПРИЛОЖЕНИЯ
ПРИЛОЖЕНИЕ 1
Дифференциация родов семейства Enterobacteriaceae по биохимическим тестам
|
Род |
Ин- |
Ме- |
Фо- |
Цит- |
Се- |
Мо- |
Фе- |
Ли- |
Ар- |
Ор- |
Под- |
Же- |
Ма- |
Газ из глю- |
Лак- |
Са- |
Ман- |
Дуль- |
Са- |
Адо- |
Ино- |
Сор- |
Ра- |
Рам- |
|
Citrobacter amalonaticus |
+ |
+ |
- |
р |
- |
р |
- |
- |
p |
+ |
+ |
- |
p |
+ |
p |
p |
+ |
- |
p |
- |
- |
+ |
- |
+ |
|
Citrobacter diversus |
+ |
+ |
- |
+ |
- |
p |
- |
- |
p |
+ |
+ |
- |
+ |
+ |
p |
p |
+ |
p |
p |
+ |
- |
+ |
- |
+ |
|
Citrobacter freundii |
- |
+ |
- |
+ |
p |
p |
- |
- |
p |
p |
+ |
- |
p |
+ |
p |
p |
+ |
p |
- |
- |
- |
+ |
p |
+ |
|
Edwardsiella hoshinae |
p |
+ |
- |
- |
- |
- |
- |
+ |
- |
+ |
+ |
- |
+ |
p |
- |
+ |
+ |
- |
p |
- |
- |
- |
- |
- |
|
Edwardsiella ictaluri |
- |
- |
- |
- |
- |
- |
- |
+ |
- |
p |
- |
- |
- |
p |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Eswardsiella tarda |
+ |
+ |
- |
- |
p |
- |
- |
+ |
- |
+ |
+ |
- |
- |
p |
- |
p |
p |
- |
- |
- |
- |
- |
- |
- |
|
Enterobacter aerogenes |
- |
- |
+ |
+ |
- |
- |
- |
+ |
- |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
+ |
|
Enterobacter cloacae |
- |
- |
+ |
+ |
- |
p |
- |
- |
+ |
+ |
+ |
- |
p |
+ |
+ |
+ |
+ |
p |
p |
p |
p |
+ |
+ |
+ |
|
Enterobacter sakazakii |
p |
p |
+ |
+ |
- |
- |
p |
- |
+ |
+ |
+ |
- |
p |
+ |
+ |
+ |
+ |
- |
+ |
- |
p |
- |
+ |
+ |
|
Esсherichia |
+ |
+ |
- |
- |
- |
- |
- |
p |
p |
p |
p |
- |
- |
+ |
+ |
p |
+ |
p |
p |
- |
- |
+ |
p |
p |
|
Hafnia alvei |
- |
p |
p |
- |
- |
- |
- |
+ |
- |
+ |
+ |
- |
p |
+ |
- |
- |
+ |
- |
p |
- |
- |
- |
- |
+ |
|
Klebsiella oxytoca |
+ |
p |
+ |
+ |
- |
+ |
- |
+ |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
p |
+ |
+ |
+ |
+ |
+ |
+ |
|
Klebsiella pneumoniae subsp. ozaenae |
- |
+ |
- |
p |
- |
- |
- |
p |
- |
- |
- |
- |
- |
p |
p |
p |
+ |
- |
+ |
+ |
p |
p |
+ |
p |
|
Klebsiella pneumoniae subsp. pneumoniae |
- |
p |
+ |
+ |
- |
+ |
- |
+ |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
p |
+ |
+ |
+ |
+ |
+ |
+ |
|
Klebsiella pneumoniae subsp. |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
p |
+ |
- |
+ |
+ |
+ |
+ |
p |
+ |
|
Morganella morganii |
+ |
+ |
- |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
- |
- |
p |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Proteus |
- |
+ |
p |
p |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
+ |
- |
p |
- |
- |
- |
- |
- |
- |
- |
- |
|
Proteus myxofaciens |
- |
+ |
+ |
p |
- |
+ |
+ |
- |
- |
- |
+ |
+ |
- |
+ |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
|
Proteus vulgaris |
+ |
+ |
- |
p |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
- |
p |
- |
+ |
- |
- |
p |
- |
- |
- |
- |
- |
|
Salmonella I |
- |
+ |
- |
+ |
+ |
- |
- |
+ |
p |
+ |
+ |
- |
- |
+ |
- |
- |
+ |
+ |
- |
- |
p |
+ |
- |
+ |
|
Salmonella II |
- |
+ |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
- |
- |
+ |
+ |
- |
- |
p |
+ |
- |
+ |
|
Salmonella Ill-Arizona |
- |
+ |
- |
+ |
+ |
- |
- |
+ |
p |
+ |
+ |
- |
+ |
+ |
p |
- |
+ |
- |
- |
- |
- |
+ |
- |
+ |
|
Salmonella IV |
- |
+ |
- |
+ |
+ |
- |
- |
+ |
p |
+ |
+ |
- |
- |
+ |
- |
- |
+ |
- |
p |
- |
p |
+ |
- |
+ |
|
Serratia liquefaciens |
- |
p |
p |
+ |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
p |
- |
+ |
+ |
- |
+ |
- |
p |
p |
+ |
p |
|
Serratia marcescens |
- |
p |
+ |
+ |
- |
p |
- |
+ |
- |
+ |
+ |
+ |
- |
p |
- |
+ |
+ |
- |
+ |
p |
p |
+ |
- |
- |
|
Shigella boydii |
p |
+ |
- |
- |
- |
- |
- |
- |
p |
- |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
p |
- |
- |
|
Shigella dysenteriae |
p |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
p |
- |
p |
|
Shigella flexneri |
p |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
p |
p |
- |
|
Shigella sonnei |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
p |
Примечание. (+) - положительный результат у 90% штаммов; (-) - отрицательный результат у 90% штаммов; р - различные реакции у разных штаммов.
ПРИЛОЖЕНИЕ 2
Схема Кауфмана-Уайта (сокращенная). Антигенные формулы Salmonella
|
Серовар |
Соматический антиген (О) |
Жгутиковый антиген (Н) | |
|
фаза 1 |
фаза 2 | ||
|
Группа А (О2) | |||
|
S. paratyphi A |
1, 2, 12 |
а |
(1, 5) |
|
S. kiel |
1, 2, 12 |
g, р |
- |
|
Группа В (О4) | |||
|
S. kisangani |
1, 4, (5), 12 |
а |
1, 2 |
|
S. hessarek |
4, 12, 27 |
а |
1, 5 |
|
S. fulica |
4, (5), 12 |
а |
1, 5 |
|
S. arechavaleta |
4, (5), 12 |
а |
1, 7 |
|
S. bispebjerg |
1, 4, (5), 12 |
а |
e, n, x |
|
S. abortusequi |
4, 12 |
- |
e, n, x |
|
S. tinda |
1, 4, 12, 27 |
а |
e, n, z |
|
S. paratyphi В (S. schottmuelleri) |
1, 4, (5), 12 |
b |
1, 2 |
|
S. java |
1, 4, (5), 12 |
b |
(1, 2) |
|
S. limete |
1, 4, 12, 27 |
b |
1, 5 |
|
S. canada |
4, 12 |
b |
1, 6 |
|
S. uppsala |
4, 12, 27 |
b |
1, 7 |
|
S. II sofia |
1, 4, 12, 27 |
b |
(e, n, x) |
|
S. abony |
1, 4, (5), 12, 27 |
b |
e, n, x |
|
S. abortusbovis |
1, 4, 12, 27 |
b |
e, n, x |
|
S. wagenia |
1, 4, 12, 27 |
b |
e, n, z |
|
S. schleissheim |
4, 12, 27 |
b |
- |
|
S. wien |
1, 4, 12, 27 |
b |
l, w |
|
S. legon |
1, 4, 12, 27 |
с |
1, 5 |
|
S. abortusovis |
4, 12 |
с |
1, 6 |
|
S. altendort |
4, 12, 27 |
с |
1, 7 |
|
S. bury |
4, 12, 27 |
с |
z |
|
S. stanley |
1, 4, (5), 12, 27 |
d |
1, 2 |
|
S. schwarzengrund |
1, 4, 12, 27 |
d |
1, 7 |
|
S. duisburg |
1, 4, 12, 27 |
d |
e, n, z |
|
S. salinatis |
4, 12 |
d, e, h |
d, e, n, z |
|
S. saintpaul |
1, 4, (5), 12 |
e, h |
1, 2 |
|
S. reading |
1, 4, (5), 12 |
e, h |
1, 5 |
|
S. kaapstad |
4, 12 |
e, h |
1, 7 |
|
S. chester |
1, 4, (5), 12 |
e, h |
e, n, x |
|
S. san-diego |
4, (5), 12 |
e, h |
e, n, z |
|
S. derby |
1, 4, (5), 12 |
f, g |
(1, 2) |
|
S. agona |
1, 4, 12 |
f, g, s |
- |
|
S. essen |
4, 12 |
g, m |
- |
|
S. II caledon |
1, 4, 12, 27 |
g, m, (s), t |
e, n, x |
|
S. hato |
4, (5), 12 |
g, m, s |
- |
|
S. california |
4,12 |
g, m, t |
- |
|
S. kingston |
1, 4, (5), 12, 27 |
g, s, t |
(1, 2) |
|
S. budapest |
1, 4, 12, 27 |
g, t |
- |
|
S. banana |
4, (5), 12 |
m, t |
1, 5 |
|
S. typhimurium |
1, 4, (5), 12 |
i |
1, 2 |
|
S. lagos |
1, 4, (5), 12 |
i |
1, 5 |
|
S. agama |
4, 12 |
i |
1, 6 |
|
S. gloucester |
1, 4, 12, 27 |
i |
l, w |
|
S. texas |
4, (5), 12 |
k |
e, n, z |
|
S. fyris |
4, 5, 12 |
l, v |
1, 2 |
|
S. azteca |
4, (5), 12, 27 |
l, v |
1, 5 |
|
S. bredeney |
1, 4, 12, 27 |
l, v |
1, 7 |
|
S. kimuenza |
1, 4, 12, 27 |
l, v |
e, n, x |
|
S. brandenburg |
1, 4, 12 |
l, v |
l, n, z |
|
S. togo |
4, 12 |
l, w |
1, 6 |
|
S. vom |
1, 4, 12, 27 |
e, z |
l, n, z |
|
S. kunduchi |
1, 4, (5), 12, 27 |
e, z |
1, 2 |
|
S. heidelberg |
1, 4, (5), 12 |
r |
1, 2 |
|
S. bradford |
4, 12, 27 |
r |
1, 5 |
|
S. remo |
1, 4, 12, 27 |
r |
1, 7 |
|
S. southampton |
1, 4, 12, 27 |
r |
z |
|
S. africana |
4, 12 |
r, i |
l, w |
|
S. coeln |
4, (5), 12 |
y |
1, 2 |
|
S. teddington |
1, 4, 12, 27 |
y |
1, 7 |
|
S. ball |
1, 4, (5), 12, 27 |
y |
e, n, x |
|
S. jos |
1, 4, 12, 27 |
y |
e, n, z |
|
S. shubra |
4, (5), 12 |
z |
1, 2 |
|
S. kiambu |
4, 12 |
z |
1, 5 |
|
S. indiana |
1, 4, 12 |
z |
1, 7 |
|
S. preston |
1, 4, 12 |
z |
l, w |
|
S. entebbe |
1, 4, 12, 27 |
z |
z |
|
S. II nordenham |
1, 4, 12, 27 |
z |
e, n, x |
|
S. stanleyville |
1, 4, (5), 12, 27 |
z |
(1, 2) |
|
S. kalamu |
4, 12 |
z |
(1, 5) |
|
S. haifa |
1, 4, (5), 12 |
z |
1, 2 |
|
S. ituri |
1, 4, 12 |
z |
1, 5 |
|
S. fortune |
1, 4, 12, 27 |
z |
z |
|
S. brancaster |
1, 4, 12, 27 |
z |
- |
|
Группа C | |||
|
S. san-juan |
6, 7 |
a |
1, 5 |
|
S. austin |
6, 7 |
a |
1, 7 |
|
S. denver |
6, 7 |
а |
е, n, z |
|
S. brazzaville |
6, 7 |
b |
1, 2 |
|
S. edinburg |
6, 7 |
b |
1, 5 |
|
S. georgia |
6, 7 |
b |
е, n, z |
|
S. leopoldville |
6, 7 |
b |
z |
|
S. paratyphi С |
6, 7(vi) |
с |
1, 5 |
|
S. choleraesuis |
6, 7 |
(с) |
1, 5 |
|
S. typhisuis |
6, 7 |
с |
1, 5 |
|
S. bilkenhead |
6, 7 |
с |
1, 6 |
|
S. isangi |
6, 7 |
d |
1, 5 |
|
S. amersfoort |
6, 7 |
d |
e, n, x |
|
S. gombe |
6, 7 |
d |
е, n, z |
|
S. livingstone |
6, 7 |
d |
l, w |
|
S. larochelle |
6, 7 |
e, h |
1, 2 |
|
S. lomita |
6, 7 |
e, h |
1, 5 |
|
S. norwich |
6, 7 |
e, h |
1, 6 |
|
S. braenderup |
6, 7 |
e, h |
е, n, z |
|
S. montevideo |
6, 7 |
g, m, (p), s |
(1, 2, 7) |
|
S. menston |
6, 7 |
g, s, t |
(1, 6) |
|
S. haelsingborg |
6, 7 |
m, p, t, (u) |
- |
|
S. oranienburg |
6, 7 |
m, t |
- |
|
S. norton |
6, 7 |
i |
l, w |
|
S. thompson |
6, 7 |
k |
1, 5 |
|
S. daytona |
6, 7 |
k |
1, 6 |
|
S. singapore |
6, 7 |
k |
e, n, x |
|
S. concord |
6, 7 |
l, v |
1, 2 |
|
S. irumu |
6, 7 |
l, v |
1, 5 |
|
S. bonn |
6, 7 |
l, v |
e, n, x |
|
S. potsdam |
6, 7 |
l, v |
е, n, z |
|
S. colorado |
6, 7 |
l, w |
1, 5 |
|
S. nessziona |
6, 7 |
l, z |
1, 5 |
|
S. kenya |
6, 7 |
l, z |
e, n, x |
|
S. virchow |
6, 7 |
r |
1, 2 |
|
S. infantis |
6, 7 |
r |
1, 5 |
|
S. nigeria |
6, 7 |
r |
1, 6 |
|
S. colindale |
6, 7 |
r |
1, 7 |
|
S. papuana |
6, 7 |
r |
е, n, z |
|
S. richmond |
6, 7 |
у |
1, 2 |
|
S. bareilly |
6, 7 |
у |
1, 5 |
|
S. gatow |
6, 7 |
у |
1, 7 |
|
S. mikawasima |
6, 7 |
у |
е, n, z |
|
S. II tosamanga |
6, 7 |
z |
1, 5 |
|
S. eaquatoria |
6, 7 |
z |
е, n, z |
|
S. inganda |
6, 7 |
z |
1, 5 |
|
S. eschweiler |
6, 7 |
z |
1, 6 |
|
S. djugu |
6, 7 |
z |
e, n, x |
|
S. tennessee |
6, 7 |
z |
- |
|
S. III arizonae |
6, 7 |
- |
1, 6 |
|
Группа С | |||
|
S. curacao |
6, 8 |
a |
1, 6 |
|
S. nordufer |
6, 8 |
a |
1, 7 |
|
S. narashino |
6, 8 |
a |
e, n, x |
|
S. nagoya |
6, 8 |
b |
1, 5 |
|
S. gatuni |
6, 8 |
b |
e, n, x |
|
S. banalia |
6, 8 |
b |
z |
|
S. wingrove |
6, 8 |
с |
1, 2 |
|
S. utah |
6, 8 |
с |
1, 5 |
|
S. bronx |
6, 8 |
с |
1, 6 |
|
S. belem |
6, 8 |
с |
е, n, х |
|
S. muenchen |
6, 8 |
d |
1, 2 |
|
S. manhattan |
6, 8 |
d |
1, 5 |
|
S. sterrenbos |
6, 8 |
d |
e, n, x |
|
S. herston |
6, 8 |
d |
е, n, z |
|
S. newport |
6, 8 |
e, h |
1, 2 |
|
S. kottbus |
6, 8 |
e, h |
1, 5 |
|
S. tshiongwe |
6, 8 |
e, h |
е, n, z |
|
S. sandow |
6, 8 |
f, g |
е, n, z |
|
S. chincol |
6, 8 |
g, m, s |
(е, n, x) |
|
S. II baragwanath |
6, 8 |
m, t |
1, 5 |
|
S. II germiston |
6, 8 |
m, t |
e, n, x |
|
S. lindenbuig |
6, 8 |
i |
1, 2 |
|
S. takoradi |
6, 8 |
i |
1, 5 |
|
S. bonariensis |
6, 8 |
i |
e, n, x |
|
S. aba |
6, 8 |
i |
е, n, z |
|
S. blockley |
6, 8 |
k |
1, 5 |
|
S. charlottenburg |
6, 8 |
k |
е, n, z |
|
S. litchfield |
6, 8 |
l, v |
1, 2 |
|
S. loanda |
6, 8 |
l, v |
1, 5 |
|
S. manchester |
6, 8 |
l, v |
1, 7 |
|
S. edmonton |
6, 8 |
l, v |
e, n, z |
|
S. fayed |
6, 8 |
l, w |
1, 2 |
|
S. bovismorbificans |
6, 8 |
r |
1, 5 |
|
S. hidalgo |
6, 6 |
r |
е, n, z |
|
S. tananarive |
6, 8 |
y |
1, 5 |
|
S. praha |
6, 8 |
у |
е, n, z |
|
S. kuru |
6, 8 |
z |
l, w |
|
S. chailey |
6, 8 |
z |
е, n, z |
|
S. duesseldorf |
6, 8 |
z |
- |
|
S. tallahassee |
6, 8 |
z |
- |
|
S. mapo |
6, 8 |
z |
1, 5 |
|
S. hadar |
6, 8 |
z |
e, n, x |
|
S. glostrup |
6, 8 |
z |
e, n, z |
|
Группа С | |||
|
S. shipley |
8, 20 |
b |
e, n, z |
|
S. virginia |
8 |
d |
1, 2 |
|
S. labadi |
8, 20 |
d |
z |
|
S. emek |
8, 20 |
g, m, s |
- |
|
S. kentucky |
8, 20 |
i |
z |
|
S. amherstiana |
8 |
l, v |
1, 6 |
|
S. hindmarsh |
8, 20 |
r |
1, 5 |
|
S. altona |
8, 20 |
r, (i) |
z |
|
S. alagbon |
8 |
y |
1, 7 |
|
S. corvallis |
8, 20 |
z |
(z |
|
S. albany |
8, 20 |
z |
- |
|
S. molade |
8, 20 |
z |
z |
|
S. tamale |
8, 20 |
z |
(e, n, z |
|
Группа C | |||
|
S. kaduna |
6, 7, 14 |
с |
e, n, z |
|
S. eimsbuettel |
6, 7, 14 |
d |
l, w |
|
S. gelsenkirchen |
6, 7, 14 |
l, v |
z |
|
Группа D | |||
|
S. sendai |
1, 9, 12 |
a |
1, 5 |
|
S. miami |
1, 9, 12 |
a |
1, 5 |
|
S. onarimon |
1, 9, 12 |
b |
1, 2 |
|
S. frintrop |
1, 9, 12 |
b |
1, 5 |
|
S. alabama |
9, 12 |
с |
e, n, z |
|
S. typhi |
9, 12, (vi) |
d |
- |
|
S. ndolo |
9, 12 |
d |
1, 5 |
|
S. eastbourne |
1, 9, 12 |
e, h |
1, 5 |
|
S. berta |
1, 9, 12 |
f, g, t |
- |
|
S. enteritidis |
1, 9, 12 |
g, m |
(1, 7) |
|
S. blegdam |
1, 9, 12 |
g, m, q |
- |
|
S. dublin |
1, 9, 12, (vi) |
g, p |
- |
|
S. rostock |
1, 9, 12 |
g, p, u |
- |
|
S. moscow |
9, 12 |
g, q |
- |
|
S. pensacola |
1, 9, 12 |
m, t |
- |
|
S. seremban |
9, 12 |
i |
1, 5 |
|
S. claibornei |
1, 9, 12 |
k |
1, 5 |
|
S. mendoza |
1, 9, 12 |
l, v |
1, 2 |
|
S. panama |
1, 9, 12 |
l, v |
1, 5 |
|
S. kapemba |
9, 12 |
l, v |
1, 7 |
|
S. II daressalaam |
1, 9, 12 |
l, w |
e, n, x |
|
S. javiana |
1, 9, 12 |
l, z |
1, 5 |
|
S. jamaica |
9, 12 |
r |
1, 5 |
|
S. lawndale |
1, 9, 12 |
z |
1, 5 |
|
S. angola |
1, 9, 12 |
z |
z |
|
S. wangata |
1, 9, 12 |
z |
(1, 7) |
|
S. portland |
9, 12 |
z |
1, 5 |
|
S. gallinarun (pullorum) |
1, 9, 12 |
- |
- |
|
Группа D | |||
|
S. baildon |
9, 46 |
a |
e, n, x |
|
S. wernigerode |
9, 46 |
f, g |
- |
|
S. india |
9, 46 |
l, v |
1, 5 |
|
S. shoreditch |
9, 46 |
i |
e, n, z |
|
S. II haarlem |
9, 46 |
z |
e, n, x |
|
S. lishabi |
9, 46 |
z |
1, 7 |
|
Группа D | |||
|
S. zuerich |
1, 9, 12 (46), 27 |
с |
z |
|
Группа E | |||
|
S. oxford |
3, 10 |
a |
1, 7 |
|
S. butantan |
3, 10 |
b |
1, 5 |
|
S. huvudsta |
3, 10 |
b |
1, 7 |
|
S. okefoko |
3, 10 |
с |
z |
|
S. shangani |
3, 10 |
d |
1, 5 |
|
S. vejle |
3, 10 |
e, h |
1, 2 |
|
S. muenster |
3, 10 |
e, h |
1, 5 |
|
S. anatum |
3, 10 |
e, h |
1, 6 |
|
S. nyborg |
3.10 |
e, h |
1, 7 |
|
S. newlands |
3, 10 |
e, h |
e, n, x |
|
S. meleagridis |
3, 10 |
e, h |
l, w |
|
S. amsterdam |
3, 10 |
g, m, s |
- |
|
S. westhampton |
3, 10 |
g, s, t |
- |
|
S. falkensee |
3, 10 |
i |
e, n, z |
|
S. zanzibar |
3, 10 |
k |
1, 5 |
|
S. nchanga |
3, 10 |
l, v |
1, 2 |
|
S. sinstorf |
3, 10 |
l, v |
1, 5 |
|
S. london |
3, 10 |
l, v |
1, 6 |
|
S. give |
3, 10 |
l, v |
1, 7 |
|
S. rusisi |
3, 10 |
l, v |
e, n, z |
|
S. uganda |
3, 10 |
l, z |
1, 5 |
|
S. II westpark |
3, 10 |
l, z |
e, n, x |
|
S. seegefeld |
3, 10 |
r, i |
1, 2 |
|
S. elisabethville |
3, 10 |
r |
1, 7 |
|
S. simi |
3.10 |
r |
e, n, z |
|
S. weltevreden |
3, 10 |
r |
z |
|
S. amager |
3, 10 |
у |
1, 2 |
|
S. orion |
3, 10 |
у |
1, 5 |
|
S. bolton |
3, 10 |
у |
e, n, z |
|
S. stockholm |
3, 10 |
у |
z |
|
S. finchley |
3, 10 |
z |
e, n, x |
|
S. adabraka |
3, 10 |
z |
(1, 7) |
|
S. okerara |
3, 10 |
z |
1, 2 |
|
S. lexington |
3, 10 |
z |
1, 5 |
|
S. coquilhatville |
3, 10 |
z |
1, 7 |
|
S. kristianstad |
3, 10 |
z |
e, n, z |
|
Группа Е | |||
|
S. newington |
3, 15 |
e, h |
1, 6 |
|
S. selandia |
3, 15 |
e, h |
1, 7 |
|
S. portsmouth |
3, 15 |
l, v |
1, 6 |
|
S. newbrunswick |
3, 15 |
l, v |
1, 7 |
|
S. kinshasa |
3, 15 |
l, z |
1, 5 |
|
S. binza |
3, 15 |
y |
1, 5 |
|
Группа Е | |||
|
S. minneapolis |
3, 15, 34 |
e, h |
1, 6 |
|
S. thomasville |
3, 15, 34 |
y |
1, 5 |
|
S. illinois |
3, 15, 34 |
z |
1, 5 |
|
S. harrisonburg |
3, 15, 34 |
|
1, 6 |
|
Группа E | |||
|
S. accra |
1, 3, 19 |
b |
z |
|
S. ahmadi |
1, 3, 19 |
d |
1, 5 |
|
S. taksony |
1, 3, 19 |
i |
z |
|
S. bedford |
1, 3, 19 |
l, z |
e, n, z |
|
S. schoeneberg |
1, 3, 19 |
z |
e, n, z |
|
S. dessau |
(1), 3, 15, 19 |
g, s, t |
- |
|
S. cannonhill |
(1), 3, 15, (19) |
y |
e, n, x |
|
Группа F (O11) | |||
|
S. marseille |
11 |
a |
1, 5 |
|
S. chandans |
11 |
d |
e, n, x |
|
S. chingola |
11 |
e, h |
1, 2 |
|
S. aberdeen |
11 |
i |
1, 2 |
|
S. veneziana |
11 |
i |
e, n, x |
|
S. abaetetuba |
11 |
k |
1, 5 |
|
S. kisarawe |
11 |
k |
e, n, x, (z |
|
S. III arizonae |
11 |
k |
z |
|
S. maracaibo |
11 |
l, v |
1, 5 |
|
S. senegal |
11 |
r |
1, 5 |
|
S. robislaw |
11 |
r |
e, n, x |
|
S. wentworth |
11 |
z |
1, 2 |
|
S. lene |
11 |
z |
- |
|
Группа G | |||
|
S. marshall |
13, 22 |
a |
l, z |
|
S. ibadan |
13, 22 |
b |
1, 5 |
|
S. friedenau |
13, 22 |
d |
1, 6 |
|
S. bron |
13, 22 |
g, m |
(e, n, z |
|
S. poona |
1, 13, 22 |
z |
1, 6 |
|
S. bristol |
13, 22 |
z |
1, 7 |
|
S. tanzania |
1, 13, 22 |
z |
e, n, z |
|
S. roodepoort |
1, 13, 22 |
z |
1, 5 |
|
S. II clifton |
13, 22 |
z |
1, 5 |
|
S. leiden |
13, 22 |
z |
- |
|
Группа G | |||
|
S. atlanta |
13, 23 |
b |
- |
|
S. durham |
13, 23 |
b |
e, n, z |
|
S. II |
13, 23 |
d |
e, n, x |
|
S. worthington |
1, 13, 23 |
z |
l, w |
|
S. ajiobo |
13, 23 |
z |
- |
|
S. III arisonae |
1, 13, 23 |
z |
- |
|
S. cubana |
1, 13, 23 |
z |
(z |
|
S. fanti |
13, 23 |
z |
- |
|
Группа Н (O6, 14) | |||
|
S. minna |
1, 6, 14, 25 |
c |
l, w |
|
S. heves |
6, 14, 24 |
d |
1, 5 |
|
S. charity |
1, 6, 14, 25 |
d |
e, n, x |
|
S. onderstepoort |
1, 6, 14, (25) |
e, h |
1, 5 |
|
S. caracas |
(1), 6, 14, (25) |
g, m, s |
- |
|
S. II emmerich |
6, 14 |
(m, t) |
e, n, x |
|
S. buzu |
1, 6, 14, 25 |
i |
1, 7 |
|
S. II |
6, 14 |
k |
(e, n, x) |
|
S. Ill arizonae |
6, 14 |
k |
z |
|
S. boecker |
(1), 6, 14, (25) |
l, v |
1, 7 |
|
S. horsham |
1, 6, 14, (25) |
l, v |
e, n, x |
|
S. carrau |
6, 14, 24 |
у |
1, 7 |
|
S. madelia |
1, 6, 14, 25 |
у |
1, 7 |
|
S. sundsvall |
1, 6, 14, 25 |
z |
e, n, x |
|
S. IV |
6, 14 |
z |
- |
|
S. Ill arisonae |
(6), 14 |
z |
(z):(z |
|
Группа I (O16) | |||
|
S. hannover |
16 |
a |
1, 2 |
|
S. amunigun |
16 |
a |
1, 6 |
|
S. oldenburg |
16 |
d |
1, 2 |
|
S. gaminara |
16 |
d |
1, 7 |
|
S. nottingham |
16 |
d |
e, n, z |
|
S. weston |
16 |
e, h |
z |
|
S. orientalis |
16 |
k |
e, n, z |
|
S. shanghai |
16 |
l, v |
1, 6 |
|
S. welikade |
16 |
l, v |
1, 7 |
|
S. saphra |
16 |
y |
1, 5 |
|
S. II haddon |
16 |
z |
- |
|
S. Ill arizonae |
16 |
z |
z |
|
Группа J (O17) | |||
|
S. kinondoni |
17 |
a |
e, n, x |
|
S. kirkee |
17 |
b |
1, 2 |
|
S. II hillbrow |
17 |
b |
e, n, x, z |
|
S. berlin |
17 |
d |
1, 5 |
|
S. II verity |
17 |
l, n, x, z |
1, 6 |
|
S. II bleadon |
17 |
(f), g, t |
(e, n, x, z |
|
S. III arizonae |
17 |
r |
z |
|
Группа K (O18) | |||
|
S. usumbura |
18 |
d |
1, 7 |
|
S. memphis |
18 |
k |
1, 5 |
|
S. Ill arisonae |
18 |
r |
z |
|
S. II |
18 |
y |
e, n, x, z |
|
S. blukwa |
18 |
z |
- |
|
Группа L (O21) | |||
|
S. assen |
21 |
a |
(1, 5) |
|
S. minnesota |
21 |
b |
e, n, x |
|
S. spartel |
21 |
d |
1, 5 |
|
S. magwa |
21 |
d |
e, n, x |
|
S. good |
21 |
f, g |
e, n, x |
|
S. III arizonae |
21 |
g, z |
- |
|
S. ruiru |
21 |
у |
e, n, x |
|
S. II gwaai |
21 |
z |
- |
|
Группа M (O28) | |||
|
S. dakar |
28 |
а |
1, 6 |
|
S. halle |
28 |
с |
1, 7 |
|
E. niundonobo |
28 |
d |
1, 7 |
|
S. patience |
28 |
d |
e, n, z |
|
S. ona |
28 |
g, s, t |
- |
|
S. ilala |
28 |
k |
1, 5 |
|
S. taunton |
28 |
k |
e, n, x |
|
S. nashua |
28 |
l, v |
e, n, z |
|
S. telaviv |
28 |
y |
e, n, z |
|
S. II ceres |
28 |
z |
z |
|
S. III arizonae |
28 |
z |
(z |
|
S. umbilo |
28 |
z |
e, n, x |
|
S. moroto |
28 |
z |
l, w |
|
Группа N (O30) | |||
|
S. zehlendorf |
30 |
а |
1, 5 |
|
S. urbana |
30 |
b |
e, n, x |
|
S. II |
30 |
с |
z |
|
S. godesberg |
30 |
g, m |
- |
|
S. morehead |
30 |
i |
1, 5 |
|
S. soerenga |
30 |
i |
l, w |
|
S. aqua |
30 |
k |
1, 6 |
|
S. angoda |
30 |
k |
e, n, x |
|
S. donna |
30 |
l, v |
1, 5 |
|
S. morocco |
30 |
l, z |
e, n, z |
|
S. gege |
30 |
r |
1, 5 |
|
S. bodjonegoro |
30 |
z |
- |
|
S. aragua |
30 |
z |
- |
|
Группа O (O35) | |||
|
S. tchad |
35 |
b |
- |
|
S. adelaide |
35 |
f, g |
- |
|
S. ealing |
35 |
g, m, s |
- |
|
S. agodi |
35 |
g, t |
- |
|
S. gambia |
35 |
i |
e, n, z |
|
S. III arizonae |
35 |
k |
z |
|
S. III arizonae |
35 |
z |
1, 5, 7 |
|
Группа P (O38) | |||
|
S. sheffield |
38 |
c |
1, 5 |
|
S. II carletonville |
38 |
d |
(1, 5) |
|
S. kasenyi |
38 |
e, h |
1, 5 |
|
S. korovi |
38 |
g, m, s |
- |
|
S. II foulpointe |
38 |
g, t |
- |
|
S. mgulani |
38 |
i |
1, 2 |
|
S. lansing |
38 |
i |
1, 5 |
|
S. inverness |
38 |
k |
1, 6 |
|
S. Ill arizonae |
38 |
(k) |
z |
|
S. roan |
38 |
l, v |
e, n, x |
|
S. colombo |
38 |
y |
1, 6 |
|
S. IV |
38 |
z |
- |
|
S. III arizonae |
38 |
z |
z |
|
Группа Q (O39) | |||
|
S. wahdsworth |
39 |
b |
1, 2 |
|
S. II |
39 |
c |
e, n, z, |
|
S. anfo |
39 |
y |
1, 2 |
|
Группа R (O40) | |||
|
S. riogrande |
40 |
b |
1, 5 |
|
S. johannesburg |
1, 40 |
b |
e, n, x |
|
S. II |
1, 40 |
с |
z |
|
S. II boksburg |
40 |
g, m, s, t |
e, n, x |
|
S. allandale |
1, 40 |
k |
1, 6 |
|
S. II sunnydale |
1, 40 |
k |
e, n, x, z |
|
S. millesi |
1, 40 |
l, v |
1, 2 |
|
S. Ill arizonae |
40 |
z |
- |
|
S. degania |
40 |
z |
z |
|
Группа S (O41) | |||
|
S. vietnam |
41 |
b |
(z |
|
S. egusi |
41 |
d |
(1, 5) |
|
S. lethe |
41 |
g, t |
- |
|
S. II dubrovnik |
41 |
z |
1, 5 |
|
S. waycross |
41 |
z |
- |
|
S. ipswich |
41 |
z |
1, 5 |
|
S. II negev |
41 |
z |
1, 2 |
|
S. landala |
41 |
z |
1, 6 |
|
S. inpraw |
41 |
z |
e, n, x |
|
S. offa |
41 |
z |
- |
|
Группа Т (O42) | |||
|
S. faji |
1, 42 |
a |
e, n, z |
|
S. antwerpen |
1, 42 |
с |
e, n, z |
|
S. III arizonae |
42 |
l, v |
z |
|
S. II detroit |
42 |
z |
1, 5 |
|
S. II |
42 |
z |
1, 6 |
|
S. loenga |
1, 42 |
z |
z |
|
S. weslaco |
42 |
z |
- |
|
Группа U (O43) | |||
|
S. berkeley |
43 |
a |
1, 5 |
|
S. milwaukee |
43 |
f, g |
- |
|
S. mbao |
43 |
i |
1, 2 |
|
S. ahuza |
43 |
k |
1, 5 |
|
S. kingabwa |
43 |
y |
1, 5 |
|
S. IV houten |
43 |
z |
- |
|
S. irigny |
43 |
z |
- |
|
Группа V (O44) | |||
|
S. niarembe |
44 |
a |
l, w |
|
S. kermel |
44 |
d |
e, n, x |
|
S. gamaba |
44 |
g, m, s |
- |
|
S. christiansborg |
44 |
z |
- |
|
S. guinea |
44 |
z |
(1, 7) |
|
S. IV |
44 |
z |
- |
|
Группа W (O45) | |||
|
S. dewersoir |
45 |
с |
e, n, x |
|
S. dugbe |
45 |
d |
1, 6 |
|
S. suelldorf |
45 |
f, g |
- |
|
S. III arizonae |
45 |
g, z |
- |
|
S. II |
45 |
z |
1, 5 |
|
Группа Х (O47) | |||
|
S. II bilthoven |
47 |
a |
(1, 5) |
|
S. saka |
47 |
b |
- |
|
S. stellingen |
47 |
d |
e, n, x |
|
S. II quimbamba |
47 |
d |
z |
|
S. luke |
1, 47 |
g, m |
- |
|
S. bergen |
47 |
i |
e, n, z |
|
S. lyon |
47 |
k |
e, n, z |
|
S. teshie |
1, 47 |
l, z |
e, n, z |
|
S. moualine |
47 |
y |
1, 6 |
|
S. kaolack |
47 |
z |
1, 6 |
|
Группа Y (O48) | |||
|
S. II hagenbeck |
48 |
d |
z |
|
S. hammonia |
48 |
e, n, x, z |
z |
|
S. III arizonae |
48 |
i |
z |
|
S. dahlem |
48 |
k |
e, n, z |
|
S. djakarta |
48 |
z |
- |
|
S. IV |
48 |
z |
- |
|
Группа Z (O50) | |||
|
S. II krugersdorp |
50 |
e, n, x |
1, 7 |
|
S. IV wassenaar |
50 |
g, z |
- |
|
S. Ill arizonae |
50 |
r |
1, 5 (7) |
|
S. dougi |
50 |
y |
1, 6 |
|
Группа O51 | |||
|
S. tlone |
51 |
a |
e, n, x |
|
S. IV harmeln |
51 |
z |
- |
|
S. II |
51 |
z |
e, n, x, z |
|
Группа O52 | |||
|
S. flottbek |
52 |
b |
e, n, x |
|
S. utrecht |
52 |
d |
1, 5 |
|
S. saintemarie |
52 |
g, t |
- |
|
S. III arizonae |
52 |
I, v |
z |
|
Группа O53 | |||
|
S. III arizonae |
53 |
r |
z |
|
S. III |
53 |
z |
- |
|
S. II humber |
53 |
z |
- |
|
Группа O54 | |||
|
S. tonev |
21, 54 |
b |
e, n, x |
|
S. uccle |
3, 54 |
g, s, t |
- |
|
S. steinwerder |
3, 15, 54 |
у |
1, 5 |
|
Группа O55 | |||
|
S. II tranoroa |
55 |
k |
z |
|
Группа O56 | |||
|
S. II artis |
56 |
b |
- |
|
S. II |
56 |
z |
e, n, x |
|
S. III arizonae |
56 |
z |
- |
|
Группа O57 | |||
|
S. antonio |
57 |
a |
z |
|
S. III arizonae |
57 |
i |
z |
|
S. II locarno |
57 |
z |
z |
|
Группа O58 | |||
|
S. II |
58 |
a |
(z |
|
S. II |
58 |
с |
z |
|
S. II basel |
58 |
l, z |
1, 5 |
|
S. III arizonae |
58 |
r |
z |
|
Группа O59 | |||
|
S. II betioky |
59 |
k |
(z) |
|
S. III arizonae |
59 |
l, v |
z |
|
S. III arizonae |
59 |
z |
- |
|
Группа O60 | |||
|
S. Ill arizonae |
60 |
k |
z |
|
S. II luton |
60 |
z |
e, n, x |
|
S. Ill arizonae |
60 |
z |
z |
|
Группа O61 | |||
|
S. III arizonae |
61 |
c |
z |
|
S. Ill arizonae |
61 |
r |
1, 5, 7 |
|
S. III arizonae |
61 |
z |
z |
|
Группа O62 | |||
|
S. Ill arizonae |
62 |
g, z |
- |
|
S. Ill arizonae |
62 |
z |
- |
|
S. III arizonae |
62 |
z |
- |
|
Группа O63 | |||
|
S. Ill arizonae |
63 |
g, z |
- |
|
S. Ill arizonae |
63 |
z |
- |
|
S. III arizonae |
63 |
z |
- |
|
Группа O65 | |||
|
S. III arizonae |
65 |
с |
15, 7 |
|
S. III arizonae |
65 |
(k) |
z |
|
S. III arizonae |
65 |
z |
z |
|
Группа O66 | |||
|
D. maregrosso |
66 |
z |
- |
|
S. brookfield |
66 |
z |
- |
|
Группа O67 | |||
|
S. crossness |
67 |
r |
1, 2 |
Примечание. 1. Римские цифры (II, III, IV) после родового названия (S) указывают на принадлежность серовара к соответствующему подроду.
2. (-) - означает, что данный антигенный комплекс может отсутствовать.
ПРИЛОЖЕНИЕ 3
Рецепты консервантов, стабилизаторов и питательных сред
1. Консерванты и стабилизаторы
1.1. Глицериновый
Состав:
|
Натрия хлорид (NaCI), 0,85%-ный раствор |
1000 мл |
|||
|
Глицерин нейтральный |
500 мл |
|||
|
Натрия гидрофосфат безводный (Na |
150 мл |
|||
|
20%-ный раствор |
||||
Приготовление. Смешивают первые два ингредиента и добавляют раствор натрия гидрофосфата в таком количестве, чтобы довести рН до 7,8-8,0, затем разливают в пробирки или флаконы, стерилизуют в автоклаве 15 мин при температуре 112 °С или текучим паром три дня подряд. После стерилизации рН 7,6-7,8.
1.2. Фосфатно-буферный
Состав:
|
Калия дигидрофосфат (KН |
0,45 г |
|||
|
Натрия гидрофосфат безводный |
5,34 г |
|||
|
Вода дистиллированная |
1000 мл |
|||
Приготовление. Ингредиенты смешивают, разливают в пробирки или флаконы, стерилизуют в автоклаве 30 мин при температуре 121 °С.
1.3. Буферный глицерино-солевой
Состав:
|
Натрия хлорид |
4,2 г |
|||
|
Калия гидрофосфат (K |
3,1 г |
|||
|
Калия дигидрофосфат |
1,0 г |
|||
|
Глицерин нейтральный |
300 мл |
|||
|
Вода дистиллированная |
700 мл |
|||
Приготовление. Ингредиенты растворяют, перемешивают, смесь разливают в стерильные пробирки по 5 мл и автоклавируют 30 мин при температуре 112 °С. Рекомендуется с целью контроля в процессе хранения раствор слабо подкрашивать феноловым красным.
2. Среды обогащения*
_____________
* Для получения сред обогащения двойной концентрации (при исследовании жидких материалов) соответственно уменьшают вдвое объем дистиллированной воды.
Предварительную среду обогащения готовят как указано в п.1.2, но вместо дистиллированной воды используют пептонную.
2.1. Селенитовая среда
Состав:
|
Натрия гидроселенит (NaHSeO |
4 г |
|||
|
Пептон |
5 г |
|||
|
Натрия гидрофосфат безводный |
7 г |
|||
|
Натрия дигидрофосфат безводный (NaH |
3 г |
|||
|
Лактоза |
4 г |
|||
|
Вода дистиллированная |
1000 мл |
|||
Приготовление. Среду готовят из двух основных растворов.
Раствор 1. Определяют пропорцию натрия гидрофосфата и натрия дигидрофосфата с используемым образцом пептона и натрия гидроселенита для установления рН 6,9-7,1. С этой целью регулируют соотношение фосфатов. Подтитровка нужна всегда при изменении серии любого из входящих в среду основных ингредиентов. После установления соотношения фосфатов к раствору добавляют пептон и лактозу. Разливают в флаконы по 50 мл и стерилизуют текучим паром по 30 мин два дня. Количество фосфатов в рецепте среды дано в расчете на безводные препараты. При отсутствии таковых заранее заготовленные навески "выветривают'' 15-16 сут в термостате.
Раствор 2. 10%-ный раствор натрия гидроселенита готовят на стерильной дистиллированной воде перед употреблением.
Перед началом работы во флакон с 50 мл раствора 1 добавляют 2 мл раствора 2, разливают по 5-7 мл в стерильные пробирки с соблюдением правил асептики и закрывают плотно пробками. Дальнейшая стерилизация не требуется.
Основной раствор (первый) для среды можно хранить в холодильнике 1-2 мес. При приготовлении среды следует использовать высококачественный пептон (желательно "Рихтер", "Спофа" или жидкий аминопептид - отечественный заменитель импортного пептона).
2.2. Селенитовый бульон с аминопептидом
Состав:
|
Бульон аминопептидный |
960 мл |
|||
|
Натрия гидрофосфат |
8 г |
|||
|
Натрия дигидрофосфат |
2 г |
|||
|
Натрия гидроселенит, 10%-ный водный раствор |
40 мл |
|||
|
Бульон аминопептидный |
||||
|
Состав: |
||||
|
Аминопептид |
250 мл |
|||
|
Натрия хлорид (NаСl) |
5,5 г |
|||
|
Вода дистиллированная |
750 мл |
|||
Приготовление. Среду хорошо перемешивают, стерилизуют 20 мин при 121 °С. Готовый бульон можно хранить в бутылях неопределенный срок, желательно при 6-10 °С.
К бульону непосредственно перед употреблением добавляют 40 мл стерильного 10%-ного водного раствора натрия гидроселенита (рН при этом снижается на 0,1-0,2), среду тщательно перемешивают и разливают в стерильные пробирки по 5 мл с соблюдением правил асептики.
Примечание. Фосфаты натрия могут быть заменены фосфатами калия в тех же количествах.
2.3. Магниевая среда
Среда состоит из трех растворов.
Раствор 1
|
Пептон |
4,2 г |
|||
|
Натрия хлорид |
7,15 г |
|||
|
Калия дигидрофосфат |
1,48 г |
|||
|
Дрожжевой диализат |
9 мл |
|||
|
Вода дистиллированная |
890 мл |
|||
|
Раствор 2 |
||||
|
Магния хлорид (MgCl |
35,7 г |
|||
|
Вода дистиллированная |
90 мл |
|||
|
Раствор 3 |
||||
|
Бриллиантовый зеленый, 0,5%-ный водный раствор |
0,9 мл |
|||
Приготовление. Все три раствора смешивают в указанных количествах, разливают в необходимых объемах в колбы, флаконы или пробирки, стерилизуют при 112 °С 30 мин.
2.4. Среда Мюллера (тетратионатовый бульон Мюллера)
Состав:
|
Мел, стерилизованный сухим жаром |
45 г |
или
|
Кальция карбонат (СаСО |
25 г |
|
Бульон Хоттингера, содержащий 120-130 мг% аминного азота |
900 мл |
|
Раствор Люголя (калия йодид (KI) - 20 г, йод кристаллический (I |
20 мл |
|
Натрия тиосульфат (Na |
100 мл |
____________
* Натрия тиосульфат часто неправильно именуют гипосульфитом.
Приготовление. В стерильные флаконы помещают по 4,5 г мела, стерилизуют сухим жаром, после чего в каждый флакон наливают 90 мл бульона Хоттингера. Стерилизуют 30 мин при температуре 121 °С (рН 7,2-7,4). В каждый флакон ex tempore добавляют 2 мл раствора Люголя и 10 мл раствора натрия тиосульфата с соблюдением правил асептики, хорошо смешивают и разливают по пробиркам. Дальнейшая стерилизация не требуется.
2.5. Среда Кауфмана
Состав:
|
Среда Мюллера (стерильная) |
500 мл |
|||
|
Желчь бычья (стерильная) |
250 мл |
|||
|
Бриллиантовый зеленый, 0,1%-ный водный раствор |
50 мл |
|||
Приготовление. Ингредиенты смешивают, асептически разливают в стерильные пробирки по 10 мл, дополнительно не стерилизуют.
2.6. Бульон желчный 20%-ный
Состав:
|
Бульон мясопептонный или Хоттингера |
800 мл |
|||
|
Желчь бычья нативная |
260 мл |
|||
Приготовление. рН должен быть 7,6. Смесь разливают по 50 мл во флаконы с поплавками. Стерилизуют текучим паром по 30 мин три дня.
3. Дифференциально-диагностические среды для первичных посевов материала и высевов со сред обогащения
По степени подавления роста посторонней микрофлоры среды подразделяют на высокоселективные (висмут-сульфитный агар), среднеселективные (среда Плоскирева, слабощелочной питательный агар) и низкоселективные (среды Эндо, Левина).
3.1. Учет роста на дифференциально-диагностических средах. На висмут-сульфитном агаре почти все сальмонеллы растут в виде черных колоний с характерным металлическим блеском, при этом наблюдается прокрашивание в черный цвет участка среды под колонией. Исключение составляет S. choleraesuis (группа С), которая при росте на этой среде образует светлые нежные зеленоватые колонии. Просмотр чашек с висмут-сульфитным агаром проводят через 24 и 48 ч после посева.
На средах Плоскирева, Эндо, Левина сальмонеллы образуют мелкие (1-2 мм в диаметре), слегка выпуклые с ровным краем и гладкой поверхностью влажные колонии. На среде Плоскирева колонии бесцветные, мутноватые, уплотненные; Эндо - обычно прозрачные, слегка розоватые; Левина - прозрачные с легким фиолетовым оттенком; на слабощелочном питательном агаре (СПА) - нежные, прозрачные, голубоватые.
4. Среды для первичной идентификации
4.1. Агар Клиглера. Коммерческую сухую среду готовят в соответствии с указаниями на этикетке. Готовая к употреблению среда имеет красновато-бурый или оранжево-красный цвет. При скашивании следует оставлять столбик высотой 2-2,5 см.
4.2. Комбинированная среда по Олькеницкому
Состав:
|
Агар питательный сухой |
25 г |
|||
|
Лактоза |
10 г |
|||
|
Аммоний-железо (II) сульфат (FeSO |
0,2 г |
|||
|
Натрия тиосульфат |
0,3 г |
|||
|
Мочевина |
10 г |
|||
|
Феноловый красный, 0,4%-ный водный раствор |
4 мл |
|||
|
Вода дистиллированная |
1000 мм |
|||
Приготовление. Соли предварительно растворяют в небольшом объеме дистиллированной воды. Углеводы и мочевину также растворяют в небольших объемах воды при подогревании на водяной бане. Сухой питательный агар расплавляют в оставшемся объеме воды при нагревании и помешивании. Затем все ингредиенты соединяют, перемешивают с расплавленным агаром, фильтруют через марлевый фильтр, устанавливают рН 7,2-7,4, добавляют индикатор и разливают в пробирки по 6-7 мл. Среду стерилизуют текучим паром по 20 мин три дня и скашивают, оставляя столбик 2-2,5 см. Готовая среда бледно-розового цвета.
4.3. Учет биохимических свойств сальмонелл на указанных средах проводят визуально. Появление желтой окраски в скошенной части агара характеризует ферментацию лактозы (и сахарозы в среде Олькеницкого), в столбике - глюкозы.
Газообразование устанавливают по появлению пузырьков, разрывам агара или его отслоению от стенок пробирки.
Об образовании сероводорода судят по почернению среды, обычно в середине столбика.
При росте культуры, гидролизующей мочевину, среда Олькеницкого приобретает красно-малиновый цвет.
При росте культур, образующих большое количество сероводорода или гидролизующих мочевину, учет ферментации углеводов в большинстве случаев невозможен.
4.4. Приготовление среды Ресселя (сухой) описано на этикетке. Учет роста сальмонелл указан в п.4.3.
5. Среды для биохимической дифференциации
5.1. Цитратный агар Симонса
Коммерческую сухую среду готовят согласно указаниям на этикетке препарата. Среду разливают в пробирки по 5-7 мл, при скашивании после стерилизации которых оставляют столбик 2-2,5 см.
Бактерии, усваивающие цитрат, окрашивают среду в синий цвет.
5.2. Агар с фенилаланином
Состав:
|
Дрожжевой экстракт сухой |
3 г |
|||
|
или |
||||
|
Экстракт жидкий |
100 мл |
|||
|
Натрия хлорид |
5 г |
|||
|
Натрия гидрофосфат |
1 г |
|||
|
L-фенилаланин |
2 г |
|||
|
или |
||||
|
DL-фенилаланин |
||||
|
Агар-агар |
12 г |
|||
|
Вода дистиллированная |
1000 мл |
|||
Приготовление. Дрожжевой экстракт вносят в холодную воду, нагревают, затем последовательно добавляют остальные ингредиенты и кипятят до полного расплавления агара (5-10 мин), фильтруют через ватно-марлевый фильтр и разливают по 2-3 мл в пробирки. рН среды должен быть 7,0-7,2. Стерилизуют 30 мин при температуре 112 °С и охлаждают в скошенном положении. Готовая среда не окрашена.
На выросшую культуру по скошенной части агара вносят 4-5 капель реактива (10%-ного водного раствора железа (III) хлорида - FeCl , хранящегося при 4-6 °С без доступа света). При наличии в культуре фенилаланиндезаминазы образуется дорожка зеленого цвета.
, хранящегося при 4-6 °С без доступа света). При наличии в культуре фенилаланиндезаминазы образуется дорожка зеленого цвета.
5.3. Среда с мочевиной по Кристенсену
Состав:
|
Пептон |
1 г |
|||
|
Натрия хлорид |
5 г |
|||
|
Калия дигидрофосфат |
2 г |
|||
|
Агар-агар |
20 г |
|||
|
Глюкоза |
1 г |
|||
|
Феноловый красный, 0,2%-ный раствор |
6 мл |
|||
|
Мочевина, 20%-ный раствор |
100 мл |
|||
|
Вода дистиллированная |
1000 мл |
|||
Приготовление. Пептон, соли и агар растворяют при нагревании, фильтруют и стерилизуют 20 мин при температуре 115 °С. Затем добавляют глюкозу и индикатор, стерилизуют текучим паром 1 ч, охлаждают до 50-55 °С, после чего вносят раствор мочевины, профильтрованный через фильтр Зейтца*. Готовую среду разливают в стерильные пробирки с соблюдением правил асептики и охлаждают в скошенном положении.
_____________
* Возможно использование 50%-ного водного раствора мочевины, выдержанного 2-3 сут для самостерилизации и добавленного к среде из расчета конечного содержания мочевины в среде 2%.
При выделении культурой уреазы среда приобретает малиновый цвет.
5.4. Среда с мочевиной по Преусу
Состав:
|
Бульон Хоттингера |
1000 мл |
|||
|
Агар-агар |
15 г |
|||
|
Глюкоза |
5 г |
|||
|
Мочевина, 50%-ный водный раствор |
20 мл |
|||
|
Бромтимоловый синий, 0,2%-ный водный раствор |
12 мл |
|||
Приготовление. Агар расплавляют в бульоне при подогревании, фильтруют, устанавливают рН 6,9-7,0. Стерилизуют 20 мин при температуре 121 °С. К стерильному питательному агару добавляют глюкозу, мочевину, индикатор. Стерилизуют текучим паром 15 мин, после чего скашивают. Цвет готовой среды оливковый. В случае гидролиза мочевины среда приобретает синий цвет.
5.5. Среда Кларка
Состав:
|
Пептон |
5 г |
|||
|
Калия гидрофосфат |
5 г |
|||
|
Глюкоза |
5 г |
|||
|
Вода дистиллированная |
1000 мл |
|||
Приготовление. Ингредиенты растворяют в воде, кипятят 2-3 мин, фильтруют через бумажный фильтр, устанавливают рН 6,9-7,0, разливают в пробирки. Стерилизуют 20 мин при температуре 112 °С или по 20 мин три дня текучим паром.
Среду Кларка применяют для постановки реакций с метиловым красным (метилротом) и Фогес-Проскауэра.
Реакция с метиловым красным
Состав реактива:
|
Метиловый красный |
0,1 г |
|||
|
Спирт этиловый 96°-ный |
300 мл |
|||
|
Вода дистиллированая |
200 мл |
|||
Приготовление. Краску растворяют в спирте, затем добавляют воду до 500 мл.
Для постановки реакции к четырехсуточной культуре добавляют 3-5 капель реактива. В случае образования кислоты при ферментации глюкозы среда окрашивается в красный цвет. При слабом кислотообразовании цвет среды желтый.
Реакция Фогес-Проскауэра
Состав реактивов:
|
6%-ный раствор L-нафтола |
30 г |
|||
|
Спирт этиловый 96°-ный |
500 мл |
|||
|
Калия гидроокись (КОН) |
120 г |
|||
|
Вода дистиллированная |
300 мл |
|||
Реактивы смешивают перед применением.
К четырехсуточной культуре добавляют равный объем смеси реактивов. Через 4-6 ч инкубирования в термостате учитывают цвет среды. В положительном случае среда приобретает розовый цвет с желтым оттенком.
5.6. Среды с углеводами*
_____________
* Выпускаются коммерческие сухие среды с углеводами (глюкозой, лактозой, мальтозой, сахарозой и маннитом). Их приготовление указано на этикетке.
Состав:
|
Пептон |
10 г |
|||
|
Натрия хлорид |
5 г |
|||
|
Индикатор Андреде |
10 мл |
|||
|
Углевод |
5 или 10 г |
|||
|
Вода дистиллированная |
1000 мл |
|||
В качестве индикатора рН могут быть использованы растворы бромтимолового синего, фенолового красного или бромкрезолового пурпурного. Для специальных целей среду с лактозой готовят с большим содержанием сахара (2-10%). К средам может быть добавлен агар (0,2-0,4%).
Приготовление. Пептон растворяют в воде при подогревании, добавляют натрия хлорид и индикатор, фильтруют, устанавливают рН 7,1-7,2, стерилизуют 15 мин при температуре 121 °С. К стерильной основе добавляют соответствующий углевод: 1% лактозы, глюкозы, маннита или сахарозы, или 0,5% рамнозы, ксилозы, мальтозы, арабинозы, салицина, трегалозы, рафинозы, целлобиозы, дульцита, сорбита, адонита или глицерина. Среду разливают в стерильные пробирки по 3-4 мл, в пробирки с глюкозой помещают поплавки (перевернутые бродильные пробирки Дюрхема). Стерилизуют 30 мин при температуре 110 °С или дробно текучим паром по 30 мин два дня. Готовая среда должна быть соломенно-желтого цвета без розового оттенка.
При образовании кислоты цвет среды меняется от бледно-розового до красного.
В коммерческие среды добавляют индикатор бромкрезоловый пурпуровый. В этом случае цвет готовой среды - фиолетовый, при образовании кислоты меняется до желтого или желто-коричневого.
5.7. Среды для определении индолообразования. Культуру высевают на одну из следующих сред: бульон на триптическом переваре казеина (1,2-1,4% аминного азота); бульон на триптическом переваре Хоттингера (1,2-1,4% аминного азота); 2%-ная пептонная вода; 1%-ная пептонная вода с добавлением 0,3% L-триптофана; полужидкий агар, приготовленный на бульоне Хоттингера. Через 24 и 48 ч инкубирования ставят реакцию с реактивом Эрлиха.
К бульонной культуре приливают 2-3 мл эфира. Содержимое перемешивают, дают эфиру отстояться и добавляют несколько капель реактива следующего состава: парадиметиламидобензальдегида 1 г, крепкой хлористоводородной кислоты 20 мл, 96°-ного спирта 95 мл.
В присутствии индола эфир окрашивается в розовый или красный цвет.
5.8. Среды с аминокислотами - лизином, оринтином и аргинином
Состав:
|
Вода дистиллированная |
1000 мл |
|||
|
Пептон |
5 г |
|||
|
Дрожжевой экстракт |
8 г |
|||
|
или |
||||
|
Аутолизат дрожжей |
12-15 мл |
|||
|
Глюкоза |
1 г |
|||
|
Бромкрезоловый пурпурный, 1,6%-ный спиртовой раствор |
0,6 мл |
|||
|
Крезоловый красный, 0,1%-ный спиртовой раствор |
5 мл |
|||
|
L-аминокислота |
10 г |
|||
|
или |
||||
|
DL-аминокислота |
20 г |
|||
Указанный в прописи индикатор может быть заменен на бромтимоловый синий (1 мл 1,6%-ного спиртового раствора).
Вместо дрожжевого экстракта или аутолизата дрожжей можно брать 400 мл мясной воды, соответственно уменьшив объем дистиллированной воды до 600 мл.
Приготовление. В воде растворяют белковую питательную основу и глюкозу. Устанавливают рН 6,0-6,1. Затем среду делят на равные части. В каждую из трех порций вносят одну из аминокислот (лизин, орнитин или аргинин) в количестве, зависящем от кристаллизационной формы реактива (L или DL). В последнюю порцию питательной основы аминокислот не добавляют, оставляя ее в качестве контрольной. Среды кипятят 5-10 мин и вновь устанавливают рН 6,0-6,1. Во все порции вносят раствор индикатора, перемешивают, разливают в пробирки по 2-3 мл. Стерилизуют 30 мин при температуре 110 °С. Цвет среды от желтого до оливкового, который при расщеплении аминокислот изменяется в зависимости от применяемого индикатора.
5.9. Глицерино-фуксиновый бульон Штерна
Состав:
|
Бульон Хоттингера стерильный, рН 8,0 |
1000 мл |
|||
|
Фуксин основной, насыщенный спиртовой раствор |
2,5 мл |
|||
|
Натрия сульфит (Na |
16,6 мл |
|||
|
Глицерин нейтральный |
10 мл |
|||
Приготовление. К бульону добавляют раствор фуксина, свежеприготовленный раствор сульфита натрия и глицерин, хорошо смешивают, разливают в пробирки по 6-7 мл, стерилизуют 15 мин при температуре 112 °С. Хранят среду в холодильнике не более 14 дней.
5.10. Полужидкий агар для определения подвижности
Состав:
|
Натрия хлорид |
5 г |
|||
|
Гидролизат Хоттингера |
120-150 мл |
|||
|
Агар-агар |
3-4 г |
|||
|
Вода дистиллированная |
1000 мл |
|||
Приготовление. Перевар Хоттингера разводят водой до содержания в среде 1,2-1,4% аминного азота, добавляют хлорид натрия, устанавливают рН 7,2-7,4, вносят агар и полностью расплавляют его, подогревая среду при постоянном помешивании. Затем фильтруют в горячем состоянии через тканевый фильтр, проверяют прозрачность (визуально) и в случае необходимости осветляют с помощью яичного белка или путем отстаивания в узких сосудах. Среду стерилизуют в пробирках 30 мин при 121 °С. Охлаждают в вертикальном положении.
Примечание. Среда может быть одновременно использована для определения индолообразования.
ПРИЛОЖЕНИЕ 4
Первичная идентификация энтеробактерий по биохимическим реакциям
в комбинированной среде и выбор тестов для установления
родовой принадлежности*
|
Реакция в среде Олькеницкого, Клигера |
Предполагаемые энтеробактерии |
Тесты и субстраты для установления рода энтеробактерий | |||
|
лактоза и (или) сахароза** |
глюкоза |
сероводород |
мочевина*** |
||
|
- |
к |
- |
- |
Shigella, некоторые серовары сальмонелл |
Подвижность (при 37 °С и 22 °С), индол, натрия ацетат, фенилаланиндезаминаза, лизиндекарбоксилаза, мочевина (по Преусу или Кристенсену), реакция Фогес-Проскауэра и проба с метиловым красным (при 22 °С), пробы с поливалентными сальмонеллезным и дизентерийным фагами, серологические пробы с поливалентными сыворотками к сальмонеллам и шигеллам |
|
- |
кг |
- |
- |
S. paratyphi А и некоторые другие серовары и биовары сальмонелл, S. flexneri, Escherichia, Hafnia, Р. inconstans, Serratia |
Подвижность (при 37 °С и 22 °С), индол, натрия ацетат, фенилаланиндезаминаза, лизиндекарбоксилаза, реакция Фогес-Проскауэра и проба с метиловым красным (при 22 °С), пробы с поливалентными сальмонеллезным и дизентерийным фагами, серологические пробы с поливалентными сыворотками к сальмонеллам и шигеллам |
|
- |
к |
+ |
- |
S. typhi и некоторые другие серовары сальмонелл |
Проба с поливалентным сальмонеллезным фагом и поливалентными сыворотками к сальмонеллам (см. тесты для идентификации сероваров) |
|
- |
кг |
+ |
- |
Salmonella, citrobacter, edwardsiella |
Индол, сорбит, лизиндекарбоксилаза, пробы с поливалентным сальмонеллезным фагом и поливалентными сыворотками к сальмонеллам |
|
+ |
к |
- |
- |
Escherichia, citiobacter или не энтеробактерии |
Цитрат Симонса, мочевина (по Преусу или Кристенсену), редукция нитратов, цитохромоксидаза |
|
+ |
кг |
- |
- |
Escherichia, cibobacter, klebsiella, enterobacter, serratia |
Цитрат Симонса, подвижность, индол, реакция Фогес-Проскауэра, проба с метиловым красным, лизиндекарбоксилаза, орнитидекарбоксилаза, мочевина (по Преусу или Кристенсену) |
|
+ |
кг |
+ |
- |
Citrobacter+Proteus (кроме Р. inconstans, Yrsinia) |
См. тесты для идентификации видов. Фенилаланиндезаминаза, см. тесты для идентификации видов в приложении 1 |
|
Proteus (кроме Р. inconstans |
То же | ||||
|
- |
- |
- |
- |
He энтеробактерии |
|
|
+ |
- |
- |
- |
To же |
|
_____________
* Сведения по роду Erwinia не включены, так как при обычном (37 °С) культивировании посевов на пластинчатых средах указанные энтеробактерии не растут или дают замедленный скудный рост.
** При использовании среды Олькеницкого.
*** При использовании среды Клиглера проводят параллельный посев в среду с мочевиной (по Преусу или по Кристенсену).
Примечание. (+) - положительная реакция, (-) - отрицательная реакция; к - ферментация глюкозы без газообразования, кг - ферментация глюкозы с образованием газа.
ПРИЛОЖЕНИЕ 5
Наставление по применению наборов сывороток сальмонеллезных
О-комплексных и монорецепторных О- и Н-агглютинирующих
для экспресс-идентификации сальмонелл
по реакции агглютинации (РА) на стекле
Общие положения
Наборы сывороток сальмонеллезных О-комплексных и монорецепторных О- и Н-агглютинирующих предназначены для экспресс-диагностики по РА на предметном стекле 33 групп сальмонелл, выделяемых от животных, из продуктов животного происхождения и объектов внешней среды.
Сыворотки выпускают наборами N 1 и N 2 в двух коробках (табл.1).
1. Состав наборов
|
Набор N 1 |
Набор N 2 | |||
|
Номер О-комплексных сывороток |
Рецепторный состав комплексных сывороток |
Монорецепторные сыворотки | ||
|
О |
Н | |||
|
|
|
первой фазы |
второй фазы | |
|
1 |
4, 7, 8, 9, 10, 15, 19 |
6 |
i m |
e, n, x |
|
2 |
4, 11, 16, 17, 18, 21, 28 |
14 |
с t |
2 |
|
3 |
7, 11, 30, 35, 38, 39, 40 |
46 |
r p |
5 |
|
4 |
8, 16, 30, 41, 42, 43, 44 |
34 |
е h |
6 |
|
5 |
9, 17, 35, 41, 45, 47, 48 |
20 |
l v |
(1, 2, 5, 6) |
|
6 |
10, 18, 38, 42, 45, 50, 52 |
|
d |
|
|
7 |
15, 21, 39, 43, 47, 50, 53 |
|
b |
|
|
8 |
19, 28, 40, 44, 48, 52, 53 |
|
g |
|
В наборе N 1 имеется по два флакона О-комплексных сывороток N 1, 2, 3, 4 и 5 объемом 4 см каждый и по одному флакону сывороток N 6, 7 и 8 объемом 2 см
каждый и по одному флакону сывороток N 6, 7 и 8 объемом 2 см каждый.
каждый.
Этикетки на флаконах и коробках красного цвета.
В наборе N 2 имеется по одному флакону О- и Н-монорецепторных сывороток объемом 2 см каждый.
каждый.
Этикетки на флаконах и коробках зеленого цвета.
В каждую коробку с сыворотками вложено наставление по их применению.
На коробках с сыворотками должны быть наклеены этикетки с указанием предприятия-изготовителя и его товарного знака, названия набора, его номера, наименования сывороток и рецепторов, входящих в набор, числа флаконов каждой сыворотки, объема препарата во флаконе, номеров серии, госконтроля и ТУ, даты изготовления, срока годности, условий хранения.
На флаконах с сыворотками должны быть наклеены этикетки с указанием предприятия-изготовителя и его товарного знака, наименования сыворотки и рецептора (для О-комплексных сывороток - номера и рецепторного состава), даты изготовления, номеров серии, госконтроля и ТУ.
Срок годности сывороток, хранящихся при температуре 6-15 °С, составляет 3 года.
Вскрытые флаконы с неиспользованной сывороткой плотно закрывают резиновыми пробками и хранят при температуре 4-6 °С для дальнейшего использования.
Сыворотка проросшая, мутная, содержащая хлопья, к употреблению не пригодна. На дне флакона допускается выпадение осадка кристаллов борной кислоты, не мешающего учету реакции.
Порядок идентификации культур
Сыворотки используют для идентификации культур бактерий, отнесенных по морфологическим, культуральным и ферментативным свойствам к роду сальмонелла.
Испытуемую культуру выращивают на скошенном мясо-пептонном агаре 18-24 ч при температуре 37-38 °С.
Первоначально культуру испытывают с О-комплексными сыворотками. Для этого РА на стекле ставят с каждой из О-комплексных сывороток последовательно, начиная с первой, до получения положительного результата с двумя сыворотками. Серогрупповую принадлежность сальмонелл устанавливают по результатам реакции агглютинации (табл.2).
При необходимости разделения сальмонелл серогрупп С от С
от С , С
, С от С
от С ; D
; D от D
от D ; Е
; Е от E
от E проводят дополнительное исследование этих культур с монорецепторными O-сыворотками (табл.3).
проводят дополнительное исследование этих культур с монорецепторными O-сыворотками (табл.3).
Для определения серотиповой принадлежности сальмонеллы, отнесенные к определенной серогруппе, испытывают с Н-моносыворотками 1- и 2-й фаз. При выборе сывороток для реакции исходят из антигенной структуры сальмонелл той группы, к которой отнесена определяемая культура, с учетом вида исследуемого животного.
2.6. Культуры сальмонелл, не идентифицированные имеющимися в наборе сыворотками, следует направлять во Всесоюзный ордена Трудового Красного Знамени государственный научно-контрольный институт ветеринарных препаратов (123022, Москва, Д-22, Звенигородское шоссе, 5).
Техника постановки РА
Из флакона, не захватывая осадка борной кислоты, пастеровской пипеткой набирают сыворотку, одну каплю которой наносят на предметное стекло. Бактериологической петлей в нее вносят 20-24-часовую испытуемую агаровую культуру сальмонелл. Для РА с O-сыворотками культуру берут с верхней части агара, с Н-сыворотками - с нижней, вблизи конденсационной жидкости.
2. Серогрупповая принадлежность сальмонелл по результатам РА
|
Сальмонеллы | ||
|
агглютинируются комплексными сыворотками |
содержат O-антиген |
относятся к серогруппе |
|
1 и 2 |
О4 |
В |
|
1 и 3 |
О7 |
С |
|
1 и 4 |
О8 |
С |
|
1 и 5 |
О9 |
D |
|
1 и 6 |
О10 |
E |
|
1 и 7 |
О15 |
Е |
|
1 и 8 |
O19 |
E |
|
2 и 3 |
O11 |
F |
|
2 и 4 |
O16 |
J |
|
2 и 5 |
O17 |
I |
|
2 и 6 |
O18 |
K |
|
2 и 7 |
O21 |
L |
|
2 и 8 |
O28 |
М |
|
3 и 4 |
O30 |
N |
|
3 и 5 |
O35 |
O |
|
3 и 6 |
O38 |
Р |
|
3 и 7 |
O39 |
Q |
|
3 и 8 |
O40 |
R |
|
4 и 5 |
O41 |
S |
|
4 и 6 |
O42 |
Т |
|
4 и 7 |
O43 |
U |
|
4 и 8 |
O44 |
V |
|
5 и 6 |
O45 |
W |
|
5 и 7 |
O47 |
X |
|
5 и 8 |
O48 |
Y |
|
6 и 7 |
O50 |
Z |
|
6 и 8 |
O52 |
52 |
|
7 и 8 |
O53 |
53 |
3. Дифференциация сальмонелл серогрупп С от С
от С ; C
; C от С
от С ; D
; D от D
от D ; Е
; Е от Е
от Е
|
Дифференцируемые серогруппы |
Реакция с сывороткой |
Результат |
Серогрупповая принадлежность |
|
С |
О14 |
- |
C |
|
С |
О6 |
+ |
С |
|
|
|
- |
С |
|
|
|
+ |
С |
|
|
О20 |
- |
С |
|
D |
|
+ |
С |
|
|
O46 |
- |
D |
|
E |
O34 |
+ |
D |
|
|
|
- |
E |
|
|
|
+ |
E |
Примечание. (+) - положительная реакция, (-) - отрицательная.
Петлю с культурой увлажняют в капле сыворотки, затем культуру тщательно растирают рядом с каплей, смешивают с сывороткой и энергично (6-10 раз) покачивают стекло круговыми движениями.
Агглютинация наступает сразу или не позднее 1-2 мин.
Реакцию учитывают при хорошем освещении. Можно использовать ручную лупу.
O-агглютинат имеет вид плотных, с трудом разбивающихся комочков и зернышек, Н-агглютинат - крупных, рыхлых, легко разбивающихся хлопьев.
Агглютинация проявляется в виде склеивания бактериальной массы и полного или частичного просветления жидкости.
При отрицательной реакции культура после тщательного смешивания с каплей сыворотки образует гомогенную взвесь.
При появлении неспецифических реакций или установлении слабой активности сывороток необходимо сообщить об этом в ВГНКИ ветпрепаратов и предприятию-изготовителю.
Одновременно в ВГНКИ ветпрепаратов в соответствии с указанием Главного управления ветеринарии "О порядке предъявления рекламаций на биопрепараты" направляют с нарочным одну коробку с сыворотками.
ПРИЛОЖЕНИЕ 6
Наставление по применению диагностических агглютинирующих
адсорбированных сальмонеллезных О- и Н-сывороток
Агглютинирующие адсорбированные О- и Н-сыворотки выпускаются согласно серологической классификации бактерий рода сальмонелла наборами и отдельными рецепторами. Кроме монорецепторных О- и Н-сывороток производят поливалентную сальмонеллезную О-сыворотку против сальмонелл основных пяти групп (А, В, С, D, E):
|
О-сыворотки |
Н-сыворотки | |
|
1 |
а | |
|
2 |
b | |
|
3, 10 |
с | |
|
4 |
d | |
|
5 |
e, n | |
|
6 |
e, n, z | |
|
6 |
e, n, z | |
|
7 |
f | |
|
8 |
g | |
|
9 |
i | |
|
10 |
h | |
|
11 |
k | |
|
12 комплексная |
l, v | |
|
12 |
m | |
|
12 |
p | |
|
13, 22 |
q | |
|
14, 24 |
r | |
|
15 |
s, t | |
|
16 |
s | |
|
17 |
t | |
|
18 |
v | |
|
19 |
l | |
|
20 |
15 | |
|
21 |
x | |
|
23 |
y | |
|
24 |
w | |
|
25 |
z | |
|
27 |
z | |
|
28 |
z | |
|
30 |
z | |
|
34 |
z | |
|
35 |
z | |
|
38 |
z | |
|
39 |
z | |
|
40 |
z | |
|
41 |
z | |
|
42 |
z | |
|
43 |
z | |
|
44 |
z | |
|
45 |
z | |
|
46 |
1,2 |
|
|
48 |
2 |
|
|
54 |
Полив Q - f, g; g; m; | |
|
55 |
g, p; g, p, u, q; s, t, m, | |
|
57 |
l; g, m, s | |
|
58 |
z | |
|
59 |
L - 1, 2; 1, 5; 1, 6; 1, 7; | |
|
60 |
z | |
|
61 |
| |
|
Полив A, B, C, D, E |
||
Наборы О- и Н-сывороток выпускают двух видов.
Узкий набор состоит из 28 рецепторов, из них О-сыворотки 1; 2; 3; 10; 4; 5; 6; 7; 8; 9; vi-полив А, В, С, D, Е и Н-cыворотки а, в, с, d, en, ... st, g, eh, i, lv, m, r, x, 1,2; 1,5 и компоненты вторых фаз 2, 5 для идентификации наиболее распространенных бактерий сальмонелла. В наборе 56 мл.
Расширенный набор включает 108 рецепторов. В наборе 216 мл.
Монорецепторные О- и Н-сыворотки применяют для идентификации бактерий рода сальмонелла по реакции агглютинации на предметном стекле, поливалентную - для отбора культур из первичных посевов.
Поливалентная сыворотка против сальмонелл основных групп содержит O-агглютинины против антигенов 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 19, 26 и vi.
При агглютинации культуры с O-сывороткой определяют ее групповую принадлежность. Затем при помощи Н-сывороток соответствующей группы окончательно устанавливают тип испытуемой культуры.
Поливалентные Н-сыворотки Q, z , L применяют также в реакции на стекле для упрощенной идентификации сальмонелл - определения антигенных комплексов, включающих родственные Н-антигены.
, L применяют также в реакции на стекле для упрощенной идентификации сальмонелл - определения антигенных комплексов, включающих родственные Н-антигены.
Сухие сыворотки перед употреблением растворяют в стерильном физиологическом растворе из расчета 2 мл на ампулу, что соответствует первоначальному объему сыворотки до высушивания. Растворенные сыворотки используют в реакции агглютинации на стекле без дальнейшего разведения.
Методика. На стекло пипеткой наносят каплю агглютинирующей сыворотки, затем испытуемую культуру после 20-часового выращивания на агаре наносят петлей вблизи края капли и растирают не месте. Далее петлей берут сыворотку из рядом лежащей капли, вносят в бактерийную массу и повторно растирают. Для определения О-антигена культуру берут с верхней части скошенного в пробирке агара, а для определения Н-антигена - с нижней.
Диагностические сыворотки консервированы очищенной борной кислотой. В случае дополнительного консервирования рекомендуется применять борную кислоту.
Растворенные сыворотки должны храниться в пробирках под резиновыми пробками, сухие - в прохладном и сухом месте.
Все замечания по качеству агглютинирующих сывороток для идентификации бактерий рода сальмонелла следует направлять в институт, изготовляющий препараты.
ПРИЛОЖЕНИЕ 7
Временное наставление по применению эритроцитарного антигена
для диагностики пуллороза-тифа птиц по кровекапельной реакции
непрямой гемагглютинации (ККРНГА)
Пуллорный эритроцитарный антиген для кровекапельной реакции непрямой гемагглютинации представляет собой жидкость коричневого цвета, состоящую из 10%-ной взвеси формалинизированных эритроцитов барана, сенсибилизированных полисахаридно-полипептидной фракцией возбудителя пуллороза-тифа, на фосфатно-буферном растворе. В процессе хранения эритроциты выпадают в осадок, легко разбивающийся при встряхивании в гомогенную взвесь.
Эритроцитарный антиген расфасован в флаконы. На каждом флаконе должна быть этикетка с указанием предприятия-изготовителя, наименования биопрепарата и количества его в флаконе, даты изготовления, номера серии, контроля, срока годности и условий хранения.
Срок годности антигена 9 мес со дня изготовления при хранении его в темном, сухом помещении при температуре 4-8 °С. Антиген, подвергшийся замораживанию или содержащий хлопья, комочки, а также при нарушении целостности флакона к применению непригоден.
Исследования птицы на пуллороз-тиф по ККРНГА проводят в возрасте 50-55 дней и повторно в возрасте 7 мес. При неблагополучии хозяйства по пуллорозу-тифу последующие исследования осуществляют в сроки, предусмотренные действующей "Инструкцией о мероприятиях по борьбе с пуллорозом-тифом птиц".
Кровь для ККРНГА берут у птицы из гребня или подкрыльцевой вены. Каплю крови наносят на сухое, обезжиренное предметное стекло и добавляют антиген. Соотношение антигена и крови должно быть 1:1. Можно вначале на стекло нанести антиген и к нему добавить каплю крови. Последовательность нанесения компонентов реакции на предметное стекло не отражается на результатах исследования. Кровь смешивают с антигеном покачиванием предметного стекла на грелке-качалке при температуре 37-40 °С. Температура в помещении, где ставят реакцию, должна быть не ниже 18 °С. На одном предметном стекле ставят одновременно не более трех реакций.
Реакцию на эритроцитарный антиген считают положительной, если в течение 2 мин в смеси крови с антигеном выпали хорошо заметные хлопья коричневого цвета, сомнительной - если за это же время появились слабовыраженные мелкозернистые хлопья коричневого цвета.
Отрицательная реакция характеризуется образованием в капле крови с антигеном равномерной стабильной гомогенной взвеси эритроцитов барана.
Птицу, кровь которой дала положительную или сомнительную реакцию с антигеном, изолируют и отправляют на убой.
Во избежание неспецифических реакций за 5-7 дней до исследования из рациона птицы исключают избыточное количество рыбьего жира, белка, антибиотики и другие лекарственные препараты.
ПРИЛОЖЕНИЕ 8
Постановка реакции пассивной гемагглютинации (РПГА) с цистеиновой пробой
для диагностики сальмонеллезов человека, выявления
и дифференциации различных форм бактерионосительства
1. Общие положения
При серологической диагностике сальмонеллезов большое диагностическое значение имеют имуноглобулины, образование которых обусловливает нарастание титра антител в крови лиц, инфицированных сальмонеллами в определенные периоды жизни. При этом наиболее специфичны в диагностическом плане IgG-антитела. Вместе с тем IgM-антитела появляются в крови раньше других. Они могут образовываться и у здоровых лиц в результате "бытовой" иммунизации или вследствие ранее перенесенной инфекции, т.е. IgM-aнтитела менее специфичны.
IgM-антитела инактивируются при обработке сыворотки крови цистеином, тогда как IgG-антитела резистентны к этому препарату. После обработки сыворотки крови цистеином в РПГА выявляются только IgG-антитела, тем самым повышается специфичность реакции.
Скорость образования антител и их титр зависят от возраста больного, стадии и тяжести течения болезни, состояния преморбидного фона и других факторов, отражаемых в анализе.
2. Порядок исследования крови человека
2.1. Сыворотку крови взрослых людей исследуют дважды: сразу после поступления больного в стационар и на второй неделе болезни, а при возможности исследование проводят и в период реконвалесценции.
2.2. Сыворотку крови детей первых двух лет жизни исследуют в динамике сразу после поступления ребенка в стационар, затем каждые 7-10 дней. При невозможности проведения повторных исследований однократное серологическое обследование назначают в следующие сроки в зависимости от возраста ребенка:
до года при легкой и средне-тяжелой формах - на третьей неделе болезни, при тяжелой форме - на четвертый-шестой;
в возрасте одного-трех лет - на второй неделе независимо от тяжести болезни;
старше трех лет независимо от тяжести болезни - на шестой-седьмой день.
Исследование проводят, как указано в п.3.1.
В таблице приведен уровень антител в крови детей.
3. Постановка РПГА
3.1. Сыворотку крови исследуют в РПГА с комплексным антигеном без цистеина. При высоком (не ниже 1:320) титре или нарастании уровня антител (и отрицательном результате бактериологического исследования) сыворотку исследуют в РПГА с цистеином со всеми групповыми О-диагностикумами. При этом следует учитывать, что в случае хронического носительства титры суммарных антител могут быть и более низкими. В этом случае при положительном результате бактериологического исследования необходимо ставить РПГА с цистеином.
3.2. Определение антител в РПГА без цистеина
3.2.1. Для постановки реакции исследуемую сыворотку крови разводят 0,85%-ным раствором натрия хлорида в соотношении 1:10.
3.2.2. Для титрования готовят раствор 0,85%-ного натрия хлорида на фосфатном буфере (рН 7,0-7,2).
3.2.3. В реакции используют коммерческие эритроцитарные сальмонеллезные О-диагностикумы основных серологических групп (А, В, С , С
, С , D и E) и комплексный (поливалентный) О-диагностикум.
, D и E) и комплексный (поливалентный) О-диагностикум.
3.2.4. Во все лунки полистироловой пластины разливают по 0,5 мл раствора для титрования.
В первую лунку ряда вносят 0,5 мл исследуемой (разведенной) сыворотки. Содержимое лунки тщательно перемешивают и 0,5 мл смеси переносят во вторую лунку, затем, после перемешивания, - в третью и т.д. до последней лунки ряда.
В каждую лунку ряда вносят 0,1 мл 1%-ной взвеси диагностикума, затем пластину встряхивают для перемешивания компонентов и помещают в термостат на 3 ч или оставляют при комнатной температуре на 18-20 ч.
Уровень антител в крови у детей
|
Возраст ребенка |
Суммарные О-антитела |
Цистеиноустойчивые О-антитела | ||||
|
титр на первой неделе болезни |
максимальный уровень |
титр на первой неделе болезни |
максимальный уровень | |||
|
|
|
сроки появления, неделя |
титр |
сроки появления, неделя |
титр | |
|
До 3 мес |
1:20-1:40 |
4-5-я |
Не более 1:320 |
Отсутствуют |
4-5-я |
1:20-1:40 |
|
3-6 мес |
1:20-1:80 |
4-5-я |
До 1:320 |
1:20 у 10% детей |
4-5-я |
1:20-1:80 |
|
6-12 мес |
1:20-1:160 |
4-5-я |
1:320 и выше |
1:20 у 30-40% детей |
5-я |
До 1:160 |
|
Старше 1 года |
1:80-1:320 |
3-4-я |
1:320 и выше |
1:80-1:320 |
3-4-я |
1:320 и выше |
|
Старше 8 лет |
1:80-1:320 |
2-3-я |
1:320 и выше |
1:80-1:320 |
2-3-я |
1:320 и выше |
3.3. Определение антител в РПГА с цистеином
3.3.1. Для определения в сыворотке крови удельного содержания IgG-антител готовят раствор цистеина. Для этого 10-15 мг солянокислого L-цистеина (производства Венгрии) или ''свободного" цистеина квалификации "ч" растворяют в 1 мл 0,1 н. раствора едкого натра с таким расчетом, чтобы рН готового раствора равнялся 7,0-7,2. Готовый раствор хранят не более 1 ч.
3.3.2. Исследуемую сыворотку разводят 0,85%-ным раствором натрия хлорида в соотношении 1:5 и смешивают с равным объемом раствора цистеина. Пробирку герметизируют (резиновой пробкой, лейкопластырем, парафином) и помещают в термостат на 18-20 ч при температуре 37 °С.
Дальнейшее исследование проводят, как указано в п.3.2.4, при этом в раствор для титрования добавляют 1% нормальной инактивированной сыворотки крови (лошадиной, кроличьей, крупного рогатого скота). Сыворотка должна быть проверена на отсутствие антител к применяемым диагностикумам.
4. Учет РПГА и интерпретация результатов
4.1. Реакция агглютинации считается положительной, если эритроциты полностью агглютинировались и расположены равномерно по дну лунки или при почти полной агглютинации небольшая часть эритроцитов оседает в центре лунки в виде ровного колечка или пуговки. Иногда при положительной реакции края агглютината в лунках могут слегка сползать, и он принимает вид "зонтика". При отрицательном результате агглютината нет, эритроциты оседают на дне в центре в виде пуговки или ровного колечка.
4.2. В случаях выявления нескольких возбудителей с неясной этиологией отсутствие нарастания титра антител (особенно IgG) позволяет предположить транзиторный характер выделения сальмонелл.
4.3. В случае возникновения вспышки сальмонеллеза серологически обследуют максимальное число лиц, подвергшихся риску заражения или подозреваемых в передаче возбудителя.
При этом обнаружение (обычно в низких титрах) антител в РПГА без цистеина и отсутствие последних при исследовании сыворотки в РПГА с цистеином характеризует транзиторное сальмонеллоносительство.
Достаточно высокий титр в РПГА с цистеином показывает хроническое сальмонеллоносительство или переболевание сальмонеллезом (даже субклинически) в течение последних 1-2 мес.
4.4. В случае контроля за бактерионосительством стабильное снижение титра антител (особенно IgG), подтверждаемое отрицательными бактериологическими исследованиями, позволяет сделать заключение об освобождении организма от возбудителя.
ПРИЛОЖЕНИЕ 9
Рекомендуемый перечень объектов, подлежащих плановым исследованиям
в порядке эпидемиологического и эпизоотологического надзора,
и частота их обследования*
_____________
* "Методические указания по санитарно-бактериологическому контролю на предприятиях общественного питания и торговли пищевыми продуктами" от 31.12.82 г. "Нормативы проведения основных санитарно-бактериологических исследований объектов окружающей среды'' от 24.02.83 г.
1. Исследования, проводимые лабораториями санитарно-эпидемиологических станций.
1.1. Предприятия общественного питания
Смывы с оборудования, инвентаря, разделочных досок, посуды, рук персонала, санодежды и т.п. при температуре воздуха 10 °С и выше - 1 раз в месяц; при температуре воздуха ниже 10 °С - 1 paз в 2 мес.
Готовые блюда, салаты, винегреты из вареных овощей, вторые блюда из рубленого мяса, подливы, паштеты, студни и т.д. при температура воздуха 10 °С и выше - 1 раз в месяц; при температуре воздуха ниже 10 °С - 1 раз в 2 мес.
Смывы из кондитерских цехов, с поверхности яиц после обработки, из помещения для приготовления кремов, с оборудования участка готовой продукции (емкости для кремов), рук персонала, тары, из холодильной камеры и т.д. - 1 раз в 2 мес.
Крем с готовых изделий, меланж - 1 раз в 2 мес.
Смывы с оборудования в цехе готовых охлажденных блюд, аппаратуры, рук персонала, санодежды и т.д., а также готовые охлажденные блюда - ежемесячно.
1.2. Предприятия торговли продуктами питания
Смывы с оборудования, инвентаря, разделочных досок, посуды, рук персонала, в производственных и вспомогательных помещениях при температуре воздуха 10 °С и выше - 1 раз в 2 мес; при температуре воздуха ниже 10 °С - 1 раз в 4 мес.
Вареные колбасные изделия, изготовленные на мясокомбинатах и кооперативных предприятиях (вареные колбасы, сосиски, сардельки, мясные хлебы, зельцы, кровяные, ливерные колбасы) при температуре воздуха 10 °С и выше - 1 раз в 2 мес; при температуре воздуха ниже 10 °С - 1 раз в 4 мес.
Варено-запеченные изделия (окороки "Тамбовский", "Московский", ''Воронежский'", говядина прессованная, рулеты, буженина и т.п.) при температуре воздуха 10 °С и выше - 1 раз в 2 мес; при температуре воздуха ниже 10 °С - 1 раз в 4 мес.
Студни, паштеты, изготовленные на мясокомбинатах, при температуре воздуха 10 °С и выше - 1 раз в 2 мес; при температуре воздуха ниже 10 °С - 1 раз в 4 мес.
Рыба холодного и горячего копчения, кулинарные изделия из рыбы при температуре воздуха 10 °С и выше - 1 раз в 2 мес; при температуре воздуха ниже 10 °С - 1 раз в 2 мес.
1.3. Комбинаты, производящие детские сухие смеси
Смывы с оборудования, аппаратуры, рук персонала, санодежды во всех цехах и производственных помещениях - ежемесячно.
Молоко коровье сухое, обезжиренное - 6-8 раз в год. Готовые детские сухие смеси типа "Детолакт", "Малютка", "Малыш" - ежемесячно.
1.4. Детские молочные кухни
Смывы с оборудования в производственных помещениях, в том числе в помещениях для хранения готовой продукции, рук персонала - 1 раз в 2 мес.
Готовые смеси (в том числе стерилизованные) ''Малютка", "Малыш", заквасочные культуры - ежемесячно.
1.5. Предприятия молокоперерабатывающей промышленности
Смывы с приемных ванн, танков, шлангов, кранов, стеклотары, укупорочного материала - ежемесячно.
Молоко пастеризованное, сухое, сливки сухие - ежеквартально.
Смывы с инвентаря и оборудования в творожном цехе, с упаковочного материала, рук персонала, санодежды и т.д. - ежемесячно.
Творожные изделия - ежемесячно.
Жидкие заквасочные культуры творога, сметаны, ряженки, простокваши, ацидофильного молока, кефира, кумыса и т.д., в цехе по изготовлению мороженого, мороженое всех сортов - 1 раз в 2-3 мес.
1.6. Предприятия маргариновой промышленности
Смывы с оборудования, трубопроводов после мойки и дезинфекции банок, крышек майонезных банок, рук персонала - ежеквартально.
Маргарин, майонез - ежеквартально.
1.7. Предприятия мясоперерабатывающей промышленности
Смывы, взятые до начала работы с обвалочного, шприцевого, ливерного оборудования колбасного и консервного цехов, тары, рук персонала, саноодежды, смывы с поверхности готовой продукции, готовая продукция, мясо и субпродукты и т.д. - ежеквартально.
1.8. Предприятия рыбоперерабатывающей промышленности
Смывы с оборудования, инвентаря, разливных машин, рук персонала, санодежды и т.д., в цехах рыбопосольном, консервном, коптильном, икорном - ежеквартально.
Рыба горячего и холодного копчения, а также сырая - ежеквартально.
1.9. Предприятия холодильной промышленности
Смывы с оборудования и инвентаря, варочных автоматов, рук персонала, санодежды и т.д. - 1 раз в 2 мес.
Готовые блюда - 1 раз в 2 мес.
1.10. Предприятия макаронной промышленности
Смывы с оборудования моечного отделения, инвентаря, бастуков, матриц, поверхности яиц и сит в яйцебитке, яичная масса и т.д. - 1 раз в 2-3 мес.
1.11. Импортируемые продукты питания
Мясные изделия, меланж яичный, детские сухие смеси, молочные и рыбопродукты - по мере поступления.
1.12. Сточные воды
До обеззараживания их для изучения циркуляции возбудителей среди населения - 1-2 раза в год.
1.13. Птицеводческие предприятия
Товарное яйцо (30 шт.), смывы с яйца, а также с инвентаря и оборудования яйцесклада, смывы из холодильных камер, три тушки птицы - 2-4 раза в год.
Смывы с оборудования убойного цеха и санитарной бойни по ходу технологического процесса (поверхности рабочих столов, ножей и другого мелкого инвентаря, проб вод из ванн для мытья, ошпарки и охлаждения тушек) не ранее чем через 1 ч после начала работы.
1.14. Молочно-товарные фермы
Смывы с внутренней поверхности цистерн, танков и других емкостей для хранения молока, рабочих поверхностей охладителей и пастеризаторов, инвентаря убойного пункта (поверхности столов, разделочной колоды, тары для сбора субпродуктов, внутренних поверхностей холодильной камеры) - 1 раз в 6 мес.
1.15. Свиноводческие комплексы (фермы)
Смывы с инвентаря убойного пункта (поверхности столов, разделочной колоды, тары для сбора субпродуктов, внутренних поверхностей холодильной камеры) - 1 раз в 6 мес.
Исследования, предусмотренные в пп.1.13-1.15, целесообразно проводить совместно со специалистами ветеринарных лабораторий.
2. Исследования, проводимые ветеринарными лабораториями
2.1. Замершие эмбрионы, трупы молодняка птиц, корма животного происхождения и комбикорма исследуют согласно действующей "Инструкции о мероприятиях по профилактике и ликвидации заболевания кур и индеек пуллорозом-тифом".
2.2. Выявленную птицу, кровь которой реагирует по ККРНГА с пуллорным антигеном, исследуют бактериологически (не более 20 гол.).
2.3. На молочно-товарных фермах, комплексах по выращиванию нетелей и откормке молодняка крупного рогатого скота, свиноводческих комплексах, убойных пунктах хозяйств исследуют сточные воды согласно п.3.4.19 данных методических указаний 2 раза в год.
2.4. Жидкие корма (ЗЦМ, ацидофилин и т.п.) - 1 раз в 6 мес.
3. Мясокостная (костная) и рыбная мука
Пробы этих кормов исследуют в ветеринарных или в ведомственных лабораториях птицефабрик, мясо- и рыбоперерабатывающих предприятий, комбикормовых и ветеринарно-санитарных заводов - каждую партию.
2.5. Исследования согласно пп. 1.13-1.15 совместно с лабораториями санитарно-эпидемиологической службы - 2-4 раза в год.
В случае возникновения неблагополучной эпидемиологической ситуации по сальмонеллезу специалисты санитарно-эпидемиологической и ветеринарной служб проводят дополнительные исследования продукции животноводства, птицеводства, других объектов внешней среды. При необходимости осуществляют внеочередное бактериологическое обследование контингентов, определенных Приказом Минздрава СССР N 555 от 29.09.89 г.
ПРИЛОЖЕНИЕ 10
Определение биоваров сальмонелл
В пределах некоторых сероваров сальмонелл наблюдается различная ферментативная активность в отношении отдельных углеводов, органических кислот или многоатомных спиртов. Это позволяет проводить биохимическое типирование штаммов сальмонелл, относящихся к таким сероварам.
Типирование можно осуществлять по любой комбинации тестов, по отношению к которым выявлены вариабельные свойства у штаммов одного серовара.
Наибольшее число биоваров сальмонелл выявлено среди штаммов S. typhimurium (табл.).
Биовары S. typhimurium
|
Биовар |
Арабиноза |
Ксилоза |
Рамноза |
i-тартрат |
d-тартрат |
Мукат |
Инозит |
|
1-й |
+ |
- |
- |
- |
- |
- |
- |
|
2-й |
+ |
+ |
- |
- |
- |
- |
- |
|
3-й |
+ |
+ |
+ |
- |
- |
- |
- |
|
4-й |
+ |
+ |
+ |
- |
- |
- |
- |
|
5-й |
+ |
+ |
+ |
+ |
+ |
- |
- |
|
6-й |
+ |
+ |
+ |
+ |
+ |
+ |
- |
|
7-й |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
8-й |
+ |
- |
+ |
+ |
+ |
+ |
+ |
|
9-й |
+ |
+ |
- |
+ |
+ |
+ |
|
|
10-й |
+ |
+ |
- |
+ |
+ |
- |
+ |
|
11-й |
- |
+ |
+ |
- |
- |
+ |
+ |
|
12-й |
+ |
+ |
- |
+ |
+ |
+ |
- |
|
13-й |
- |
- |
- |
+ |
+ |
+ |
+ |
|
14-й |
- |
- |
+ |
+ |
+ |
+ |
+ |
|
15-й |
+ |
- |
+ |
+ |
+ |
+ |
- |
|
16-й |
+ |
- |
+ |
- |
- |
+ |
+ |
|
17-й |
+ |
+ |
+ |
- |
- |
+ |
- |
|
18-й |
+ |
+ |
+ |
- |
- |
+ |
+ |
|
19-й |
+ |
+ |
+ |
- |
- |
- |
+ |
|
20-й |
+ |
+ |
+ |
- |
+ |
- |
- |
|
21-й |
+ |
+ |
+ |
+ |
- |
+ |
+ |
|
22-й |
+ |
+ |
+ |
- |
+ |
+ |
- |
|
23-й |
+ |
+ |
+ |
- |
+ |
+ |
+ |
|
24-й |
+ |
+ |
+ |
+ |
- |
+ |
- |
|
25-й |
+ |
+ |
+ |
+ |
+ |
- |
+ |
В настоящее время типирование среди S. enteritidis проводят по способности к ферментации бульона Штерна и наличию лизиндекарбоксилазы. S. enteritidis var. ratin характеризуется отсутствием указанных ферментов, a S. enteritidis var jena - их наличием.
По способности ферментировать d-тартрат различают S. java (d-тартрат положительна) и S. paratyphi В (d-тартрат отрицательна).

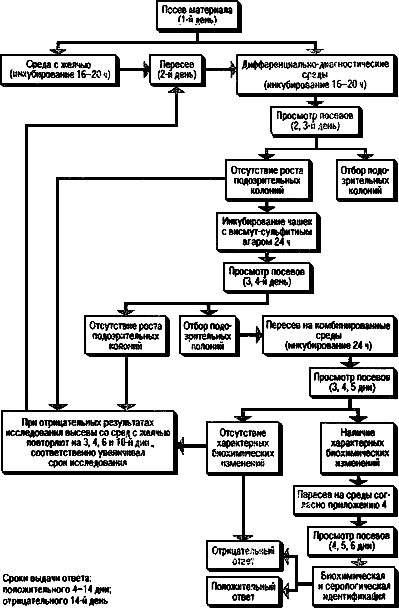
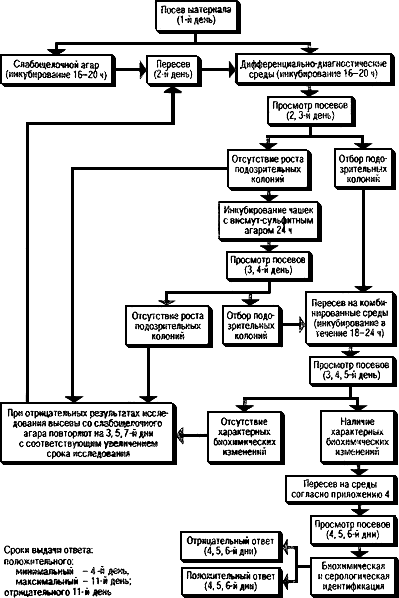
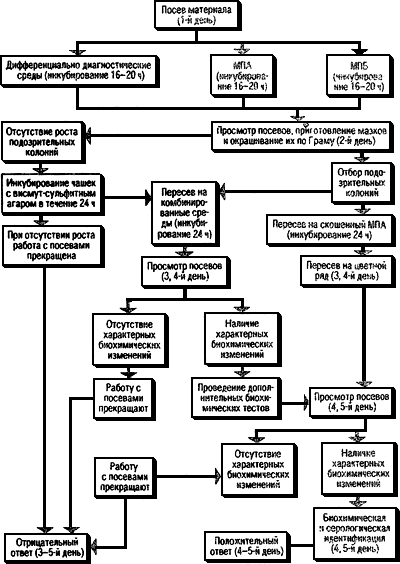
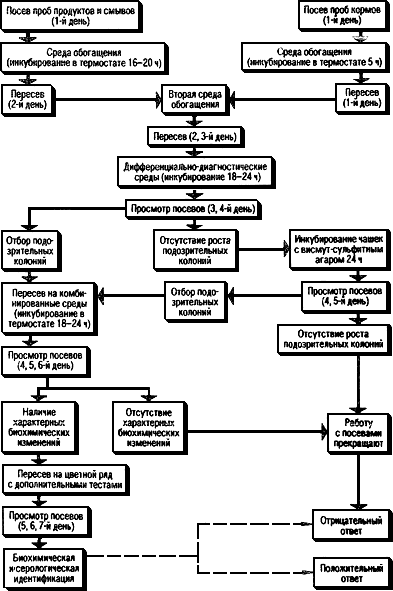
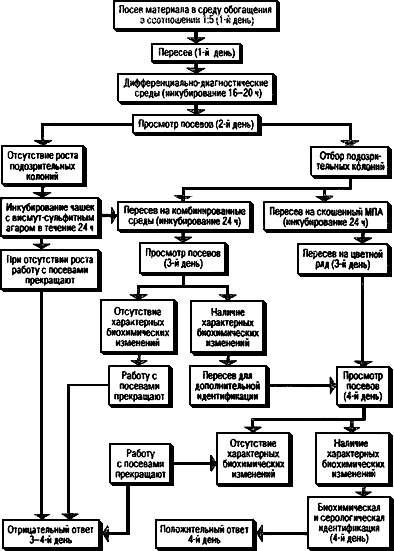
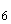
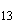 , z
, z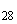
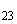
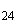
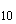
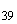
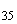
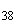
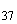 )
) 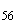 )
) 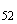
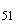
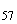 )
) 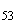
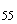
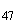
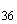
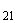
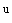
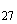
 общие вторых фаз
общие вторых фаз  частичные вторых фаз
частичные вторых фаз  «Я не смогла вовремя остановиться»: Новый день для Дарьи из...
«Я не смогла вовремя остановиться»: Новый день для Дарьи из...  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов