- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
ГОСТ 20264.2-88
Группа С09
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРЕПАРАТЫ ФЕРМЕНТНЫЕ
Методы определения протеолитической активности
Enzyme preparations.
Methods for determination of proteolytic activity
МКС 07.100.30
65.120
ОКСТУ 9291
Дата введения 1989-01-01
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Министерством медицинской и микробиологической промышленности СССР
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 02.03.88 N 440
3. ВЗАМЕН ГОСТ 20264.2-74
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначение НТД, на который дана ссылка |
Номер раздела, пункта |
|
2.2 | |
|
2.2, 3.1 | |
|
2.2 | |
|
3.1 | |
|
2.2 | |
|
2.2 | |
|
2.2 | |
|
2.2 | |
|
2.2 | |
|
2.2 | |
|
ГОСТ 10931-74 |
2.2 |
|
2.2 | |
|
2.2 | |
|
ГОСТ 18289-78 |
2.2 |
|
Раздел 1 | |
|
2.2 | |
|
2.2 | |
|
2.2 | |
|
2.2 | |
|
2.2 |
5. Ограничение срока действия снято по протоколу N 3-93 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 5-6-93)
6. ИЗДАНИЕ с Изменением N 1, утвержденным в декабре 1989 г. (ИУС 4-90)
Настоящий стандарт распространяется на ферментные препараты и устанавливает методы определения протеолитической активности ферментных препаратов микробного происхождения.
1. МЕТОД ОТБОРА ПРОБ - по ГОСТ 20264.0
2. МЕТОД ОПРЕДЕЛЕНИЯ ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТИ (ПС)
(модифицированный метод Ансона)
2.1. Метод основан на гидролизе казеината натрия исследуемым ферментным препаратом до пептидов и аминокислот с последующим их определением.
За единицу протеолитической активности принята способность фермента превращать за 1 мин при температуре 30 °С казеинат натрия в неосаждаемое трихлоруксусной кислотой состояние в количестве, соответствующем 1 мкмолю тирозина.
Протеолитическую активность выражают числом указанных единиц в 1 г испытуемого препарата.
Активность грибных и бактериальных протеиназ определяют при значениях рН в следующих диапазонах:
2,5±0,2 и 5,5±0,2 - кислые протеиназы;
7,2±0,2 - нейтральные протеиназы;
9,5±0,2 - щелочные протеиназы.
2.2. Аппаратура, материалы, реактивы, растворы
Весы лабораторные общего назначения по ГОСТ 24104*;
________________
* С 1 июля 2002 г. введен в действие ГОСТ 24104-2001.
2-го класса точности с наибольшим пределом взвешивания 200 г;
1-го класса точности с наибольшим пределом взвешивания 200 г или 2-го класса точности с наибольшим пределом взвешивания 20 г.
Прибор для определения рН среды в диапазоне от 0 до 14 с погрешностью измерения ±0,1 единиц рН.
Мешалка магнитная любого типа, обеспечивающая 3000 об/мин.
Термостат любого типа, обеспечивающий температуру нагрева 40±0,2 °С.
Колориметр фотоэлектрический лабораторный, обеспечивающий измерения в интервалах длин волн 630-670 нм с погрешностью ±1% (по коэффициенту пропускания) или 0,01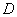 (по оптической плотности).
(по оптической плотности).
Секундомер.
Термометры 0-150 °С по ГОСТ 28498 с ценой деления 1 °С.
Холодильник бытовой любой марки.
Электроплитка с терморегулятором по ГОСТ 14919.
Баня водяная любого типа.
Холодильник ХСВО 10 ХС по ГОСТ 25336.
Стаканы любого типа и исполнения вместимостью 100, 250, 600, 1000 и 2000 см по ГОСТ 25336.
по ГОСТ 25336.
Стаканчики для взвешивания СВ-19/9 или СВ-24/10 по ГОСТ 25336.
Колбы типов П и Кн любого исполнения вместимостью 100, 250, 500, 1000 см по ГОСТ 25336.
по ГОСТ 25336.
Колбы типов К-1-2000-45/40 ТС, К-2-200-45/40 ТС по ГОСТ 25336.
Колбы мерные исполнения 1 или 2, любого класса точности, наливные вместимостью 50, 100, 200, 250, 500, 1000 и 2000 см по ГОСТ 1770.
по ГОСТ 1770.
Пробирки П1-16-150 ХС, П2-16-180 ХС по ГОСТ 25336.
Цилиндры любого исполнения вместимостью 50 и 100 см по ГОСТ 1770.
по ГОСТ 1770.
Пипетки любого исполнения вместимостью 1, 2, 5 и 10 см по ГОСТ 29227.
по ГОСТ 29227.
Бюретки по ГОСТ 29251.
Воронки стеклянные типа В по ГОСТ 25336.
Бумага фильтровальная лабораторная по ГОСТ 12026.
Кислота уксусная по ГОСТ 61, раствор концентрации 0,1 моль/дм .
.
Кислота ортофосфорная по ГОСТ 6552, раствор с массовой долей кислоты 85% и раствор концентрации 0,1 моль/дм .
.
Кислота борная по ГОСТ 9656, раствор концентрации 0,1 моль/дм .
.
Натрий вольфрамовокислый 2-водный по ГОСТ 18289.
Натрий молибденовокислый по ГОСТ 10931.
Литий сернокислый.
Кислота соляная по ГОСТ 3118, концентрированная, раствор концентрации 1 моль/дм и 0,2 моль/дм
и 0,2 моль/дм .
.
Бром по ГОСТ 4109.
Натрия гидроокись по ГОСТ 4328, раствор концентрации 1 моль/дм и 0,1 моль/дм
и 0,1 моль/дм .
.
Натрий казеиновокислый (казеинат натрия).
Натрий углекислый по ГОСТ 83, раствор концентрации 0,5 моль/дм .
.
Тирозин.
Кислота трихлоруксусная (ТХУ).
Фенолфталеин.
Вода дистиллированная по ГОСТ 6709.
Примечания:
1. Все реактивы должны быть марки х.ч. или ч.д.а., кроме трихлоруксусной кислоты, которая используется марки ч.
2. Допускается использование импортной посуды и приборов с аналогичными техническими характеристиками.
2.3. Подготовка к испытанию
2.3.1. Приготовление универсального буферного раствора 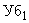 концентрации 0,1 моль/дм
концентрации 0,1 моль/дм
Для приготовления универсального буферного раствора 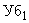 готовят растворы концентрации 0,1 моль/дм
готовят растворы концентрации 0,1 моль/дм : уксусной кислоты (раствор А), ортофосфорной кислоты (раствор В) и борной кислоты (раствор С) и смешивают их в равных соотношениях. Получают буферный раствор с рН 1,8. Добавляя к этой смеси различные объемы раствора гидроокиси натрия концентрации 1 моль/дм
: уксусной кислоты (раствор А), ортофосфорной кислоты (раствор В) и борной кислоты (раствор С) и смешивают их в равных соотношениях. Получают буферный раствор с рН 1,8. Добавляя к этой смеси различные объемы раствора гидроокиси натрия концентрации 1 моль/дм получают буферные растворы:
получают буферные растворы:
а) рН реакционной смеси 2,5±0,2 и 5,5±0,2 (для кислых протеиназ);
б) рН реакционной смеси 7,2±0,2 (для нейтральных протеиназ);
в) рН реакционной смеси 9,5±0,2 (для щелочных протеиназ).
2.3.2. Приготовление универсального буферного раствора  концентрации 0,5 моль/дм
концентрации 0,5 моль/дм
Для приготовления универсального буферного раствора  готовят растворы А, В и С концентрации 0,5 моль/дм
готовят растворы А, В и С концентрации 0,5 моль/дм и смешивают их в равных соотношениях.
и смешивают их в равных соотношениях.
2.3.3. Приготовление универсального буферного раствора  концентрации 0,01 моль/дм
концентрации 0,01 моль/дм
Универсальный буферный раствор  готовят смешиванием девяти объемов дистиллированной воды с одним объемом буферного раствора
готовят смешиванием девяти объемов дистиллированной воды с одним объемом буферного раствора 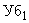 .
.
2.3.4. Приготовление реактива Фолина (основной раствор)
Для приготовления основного раствора Фолина в круглодонную колбу с пришлифованным обратным холодильником вместимостью 2000 см наливают 700 см
наливают 700 см дистиллированной воды, добавляют 100,00 г вольфрамовокислого натрия и 25,00 г молибденовокислого натрия. Затем приливают 50 см
дистиллированной воды, добавляют 100,00 г вольфрамовокислого натрия и 25,00 г молибденовокислого натрия. Затем приливают 50 см ортофосфорной кислоты с массовой долей 85% и 100 см
ортофосфорной кислоты с массовой долей 85% и 100 см концентрированной соляной кислоты. Смесь кипятят на слабом огне на асбестовой сетке в течение 10 ч. Кипячение допускается прерывать.
концентрированной соляной кислоты. Смесь кипятят на слабом огне на асбестовой сетке в течение 10 ч. Кипячение допускается прерывать.
В охлажденную смесь добавляют 150,00 г сернокислого лития, 50 см дистиллированной воды и пять капель брома. Открытую колбу кипятят на слабом огне под тягой в течение 15-20 мин, чтобы удалить избыток паров брома. Раствор должен иметь желтую окраску. После охлаждения раствор доводят дистиллированной водой до 1000 см
дистиллированной воды и пять капель брома. Открытую колбу кипятят на слабом огне под тягой в течение 15-20 мин, чтобы удалить избыток паров брома. Раствор должен иметь желтую окраску. После охлаждения раствор доводят дистиллированной водой до 1000 см (при необходимости фильтруют через трубку Аллина, заполненную стеклянной ватой).
(при необходимости фильтруют через трубку Аллина, заполненную стеклянной ватой).
Приготовленный раствор хранят в склянке из темного стекла в холодильнике. Через 2-3 мес хранения следует добавить в него 1-2 капли брома и снова прокипятить в течение 15-20 мин. Показателем непригодности раствора считается его помутнение и изменение окраски из желтой в зеленую.
Концентрацию реактива Фолина проверяют титрованием разбавленного 1:10 реактива Фолина раствором гидроокиси натрия концентрации 0,1 моль/дм по фенолфталеину. Реактив Фолина должен быть концентрации 2 моль/дм
по фенолфталеину. Реактив Фолина должен быть концентрации 2 моль/дм по кислоте. Если кислотность реактива Фолина больше 2 моль/дм
по кислоте. Если кислотность реактива Фолина больше 2 моль/дм , то его разбавляют дистиллированной водой, если меньше - реактив для работы не пригоден.
, то его разбавляют дистиллированной водой, если меньше - реактив для работы не пригоден.
Рабочий раствор Фолина готовится разведением основного раствора 1:2 (одна часть реактива Фолина и две части дистиллированной воды) для определения активности модифицированным методом Ансона и 1:3 (одна часть реактива Фолина и три части дистиллированной воды) для определения активности методом ФОЛП.
2.3.5. Приготовление раствора ферментного препарата
0,100-1,000 г исследуемого препарата (в зависимости от предполагаемой активности), тщательно растирают в стаканчике стеклянной палочкой с небольшим количеством буферного раствора 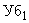 с соответствующим рН реакционной смеси. Затем количественно переносят в мерную колбу вместимостью 100 см
с соответствующим рН реакционной смеси. Затем количественно переносят в мерную колбу вместимостью 100 см , доводят этим же буферным раствором объем жидкости до метки и перемешивают. Из этого раствора готовят не менее двух разведений в зависимости от предполагаемой активности, используя этот же буферный раствор.
, доводят этим же буферным раствором объем жидкости до метки и перемешивают. Из этого раствора готовят не менее двух разведений в зависимости от предполагаемой активности, используя этот же буферный раствор.
Каждое разведение испытуемого раствора анализируют в двух повторностях. Для испытания берут две параллельные навески препарата.
Раствор ферментного препарата готовят непосредственно перед определением.
2.3.6. Приготовление раствора с массовой долей казеината натрия 2% (субстрат)
2.3.6.1. Для кислых протеиназ (рН 2,5)
2,000 г воздушно-сухого казеината натрия растворяют в 90 см буферного раствора
буферного раствора  с рН 5,5. Затем раствор доводят до рН 2,5 добавлением 3,0-3,5 см
с рН 5,5. Затем раствор доводят до рН 2,5 добавлением 3,0-3,5 см раствора соляной кислоты концентрации 1 моль/дм
раствора соляной кислоты концентрации 1 моль/дм .
.
Добавление соляной кислоты (до рН 3,0) следует проводить быстро при интенсивном перемешивании раствора. При дальнейшем подкислении раствора до рН 2,5 кислота вносится по каплям.
Затем раствор переносят в мерную колбу вместимостью 100 см и доводят объем до метки буферным раствором
и доводят объем до метки буферным раствором 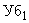 с рН 2,5.
с рН 2,5.
Примечание. При подкислении раствора казеината натрия соляной кислотой первоначально (при значении рН в диапазоне 5,1-3,0) наблюдается образование мелких хлопьев, которые исчезают при дальнейшем добавлении соляной кислоты до рН 2,5.
2.3.6.2. Для кислых (рН 5,5), нейтральных (рН 7,2) и щелочных (рН 9,5) протеиназ
2,000 г воздушно-сухого казеината натрия растворяют в 90 см
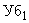 соответствующего рН, после чего раствор доводят до рН 5,5 (для кислых протеиназ) добавлением нескольких капель раствора соляной кислоты концентрации 1 моль/дм
соответствующего рН, после чего раствор доводят до рН 5,5 (для кислых протеиназ) добавлением нескольких капель раствора соляной кислоты концентрации 1 моль/дм , а до рН 7,2 (нейтральных) и 9,5 (щелочных) добавлением нескольких капель раствора гидроокиси натрия концентрации 1 моль/дм
, а до рН 7,2 (нейтральных) и 9,5 (щелочных) добавлением нескольких капель раствора гидроокиси натрия концентрации 1 моль/дм .
.
Затем раствор переносят в мерную колбу вместимостью 100 см и доводят объем до метки буферным раствором
и доводят объем до метки буферным раствором 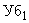 соответствующего рН.
соответствующего рН.
Примечания:
1. Для сокращения времени растворения казеината натрия раствор готовят при нагревании до температуры 70 °С на магнитной мешалке.
2. Срок хранения раствора в холодильнике в плотно закрытой склянке - не более 3 сут.
2.3.7. Проведение испытания
Берут три пробирки (одна контрольная, две опытные).
В опытные пробирки наливают по 2 см субстрата и помещают их в ультратермостат при температуре 30 °С.
субстрата и помещают их в ультратермостат при температуре 30 °С.
Примерно через 10 мин в каждую пробирку приливают по 2 см раствора фермента (предварительно термостатированного при 30 °С 3-4 мин), пробирки встряхивают и оставляют на гидролиз ровно на 10 мин при температуре 30 °С. Через 10 мин добавляют в обе пробирки по 4 см
раствора фермента (предварительно термостатированного при 30 °С 3-4 мин), пробирки встряхивают и оставляют на гидролиз ровно на 10 мин при температуре 30 °С. Через 10 мин добавляют в обе пробирки по 4 см раствора ТХУ, чтобы прервать ферментативную реакцию и осадить белок и высокомолекулярные продукты гидролиза. Быстро перемешивают смесь и для обеспечения полного осаждения выдерживают пробирки со смесью при температуре 30 °С еще в течение 20 мин. Затем смесь фильтруют в сухие пробирки. Фильтрат должен быть совершенно прозрачен. Отбирают в пробирки с предварительно налитыми туда 5 см
раствора ТХУ, чтобы прервать ферментативную реакцию и осадить белок и высокомолекулярные продукты гидролиза. Быстро перемешивают смесь и для обеспечения полного осаждения выдерживают пробирки со смесью при температуре 30 °С еще в течение 20 мин. Затем смесь фильтруют в сухие пробирки. Фильтрат должен быть совершенно прозрачен. Отбирают в пробирки с предварительно налитыми туда 5 см раствора углекислого натрия концентрации 0,5 моль/дм
раствора углекислого натрия концентрации 0,5 моль/дм по 1 см
по 1 см фильтрата, перемешивают и быстро приливают по 1 см
фильтрата, перемешивают и быстро приливают по 1 см рабочего раствора реактива Фолина. Дают реакционной смеси постоять 20 мин. После реакции растворы приобретают голубую окраску, интенсивность которой определяют фотоэлектрическим колориметром против контроля.
рабочего раствора реактива Фолина. Дают реакционной смеси постоять 20 мин. После реакции растворы приобретают голубую окраску, интенсивность которой определяют фотоэлектрическим колориметром против контроля.
Контрольный опыт готовят, прибавляя реактивы в обратной последовательности: для этого в контрольную пробирку наливают 2 см ферментного раствора того же разведения, как и в опыте, добавляют 4 см
ферментного раствора того же разведения, как и в опыте, добавляют 4 см ТХУ, выдерживают в ультратермостате при температуре 30 °С в течение 10 мин, а затем вносят 2 см
ТХУ, выдерживают в ультратермостате при температуре 30 °С в течение 10 мин, а затем вносят 2 см субстрата. Через 20 мин нахождения в термостате раствор фильтруют, отбирают в сухую пробирку с предварительно налитыми туда 5 см
субстрата. Через 20 мин нахождения в термостате раствор фильтруют, отбирают в сухую пробирку с предварительно налитыми туда 5 см раствора углекислого натрия концентрации 0,5 моль/дм
раствора углекислого натрия концентрации 0,5 моль/дм 1 см
1 см фильтрата, перемешивают, добавляют 1 см
фильтрата, перемешивают, добавляют 1 см рабочего раствора реактива Фолина.
рабочего раствора реактива Фолина.
Колориметрирование проводят фотоэлектрическим колориметром в диапазоне длин волн 630-670 нм в кюветах с толщиной поглощающего свет слоя 10 мм.
Значения оптической плотности должны лежать в диапазоне 0,07-0,45 для кислых протеиназ и 0,2-0,6 для нейтральных и щелочных протеиназ.
При отклонении оптической плотности от указанной необходимо подобрать такое разведение препарата, чтобы оптическая плотность укладывалась в данные пределы.
2.3.8. Построение градуировочной характеристики
Для вычисления протеолитической активности строят градуировочную характеристику по тирозину и по ней вычисляют тирозиновый эквивалент ( ), то есть ту оптическую плотность, которую бы дал 1 мкмоль тирозина в 1 см
), то есть ту оптическую плотность, которую бы дал 1 мкмоль тирозина в 1 см стандартного раствора. Этот эквивалент необходимо установить для каждой новой партии реактива Фолина и каждого фотоэлектрического колориметра.
стандартного раствора. Этот эквивалент необходимо установить для каждой новой партии реактива Фолина и каждого фотоэлектрического колориметра.
Для построения градуировочной характеристики готовят раствор тирозина концентрации 10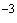 моль/дм
моль/дм . Для этого 181,2 мг чистого тирозина растворяют в растворе соляной кислоты концентрации 0,2 моль/дм
. Для этого 181,2 мг чистого тирозина растворяют в растворе соляной кислоты концентрации 0,2 моль/дм в мерной колбе вместимостью 1 дм
в мерной колбе вместимостью 1 дм . Из этого исходного раствора тирозина готовят дальнейшие разведения следующим образом.
. Из этого исходного раствора тирозина готовят дальнейшие разведения следующим образом.
Раствор 1. В мерную колбу вместимостью 50 см вносят 1 см
вносят 1 см исходного раствора тирозина и доводят объем до метки раствором соляной кислоты концентрации 0,2 моль/дм
исходного раствора тирозина и доводят объем до метки раствором соляной кислоты концентрации 0,2 моль/дм . Концентрация тирозина (
. Концентрация тирозина (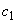 ) при этом составляет 0,2·10
) при этом составляет 0,2·10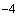 моль/дм
моль/дм или 0,02 мкмоль/см
или 0,02 мкмоль/см .
.
Последующие растворы готовят аналогичным образом:
раствор 2: 2 см исходного раствора
исходного раствора 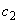 - 0,4·10
- 0,4·10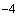 моль/дм
моль/дм или 0,04 мкмоль/см
или 0,04 мкмоль/см ;
;
раствор 3: 4 см исходного раствора
исходного раствора 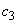 - 0,8·10
- 0,8·10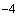 моль/дм
моль/дм или 0,08 мкмоль/см
или 0,08 мкмоль/см ;
;
раствор 4: 5 см исходного раствора
исходного раствора 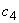 - 1,0·10
- 1,0·10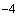 моль/дм
моль/дм или 0,10 мкмоль/см
или 0,10 мкмоль/см ;
;
раствор 5: 7,5 см исходного раствора
исходного раствора 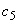 - 1,5·10
- 1,5·10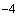 моль/дм
моль/дм или 0,15 мкмоль/см
или 0,15 мкмоль/см ;
;
раствор 6: 10 см исходного раствора
исходного раствора  - 2,0·10
- 2,0·10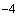 моль/дм
моль/дм или 0,20 мкмоль/см
или 0,20 мкмоль/см ;
;
раствор 7: 15 см исходного раствора
исходного раствора  - 3,0·10
- 3,0·10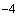 моль/дм
моль/дм или 0,30 мкмоль/см
или 0,30 мкмоль/см .
.
Затем берут 7 пробирок, вносят в каждую по 1 см раствора тирозина разной концентрации и добавляют при постоянном перемешивании по 5 см
раствора тирозина разной концентрации и добавляют при постоянном перемешивании по 5 см раствора углекислого натрия концентрации 0,5 моль/дм
раствора углекислого натрия концентрации 0,5 моль/дм и 1 см
и 1 см рабочего раствора Фолина.
рабочего раствора Фолина.
Контрольный опыт готовят также, но вместо раствора тирозина берут 1 см дистиллированной воды. Дают реакционной жидкости постоять в течение 20 мин.
дистиллированной воды. Дают реакционной жидкости постоять в течение 20 мин.
Интенсивность окраски измеряется фотоэлектрическим колориметром против контрольной пробы в диапазоне длин волн 630-670 нм в кюветах с толщиной поглощающего свет слоя 10 мм.
Следует приготовить растворы из двух навесок тирозина и провести два параллельных опыта способом, указанным выше.
По средним данным, полученным из двух опытов, строится градуировочная характеристика, имеющая линейную зависимость.
На оси абсцисс откладывают значение концентрации ( ) мкмоль/см
) мкмоль/см , на оси ординат - соответствующие значения оптической плотности (
, на оси ординат - соответствующие значения оптической плотности (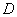 ).
).
По градуировочной характеристике находят тирозиновый эквивалент, соответствующий оптической плотности 1 мкмоля тирозина в 1 см .
.
2.4. Обработка результатов
Протеолитическую активность ( ), ед/г, вычисляют по формуле
), ед/г, вычисляют по формуле
 , (1)
, (1)
где 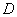 - оптическая плотность исследуемого раствора;
- оптическая плотность исследуемого раствора;
4 - отношение объемов реакционной смеси и раствора фермента после добавления ТХУ;
 - тирозиновый эквивалент, определяемый по градуировочной характеристике, мкмоль/см
- тирозиновый эквивалент, определяемый по градуировочной характеристике, мкмоль/см ;
;
10 - время гидролиза субстрата, мин;
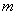 - масса ферментного препарата, взятая на протеолиз (расчет ведется на 1 см
- масса ферментного препарата, взятая на протеолиз (расчет ведется на 1 см ферментного раствора), мг;
ферментного раствора), мг;
1000 - переводной коэффициент полученных единиц на 1 г ферментного препарата.
За окончательный результат испытания принимают среднеарифметическое значение активностей, полученных при анализе двух параллельных навесок препарата.
Относительное допускаемое расхождение между значениями активностей двух параллельных навесок не должно превышать 5%. Результат округляют до первого десятичного знака.
Предел возможных значений относительной погрешности измерений протеолитической активности при доверительной вероятности 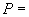 0,95 составляет 5%.
0,95 составляет 5%.
(Измененная редакция, Изм. N 1).
3. ОПРЕДЕЛЕНИЕ ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТИ МЕТОДОМ ФОЛП
(для определения щелочных протеиназ при рН 10,5)
За единицу протеолитической активности принята способность фермента катализировать гидролиз 1 г белка (казеина) в строго определенных условиях: температуре 40 °С, рН 10,5 и времени гидролиза 1 ч.
3.1. Аппаратура, материалы, реактивы, растворы
Применяемая аппаратура и материалы по п.2.2.
Казеин по Гаммерстену.
Натрий углекислый по ГОСТ 83, раствор концентрации 0,2 моль/дм и 0,5 моль/дм
и 0,5 моль/дм .
.
Натрий двууглекислый по ГОСТ 2156, раствор концентрации 0,2 моль/дм .
.
Трихлоруксусная кислота (ТХУ), раствор концентрации 0,3 моль/дм .
.
Натрия гидроокись, раствор концентрации 1 моль/дм .
.
Реактив Фолина по п.2.3.4.
3.2. Подготовка к испытанию
3.2.1. Приготовление раствора ферментного препарата
0,100-1,000 г исследуемого препарата (в зависимости от предполагаемой активности) тщательно растирают с небольшим количеством дистиллированной воды, количественно переносят в мерную колбу вместимостью 100 см , доводят дистиллированной водой до метки и перемешивают. Из этого раствора готовят не менее двух разведений в зависимости от предполагаемой активности.
, доводят дистиллированной водой до метки и перемешивают. Из этого раствора готовят не менее двух разведений в зависимости от предполагаемой активности.
Каждое разведение испытуемого раствора анализируют в двух повторностях.
Для испытания берут две параллельные навески препарата.
Раствор ферментного препарата готовят непосредственно перед определением.
3.2.2. Приготовление карбонатно-бикарбонатного буферного раствора с рН 10,7
Для приготовления буферного раствора в мерную колбу вместимостью 200 см наливают 45 см
наливают 45 см раствора углекислого натрия концентрации 0,2 моль/дм
раствора углекислого натрия концентрации 0,2 моль/дм и 5 см
и 5 см раствора двууглекислого натрия. Объем доводят до метки дистиллированной водой.
раствора двууглекислого натрия. Объем доводят до метки дистиллированной водой.
3.2.3. Приготовление раствора с массовой долей казеина 1% (субстрат)
2,000 г казеинового порошка переносят в коническую колбу вместимостью 250 см и приливают 140 см
и приливают 140 см карбонатно-бикарбонатного буферного раствора с концентрацией водородных ионов рН 10,7. Колбу ставят на магнитную мешалку и раствор перемешивают в течение 30 мин, затем, продолжая перемешивать, колбу с субстратом помещают в водяную баню и нагревают до температуры 40 °С; рН при этой температуре доводят до 10,5 добавлением (если необходимо) раствора гидроокиси натрия концентрации 1 моль/дм
карбонатно-бикарбонатного буферного раствора с концентрацией водородных ионов рН 10,7. Колбу ставят на магнитную мешалку и раствор перемешивают в течение 30 мин, затем, продолжая перемешивать, колбу с субстратом помещают в водяную баню и нагревают до температуры 40 °С; рН при этой температуре доводят до 10,5 добавлением (если необходимо) раствора гидроокиси натрия концентрации 1 моль/дм . Далее раствор субстрата из конической колбы переводят в мерную колбу вместимостью 200 см
. Далее раствор субстрата из конической колбы переводят в мерную колбу вместимостью 200 см , охлаждают проточной водой до 20 °С и объем субстрата доводят до метки карбонатно-бикарбонатным буферным раствором. Срок хранения субстрата в холодильнике не более 3 сут в плотно закрытой склянке.
, охлаждают проточной водой до 20 °С и объем субстрата доводят до метки карбонатно-бикарбонатным буферным раствором. Срок хранения субстрата в холодильнике не более 3 сут в плотно закрытой склянке.
3.3. Проведение испытания
В три пробирки (одна контрольная) наливают по 5 см раствора казеина и выдерживают в ультратермостате при температуре 40 °С в течение 5 мин.
раствора казеина и выдерживают в ультратермостате при температуре 40 °С в течение 5 мин.
В первую пробирку (контрольную) добавляют 2,5 см дистиллированной воды, в последующие - по 2,5 см
дистиллированной воды, в последующие - по 2,5 см испытуемого раствора ферментного препарата.
испытуемого раствора ферментного препарата.
Содержимое пробирок тщательно перемешивают и выдерживают в ультратермостате в течение 60 мин при температуре 40 °С.
По истечении времени гидролиза в каждую из пробирок, начиная с первой (контрольной), добавляют по 5 см раствора ТХУ, чтобы прервать ферментативную реакцию и осадить белок и высокомолекулярные продукты гидролиза.
раствора ТХУ, чтобы прервать ферментативную реакцию и осадить белок и высокомолекулярные продукты гидролиза.
Смесь быстро перемешивают и для полноты осаждения выдерживают в течение 15 мин при температуре 40 °С в ультратермостате. Затем растворы фильтруют через фильтровальную бумагу и в фильтрате определяют количество прогидролизованного белка по тирозину. Для этого берут три пробирки и в каждую (начиная с контрольной) наливают по 2 см фильтрата, затем медленно приливают в каждую по 5 см
фильтрата, затем медленно приливают в каждую по 5 см раствора углекислого натрия концентрации 0,5 моль/дм
раствора углекислого натрия концентрации 0,5 моль/дм и по 1 см
и по 1 см рабочего раствора Фолина, непрерывно перемешивают, выдерживают в ультратермостате (для развития окраски) при температуре 40 °С в течение 30 мин, охлаждают до комнатной температуры, затем фотометрируют при длине волны 630-670 нм при использовании кювет с толщиной поглощающего свет слоя 5 мм.
рабочего раствора Фолина, непрерывно перемешивают, выдерживают в ультратермостате (для развития окраски) при температуре 40 °С в течение 30 мин, охлаждают до комнатной температуры, затем фотометрируют при длине волны 630-670 нм при использовании кювет с толщиной поглощающего свет слоя 5 мм.
Оптическую плотность испытуемых растворов измеряют по отношению к контрольной пробе (воде).
Значение оптической плотности для ферментных препаратов должно находиться в диапазоне 0,15-0,70.
В случае отклонения оптической плотности от указанной необходимо подобрать такое разведение препарата, чтобы оптическая плотность укладывалась в данные пределы.
3.4. Обработка результатов
Протеолитическую активность ( ), ед/г, вычисляют по формуле
), ед/г, вычисляют по формуле
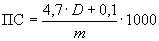 , (2)
, (2)
где 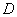 - значение оптической плотности испытуемых растворов;
- значение оптической плотности испытуемых растворов;
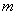 - масса ферментного препарата в фильтрате, взятом для развития окраски, мг;
- масса ферментного препарата в фильтрате, взятом для развития окраски, мг;
4,7 и 0,1 - постоянные коэффициенты, полученные экспериментально, г/ч;
1000 - переводной коэффициент миллиграмм в граммы.
За окончательный результат испытания принимают среднеарифметическое значение активностей, полученных при анализе двух параллельных навесок препарата.
Относительное допускаемое расхождение между значениями активностей двух параллельных навесок не должно превышать 5%. Результат округляют до первого десятичного знака.
Предел возможных значений относительной погрешности измерений протеолитической активности при доверительной вероятности 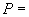 0,95 составляет 5%.
0,95 составляет 5%.

 Танцы кубанского блогера Каграманова в шоу “Звездные танцы” не понравятся...
Танцы кубанского блогера Каграманова в шоу “Звездные танцы” не понравятся...  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов