- USD ЦБ 03.12 30.8099 -0.0387
- EUR ЦБ 03.12 41.4824 -0.0244
|
Краснодар:
|
погода |
Курсы
Индексы
- DJIA 03.12 12019.4 -0.01
- NASD 03.12 2626.93 0.03
- RTS 03.12 1545.57 -0.07
ГОСТ 13496.7-97
Группа С19
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ЗЕРНО ФУРАЖНОЕ, ПРОДУКТЫ ЕГО ПЕРЕРАБОТКИ,
КОМБИКОРМА
Методы определения токсичности
Feed grain, grain by-products, compound feeds.
Methods for determination of toxicity
МКС 65.120
ОКСТУ 9209, 9296
Дата введения 2000-11-01
Предисловие
1 РАЗРАБОТАН Киевским институтом хлебопродуктов, Институтом ветеринарной медицины Украинской Академии аграрных наук, Всероссийским научно-исследовательским институтом комбикормовой промышленности (АООТ "ВНИИКП") и Санкт-Петербургским Государственным технологическим институтом
ВНЕСЕН Государственным комитетом Украины по стандартизации, метрологии и сертификации
2 ПРИНЯТ Межгосударственным Советом по стандартизации, метрологии и сертификации (протокол N 12 от 21.11.97)
За принятие проголосовали:
|
Наименование государства |
Наименование национального органа по стандартизации |
|
Азербайджанская Республика |
Азгосстандарт |
|
Республика Армения |
Армгосстандарт |
|
Республика Беларусь |
Госстандарт Беларуси |
|
Республика Казахстан |
Госстандарт Республики Казахстан |
|
Киргизская Республика |
Киргизстандарт |
|
Российская Федерация |
Госстандарт России |
|
Республика Таджикистан |
Таджикгосстандарт |
|
Туркменистан |
Главная государственная инспекция Туркменистана |
|
Республика Узбекистан |
Узгосстандарт |
|
Украина |
Госстандарт Украины |
Изменение N 1 принято Межгосударственным Советом по стандартизации, метрологии и сертификации (протокол N 13 от 28.05.98)
За принятие проголосовали:
|
Наименование государства |
Наименование национального органа по стандартизации |
|
Республика Армения |
Армгосстандарт |
|
Республика Беларусь |
Госстандарт Беларуси |
|
Грузия |
Грузстандарт |
|
Киргизская Республика |
Киргизстандарт |
|
Республика Молдова |
Молдовастандарт |
|
Российская Федерация |
Госстандарт России |
|
Республика Таджикистан |
Таджикгосстандарт |
|
Туркменистан |
Главная государственная инспекция Туркменистана |
|
Республика Узбекистан |
Узгосстандарт |
|
Украина |
Госстандарт Украины |
Постановлением Государственного комитета Российской Федерации по стандартизации и метрологии 17 октября 1999 г. N 414-ст межгосударственный стандарт ГОСТ 13496.7-97 с Изменением N 1 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1 июля 2000 г.
3 ВЗАМЕН ГОСТ 13496.7-92
4 ПЕРЕИЗДАНИЕ
1 Область применения
Настоящий стандарт распространяется на все виды фуражного зерна, продукты его переработки и комбикорма.
Стандарт устанавливает основной (арбитражный) метод определения токсичности по кожной пробе на кроликах и взаимозаменяемые ускоренные методы - по биопробе на инфузориях тетрахимена пириформис (Tetryhymena pyriformis), инфузориях стилонихиях (Stylonychia) и инфузориях колподах (Colpoda steinii) штамм П-1.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 12.1.030-81 Система стандартов безопасности труда. Электробезопасность. Защитное заземление, зануление
ГОСТ 171-81 Дрожжи пекарские прессованные. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Ацетон. Технические условия
ГОСТ 2715-75 Сетки металлические проволочные
ГОСТ 4328-77 Натрия гидроокись. Технические условия
ГОСТ 6038-79 Д-глюкоза. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13496.0-80 Комбикорма, сырье. Методы отбора проб
ГОСТ 13586.3-83 Зерно. Правила приемки и методы отбора проб
ГОСТ 13805-76 Пептон сухой ферментативный для бактериологических целей. Технические условия
ГОСТ 17299-78 Спирт этиловый технический. Технические условия
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
ГОСТ 22967-90 Шприцы медицинские инъекционные многократного применения. Технические условия
ГОСТ 24104-88* Весы лабораторные общего назначения и образцовые. Общие технические условия
________________
* С 1 июля 2002 г. вводится в действие ГОСТ 24104-2001.
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 27668-88 Мука и отруби. Приемка и методы отбора проб
ГОСТ 29169-91 Посуда лабораторная стеклянная. Пипетки с одной отметкой. Технические условия
ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29228-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 2. Пипетки градуированные без установленного времени ожидания.
3 Методы отбора проб
Отбор проб по ГОСТ 13496.0; ГОСТ 13586.3; ГОСТ 27668.
4 Определение токсичности биопробой на кроликах (основной метод)
4.1 Сущность метода
Сущность метода заключается в проведении исследований на коже кролика, основанных на дермонекротическом действии токсичных веществ микогенного происхождения, извлекаемых из кормов ацетоном.
4.2 Аппаратура, материалы и реактивы:
- шкаф вытяжной;
- аппарат для встряхивания жидкостей;
- мельница лабораторная марки МРП-2 или других аналогичных марок;
- весы лабораторные общего назначения второго класса точности по ГОСТ 24104;
- баня водяная;
- колбы с пришлифованными пробками исполнения 2 вместимостью 500 или 1000 см второго класса точности по ГОСТ 1770;
второго класса точности по ГОСТ 1770;
- чашки выпарительные N 5 вместимостью 250 см по ГОСТ 9147;
по ГОСТ 9147;
- воронки лабораторные по ГОСТ 25336;
- цилиндры мерные исполнения 1 или 3 вместимостью 250 см по ГОСТ 1770;
по ГОСТ 1770;
- лопатки стеклянные для нанесения экстракта;
- сито металлическое штампованное с отверстиями диаметром 1 мм;
- ножницы;
- бумага фильтровальная по ГОСТ 12026;
- кролики массой 2-3 кг;
- воротник из фанеры размером 16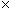 20 см;
20 см;
- ацетон ч. д. а. по ГОСТ 2603.
4.3 Подготовка к испытанию
4.3.1 Пробу фуражного зерна, комбикорма или комбикормового сырья (далее - корма), токсичность которой определяют, при необходимости, измельчают до прохода через сито с отверстиями диаметром 1 мм.
В колбу с пришлифованной пробкой вместимостью 500 см помещают 50 г измельченного корма, заливают 150 см
помещают 50 г измельченного корма, заливают 150 см ацетона и экстрагируют 24 ч, периодически встряхивая, или экстрагируют 3 ч на аппарате для встряхивания жидкостей. Слой экстрагента над пробой должен быть не менее 1 см.
ацетона и экстрагируют 24 ч, периодически встряхивая, или экстрагируют 3 ч на аппарате для встряхивания жидкостей. Слой экстрагента над пробой должен быть не менее 1 см.
После окончания экстракции жидкость фильтруют через бумажный фильтр в выпарительную чашку. Оставшуюся в колбе пробу корма дополнительно промывают небольшой порцией экстрагента (не менее 20 см ), промывную порцию фильтруют через тот же фильтр.
), промывную порцию фильтруют через тот же фильтр.
Экстракт концентрируют до получения маслянистого остатка желтоватого или коричневого оттенка. Для ускорения процесса чашку для выпаривания с экстрактом помещают на водяную баню температурой от 30 до 40 °С. Экстракт, оставшийся на стенках чашки, смывают экстрагентом на дно чашки, затем снова концентрируют. При необходимости экстракт сохраняют в холодильнике.
Примечание - Экстрагирование токсинов этим же растворителем можно проводить в аппарате Сокслета.
4.3.2 У кролика на участке кожи размером 6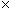 6 см в области бедра, лопатки или бока в день постановки пробы тщательно выстригают волосяной покров (до полного оголения). Повреждение кожи не допускается. Пигментированная кожа, а также кожа с признаками шелушения не пригодна для проведения испытания. На одном кролике допускается ставить одновременно не более четырех проб. Повторное использование кролика для постановки пробы допускается лишь при отрицательных результатах предыдущих исследований.
6 см в области бедра, лопатки или бока в день постановки пробы тщательно выстригают волосяной покров (до полного оголения). Повреждение кожи не допускается. Пигментированная кожа, а также кожа с признаками шелушения не пригодна для проведения испытания. На одном кролике допускается ставить одновременно не более четырех проб. Повторное использование кролика для постановки пробы допускается лишь при отрицательных результатах предыдущих исследований.
4.4 Проведение испытания
На выстриженный участок кожи кролика стеклянной лопаткой наносят, слегка втирая, половину экстракта, вторую половину экстракта оставляют для повторного нанесения на следующий день. Небольшую часть оголенного участка кожи оставляют свободной от экстракта для контроля. Если экстракта недостаточно для двух нанесений, его предварительно разбавляют растительным маслом так, чтобы общее количество его было не менее 1 г.
Для предупреждения слизывания экстракта, нанесенного на кожу, на шею кролика надевают воротник, который снимают не ранее чем через 3 сут.
Наблюдение за реакцией начинают на следующий день после повторного нанесения экстракта и продолжают в течение 3-5 сут в зависимости от степени токсичности корма.
4.5 Обработка результатов
Токсичность исследуемых кормов определяют по наличию воспалительного процесса на участке нанесения экстракта:
- нетоксичный корм - отсутствие воспалительной реакции. Допускается наличие гиперемии, сохраняющейся не более 2 сут после нанесения экстракта и не сопровождающейся шелушением кожи;
- слаботоксичный корм - гиперемия, сохраняющаяся 2-3 сут после нанесения экстракта, заканчивающаяся шелушением кожи, или гиперемия, болезненность и отечность, проявляющиеся незначительным утолщением кожи с последующим образованием отдельных чешуек;
- токсичный корм - резкая гиперемия, болезненность, складчатость, отек, проявляющиеся сильным утолщением кожи, по всей поверхности участка появляются язвы, затем сплошной струп.
4.6 Оформление результатов испытания
4.6.1 Результаты испытаний заносят в журнал и (или) оформляют акт экспертизы, где указывают степень токсичности корма и возможность его применения.
4.6.2 Нетоксичный корм используют по назначению.
4.6.3 Слаботоксичный корм подлежит специальной обработке согласно правилам, утвержденным в установленном порядке, и повторному испытанию на токсичность, а также направлению на микологические и химико-токсикологические исследования.
4.6.4 Токсичный корм использованию не подлежит.
5 Определение токсичности биопробой на инфузориях тетрахимена пириформис
5.1 Сущность метода
Метод основан на экстракции ацетоном из испытуемой пробы токсичных веществ, в основном микогенного происхождения, и последующем воздействии водных растворов этих фракций на инфузории тетрахимена пириформис.
5.2 Аппаратура, материалы, реактивы
- весы лабораторные общего назначения второго класса точности по ГОСТ 24104;
- мельница лабораторная марки МПР-2, ЛЗМ или других аналогичных марок;
- микроскоп бинокулярный стереоскопический, с увеличением 7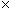 10, марки МБС;
10, марки МБС;
- рН-метр;
- аппарат для встряхивания жидкостей;
- сито металлическое штампованное с отверстиями диаметром 1 мм;
- баня водяная;
- чашки фарфоровые для выпаривания вместимостью 250 см по ГОСТ 9147;
по ГОСТ 9147;
- колбы конические плоскодонные вместимостью 250 см по ГОСТ 25336;
по ГОСТ 25336;
- колбы плоскодонные с пришлифованными пробками вместимостью 250 см по ГОСТ 1770;
по ГОСТ 1770;
- пробирки стеклянные вместимостью 25 и 50 см по ГОСТ 25336;
по ГОСТ 25336;
- пипетки исполнения 2-2-10 по ГОСТ 29169 или исполнения 2-2-2-25 по ГОСТ 29227; ГОСТ 29228;
- пипетки пастеровские;
- петля бактериологическая;
- предметные стекла;
- флакончики для антибиотиков;
- бумага фильтровальная по ГОСТ 12026;
- марля;
- пептон бактериологический по ГОСТ 13805;
- экстракт дрожжевой по нормативному документу;
- глюкоза по ГОСТ 6038;
- соль морская;
- ацетон, ч. д. а. по ГОСТ 2603;
- стандарт-титр гидроокиси натрия молярной концентрации эквивалента 0,1 моль/дм или натрия гидроокись по ГОСТ 4328;
или натрия гидроокись по ГОСТ 4328;
- липоцеребрин по фармакопее;
- спирт этиловый технический по ГОСТ 17299 или спирт этиловый ректификованный технический по ГОСТ 18300;
- вода дистиллированная по ГОСТ 6709;
- инфузория тетрахимена пириформис - 3-5-суточная тест-культура.
5.3 Подготовка к испытанию
5.3.1 Приготовление пептоновой среды
К 100 см дистиллированной воды прибавляют в граммах: пептона - 2, глюкозы - 0,5, дрожжевого экстракта - 0,1, морской соли - 0,1. Доводят рН полученного раствора до 7-7,5 раствором гидроокиси натрия молярной концентрации эквивалента 0,1 или 0,01 моль/дм
дистиллированной воды прибавляют в граммах: пептона - 2, глюкозы - 0,5, дрожжевого экстракта - 0,1, морской соли - 0,1. Доводят рН полученного раствора до 7-7,5 раствором гидроокиси натрия молярной концентрации эквивалента 0,1 или 0,01 моль/дм , рН проверяют на рН-метре. Стерилизуют кипячением 30 мин.
, рН проверяют на рН-метре. Стерилизуют кипячением 30 мин.
5.3.2 Приготовление 5%-ного раствора глюкозы
В колбу емкостью 100 см помещают 5 г глюкозы и доводят до метки дистиллированной водой.
помещают 5 г глюкозы и доводят до метки дистиллированной водой.
5.3.3 Хранение маточной культуры инфузории тетрахимена пириформис
В бактериологические пробирки приливают по 2 см или в плоскодонные конические колбы по 10 см
или в плоскодонные конические колбы по 10 см пептоновой среды и стерилизуют кипячением 30 мин.
пептоновой среды и стерилизуют кипячением 30 мин.
Пересев культуры инфузории проводят через каждые 4-5 сут стерильной пипеткой. При использовании конических колб берут 0,2 см инокулята, а при использовании пробирок пересев проводят бактериологической петлей. Конические колбы или пробирки с культурой инфузории хранят при температуре от 22 до 24 °С.
инокулята, а при использовании пробирок пересев проводят бактериологической петлей. Конические колбы или пробирки с культурой инфузории хранят при температуре от 22 до 24 °С.
5.3.4 Консервирование культуры инфузории тетрахимена пириформис
В плоскодонные конические колбы слоем не более 1 см разливают 5%-ный раствор глюкозы. Стерилизуют кипячением 30 мин. Охлаждают до комнатной температуры и вносят от 0,5 до 1 см культуры тетрахимена пириформис, выращенной на пептоновой среде в течение 3 сут. Хранят колбы в затемненном месте при комнатной температуре не более 2 мес.
культуры тетрахимена пириформис, выращенной на пептоновой среде в течение 3 сут. Хранят колбы в затемненном месте при комнатной температуре не более 2 мес.
Можно консервировать инфузории в пептоновой среде с применением от 5 до 10 мг фармакопейного липоцеребрина, растворенного в 100 см пептоновой среды. Для этого липоцеребрин добавляют в среду, кипятят 30 мин, охлаждают и делают посев инфузорий, инкубируют 4 сут при комнатной температуре, а затем ставят в холодильник при температуре от 5 до 8 °С, где хранят в пробирках не более 3 мес, в колбах - не более 6 мес без потери жизнеспособности инфузорий.
пептоновой среды. Для этого липоцеребрин добавляют в среду, кипятят 30 мин, охлаждают и делают посев инфузорий, инкубируют 4 сут при комнатной температуре, а затем ставят в холодильник при температуре от 5 до 8 °С, где хранят в пробирках не более 3 мес, в колбах - не более 6 мес без потери жизнеспособности инфузорий.
5.3.5 Подготовка пробы
Среднюю пробу корма при необходимости измельчают и просеивают через сито с отверстиями диаметром 1 мм.
5.3.6 Экстрагирование токсических веществ из проб корма
Навеску исследуемого корма около 50 г (зерно измельчают, комбикорма, отруби и другие рассыпные корма используют без измельчения) высыпают в плоскодонную колбу со шлифом, приливают 100 см ацетона и экстрагируют на аппарате для встряхивания жидкостей в течение 1 ч. Затем раствор осторожно сливают через бумажный фильтр в колбу или чашку для выпаривания. Повторное экстрагирование проводят 50 см
ацетона и экстрагируют на аппарате для встряхивания жидкостей в течение 1 ч. Затем раствор осторожно сливают через бумажный фильтр в колбу или чашку для выпаривания. Повторное экстрагирование проводят 50 см экстрагента (ацетона) в течение 30 мин. Жидкость сливают через бумажный фильтр, промывают его от 10 до 20 см
экстрагента (ацетона) в течение 30 мин. Жидкость сливают через бумажный фильтр, промывают его от 10 до 20 см экстрагента. Экстракты объединяют и выпаривают на водяной бане при температуре от 50 до 60 °С в вытяжном шкафу до полного испарения экстрагента.
экстрагента. Экстракты объединяют и выпаривают на водяной бане при температуре от 50 до 60 °С в вытяжном шкафу до полного испарения экстрагента.
После выпаривания вносят от 1 до 2 см экстрагента, чтобы смыть маслянистый экстракт со стенок чашки, и приливают 10 см
экстрагента, чтобы смыть маслянистый экстракт со стенок чашки, и приливают 10 см пептоновой среды. Перемешивают и выпаривают содержимое до полного удаления запаха растворителя, фильтруют во флаконы и доводят до рН 7-7,5, согласно 5.3.1.
пептоновой среды. Перемешивают и выпаривают содержимое до полного удаления запаха растворителя, фильтруют во флаконы и доводят до рН 7-7,5, согласно 5.3.1.
Параллельно, с целью определения качества растворителя и среды, готовят контрольный экстракт. Для этого проводят упаривание растворителя (без навески корма), внесение среды, доведение рН вышеизложенным способом.
5.4 Проведение испытаний
Исследование каждой пробы проводят 3 раза.
В 3 флакона для антибиотиков вносят по 1 см экстракта, приготовленного по 5.3,6, приливают 0,1 см
экстракта, приготовленного по 5.3,6, приливают 0,1 см 3-5-суточной культуры инфузории тетрахимена пириформис и оставляют при комнатной температуре.
3-5-суточной культуры инфузории тетрахимена пириформис и оставляют при комнатной температуре.
Через 30 и 60 мин подсчитывают эффект биопробы в капле, взятой пастеровской пипеткой, на предметном стекле под микроскопом (увеличение 7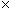 10), просматривают весь объем капли и всех ее слоев.
10), просматривают весь объем капли и всех ее слоев.
В исследуемых пробах подсчитывают наличие живых и погибших инфузорий, что зависит от степени токсичности корма.
Наблюдение проводят на фоне контроля - пептоновая среда, все инфузории в контроле должны быть живыми. В случае гибели инфузорий контроль повторяют на новой среде и культуре.
5.5 Обработка результатов
5.5.1 Степень токсичности корма определяют по количеству живых инфузорий через 30 и 60 мин от начала испытаний:
- нетоксичный корм - гибели и никаких морфологических изменений в инфузориях не происходит в течение 60 мин наблюдений;
- слаботоксичный корм - морфологические изменения и частичная (от 25% до 30%) гибель инфузорий в течение 60 мин наблюдений;
- токсичный корм - гибель всех инфузорий в течение 60 мин наблюдений.
5.6 Оформление результатов
5.6.1 Результаты испытаний заносят в экспертный журнал и (или) оформляют акт экспертизы, где указывают степень токсичности корма и возможность его использования.
5.6.2 Нетоксичный корм дальнейшему исследованию не подлежит и используется по назначению.
5.6.3 Слаботоксичный и токсичный корм направляют на повторные испытания основным методом согласно разделу 4, а также на микологические и химико-токсикологические исследования.
6 Определение токсичности биопробой на инфузориях стилонихиях
6.1 Сущность метода
Метод основан на извлечении из исследуемых продуктов различных фракций токсичных веществ ацетоном и последующим воздействием водных растворов этих фракций на инфузории стилонихии.
6.2 Аппаратура, материалы, реактивы
- весы лабораторные четвертого класса точности по ГОСТ 24104;
- мельница лабораторная марки МРП-2 или других аналогичных марок;
- микроскоп бинокулярный стереоскопический с увеличением 2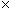 8, марки МБС;
8, марки МБС;
- фильтр мембранный N 6;
- шкаф сушильный;
- блок микроаквариумов луночных;
- колбы конические исполнения 2 (с пришлифованными пробками) вместимостью 50 и 100 см по ГОСТ 1770;
по ГОСТ 1770;
- стаканы химические вместимостью 100 см по ГОСТ 25336;
по ГОСТ 25336;
- шприц медицинский многократного использования по ГОСТ 22967;
- пипетки исполнения 2-2-10 по ГОСТ 29169 и 2-2-25 по ГОСТ 29227;
- пробирки исполнения 2 (с пришлифованными пробками) вместимостью 25 см по ГОСТ 1770;
по ГОСТ 1770;
- пробирки вместимостью 5 см по ГОСТ 25336;
по ГОСТ 25336;
- пипетки пастеровские;
- чашки Петри;
- штатив для пробирок;
- часы песочные на 2 мин;
- дрожжи пекарные прессованные по ГОСТ 171;
- бумага фильтровальная по ГОСТ 12026;
- карандаш по стеклу;
- сито лабораторное с отверстиями диаметром 1 мм;
- инфузории стилонихии - тест-культура;
- ацетон, ч. д. а. по ГОСТ 2603.
6.3 Подготовка к испытанию
6.3.1 Изготовление блока луночных микроаквариумов (см. рисунок 1)

Рисунок 1 - Блок луночных микроаквариумов
Блок луночных микроаквариумов изготовляют из пластины органического стекла размером 15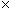 9
9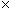 1,3 см. В пластине высверливают с последующей полировкой 5 рядов по 10 лунок. Диаметр каждой лунки 1,4 см - верхний, 0,8 см - нижний, 0,7 см - глубина, рабочий объем каждой лунки 0,4 см
1,3 см. В пластине высверливают с последующей полировкой 5 рядов по 10 лунок. Диаметр каждой лунки 1,4 см - верхний, 0,8 см - нижний, 0,7 см - глубина, рабочий объем каждой лунки 0,4 см .
.
6.3.2 Порядок обработки емкостей для проведения анализа
Чашки Петри, блоки микроаквариумов моют мыльным раствором и ополаскивают водопроводной проточной водой. Блоки из органического стекла сушат только на воздухе, чашки Петри прокаливают в сушильном шкафу при температуре от 150 до 180 °С.
Не допускается использовать посуду и проводить испытания в помещениях, предназначенных для проведения химических анализов.
6.3.3 Культуру инфузорий стилонихий транспортируют в стеклянной посуде вместимостью от 50 до 100 см , не допуская перегрева и переохлаждения.
, не допуская перегрева и переохлаждения.
Период акклиматизации к лабораторным условиям - 24 ч.
6.3.4 Приготовление среды для культивирования инфузорий (питательной среды)
Средой для культивирования стилонихий является водопроводная вода, которую отстаивают в закрытых ватным тампоном колбах в течение недели и стерилизуют нагреванием в кипящей водяной бане в течение 1 ч.
6.3.5 Приготовление корма для инфузорий
Свежие пекарные прессованные дрожжи массой около 50 г измельчают и высушивают до постоянной массы в бытовом холодильнике. Хранят в чистой банке с притертой пробкой. Срок хранения - 12 мес.
6.3.6 Культивирование стилонихий
В чашку Петри вносят 25 см питательной среды, 0,003 г сухих пекарных дрожжей и приливают 0,1-0,2 см
питательной среды, 0,003 г сухих пекарных дрожжей и приливают 0,1-0,2 см культуры инфузорий. Пересев культуры проводят два раза в неделю.
культуры инфузорий. Пересев культуры проводят два раза в неделю.
При пересадке инфузорий носик пипетки необходимо вносить непосредственно в водяную среду, находящуюся в чашке Петри.
Культивирование проводят при температуре от 18 до 23 °С и естественном освещении, избегая прямых солнечных лучей. Допускается в случае низкой комнатной температуры использовать лампу дневного света, устанавливая ее сверху на расстоянии 1 м от стола, на котором находится стилонихия. Для поддержания необходимой температуры лампу вместе с чашками Петри со стилонихией накрывают полиэтиленовой пленкой (подобие теплички).
6.3.7 Подготовка пробы для испытаний
Среднюю пробу исследуемого продукта измельчают и просеивают через сито с отверстиями диаметром 1 мм.
6.3.8 Приготовление водного раствора ацетонового экстракта исследуемого продукта
Навеску исследуемого продукта массой 10 г помещают в пробирку с пришлифованной пробкой вместимостью 25 см , заливают ацетоном в количестве (в зависимости от вида испытуемого продукта), указанном в таблице 1, и экстрагируют при энергичном встряхивании не менее 2 мин. Пробирку помещают в штатив и дают отстояться в течение 15 мин. При необходимости допускается увеличивать количество ацетона, но не более чем на 2 см
, заливают ацетоном в количестве (в зависимости от вида испытуемого продукта), указанном в таблице 1, и экстрагируют при энергичном встряхивании не менее 2 мин. Пробирку помещают в штатив и дают отстояться в течение 15 мин. При необходимости допускается увеличивать количество ацетона, но не более чем на 2 см (при высокой разбухаемости исследуемого продукта и невозможности получения отстоявшегося экстракта в нужном количестве), и вновь экстрагируют в течение 2 мин.
(при высокой разбухаемости исследуемого продукта и невозможности получения отстоявшегося экстракта в нужном количестве), и вновь экстрагируют в течение 2 мин.
Экстракт в количестве 0,5 см осторожно отбирают при помощи шприца с длинной иглой и переносят в химический стакан с отстоянной в течение недели и декантированной водой комнатной температуры (допускается изменение цвета смеси). Количество воды в стакане для различных видов испытуемого продукта указано в таблице 1.
осторожно отбирают при помощи шприца с длинной иглой и переносят в химический стакан с отстоянной в течение недели и декантированной водой комнатной температуры (допускается изменение цвета смеси). Количество воды в стакане для различных видов испытуемого продукта указано в таблице 1.
Таблица 1
|
Наименование исследуемого продукта |
Количество ацетона, см |
Количество воды, см |
|
Комбикорма для рыб |
14 |
50 |
|
Комбикорма для сельскохозяйственных животных и птицы |
15 |
40 |
|
Зерно, отруби |
15 |
40 |
|
Мучка пшеничная |
10 |
40 |
Экстракцию сырья с малой объемной массой (мучки, отруби) следует проводить в конических колбах вместимостью от 50 до 100 см с пришлифованными пробками, а отстоявшийся в них экстракт для удобства отбора шприцем переливают в пробирку вместимостью 5 см
с пришлифованными пробками, а отстоявшийся в них экстракт для удобства отбора шприцем переливают в пробирку вместимостью 5 см , дают отстояться еще 5 мин, а затем 0,5 см
, дают отстояться еще 5 мин, а затем 0,5 см экстракта переносят также в химический стакан с водой.
экстракта переносят также в химический стакан с водой.
6.3.9 Подготовка тест-организмов
Для биотестирования используют суточную культуру инфузорий. Для этого инфузории за сутки до постановки опыта массово пересаживают на новую среду с кормом (на 25 см среды не более 0,003 г пекарных сухих дрожжей, избыток корма может привести к гибели инфузорий) и культивируют при температуре от 24 до 26 °С. При этом инфузории концентрируются вокруг корма.
среды не более 0,003 г пекарных сухих дрожжей, избыток корма может привести к гибели инфузорий) и культивируют при температуре от 24 до 26 °С. При этом инфузории концентрируются вокруг корма.
6.4 Проведение испытания
Исследования одного образца корма проводят пять раз (пять микроаквариумов). Пересадку и подсчет инфузорий проводят под микроскопом при увеличении 2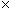 8.
8.
Отбирают пастеровской пипеткой инфузории, сконцентрированные вокруг корма в чашке Петри, и вносят их в каждый микроаквариум по одной капле. При этом в каждый микроаквариум должно попасть от 10 до 20 инфузорий.
Просматривают под микроскопом численность инфузорий в каждом микроаквариуме и если их слишком много в одном и недостает в других, то инфузории по возможности равномерно распределяют в микроаквариумах той же пипеткой.
После распределения инфузорий в каждый микроаквариум другой пастеровской пипеткой для биотестирования вносят по две капли пробы, приготовленной по 6.3.8. Через 5 мин подсчитывают инфузории в каждом микроаквариуме и заносят их численность в журнал. Травмированные инфузории при подсчете не учитывают.
После подсчета инфузорий объемы содержимого в микроаквариумах доводят до 1/2 их вместимости внесением той же пробы, приготовленной по 6.3.8 и регистрируют время в журнале.
При внесении экстракта исследуемой пробы в микроаквариумы носик пипетки следует вытирать ватой во избежание попадания в микроаквариумы жира с наружной стороны пипеток.
Параллельно, с целью определения качества ацетона и воды, проводят контрольный опыт. Для этого также в пять микроаквариумов помещают вышеуказанным способом инфузории и доводят каждый микроаквариум водным раствором ацетона массовой долей 1% до 1/2 его вместимости. Численность инфузорий в каждом аквариуме регистрируют в журнале.
Через 1 ч экспозиции вторично подсчитывают численность инфузорий. Инфузории в контроле должны остаться живыми.
В случае токсичности продукта инфузории в опыте подвергаются распаду - лизису. Количество погибших (лизированных) организмов зависит от степени токсичности корма.
6.5 Обработка результатов
6.5.1 Степень токсичности исследуемого продукта определяют по выживаемости инфузорий через 1 ч экспозиции в вытяжке исследуемого продукта.
6.5.2 Выживаемость инфузорий 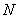 , %, вычисляют по формуле
, %, вычисляют по формуле
 , (1)
, (1)
где 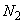 - среднее арифметическое (из пяти исследований) количества инфузорий через 1 ч экспозиции, шт;
- среднее арифметическое (из пяти исследований) количества инфузорий через 1 ч экспозиции, шт;
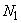 - среднее арифметическое (из пяти исследований) количества инфузорий в начале опыта, шт.
- среднее арифметическое (из пяти исследований) количества инфузорий в начале опыта, шт.
6.5.3 Степень токсичности исследуемого продукта определяют по таблице 2.
Таблица 2
|
Степень токсичности исследуемого продукта |
Выживаемость инфузорий ,% | |
|
Комбикорма для свиней |
Комбикорма для других видов сельскохозяйственных животных, птицы и рыб; фуражное зерно и продукты его переработки | |
|
Нетоксичный |
90-100 |
81-100 |
|
Слаботоксичный |
50-89 |
50-80 |
|
Токсичный |
0-49 |
0-49 |
6.6 Оформление результатов
Результаты испытаний заносят в экспертный журнал и (или) оформляют акт экспертизы, где указывают степень токсичности корма и возможность его использования.
6.6.1 Нетоксичный корм дальнейшему исследованию не подлежит и используется по назначению.
6.6.2 Слаботоксичный и токсичный корм направляют на повторные испытания основным (арбитражным) методом согласно разделу 4, а также на микологические и химико-токсикологические исследования.
Примечание - Допускается использовать при испытаниях импортную лабораторную посуду по классу точности и химреактивы по качеству не ниже отечественных.
7 Определение токсичности биопробой на инфузории колподы
7.1 Сущность метода
Метод основан на извлечении из исследуемых продуктов различных фракций токсических веществ водой и последующем воздействии этих экстрактов на культуру инфузории колподы.
7.2 Аппаратура, материалы и реактивы:
- весы лабораторные четвертого класса точности по ГОСТ 24104;
- мельница лабораторная марки МРП-2 или других аналогичных марок;
- микроскоп бинокулярный стереоскопический марки МБС с увеличением от 80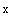 до 150
до 150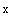 ;
;
- аппарат для встряхивания жидкости типа АВУ-1;
- колбы конические плоскодонные с пришлифованными пробками вместимостью 250 см по ГОСТ 25336;
по ГОСТ 25336;
- пипетки 1 (1а, 2, 2а)-2-2 - по ГОСТ 29169 или 1 (2, 3, 5) - 1 (1а, 2, 2а)-2-2 (5, 10) по ГОСТ 29227;
- цилиндры 1 (2, 3, 4)-100 по ГОСТ 1770;
- пипетки пастеровские;
- флаконы по нормативному документу [1];
- пробирки лабораторные по ГОСТ 25336;
- сито лабораторное из тканой сетки с размером ячейки в свету 0,2 мм по ГОСТ 2715;
- бумага фильтровальная марки ФОБ по ГОСТ 12026 или фильтры обеззоленные по нормативному документу [2];
- воронки лабораторные типа "В" по ГОСТ 25336;
- стекла предметные;
- стекла покровные;
- пробки ватно-марлевые;
- культура инфузории колподы сухая по нормативному документу [3, 4];
- среда питательная - пептоновая среда, приготовленная на минеральном растворе Лозина-Лозинского;
- вода дистиллированная по ГОСТ 6709.
7.3 Подготовка к испытанию
7.3.1 Сухую культуру инфузории колподы в комплексе с питательной средой приобретают на биофабрике, биокомбинате или в производственном отделе ветеринарной лаборатории (приложение А, [3, 4]).
Срок годности культуры - 1 год от даты выпуска препарата. Препарат хранят при комнатной температуре в защищенном от света месте.
Для проведения одного исследования, не ранее чем за 12-24 ч до использования, вскрывают два флакона с культурой колподы и один флакон с питательной средой. В каждый флакон с культурой колподы наливают по 2 см питательной среды.
питательной среды.
Питательная среда готовится по рецепту: пептон - 0,12 г, дрожжевой экстракт - 0,006 г, глюкоза - 0,03 г, раствор Лозина-Лозинского до 1 дм (состав минерального раствора Лозина-Лозинского: NaCl - 0,01%, КСl - 0,001%, СаСl
(состав минерального раствора Лозина-Лозинского: NaCl - 0,01%, КСl - 0,001%, СаСl - 0,001%, MgCl
- 0,001%, MgCl - 0,001%, NaHCO
- 0,001%, NaHCO - 0,002%). Полученный раствор автоклавируют при 1 атм в течение 30 мин и стерильно разливают во флаконы для антибиотиков, закрывают резиновыми пробками и закатывают алюминиевыми колпачками. Флаконы закрывают ватно-марлевыми пробками.
- 0,002%). Полученный раствор автоклавируют при 1 атм в течение 30 мин и стерильно разливают во флаконы для антибиотиков, закрывают резиновыми пробками и закатывают алюминиевыми колпачками. Флаконы закрывают ватно-марлевыми пробками.
Непосредственно перед применением необходимо убедиться в активности культуры колподы. Для этого культуру исследуют методом висячей или раздавленной капли под микроскопом (увеличение от 80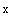 до 150
до 150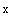 ). Колподы в количестве не менее 6 клеток в поле зрения должны активно двигаться.
). Колподы в количестве не менее 6 клеток в поле зрения должны активно двигаться.
Все предметные и покровные стекла, пипетки, колбы и т.п., которые используются для испытания, должны быть чистыми и употребляться только для этих целей.
7.3.2 Подготовка пробы для испытаний
Среднюю пробу испытуемого продукта измельчают до прохода через сито с ячейками диаметром 0,2 мм.
7.3.3 Приготовление водного экстракта исследуемого продукта
Навеску массой (20±0,1) г вносят в колбу вместимостью 250 см и заливают 100 см
и заливают 100 см дистиллированной воды. Колбы с содержимым встряхивают на аппарате со скоростью (120±2) мин
дистиллированной воды. Колбы с содержимым встряхивают на аппарате со скоростью (120±2) мин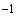 в течение 20 мин, после этого смесь фильтруют через бумажный фильтр.
в течение 20 мин, после этого смесь фильтруют через бумажный фильтр.
7.4 Проведение испытания
2 см экстракта (7.3.3) вносят во флакон (пробирку) с активной культурой колподы и перемешивают. В контрольный флакон (пробирку) с активной культурой колподы вносят 2 см
экстракта (7.3.3) вносят во флакон (пробирку) с активной культурой колподы и перемешивают. В контрольный флакон (пробирку) с активной культурой колподы вносят 2 см питательной среды. Через 10 мин, а потом через 3 ч из опытного и контрольного флаконов соответственно отбирают по одной капле смеси и просматривают их под микроскопом (увеличение от 80
питательной среды. Через 10 мин, а потом через 3 ч из опытного и контрольного флаконов соответственно отбирают по одной капле смеси и просматривают их под микроскопом (увеличение от 80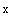 до 150
до 150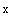 ), используя метод висячей или раздавленной капли. В исследуемых пробах учитывают наличие живых и погибших инфузорий. Просматривают весь объем капли.
), используя метод висячей или раздавленной капли. В исследуемых пробах учитывают наличие живых и погибших инфузорий. Просматривают весь объем капли.
7.5 Обработка результатов
7.5.1 Критерием определения токсичности служит время от начала воздействия испытуемого экстракта до гибели большинства (более 90%) колпод, факт которой констатируют на основании полного прекращения их движения и наличия распада.
В контрольной пробе все колподы должны оставаться подвижными.
7.5.2 Исследуемый продукт токсичный, если гибель колпод наступила за 10 мин до исследований.
7.5.3 Исследуемый продукт слаботоксичный, если гибель колпод наступила в интервале до 3 ч исследований.
7.5.4 Исследуемый продукт нетоксичный, если через 3 ч исследований все колподы остаются подвижными.
7.6 Оформление результатов
7.6.1 Результаты испытаний заносят в экспертный журнал и (или) оформляют акт экспертизы, где указывают степень токсичности корма и возможность его использования.
7.6.2 Нетоксичный корм дальнейшему исследованию не подлежит и используется по назначению.
7.6.3 Слаботоксичный и токсичный корм направляют на повторные испытания основным методом согласно разделу 4, а также на микологические и химико-токсикологические исследования.
8 Требования безопасности
Все работы, связанные с экстрагированием, проводят в вытяжном шкафу. Необходимо соблюдать требования безопасности при работе на электроприборах. Все электроприборы должны быть заземлены согласно требованиям ГОСТ 12.1.030.
ПРИЛОЖЕНИЕ А
(справочное)
Библиография
[1] ТУ 64-2-100-78 Флаконы для разливки, хранения биопрепаратов и бактериофагов
[2] ТУ 6-09-1678-95 Фильтры обеззоленные (белая, красная, синяя ленты)
[3] ТУ 9388-001-885-95 Культура Colpoda steinii сухая для эколого-токсикологических исследований
[4] ТУ У 46.15.243-97 Культура Colpoda steinii суха для еколого-токсикологiчних дослiджень об'єктiв зовнiшнього середовища, тварин та птицi
Культура тетрахимена пириформис производится в Институте ветеринарной медицины по адресу: 252151, г.Киев, ул.Донецкая, 30, тел. 243-72-96.
Культура колподы производится в АООТ НИТИАФ (Научно-исследовательском технологическом институте антибиотиков и ферментов медицинского назначения) по адресу: 198013, г.Санкт-Петербург, Рижский проспект, 40
Текст документа сверен по:
официальное издание
Комбикорма. Часть 4. Корма. Комбикорма.
Комбикормовое сырье. Методы анализа:
Сб. ГОСТов. - М.: ИПК Издательство стандартов, 2002

 Песков охарактеризовал визит Уиткоффа в Москву челночной дипломатией
Песков охарактеризовал визит Уиткоффа в Москву челночной дипломатией  Создайте свой интернет-магазин на новой платформе ReadyScript
Создайте свой интернет-магазин на новой платформе ReadyScript  Хостинг, домены, VPS/VDS, размещение серверов
Хостинг, домены, VPS/VDS, размещение серверов