ГОСТ 20264.4-89
Группа С09
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРЕПАРАТЫ ФЕРМЕНТНЫЕ
Методы определения амилолитической активности
Enzyme preparations.
Methods for the determination of amylase activity
МКС 07.100.30
65.120
ОКСТУ 9291
Дата введения 1990-07-01
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Министерством медицинской и микробиологической промышленности СССР
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 24.03.89 N 677
Изменение N 1 принято Межгосударственным советом по стандартизации, метрологии и сертификации (протокол N 12 от 21.11.97)
За принятие изменения проголосовали:
|
Наименование государства |
Наименование национального органа стандартизации |
|
Азербайджанская Республика |
Азгосстандарт |
|
Республика Армения |
Армгосстандарт |
|
Республика Белоруссия |
Госстандарт Белоруссии |
|
Грузия |
Грузстандарт |
|
Киргизская Республика |
Киргизстандарт |
|
Республика Молдова |
Молдовастандарт |
|
Российская Федерация |
Госстандарт России |
|
Республика Таджикистан |
Таджикгосстандарт |
|
Туркменистан |
Главная государственная инспекция Туркменистана |
|
Республика Узбекистан |
Узгосстандарт |
|
Украина |
Госстандарт Украины |
3. ВЗАМЕН ГОСТ 20264.4-74
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначение НТД, на который дана ссылка |
Номер раздела, пункта |
|
3.2, 4.2 | |
|
3.2, 4.2 | |
|
2.2 | |
|
2.2, 4.2 | |
|
2.2, 4.2 | |
|
2.2, 4.2 | |
|
3а.2 | |
|
2.2, 3.2, 4.2 | |
|
4.2 | |
|
3.2 | |
|
4.2 | |
|
2.2, 4.2 | |
|
4.2 | |
|
2.2 | |
|
ГОСТ 5962-67 |
3.2 |
|
3.2 | |
|
2.2, 3.2, 4.2 | |
|
2.2, 3.2, 4.2 | |
|
ГОСТ 10521-78 |
3.2 |
|
2.2 | |
|
3.2 | |
|
1 | |
|
2.2 | |
|
3.2, 4.2 | |
|
2.2 | |
|
4.2 | |
|
2.2 | |
|
3а.2 | |
|
2.2 | |
|
2.2 |
5. Ограничение срока действия снято по протоколу N 4-93 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 4-94)
6. ИЗДАНИЕ с Изменением N 1, утвержденным в октябре 1997 г. (ИУС 4-94)
Настоящий стандарт распространяется на ферментные препараты и устанавливает методы определения активности амилолитического комплекса ферментных препаратов микробного происхождения.
1. МЕТОДЫ ОТБОРА ПРОБ
Методы отбора проб - по ГОСТ 20264.0.
2. ОПРЕДЕЛЕНИЕ АМИЛОЛИТИЧЕСКОЙ АКТИВНОСТИ (АС)
2.1. Метод основан на гидролизе крахмала ферментами амилолитического комплекса до декстринов различной молекулярной массы.
Амилолитическая активность характеризует способность амилолитических ферментов катализировать гидролиз крахмала до декстринов различной молекулярной массы и выражается числом единиц указанных ферментов в 1 г препарата.
За единицу амилолитической активности (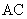 ) принята способность фермента при определенных значениях температуры, рН и времени действия катализировать до декстринов различной молекулярной массы 1 г крахмала, что составляет 30% крахмала, введенного в реакцию.
) принята способность фермента при определенных значениях температуры, рН и времени действия катализировать до декстринов различной молекулярной массы 1 г крахмала, что составляет 30% крахмала, введенного в реакцию.
2.2. Аппаратура, материалы, реактивы
Весы лабораторные общего назначения не ниже 2-го класса точности с наибольшим пределом взвешивания 200 г по ГОСТ 24104*.
________________
* С 1 июля 2002 г. введен в действие ГОСТ 24104-2001.
Колориметр фотоэлектрический лабораторный (фотоэлектроколориметр) по НТД обеспечивающий измерения в интервалах длин волн 434-450 нм и 630-670 нм с погрешностью ±1% абс. (по коэффициенту пропускания) или 0,01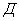 (по оптической плотности) или спектрофотометр.
(по оптической плотности) или спектрофотометр.
Прибор для измерения рН среды в диапазоне 0-14 с погрешностью измерения ±0,1 рН.
Термостат или ультратермостат, обеспечивающий температуру нагрева (30,0±0,2) °С.
Баня водяная.
Мешалка магнитная.
Термометры по ГОСТ 28498 диапазоном измерения 0-100 °С и ценой деления шкалы не более 0,1 °С.
Холодильник бытовой.
Стаканчики для взвешивания по ГОСТ 25336.
Стаканы вместимостью от 100 до 2000 см по ГОСТ 25336.
по ГОСТ 25336.
Колбы типа Кн вместимостью от 100 до 2000 см по ГОСТ 25336.
по ГОСТ 25336.
Колбы мерные наливные 1-го или 2-го исполнения вместимостью 100, 200, 250 и 1000 см по ГОСТ 1770.
по ГОСТ 1770.
Воронки типа В по ГОСТ 25336.
Пипетки 1-1-2-0,5; 1-1-2-1; 1-2-2-5; 1-2-2-10; 1-2-2-25 по ГОСТ 29227.
Пробирки П1-21-200 или П1-16-150, или П2-19-180, или П2-16-150(180) по ГОСТ 25336.
Бюретка 1-1-2-25 по ГОСТ 29251.
Эксикатор по ГОСТ 25336.
Секундомер по НТД.
Бумага фильтровальная лабораторная по ГОСТ 12026.
Крахмал растворимый по ГОСТ 10163.
Ацетатный буферный раствор с рН 4,7, приготовленный по ГОСТ 4919.2.
Натрий фосфорнокислый двузамещенный 12-водный по ГОСТ 4172, раствор молярной концентрации 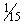 моль/дм
моль/дм .
.
Калий фосфорнокислый однозамещенный по ГОСТ 4198, раствор молярной концентрации 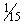 моль/дм
моль/дм .
.
Кислота соляная по ГОСТ 3118, раствор молярной концентрации вещества эквивалента 0,1 моль/дм , приготовленный по ГОСТ 4919.2.
, приготовленный по ГОСТ 4919.2.
Йод по ГОСТ 4159.
Калий йодистый по ГОСТ 4232.
Вода дистиллированная по ГОСТ 6709.
Примечания:
1. Все реактивы должны быть квалификации ч., х.ч. или ч.д.а.
2. Допускается использование импортной посуды и приборов с метрологическими характеристиками и реактивов с квалификацией не ниже отечественных.
(Измененная редакция, Изм. N 1).
2.3. Подготовка к анализу
2.3.1. Приготовление раствора крахмала с массовой долей 1% (субстрата)
(1,00±0,01) г крахмала, взятого с учетом влажности, помещают в мерную колбу вместимостью 100 см , добавляют 25 см
, добавляют 25 см воды и перемешивают. Затем добавляют в колбу еще 25 см
воды и перемешивают. Затем добавляют в колбу еще 25 см воды, помещают колбу в кипящую водяную баню не менее чем на 10-15 мин, непрерывно перемешивая содержимое до полного растворения крахмала. После этого содержимое колбы охлаждают, добавляют 10 см
воды, помещают колбу в кипящую водяную баню не менее чем на 10-15 мин, непрерывно перемешивая содержимое до полного растворения крахмала. После этого содержимое колбы охлаждают, добавляют 10 см ацетатного буферного раствора с рН 4,7 (для препаратов грибного происхождения), фосфатного буферного раствора с рН 6,0 (для препаратов бактериального происхождения) или фосфатного буферного раствора с рН 5,6 (для препаратов из дрожжевых микроорганизмов). Объем жидкости доводят до метки дистиллированной водой и содержимое колбы перемешивают. Раствор должен быть прозрачным.
ацетатного буферного раствора с рН 4,7 (для препаратов грибного происхождения), фосфатного буферного раствора с рН 6,0 (для препаратов бактериального происхождения) или фосфатного буферного раствора с рН 5,6 (для препаратов из дрожжевых микроорганизмов). Объем жидкости доводят до метки дистиллированной водой и содержимое колбы перемешивают. Раствор должен быть прозрачным.
Раствор крахмала готовят в день проведения анализа.
2.3.2. Приготовление фосфатного буферного раствора с рН 5,6 и рН 6,0
Смешивают растворы фосфорнокислого натрия и фосфорнокислого калия молярной концентрации 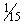 моль/дм
моль/дм в соотношении 0,5:9,5 (для рН 5,6) и 1:9 (для рН 6,0).
в соотношении 0,5:9,5 (для рН 5,6) и 1:9 (для рН 6,0).
Величину рН проверяют на приборе. В случае отклонения рН буфера от требуемого, соответствующими растворами доводят его до нормы.
2.3.3. Приготовление основного раствора йода
0,50 г йода и 5,00 г йодистого калия растворяют в бюксе с притертой крышкой в небольшом количестве воды.
Содержимое перемешивают на магнитной мешалке при плотно закрытой крышке бюксы.
Раствор после полного растворения йода переносят в мерную колбу с притертой крышкой вместимостью 200 см и объем доводят дистиллированной водой до метки.
и объем доводят дистиллированной водой до метки.
Основной раствор йода хранят в течение 1 мес в склянке из темного стекла с притертой пробкой.
2.3.4. Приготовление рабочего раствора йода
2 см основного раствора йода разводят раствором соляной кислоты молярной концентрации 0,1 моль/дм
основного раствора йода разводят раствором соляной кислоты молярной концентрации 0,1 моль/дм при анализе препаратов грибного происхождения и молярной концентрации 0,5 моль/дм
при анализе препаратов грибного происхождения и молярной концентрации 0,5 моль/дм - препаратов бактериального происхождения с предполагаемой активностью больше 50 ед/см
- препаратов бактериального происхождения с предполагаемой активностью больше 50 ед/см в мерной колбе вместимостью 100 см
в мерной колбе вместимостью 100 см . Перед употреблением рабочего раствора проверяют его оптическую плотность в диапазоне длин волн 434-450 нм в кюветах с толщиной поглощающего свет слоя 10 мм.
. Перед употреблением рабочего раствора проверяют его оптическую плотность в диапазоне длин волн 434-450 нм в кюветах с толщиной поглощающего свет слоя 10 мм.
Оптическая плотность рабочего раствора йода должна быть равна 0,220 (±0,01).
В случае отклонения ее от этого значения добавляют в раствор несколько капель соляной кислоты или основного раствора йода.
2.3.5. Приготовление основного раствора очищенных ферментных препаратов
0,1000-1,0000 г исследуемого препарата (в зависимости от предполагаемой активности) растворяют в небольшом количестве воды, при необходимости тщательно растирая стеклянной палочкой, количественно переносят в мерную колбу вместимостью 100 см , доводят дистиллированной водой до метки и перемешивают. Препараты с нерастворимыми наполнителями фильтруют. Раствор хранят в течение суток при температуре от 2 °С до 6 °С.
, доводят дистиллированной водой до метки и перемешивают. Препараты с нерастворимыми наполнителями фильтруют. Раствор хранят в течение суток при температуре от 2 °С до 6 °С.
2.3.6. Приготовление рабочего раствора очищенных ферментных препаратов
Рабочий раствор готовят в соответствии с табл.1 из основного раствора (для навески 0,1000 г), разбавляя его дистиллированной водой так, чтобы в 5 см рабочего раствора содержалась масса фермента, обеспечивающая в принятых условиях гидролиз крахмала от 20% до 60%.
рабочего раствора содержалась масса фермента, обеспечивающая в принятых условиях гидролиз крахмала от 20% до 60%.
Таблица 1
|
Амилолитическая активность ( |
Масса препарата в 5 см |
Объем основного раствора, необходимый для вторичного разбавления, см |
Общий объем разбавленного раствора, см |
|
От 20 до 80 включ. |
5,0 |
50,0 |
50,0 |
|
" 80 " 150 " |
2,0 |
20,0 |
50,0 |
|
" 150 " 300 " |
1,0 |
10,0 |
50,0 |
|
" 300 " 700 " |
0,5 |
5,0 |
50,0 |
|
" 700 " 1200 " |
0,25 |
10,0 |
200,0 |
|
" 1200 " 2500 " |
0,125 |
5,0 |
200,0 |
|
" 2500 " 5000 " |
0,05 |
2,0 |
200,0 |
|
Св. 5000 |
0,025 |
1,0 |
200,0 |
Примечание. Для анализа берут две параллельные навески препарата и из каждой делают одно разведение, которое анализируют не менее трех раз.
Рабочий раствор ферментного препарата готовят непосредственно перед определением.
2.3.7. Приготовление основного раствора из воздушно-сухой культуры гриба
5,00 г исследуемой воздушно-сухой культуры гриба, предварительно растертой в ступке, переносят в коническую колбу вместимостью 250 см , добавляют 90 см
, добавляют 90 см дистиллированной воды и 10 см
дистиллированной воды и 10 см ацетатного буферного раствора с рН 4,7. Смесь выдерживают в течение 1 ч в термостате при температуре (30,0±0,2) °С, периодически перемешивая, и затем фильтруют. Фильтрат используют в качестве основного раствора.
ацетатного буферного раствора с рН 4,7. Смесь выдерживают в течение 1 ч в термостате при температуре (30,0±0,2) °С, периодически перемешивая, и затем фильтруют. Фильтрат используют в качестве основного раствора.
Фильтрат хранят в течение суток при температуре от 2 до 6 °С.
2.3.8. Приготовление рабочего раствора из воздушно-сухой культуры гриба
Рабочий раствор готовят из основного раствора, разбавляя его дистиллированной водой, в соответствии с табл.2.
Таблица 2
|
Амилолитическая активность ( |
Масса культуры гриба в 5 см |
Объем основного раствора, необходимый для вторичного разбавления, см |
Общий объем разбавленного раствора, см |
|
От 5 до 15 включ. |
37,5 |
15 |
100 |
|
" 15 " 50 " |
10,0 |
4 |
100 |
|
" 50 " 100 " |
2,5 |
1 |
100 |
|
" 100 " 150 " |
1,25 |
1 |
200 |
|
" 150 " 300 " |
0,625 |
0,5 |
200 |
2.3.9. Приготовление основного раствора из культуральной жидкости бактериального происхождения
В мерную колбу вместимостью 100 см наливают 90 см
наливают 90 см дистиллированной воды и вносят 1 см
дистиллированной воды и вносят 1 см испытуемой культуральной жидкости. Объем доводят до метки дистиллированной водой.
испытуемой культуральной жидкости. Объем доводят до метки дистиллированной водой.
2.3.10. Приготовление рабочего раствора из культуральной жидкости
Рабочий раствор готовят из основного раствора, разбавляя его дистиллированной водой в мерной колбе вместимостью 100 см в соответствии с табл.3.
в соответствии с табл.3.
Таблица 3
|
Амилолитическая активность ( |
Объем культуральной жидкости в 5 см |
Объем основного раствора, необходимый для вторичного разбавления, см |
|
От 10 до 25 включ. |
0,01 |
20,0 |
|
" 25 " 50 " |
0,005 |
10,0 |
|
" 50 " 75 " |
0,003-0,0035 |
6,0-7,0 |
|
" 75 " 100 " |
0,0025 |
5,0 |
|
" 100 " 125 " |
0,0020 |
4,0 |
|
" 125 " 150 " |
0,0015 |
3,0 |
|
Св. 150 |
0,00125 |
2,5 |
Примечание. При анализе культур бактериального происхождения с предполагаемой активностью 50-150 ед/см берут разведение фермента, обеспечивающее гидролиз крахмала от 0,02 до 0,04 г.
берут разведение фермента, обеспечивающее гидролиз крахмала от 0,02 до 0,04 г.
2.4. Проведение анализа
Берут две пробирки, наливают в каждую по 10 см раствора крахмала (субстрата) и ставят в термостат или водяную баню с температурой (30±0,2) °С на 5-10 мин. Затем, не вынимая пробирок из термостата, наливают в первую 5 см
раствора крахмала (субстрата) и ставят в термостат или водяную баню с температурой (30±0,2) °С на 5-10 мин. Затем, не вынимая пробирок из термостата, наливают в первую 5 см дистиллированной воды (контрольная пробирка), во вторую - 5 см
дистиллированной воды (контрольная пробирка), во вторую - 5 см рабочего раствора анализируемого продукта (опытная). Смеси быстро перемешивают и выдерживают в термостате в течение 10 мин, используя секундомер.
рабочего раствора анализируемого продукта (опытная). Смеси быстро перемешивают и выдерживают в термостате в течение 10 мин, используя секундомер.
Затем из каждой пробирки поочередно отбирают по 0,5 см раствора и переносят в колбы с предварительно налитыми 50 см
раствора и переносят в колбы с предварительно налитыми 50 см рабочего раствора йода. Содержимое колб перемешивают.
рабочего раствора йода. Содержимое колб перемешивают.
Полученные растворы приобретают следующую окраску:
контрольный раствор - синий цвет, опытный - фиолетовый различной интенсивности в зависимости от количества непрогидролизованного крахмала.
Через 5-10 мин после смешивания определяют оптическую плотность растворов фотоэлектрическим колориметром в диапазоне длин волн 630-670 нм в кюветах с толщиной поглощающего свет слоя 10 мм.
Контрольным раствором при колориметрировании является дистиллированная вода.
2.5. Обработка результатов
Массу прогидролизованного крахмала (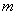 ) в граммах вычисляют по формуле
) в граммах вычисляют по формуле
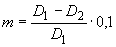 , (1)
, (1)
где 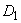 - оптическая плотность контрольного раствора;
- оптическая плотность контрольного раствора;
 - оптическая плотность опытного раствора;
- оптическая плотность опытного раствора;
0,1 - масса крахмала, взятая для анализа, г.
Если масса прогидролизованного крахмала меньше 0,02 г или больше 0,06 г, то анализ повторяют, подбирая другое разведение.
Амилолитическую активность (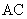 ) в ед/г для препаратов бактериального происхождения и в ед/см
) в ед/г для препаратов бактериального происхождения и в ед/см для культуральной жидкости вычисляют по формуле
для культуральной жидкости вычисляют по формуле
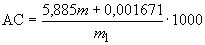 . (2)
. (2)
Амилолитическую активность (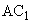 ) в ед/г для препаратов грибного происхождения вычисляют по формуле
) в ед/г для препаратов грибного происхождения вычисляют по формуле
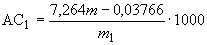 , (3)
, (3)
где 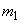 - масса ферментного препарата, содержащаяся в 5 см
- масса ферментного препарата, содержащаяся в 5 см рабочего раствора, мг;
рабочего раствора, мг;
5,885; 0,001671; 7,264; 0,03766 - коэффициенты расчетного уравнения, полученные при математической обработке экспериментальных данных зависимости массы прогидролизованного крахмала от массы фермента, взятого для анализа в пересчете на 1 ч действия фермента.
За окончательный результат анализа принимают среднеарифметическое значение результатов определения активностей, полученных при анализе двух параллельных навесок препарата, относительное допускаемое расхождение между которыми не должно превышать 5%. Результат округляют до первого десятичного знака.
Предел возможных значений относительной погрешности измерений при доверительной вероятности 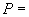 0,95 составляет 5%.
0,95 составляет 5%.
3. ОПРЕДЕЛЕНИЕ ГЛЮКОАМИЛАЗНОЙ АКТИВНОСТИ (ГлС)
ГЛЮКОЗООКСИДАЗНЫМ МЕТОДОМ (АРБИТРАЖНЫЙ МЕТОД)
3.1. Метод основан на определении глюкозы, образующейся при гидролизе растворимого крахмала ферментом глюкоамилазы.
Глюкоамилазная активность (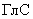 ) характеризует способность ферментного препарата катализировать расщепление растворимого крахмала до глюкозы и выражается числом единиц активности в грамме препарата.
) характеризует способность ферментного препарата катализировать расщепление растворимого крахмала до глюкозы и выражается числом единиц активности в грамме препарата.
За единицу глюкоамилазной активности принята способность фермента катализировать гидролиз растворимого крахмала при определенных условиях температуры и рН, высвобождая за 1 мин 1 мкмоль глюкозы.
3.2. Аппаратура, материалы, реактивы
Аппаратура и материалы - по п.2.2 со следующими дополнениями.
Колориметр фотоэлектрический лабораторный (фотоэлектроколориметр) по НД, обеспечивающий измерения в интервале длин волн 390-415 нм с погрешностью ±1% абс. (по коэффициенту пропускания) или 0,01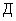 (по оптической плотности) или спектрофотометр.
(по оптической плотности) или спектрофотометр.
Калий фосфорнокислый однозамещенный по ГОСТ 4198, раствор молярной концентрации 1 моль/дм .
.
Калий железистосинеродистый по ГОСТ 4207.
Глюкоза по ГОСТ 6038.
Натрий уксуснокислый по ГОСТ 199.
Кислота уксусная по ГОСТ 61.
Крахмал растворимый по ГОСТ 10163.
Кислота бензойная по ГОСТ 10521.
Калия гидроокись по ГОСТ 24363, раствор молярной концентрации 1 моль/дм .
.
Кальций хлористый.
Спирт этиловый ректификованный по ГОСТ 5962* или спирт этиловый ректификованный технический по ГОСТ 18300.
________________
* На территории Российской Федерации действует ГОСТ Р 51652-2000.
Глюкозооксидаза с ферментативной активностью 100000 ед/г.
Пероксидаза.
Вода дистиллированная по ГОСТ 6709.
Примечание. Все реактивы должны быть квалификации ч.; х.ч. или ч.д.а.
3.3. Подготовка к анализу
3.3.1. Приготовление раствора крахмала с массовой долей 1% (субстрата) - по п.2.3.1.
3.3.2. Приготовление фосфатного буферного раствора с рН 7,5 молярной концентрации 1 моль/дм
Смешивают равные объемы растворов фосфорнокислого однозамещенного калия и гидроокиси калия молярной концентрации 1 моль/дм .
.
Величину рН проверяют на приборе. В случае отклонения рН от требуемого составляющими растворами доводят его до нормы.
3.3.3. Приготовление раствора железистосинеродистого калия с массовой долей 1% (раствора А)
0,05 г железистосинеродистого калия количественно переносят в мерную колбу вместимостью 50 см и объем доводят дистиллированной водой до метки.
и объем доводят дистиллированной водой до метки.
Раствор готовят непосредственно перед определением.
3.3.4. Приготовление раствора глюкозооксидазы (раствора Б)
5,00 (6,00) мг глюкозооксидазы растворяют фосфатным буферным раствором с рН 7,5 в мерной колбе вместимостью 50 см и затем добавляют 2,0 мг пероксидазы. Объем доводят до метки фосфатным буферным раствором.
и затем добавляют 2,0 мг пероксидазы. Объем доводят до метки фосфатным буферным раствором.
Если активность глюкозооксидазы отличается от требуемой (100000 ед/г), то навеску берут с таким расчетом, чтобы в 50 см раствора содержалось 500-600 ед активности.
раствора содержалось 500-600 ед активности.
3.3.5. Приготовление рабочего раствора С
Рабочий раствор С готовят смешиванием равных объемов растворов А и Б.
Полученный раствор хранят в темной склянке в холодильнике в течение 2-3 сут.
3.3.6. Приготовление насыщенной бензойной кислоты
2,70 г бензойной кислоты количественно переносят в мерную колбу вместимостью 1000 см и доводят до метки дистиллированной водой.
и доводят до метки дистиллированной водой.
3.3.7. Приготовление стандартных растворов глюкозы
Для приготовления стандартных растворов глюкозы пользуются перекристаллизованной из спирта безводной глюкозой, которую хранят в эксикаторе над хлористым кальцием.
100,00 мг глюкозы растворяют в 100 см насыщенного раствора бензойной кислоты. Из этого раствора отбирают поочередно 5, 10 и 15 см
насыщенного раствора бензойной кислоты. Из этого раствора отбирают поочередно 5, 10 и 15 см в мерной колбе вместимостью 100 см
в мерной колбе вместимостью 100 см и доводят объем до метки бензойной кислотой. Полученные растворы соответствуют содержанию 50, 100 и 150 мкг глюкозы в 1 см
и доводят объем до метки бензойной кислотой. Полученные растворы соответствуют содержанию 50, 100 и 150 мкг глюкозы в 1 см .
.
Этими растворами пользуются для построения градуировочного графика.
3.3.8. Приготовление основного и рабочего растворов очищенных ферментных препаратов
Основной раствор очищенных ферментных препаратов готовят по п.2.3.5.
Рабочий раствор готовят из основного раствора, разбавляя его дистиллированной водой в зависимости от предполагаемой активности препарата.
3.3.9. Приготовление основного и рабочего растворов из воздушно-сухой культуры гриба
1,00-5,00 г исследуемой воздушно-сухой культуры гриба (в зависимости от активности), предварительно растертой в ступке, переносят в коническую колбу вместимостью 250 см , добавляют 100 см
, добавляют 100 см дистиллированной воды, смесь выдерживают при комнатной температуре в течение 1 ч, периодически перемешивая, а затем фильтруют.
дистиллированной воды, смесь выдерживают при комнатной температуре в течение 1 ч, периодически перемешивая, а затем фильтруют.
Основной раствор хранят в течение суток при температуре от 2 °С до 6 °С.
Рабочий раствор готовят из основного, разбавляя его дистиллированной водой в зависимости от предполагаемой активности.
3.3.10. Приготовление рабочего раствора из культуральной жидкости
Отфильтрованную культуральную жидкость разбавляют дистиллированной водой в 1000 и более раз в зависимости от предполагаемой активности.
3.3.11. Построение градуировочного графика
В пробирки приливают по 1 см стандартных растворов глюкозы, добавляют по 3 см
стандартных растворов глюкозы, добавляют по 3 см рабочего раствора С. В контрольную пробу (контроль на реактив С) вместо раствора глюкозы приливают 1 см
рабочего раствора С. В контрольную пробу (контроль на реактив С) вместо раствора глюкозы приливают 1 см дистиллированной воды. Оставляют пробирки на 45 мин при комнатной температуре для развития окраски. Затем измеряют интенсивность окраски раствора глюкозы в диапазоне длин волн 390-415 нм в кюветах с толщиной поглощающего свет слоя 10 мм против контрольной пробы на реактив С.
дистиллированной воды. Оставляют пробирки на 45 мин при комнатной температуре для развития окраски. Затем измеряют интенсивность окраски раствора глюкозы в диапазоне длин волн 390-415 нм в кюветах с толщиной поглощающего свет слоя 10 мм против контрольной пробы на реактив С.
По полученным значениям строится градуировочный график, имеющий линейную зависимость.
Рабочая зона градуировочного графика лежит в области 50-150 мкг.
Оптическая плотность раствора должна быть близка к значениям 0,1±0,01; 0,2±0,01; 0,3±0,01.
Если оптическая плотность отличается от этих значений, то навеску глюкозооксидазы увеличивают.
3.4. Проведение анализа
Берут две параллельные навески анализируемого продукта и из каждой делают не менее двух разведений. Каждое разведение исследуемого раствора анализируют не менее двух раз.
В пробирку наливают 10 см раствора крахмала (субстрата) и ставят в термостат или водяную баню с температурой (30,0±0,2) °С на 5-10 мин. Затем приливают к содержимому пробирки 5 см
раствора крахмала (субстрата) и ставят в термостат или водяную баню с температурой (30,0±0,2) °С на 5-10 мин. Затем приливают к содержимому пробирки 5 см раствора анализируемого продукта и инкубируют смесь в течение 10 мин при той же температуре.
раствора анализируемого продукта и инкубируют смесь в течение 10 мин при той же температуре.
Затем 1 см смеси переносят в другую пробирку, помещенную в кипящую водяную баню, выдерживают в течение 2 мин (для инактивации фермента) и охлаждают холодной водой. Затем к смеси добавляют 3 см
смеси переносят в другую пробирку, помещенную в кипящую водяную баню, выдерживают в течение 2 мин (для инактивации фермента) и охлаждают холодной водой. Затем к смеси добавляют 3 см раствора С, перемешивают и оставляют на 45 мин при комнатной температуре.
раствора С, перемешивают и оставляют на 45 мин при комнатной температуре.
Одновременно готовят контрольную пробу. Для этого 5 см раствора анализируемого продукта выдерживают в кипящей водяной бане в течение 10 мин (для инактивации фермента). Затем раствор охлаждают и добавляют 10 см
раствора анализируемого продукта выдерживают в кипящей водяной бане в течение 10 мин (для инактивации фермента). Затем раствор охлаждают и добавляют 10 см раствора крахмала.
раствора крахмала.
Все последующие операции с контрольными пробами проводят так же, как и с опытными.
Кроме указанной контрольной пробы на инактивированный фермент ставят контрольную пробу на рабочий раствор С. Для этого к 3 см этого раствора приливают 1 см
этого раствора приливают 1 см дистиллированной воды.
дистиллированной воды.
Интенсивность окраски определяют на фотоэлектроколориметре в диапазоне длин волн 390-415 нм в кюветах с толщиной поглощающего свет слоя 10 мм.
Если контрольные пробы на инактивированный фермент имеют заметную окраску, то необходимо исследуемый раствор проколориметрировать, взяв в качестве раствора сравнения рабочий раствор.
Значение оптической плотности должно лежать в пределах, соответствующих массе глюкозы от 50 до 150 мкг.
3.5. Обработка результатов
Глюкоамилазную активность (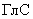 ) в ед/г вычисляют по формуле
) в ед/г вычисляют по формуле
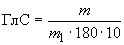 , (4)
, (4)
где 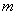 - масса глюкозы, образовавшейся в 1 см
- масса глюкозы, образовавшейся в 1 см гидролизата за счет действия фермента, найденная по калибровочному графику, мкг;
гидролизата за счет действия фермента, найденная по калибровочному графику, мкг;
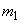 - масса фермента, содержащегося в 1 см
- масса фермента, содержащегося в 1 см гидролизата, взятая на определение, г;
гидролизата, взятая на определение, г;
10 - время гидролиза, мин;
180 - молекулярная масса глюкозы, г/мкмоль.
Примечание. Глюкоамилазную активность в ед/см вычисляют по формуле 4, только вместо массы фермента берется объем (
вычисляют по формуле 4, только вместо массы фермента берется объем (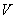 ).
).
За окончательный результат анализа принимают среднеарифметическое значение результатов определения активностей, полученных при анализе двух параллельных навесок препарата, относительное допускаемое расхождение между которыми не должно превышать 5%. Результат округляют до первого десятичного знака.
Предел возможных значений относительной погрешности измерений глюкоамилазной активности при доверительной вероятности 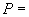 0,95 составляет 5%.
0,95 составляет 5%.
3а. Определение глюкоамилазной активности (ГлСп) поляриметрическим методом
3а.1. Метод основан на определении глюкозы, образующейся при гидролизе мальтозы ферментом глюкоамилазой.
Глюкоамилазная активность характеризует способность ферментного препарата катализировать гидролиз мальтозы с образованием глюкозы и выражается числом единиц активности в грамме (или см ) препарата.
) препарата.
За единицу активности глюкоамилазы принимается способность фермента катализировать при определенных значениях температуры и рН гидролиз 1 мкмоль мальтозы до глюкозы за 1 мин.
3а.2. Аппаратура, материалы, реактивы
Весы лабораторные общего назначения по ГОСТ 24104 с наибольшим пределом взвешивания 200 г, не ниже 2-го класса точности.
Сахариметр универсальный СУ-3, СУ-4, автоматический СП или автоматические поляриметры А1-ЕПО или А1-ЕПЛ.
Прибор для измерения рН среды в диапазоне 0-14 с погрешностью измерения ±0,1 рН.
Термостат или ультратермостат, обеспечивающий температуру нагрева (50±0,2) °С.
Термометры по ГОСТ 28498 диапазоном измерения 0-100 °С и ценой деления шкалы не более 0,1 °С.
Баня водяная.
Стаканчики для взвешивания по ГОСТ 25336.
Колбы типа Кн вместимостью от 100 до 1000 см по ГОСТ 25336.
по ГОСТ 25336.
Колбы мерные наливные 1-го или 2-го исполнения вместимостью 100, 200, 250 и 1000 см по ГОСТ 1770.
по ГОСТ 1770.
Воронки типа В по ГОСТ 25336.
Пипетки типа 2; 1-го и 2-го исполнения вместимостью от 1 до 25 см по ГОСТ 29227 или ГОСТ 29169.
по ГОСТ 29227 или ГОСТ 29169.
Пробирки П1-21-200, или П1-16-150, или П2-19-180, или П2-16-150 по ГОСТ 25336.
Секундомер по НД.
Бумага фильтровальная лабораторная по ГОСТ 12026.
Мальтоза перекристаллизованная для бактериологических целей по НД.
Раствор буферный ацетатный с рН 4,7, приготовленный по ГОСТ 4919.2.
Кислота соляная по ГОСТ 3118, раствор молярной концентрации 5 моль/дм .
.
Цинк сернокислый 7-водный по ГОСТ 4174.
Калий железистосинеродистый 3-водный по ГОСТ 4207.
Вода дистиллированная по ГОСТ 6709.
Примечания:
1. Все реактивы должны быть квалификации ч., х.ч. или ч.д.а.
2. Допускается использование импортной посуды и приборов с метрологическими характеристиками и реактивов с квалификацией не ниже отечественных.
3а.3. Подготовка к анализу
3а.3.1. Приготовление раствора мальтозы массовой долей 2% (субстрат)
20,00 г перекристаллизованной мальтозы, взятой с учетом влаги, растворяют в мерной колбе вместимостью 1000 см в небольшом количестве воды, добавляют 100 см
в небольшом количестве воды, добавляют 100 см ацетатного буферного раствора, доводят до метки дистиллированной водой и фильтруют. Раствор мальтозы готовят не менее чем за сутки до его использования, чтобы в нем прошла мутаротация.
ацетатного буферного раствора, доводят до метки дистиллированной водой и фильтруют. Раствор мальтозы готовят не менее чем за сутки до его использования, чтобы в нем прошла мутаротация.
Хранят раствор при температуре 4-6 °С в течение 30 дней. Если при хранении раствор мальтозы помутнеет, пользоваться им не следует.
3а.3.2. Приготовление раствора железистосинеродистого калия массовой долей 15%
17,65 г калия железистосинеродистого количественно переносят в мерную колбу вместимостью 100 см , перемешивают до полного растворения соли (в случае необходимости раствор подогревают) и доводят до метки дистиллированной водой.
, перемешивают до полного растворения соли (в случае необходимости раствор подогревают) и доводят до метки дистиллированной водой.
3а.3.3. Приготовление раствора сернокислого цинка массовой долей 30%
42,85 г сернокислого цинка количественно переносят в мерную колбу вместимостью 100 см , перемешивают до полного растворения соли (в случае необходимости раствор подогревают) и доводят до метки дистиллированной водой.
, перемешивают до полного растворения соли (в случае необходимости раствор подогревают) и доводят до метки дистиллированной водой.
3а.3.4. Приготовление раствора соляной кислоты концентрации 5 моль/дм
430 см соляной кислоты помещают в мерную колбу вместимостью 1000 см
соляной кислоты помещают в мерную колбу вместимостью 1000 см , растворяют и доводят объем до метки дистиллированной водой.
, растворяют и доводят объем до метки дистиллированной водой.
3а.3.5. Приготовление растворов ферментных препаратов
3а.3.5.1. Приготовление основного и рабочего растворов очищенных ферментных препаратов
Основной раствор из очищенных ферментных препаратов готовят в соответствии с 2.3.5.
Рабочий раствор готовят из основного, разбавляя его дистиллированной водой в зависимости от предполагаемой активности.
3а.3.5.2. Приготовление основного и рабочего растворов из воздушно-сухой культуры гриба
Основной раствор из воздушно-сухой культуры гриба готовят в соответствии с 2.3.7.
Рабочий раствор готовят из основного, разбавляя его дистиллированной водой в зависимости от предполагаемой активности.
3а.3.5.3. Приготовление раствора из культуральной жидкости
Культуральную жидкость фильтруют через бумажный фильтр (или двойной полотняный мешок), возвращая первые порции обратно, добиваясь получения прозрачного раствора.
От 5 до 20 см прозрачного раствора культуральной жидкости помещают в мерную колбу вместимостью 100 см
прозрачного раствора культуральной жидкости помещают в мерную колбу вместимостью 100 см и доводят до метки дистиллированной водой.
и доводят до метки дистиллированной водой.
3а.3.5.4. Приготовление раствора из ультраконцентрата
5 см прозрачного ультраконцентрата (после отбора пипетку снаружи отбирают* фильтровальной бумагой) количественно переносят в мерную колбу вместимостью 250 или 500 см
прозрачного ультраконцентрата (после отбора пипетку снаружи отбирают* фильтровальной бумагой) количественно переносят в мерную колбу вместимостью 250 или 500 см , частично заполненную водой. Объем доводят до метки дистиллированной водой и перемешивают.
, частично заполненную водой. Объем доводят до метки дистиллированной водой и перемешивают.
_________________
* Текст соответствует оригиналу. - Примечание изготовителя базы данных.
Все исследуемые растворы глюкоамилазы, приготовленные по 3а.3.5, должны обеспечивать разность угла вращения плоскости поляризации (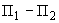 ) в пределах от 0,5° до 2,5° нормальной сахарной шкалы.
) в пределах от 0,5° до 2,5° нормальной сахарной шкалы.
Если эта разность ниже 0,5° или выше 2,5°, то основной раствор разбавляют в ту или другую сторону.
3а.4. Проведение анализа
Берут две параллельные навески анализируемого продукта и из каждой делают не менее двух разведений. Каждое разведение исследуемого раствора анализируют не менее двух раз.
В две пробирки наливают по 25 см раствора мальтозы и ставят в термостат или ультратермостат, или водяную баню температурой (50±0,2) °С на 5-10 мин. Затем к содержимому пробирок приливают по 5 см
раствора мальтозы и ставят в термостат или ультратермостат, или водяную баню температурой (50±0,2) °С на 5-10 мин. Затем к содержимому пробирок приливают по 5 см раствора исследуемого ферментного препарата, быстро перемешивают и инкубируют смесь в течение 15 мин при этой же температуре. По истечении указанного времени в пробирки добавляют по 1 см
раствора исследуемого ферментного препарата, быстро перемешивают и инкубируют смесь в течение 15 мин при этой же температуре. По истечении указанного времени в пробирки добавляют по 1 см раствора соляной кислоты (для прерывания ферментативной реакции) и охлаждают растворы до 20 °С.
раствора соляной кислоты (для прерывания ферментативной реакции) и охлаждают растворы до 20 °С.
Одновременно готовят контрольную пробу. Для этого к 25 см раствора мальтозы приливают сначала 1 см
раствора мальтозы приливают сначала 1 см раствора соляной кислоты, затем 5 см
раствора соляной кислоты, затем 5 см исследуемого раствора ферментного препарата.
исследуемого раствора ферментного препарата.
Если опытные и контрольные растворы получились мутными, их осветляют. Для этого приливают по 1 см осветлителей - раствора сернокислого цинка и железистосинеродистого калия.
осветлителей - раствора сернокислого цинка и железистосинеродистого калия.
Содержимое пробирок перемешивают и фильтруют. На сахариметре или автоматическом поляриметре измеряют угол вращения плоскости поляризации опытного и контрольного растворов, используя поляриметрическую трубку (кювету) длиной 200 мм. При использовании автоматического поляриметра показания прибора умножают на коэффициент перевода круговых градусов в градусы нормальной сахарной шкалы, равный 2,8885. Величина 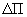 при измерении на сахариметре должна находиться в пределах от 0,2 до 2,5 °S; при измерении на автоматическом поляриметре - от 0,6 до 7 °S.
при измерении на сахариметре должна находиться в пределах от 0,2 до 2,5 °S; при измерении на автоматическом поляриметре - от 0,6 до 7 °S.
3а.5. Обработка результатов
Глюкоамилазную активность 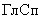 , ед/г (или ед/см
, ед/г (или ед/см ), вычисляют по формуле
), вычисляют по формуле
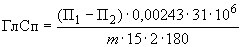 , (4а)
, (4а)
где 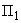 - угол вращения плоскости поляризации опытного раствора, °S,
- угол вращения плоскости поляризации опытного раствора, °S,
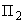 - угол вращения плоскости поляризации контрольного раствора, °S;
- угол вращения плоскости поляризации контрольного раствора, °S;
0,00243 - массовая концентрация глюкозы, соответствующая 1 °S, г/см ;
;
31 - объем инкубационной смеси, см ;
;
10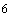 - коэффициент перевода г в мкг;
- коэффициент перевода г в мкг;
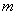 - масса (объем) препарата в рабочем растворе, г (см
- масса (объем) препарата в рабочем растворе, г (см );
);
15 - время гидролиза, мин;
2 - коэффициент, учитывающий образование из мальтозы двух молекул глюкозы;
180 - молярная масса глюкозы, мкг/мкмоль.
В случае применения осветления конечный результат, вычисленный по формуле (4а), умножают на коэффициент, учитывающий изменение объема инкубационной смеси на 2 см за счет осветления, равный 1,06.
за счет осветления, равный 1,06.
За окончательный результат анализа принимают среднеарифметическое значение результатов определения активностей, полученных при анализе двух параллельных навесок. Результат округляют до второго десятичного знака. Расхождение между каждым измерением и среднеарифметическим значением не должно превышать 5% среднего значения при доверительной вероятности 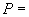 0,95.
0,95.
Перевод единиц активности, полученных поляриметрическим методом, в единицы стандартного глюкозооксидазного метода осуществляется в соответствии с приложением А.
Разд.3а. (Введен дополнительно, Изм. N 1).
4. ОПРЕДЕЛЕНИЕ ОСАХАРИВАЮЩЕЙ АКТИВНОСТИ (ОС)
4.1. Метод основан на гидролизе растворимого крахмала в пределах 25% глюкозидных связей исследуемым ферментом с последующим йодометрическим определением количества образовавшихся сахаров.
Осахаривающая активность характеризует способность амилолитических ферментов катализировать осахаривание крахмала до мальтозы или мальтозы в смеси с глюкозой.
За единицу осахаривающей активности принята способность фермента катализировать за 1 мин при определенных значениях температуры и рН расщепление 1 мкмоля гликозидных связей до восстанавливающих сахаров. Активность выражается в ед/г препарата.
4.2. Аппаратура, материалы, реактивы
Аппаратура и материалы - по п.2.2.
Крахмал растворимый по ГОСТ 10163.
Натрий уксуснокислый 3-водный по ГОСТ 199, раствор молярной концентрации вещества эквивалента 1 моль/дм .
.
Натрий фосфорнокислый двузамещенный 12-водный по ГОСТ 4172, раствор молярной концентрации 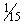 моль/дм
моль/дм .
.
Калий фосфорнокислый однозамещенный по ГОСТ 4198, раствор молярной концентрации 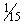 моль/дм
моль/дм .
.
Калий двухромовокислый по ГОСТ 4220.
Кислота соляная по ГОСТ 3118, раствор молярной концентрации 1 моль/дм .
.
Кислота уксусная по ГОСТ 61, раствор молярной концентрации вещества эквивалента 1 моль/дм .
.
Калий йодистый по ГОСТ 4232.
Калия гидроокись по ГОСТ 24363 или натрия гидроокись по ГОСТ 4328, раствор молярной концентрации вещества эквивалента 0,1 моль/дм .
.
Натрий серноватистокислый (натрия тиосульфат) по ГОСТ 27068 или фиксанал.
Кислота серная по ГОСТ 4204 (плотность 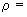 1,850 г/см
1,850 г/см ).
).
Йод по ГОСТ 4159.
Вода дистиллированная по ГОСТ 6709.
Примечание. Все реактивы должны быть марки ч.; х.ч. или ч.д.а.
4.3. Подготовка к анализу
4.3.1. Приготовление раствора крахмала с массовой долей 1% (субстрата) - по п.2.3.1.
4.3.2. Приготовление раствора йода молярной концентрации 0,1 моль/дм
25,00 г йодистого калия растворяют в мерной колбе вместимостью 1000 см в минимальном количестве дистиллированной воды и туда же вносят 12,70 г йода. После полного растворения йода объем раствора доводят дистиллированной водой до метки. Раствор хранят в склянке из темного стекла с притертой пробкой. Титр не устанавливают, но проверяют по раствору гипосульфита. Концентрация приготовленного раствора йода должна быть не ниже 0,95-1,05 моль/дм
в минимальном количестве дистиллированной воды и туда же вносят 12,70 г йода. После полного растворения йода объем раствора доводят дистиллированной водой до метки. Раствор хранят в склянке из темного стекла с притертой пробкой. Титр не устанавливают, но проверяют по раствору гипосульфита. Концентрация приготовленного раствора йода должна быть не ниже 0,95-1,05 моль/дм .
.
4.3.3. Приготовление раствора серноватистокислого натрия (гипосульфита) молярной концентрации 0,1 моль/дм
25,00 г гипосульфита растворяют в мерной колбе вместимостью 1000 см в небольшом количестве дистиллированной воды, не содержащей углекислоту. Содержимое перемешивают и объем жидкости доводят до метки дистиллированной водой.
в небольшом количестве дистиллированной воды, не содержащей углекислоту. Содержимое перемешивают и объем жидкости доводят до метки дистиллированной водой.
Приготовленный раствор хранят в склянке из темного стекла с сифоном и бюреткой с хлоркальциевой трубкой, заполненной натронной известью.
Титр устанавливают по двухромовокислому калию после выдерживания раствора гипосульфита в течение 15 сут.
4.3.4. Приготовление раствора серной кислоты 1:4
К четырем объемам дистиллированной воды приливают один объем серной кислоты.
4.3.5. Приготовление основного раствора очищенных ферментных препаратов - по п.2.3.5.
4.3.6. Приготовление основного раствора из воздушно-сухой культуры гриба
5,00 г исследуемой воздушно-сухой культуры гриба, предварительно растертой в ступке, переносят в коническую колбу вместимостью 250 см , приливают 100 см
, приливают 100 см дистиллированной воды и настаивают 1 ч при комнатной температуре, периодически перемешивая.
дистиллированной воды и настаивают 1 ч при комнатной температуре, периодически перемешивая.
Через 1 ч раствор фильтруют и фильтрат используют для анализа.
Фильтрат хранят в течение суток при температуре от 2 до 6 °С.
4.4. Проведение анализа
4.4.1. Берут две параллельные навески исследуемого продукта и из каждой делают не менее двух разведений. Каждое разведение анализируют не менее двух раз.
4.4.2. Определение осахаривающей активности в очищенных препаратах и культуре гриба, полученных из Asp. oryzae
В коническую колбу вместимостью 50 см наливают 20 см
наливают 20 см субстрата (раствора крахмала, приготовленного на буферном растворе с рН 4,7), колбу закрывают часовым стеклом и помещают в термостат или водяную баню с температурой (30,0±0,2) °С. Через 10 мин добавляют от 1 до 10 см
субстрата (раствора крахмала, приготовленного на буферном растворе с рН 4,7), колбу закрывают часовым стеклом и помещают в термостат или водяную баню с температурой (30,0±0,2) °С. Через 10 мин добавляют от 1 до 10 см ферментного раствора (в зависимости от предполагаемой активности) и содержимое тщательно перемешивают. Общий объем реакционной смеси должен быть 30 см
ферментного раствора (в зависимости от предполагаемой активности) и содержимое тщательно перемешивают. Общий объем реакционной смеси должен быть 30 см . Если на определение берут меньше 10 см
. Если на определение берут меньше 10 см ферментного раствора, то недостающий объем дополняют дистиллированной водой непосредственно перед добавлением ферментного раствора.
ферментного раствора, то недостающий объем дополняют дистиллированной водой непосредственно перед добавлением ферментного раствора.
Через 10 мин после добавления ферментного раствора действие фермента приостанавливают добавлением 2 см раствора соляной кислоты. Затем содержимое колбы количественно переносят, смывая дистиллированной водой, в коническую колбу вместимостью 500 см
раствора соляной кислоты. Затем содержимое колбы количественно переносят, смывая дистиллированной водой, в коническую колбу вместимостью 500 см приливают 20 см
приливают 20 см раствора йода и сразу же по каплям, при тщательном перемешивании, добавляют 60 см
раствора йода и сразу же по каплям, при тщательном перемешивании, добавляют 60 см раствора гидроокиси натрия или калия.
раствора гидроокиси натрия или калия.
Колбу закрывают и оставляют на 15 мин в защищенном от света месте. Через 15 мин в раствор добавляют 2 см серной кислоты и титруют выделившийся йод раствором гипосульфита в присутствии (в качестве индикатора) растворимого крахмала до исчезновения синего окрашивания. Раствор становится бесцветным.
серной кислоты и титруют выделившийся йод раствором гипосульфита в присутствии (в качестве индикатора) растворимого крахмала до исчезновения синего окрашивания. Раствор становится бесцветным.
Одновременно ставят контрольный опыт с теми же количествами всех реагентов, только ферментный раствор вводят после добавления 2 см раствора соляной кислоты (без выдержки в термостате).
раствора соляной кислоты (без выдержки в термостате).
Разность между результатами титрования контрольного и опытного растворов должна составлять 0,5-6 см раствора гипосульфита. Если разность меньше 0,5 см
раствора гипосульфита. Если разность меньше 0,5 см или больше 6 см
или больше 6 см , то анализ повторяют с большим или меньшим количеством ферментного раствора.
, то анализ повторяют с большим или меньшим количеством ферментного раствора.
4.4.3. Определение осахаривающей активности в очищенных препаратах и в культуре гриба, полученный из Asp. awamori
Все операции по определению осахаривающей активности проводят по п.4.4.2 со следующим дополнением:
для прекращения ферментативной реакции добавляют 5 см раствора соляной кислоты. При тщательном перемешивании сначала добавляют 3 см
раствора соляной кислоты. При тщательном перемешивании сначала добавляют 3 см , затем 60 см
, затем 60 см раствора гидроокиси натрия (калия).
раствора гидроокиси натрия (калия).
4.4.4. Определение осахаривающей активности в очищенных препаратах и в культуре из Вас. subtilis
Все операции по определению осахаривающей активности проводят по п.4.4.2 со следующими дополнениями:
в качестве субстрата берут раствор крахмала, приготовленного на буферном растворе с рН 6,0;
после введения 20 см раствора йода добавляют 52,5 см
раствора йода добавляют 52,5 см раствора гидроокиси натрия или калия;
раствора гидроокиси натрия или калия;
при пересчете найденных значений скорости реакции на начальную скорость (в пределах 4-25% гидролиза гликозидных связей крахмала) следует пользоваться градуировочным графиком, построенном на основании экспериментальных данных.
4.5. Обработка результатов
4.5.1. Осахаривающую активность (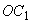 ), ед/г в культуре гриба и в очищенных препаратах из Asp. oryzae вычисляют по формуле
), ед/г в культуре гриба и в очищенных препаратах из Asp. oryzae вычисляют по формуле
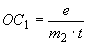 , (5)
, (5)
где 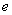 - эквивалентная масса вещества, мкмоль, найденная по табл.3;
- эквивалентная масса вещества, мкмоль, найденная по табл.3;
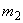 - масса препарата, введенная в реакционную смесь, г;
- масса препарата, введенная в реакционную смесь, г;
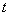 - время гидролиза, мин.
- время гидролиза, мин.
Эквивалентную массу вещества, в зависимости от разности титрования контрольного и опытного растворов (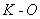 ), определяют по табл.3.
), определяют по табл.3.
Таблица 3
|
( |
|
|
0,1 |
5,0 |
|
0,2 |
10,0 |
|
0,3 |
15,0 |
|
0,4 |
20,2 |
|
0,5 |
25,5 |
|
0,6 |
30,8 |
|
0,7 |
36,2 |
|
0,8 |
41,6 |
|
0,9 |
47,0 |
|
1,0 |
52,6 |
|
1,1 |
58,2 |
|
1,2 |
63,9 |
|
1,3 |
69,7 |
|
1,4 |
75,5 |
|
1,5 |
81,5 |
|
1,6 |
87,6 |
|
1,7 |
93,6 |
|
1,8 |
99,8 |
|
1,9 |
106,1 |
|
2,0 |
112,5 |
|
2,1 |
118,9 |
|
2,2 |
125,5 |
|
2,3 |
132,1 |
|
2,4 |
138,9 |
|
2,5 |
145,8 |
|
2,6 |
152,8 |
|
2,7 |
159,9 |
|
2,8 |
167,1 |
|
2,9 |
174,5 |
|
3,0 |
181,9 |
|
3,1 |
189,5 |
|
3,2 |
197,2 |
|
3,3 |
205,1 |
|
3,4 |
213,1 |
|
3,5 |
221,3 |
|
3,6 |
229,6 |
|
3,7 |
238,1 |
|
3,8 |
246,8 |
|
3,9 |
255,6 |
|
4,0 |
264,6 |
|
4,1 |
273,8 |
|
4,2 |
283,2 |
|
4,3 |
292,8 |
|
4,4 |
302,7 |
|
4,5 |
312,8 |
|
4,6 |
323,1 |
|
4,7 |
333,6 |
|
4,8 |
344,4 |
|
4,9 |
355,5 |
|
5,0 |
366,9 |
|
5,1 |
378,6 |
|
5,2 |
390,6 |
|
5,3 |
402,9 |
|
5,4 |
415,6 |
|
5,5 |
428,8 |
|
5,6 |
442,3 |
|
5,7 |
456,2 |
|
5,8 |
470,6 |
|
5,9 |
485,0 |
|
6,0 |
501,2 |
4.5.2. Осахаривающую активность (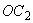 ), ед/г, в культуре гриба и в очищенных препаратах из Asp. awamori вычисляют по формуле
), ед/г, в культуре гриба и в очищенных препаратах из Asp. awamori вычисляют по формуле
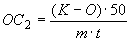 , (6)
, (6)
где 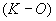 - разность титрования контрольного и опытного растворов, см
- разность титрования контрольного и опытного растворов, см ;
;
50 - коэффициент пересчета на мкмоль гликозидных связей;
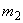 - масса ферментного препарата, введенная в реакционную смесь, г;
- масса ферментного препарата, введенная в реакционную смесь, г;
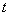 - время гидролиза, мин.
- время гидролиза, мин.
4.5.3. Осахаривающую активность (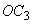 ), ед/г, в культуре и в очищенных препаратах из Вас. subtilis вычисляют по формуле
), ед/г, в культуре и в очищенных препаратах из Вас. subtilis вычисляют по формуле
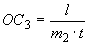 , (7)
, (7)
где 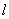 - эквивалентная масса вещества, мкмоль, найденная по табл.4;
- эквивалентная масса вещества, мкмоль, найденная по табл.4;
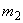 - масса ферментного препарата, введенная в реакционную смесь, г;
- масса ферментного препарата, введенная в реакционную смесь, г;
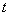 - время гидролиза, мин.
- время гидролиза, мин.
Эквивалентную массу вещества в зависимости от разности титрования контрольного и опытного растворов 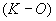 определяют по табл.4.
определяют по табл.4.
Таблица 4
|
|
|
|
0,9 |
45,0 |
|
1,0 |
52,1 |
|
1,1 |
58,7 |
|
1,2 |
63,3 |
|
1,3 |
67,8 |
|
1,4 |
74,7 |
|
1,5 |
81,4 |
|
1,6 |
85,9 |
|
1,7 |
92,7 |
|
1,8 |
99,6 |
|
1,9 |
108,5 |
|
2,0 |
113,1 |
|
2,1 |
119,9 |
|
2,2 |
128,8 |
|
2,3 |
138,0 |
|
2,4 |
150,3 |
|
2,5 |
158,3 |
|
2,6 |
169,7 |
|
2,7 |
180,9 |
|
2,8 |
192,3 |
|
2,9 |
209,9 |
|
3,0 |
226,1 |
|
3,1 |
250,6 |
|
3,2 |
278,2 |
|
3,3 |
312,1 |
|
3,4 |
366,2 |
|
3,5 |
452,3 |
|
3,6 |
517,9 |
|
3,7 |
585,7 |
|
3,8 |
662,7 |
|
3,9 |
740,3 |
|
4,0 |
811,9 |
|
4,1 |
891,6 |
|
4,2 |
968,1 |
4.5.4. За окончательный результат анализа принимают среднеарифметическое значение результатов определения активностей, полученных при анализе двух параллельных навесок препарата, относительное допускаемое расхождение между которыми не должно превышать 5%.
Результат округляют до первого десятичного знака.
Предел возможных значений относительной погрешности измерений при доверительной вероятности 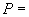 0,95 составляет 5%.
0,95 составляет 5%.
ПРИЛОЖЕНИЕ А
Справочное
ПЕРЕВОД ЕДИНИЦ АКТИВНОСТИ В ЕДИНИЦЫ ГЛЮКОЗООКСИДАЗНОГО МЕТОДА
Для перевода единиц активности, полученных поляриметрическим методом, в единицы глюкозооксидазного метода используется переводной коэффициент 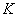 , полученный экспериментальным путем.
, полученный экспериментальным путем.
1. Для препаратов, полученных при культивировании гриба Asp. awamori, выращенного глубинным способом, 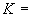 1,76±0,11; выращенного поверхностным способом -
1,76±0,11; выращенного поверхностным способом - 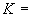 1,51±0,11.
1,51±0,11.
При изменении условий культивирования продуцента глюкоамилазы значение коэффициента следует уточнять. Для контрольных заводских условий уточнение коэффициента проводят путем сравнительного определения активности глюкоамилазы глюкозооксидазным и поляриметрическим методами.
Работу проводят на пяти пробах, полученных при разных ферментациях.
Переводной коэффициент 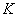 вычисляют по формуле
вычисляют по формуле
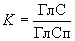 , (А.1)
, (А.1)
где 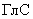 - глюкоамилазная активность, определенная глюкозооксидазным методом, ед/г;
- глюкоамилазная активность, определенная глюкозооксидазным методом, ед/г;
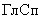 - глюкоамилазная активность, определенная поляриметрическим методом, ед/г.
- глюкоамилазная активность, определенная поляриметрическим методом, ед/г.
ПРИЛОЖЕНИЕ. (Введено дополнительно, Изм. N 1).
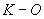 ), см
), см